เซลล์ไฟฟ้าเคมี
เซลล์ไฟฟ้าเคมีคืออะไร
เซลล์ไฟฟ้าเคมี (Electrochemical cell) คือ เครื่องมือหรืออุปกรณ์ทางเคมีที่เกิดจากการเปลี่ยนแปลงพลังงานเคมีเป็นพลังงานไฟฟ้า หรือไฟฟ้าเป็นเคมี
เซลล์ไฟฟ้าเคมีแบ่งออกเป็น 2 ประเภท
1. เซลล์กัลวานิก (Galvanic cell)คือ เซลล์ไฟฟ้าเคมีที่เปลี่ยนพลังงานเคมีเป็นพลังงานไฟฟ้า เกิดจากสารเคมีทำปฏิกิริยากันในเซลล์ แล้วเกิดกระแสไฟฟ้า เช่น ถ่านไฟฉาย เซลล์แอลคาไลน์ เซลล์ปรอท เซลล์เงิน แบตเตอรี่
2. เซลล์อิเล็กโทรไลต์ (Electrolytic cell)คือ เซลล์ไฟฟ้าเคมีที่เปลี่ยนพลังงานไฟฟ้าเป็นพลังงานเคมี เกิดจาก การผ่านกระแสไฟฟ้าเข้าไปในเซลล์ แล้วเกิดปฏิกิริยาเคมีขึ้น เช่น เซลล์แยกน้ำด้วยไฟฟ้า การชุบโลหะด้วยไฟฟ้า การใช้ปฏิกิริยาเคมีทำให้เกิดกระแสไฟฟ้าหรือการใช้กระแสไฟฟ้าทำให้เกิดการเปลี่ยนแปลงทางเคมีเกิดได้ในเซลล์ไฟฟ้าเคมี(Electrochemical cell)
ส่วนประกอบของเซลล์ไฟฟ้าเคมี
1. ขั้วไฟฟ้า เป็นวัสดุที่นำไฟฟ้าโดยอาศัยการเคลื่อนที่ของอิเล็กตรอน มี 2 ชนิด
1.1 ขั้วว่องไว (Active electrode)ได้แก่ ขั้วโลหะทั่วไป เช่น Zn Cu Pbขั้วพวกนี้บางโอกาสจะมีส่วนร่วมใน ปฏิกิริยาด้วย
1.2 ขั้วเฉื่อย (Inert electrode)คือ ขั้วที่ไม่มีส่วนร่วมใดๆ ในการเกิดปฏิกิริยาเคมี เช่น PtC(แกรไฟต์)
ในเซลล์ไฟฟ้าปกติ จะประกอบด้วยขั้วไฟฟ้า 2 ขั้วเสมอ ดังนี้
1.ขั้วแอโนด (Anode)คือ ขั้วที่เกิดออกซิเดชัน
2. ขั้วแคโทด(Cathode)คือ ขั้วที่เกิดรีดักชัน
2. สารละลายอิเล็กโทรไลต์ (Electrolyte)
อิเล็กโทรไลต์ (Electrolyte)เป็นวัสดุนำไฟฟ้าได้โดยการเคลื่อนที่ของไอออนที่เป็นองค์ประกอบ นำไฟฟ้าได้ เพราะมีไอออนเคลื่อนที่ไปมาอยู่ในสารละลายสารละลายอิเล็กโทรไลต์ มี 2 ชนิดคือ
1. สารประกอบไอออนิกหลอมเหลว เช่น สารละลาย NaCl
2. สารละลายอิเล็กโทรไลต์ เช่น สารละลายกรด เบส เกลือ
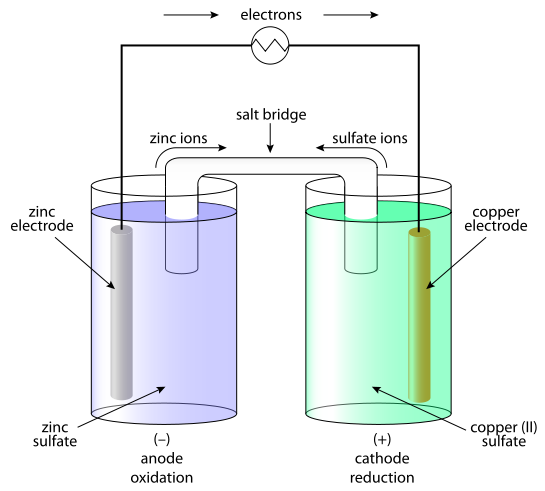
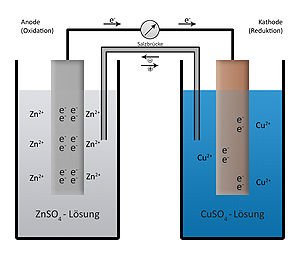
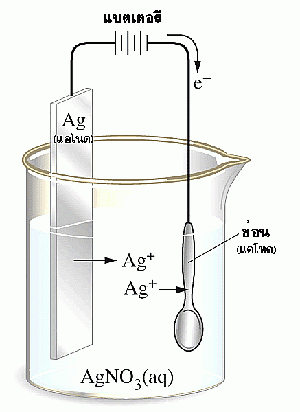
การสร้างเซลล์ไฟฟ้าเคมีจะต้องมีบริเวณที่ขั้วไฟฟ้าและอิเล็กโทรไลต์สัมผัสกันที่แตกต่างกันอย่างน้อย 2 ชนิด เซลล์ไฟฟ้าเคมีที่ง่ายที่สุด จะประกอบด้วยขั้วไฟฟ้าอย่างน้อย 2 ขั้ว และอิเล็กโทรไลต์ 1 ชนิด ดังรูป
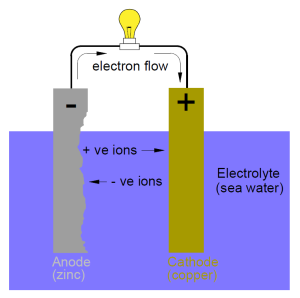
ส่วนเซลล์ไฟฟ้าเคมีที่มีอิเล็กโทรไลต์ต่างชนิดกันจะเชื่อมต่อกันด้วยสะพานเกลือ ดังรูป
กลับไปที่เนื้อหา
ประเภทของเซลล์ไฟฟ้าเคมี (เซลล์กัลวานิก)
เซลล์ไฟฟ้าเคมีแบ่งออกเป็น 2 ประเภท คือ
1. เซลล์กัลวานิกหรือเซลล์โวลตอิก (galvanic cell or voltaic cell) คือเซลล์ไฟฟ้าเคมีที่สารทำปฏิกิริยาเคมีกันแล้วให้กระแสไฟฟ้า
2. เซลล์อิเล็กโตรไลต์คือเซลล์ไฟฟ้าเคมีอีกประเภทหนึ่งต้องผ่านกระแสไฟฟ้าจากภายนอกเข้าไปทำให้สารเกิดปฏิกิริยาเคมี
1. เซลล์กัลวานิกหรือเซลล์โวลตอิก (galvanic cell or voltaic cell)
คือ เซลล์ไฟฟ้าเคมีซึ่งเป็นระบบที่ทำหน้าที่เปลี่ยนพลังงานเคมีเป็นพลังงานไฟฟ้า โดยภายในเซลล์เกิดปฏิกิริยาการถ่ายโอนอิเล็กตรอนจากสารหนึ่งไปอีกสารหนึ่ง(ปฏิกิริยารีดอกซ์)โดยที่สารตั้งต้นไม่ได้สัมผัสกันโดยตรง ทำให้การไหลของอิเล็กตรอนผ่านตัวนำอย่างต่อเนื่อง จึงเกิดกระแสไฟฟ้าในวงจร ตัวอย่างเช่น เซลล์ไฟฟ้าเคมี ถ่านไฟฉาย แบตเตอรี่รถยนต์ และเซลล์เชื้อเพลิงที่มนุษย์อวกาศใช้ในการเดินทางไปสำรวจดวงจันทร์
องค์ประกอบของเซลล์กัลวานิก
เซลล์กัลวานิก ประกอบด้วยสองครึ่งเซลล์ แต่ละครึ่งเซลล์มักประกอบด้วยโลหะ ซึ่งเป็นขั้วไฟฟ้าจุ่มอยู่ในสารละลายของไอออนของโลหะนั้น ทำหน้าที่เป็นสารละลายอิเล็กโทรไลต์ แต่ไอออน สองชนิดกรณีนี้มักใช้ขั้วเฉี่อย เป็นขั้วไฟฟ้า เพราะอโลหะหรือไอออนไม่สามารถเป็นขั้วไฟฟ้าได้ เช่น มีก๊าซ H2อยู่ร่วมกับ H+หรือ ก๊าซ Cl2อยู่ร่วมกับ Sn4+โดยมี Pt เป็นขั้วไฟฟ้า เป็นต้น (ขั้วไฟฟ้าเฉื่อย ไม่มีส่วนในการเกิดปฏิกิริยารีดอกซ์ เพียงแต่ทำหน้าที่ให้กระแสอิเล็กตรอนหรือ กระแสไฟฟ้าไหลผ่านเท่านั้น)
เซลล์กัลวานิก เป็นเซลล์ไฟฟ้าที่สามารถผลิตไฟฟ้าให้เกิดขึ้นได้เองด้วยปฏิกิริยารีดอกซ์ ในการศึกษาปฏิกิริยารีดอกซ์ เราใช้แผ่นโลหะจุ่มในสารละลายโดยตรง แต่ในเซลล็ไฟฟ้าเคมีแผ่นโลหะที่จะ เกิดปฏิกิริยากับสารละลาย จะอยู่ในภาชนะต่างกัน แล้วนำมาต่อเชื่อมกัน เชลล์ไฟฟ้าจึงประกอบด้วยภาชนะ 2 ใบ เรียกภาชนะแต่ละใบว่า ครึ่งเซลล์ (Half Cell) ครึ่งเซลล์คือ แผ่นโลหะที่จุ่มลงไปในสารละลายของไอออนของโลหะนั้นหรือก๊าซที่พ่นลงในสารละลาย ของก๊าซนั้น แผ่นโลหะหรือก๊าซที่จุ่มอยู่ในสารละลายเรียกว่า ขั้วไฟฟ้า
ขั้วไฟฟ้าจะมี 3 ชนิด
1. ขั้วไฟฟ้าโลหะ คือ แผ่นโลหะที่จุ่มในสารละลายของไอออนของโลหะนั้น ขั้วโลหะจะทำหน้าที่ เกิดปฏิกิริยาและนำอิเล็กตรอน
2. ขั้วไฟฟ้าก๊าซ คือ ก๊าซที่พ่นลงไปในสารละลาย ก๊าซจะทำหน้าที่ในการเกิดปฏิกิริยา แต่นำอิเล็กตรอนไม่ได้ จึงต้องใช้ร่วมกับขั้วไฟฟ้าเฉื่อย
3. ขั้วไฟฟ้าเฉื่อย เป็นขั้วไฟฟ้าที่ช่วยนำอิเล็กตรอน แต่ไม่มีส่วนร่วมในการเกิดปฏิกิริยาต้องใช้ร่วมกับขั้วไฟฟ้าก๊าซ ขั้วไฟฟ้าเฉื่อย
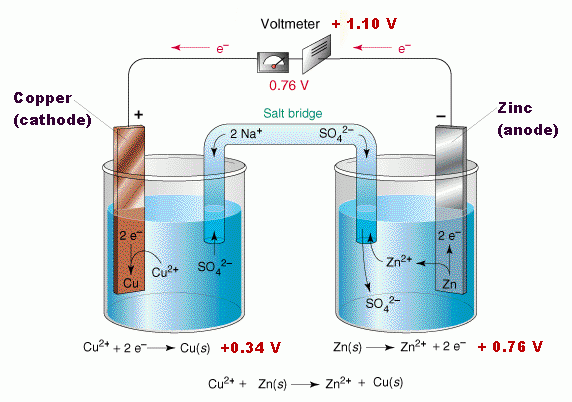
เมื่อนำครึ่งเซลล์ที่ต่างกัน 2 ครึ่งเซลล์ มาต่อเชื่อมเข้าด้วยกัน โดยเชื่อมวงจรภายในด้วยสะพานไอออนและเชื่อมวงจรภายนอกด้วยตัวต้านทานจะเกิดการไหลของอิเล็กตรอนขึ้น อิเล็กตรอนไหลไป ทางใดเข็มโวลต์มิเตอร์จะเบนไปในทิศทางนั้น
เซลล์กัลวานิกประกอบด้วยสองครึ่งเซลล์ โดยแต่ละครึ่งเซลล์จะประกอบด้วยขั้วไฟฟ้าที่จุ่มลงไปในสารละลาย แท่งสังกะสีและแท่งทองแดงในเซลล์เป็นขั้วไฟฟ้าซึ่งเรียกว่า อิเล็กโทรด (electrode) ขั้วที่เกิดปฏิกิริยาออกซิเดชัน เรียกว่า ขั้วแอโนด (anode) และขั้วที่เกิดปฏิกิริยารีดักชัน เรียกว่า ขั้วแคโทด (cathode)
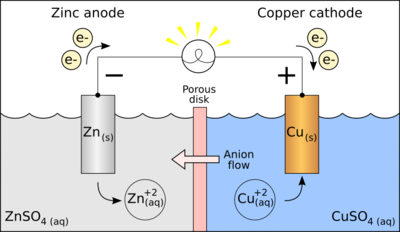
ที่มา :http://th.wikipedia.org/wiki/เซลล์กัลวานิก
เซลล์กัลวานิกแบ่งออกได้เป็น 2 ชนิด
1.เซลล์ปฐมภูมิ (primary cell)เมื่อปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นและดำเนินไปแล้ว ปฏิกิริยาจะเกิดขึ้นอย่างสมบูรณ์และเกิดปฏิกิริยาย้อนกลับไม่ได้หรือนำมาอัดไฟใหม่ไม่ได้คือ เซลล์กัลวานิกชนิดที่เมื่อปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นและดำเนินไปแล้ว ปฏิกิริยาจะเกิดขึ้นอย่างสมบูรณ์และทำให้เกิดปฏิกิริยาย้อนกลับ อีกไม่ได้ หรือนำมาอัดไฟใหม่ไม่ได้ เซลล์ปฐมภูมิได้แก่
- เซลล์แห้ง (Dry Cell)เป็นเซลล์ที่ใช้ในไฟฉาย หรือใช้ในประโยชน์อื่นๆ เช่น ในวิทยุ เครื่องคิดเลข ฯลฯ โดยกล่องของเซลล์ทำด้วยโลหะสังกะสีซึ่งทำหน้าที่เป็นขั้วแอโนด
(ขั้วลบ) ส่วนแท่งคาร์บอนหรือแกรไฟต์อยู่ตรงกลางทำหน้าที่เป็นขั้วแคโทด (ขั้วบวก) ระหว่างอิเล็กโตรดทั้งสองบรรจุด้วยของผสมชื้นของ NH4Cl , MnO2, ZnCl2ผงคาร์บอน ตอนบนของเซลล์นั้นผนึกด้วยวัสดุที่สามารถรักษาความชื้นภายในเซลล์ให้คงที่
- เซลล์แอลคาไลน์ (Alkaline Cell) เซลล์แอลคาไลน์มีส่วนประกอบของเซลล์เหมือนกับเซลล์เลอคลังเชแต่มีสิ่งที่แตกต่างกันคือเซลล์แอลคาไลน์ใช้เบสซึ่งได้แก่โพแตสเซียมไฮดรอกไซด์ (KOH) เป็นอิเล็กโทรไลต์แทนแอมโมเนียมคลอไรด์ (NH4Cl) และเนื่องจากใช้สารละลายเบสนี่เองเซลล์ชนิดนี้จึงถูกเรียกว่า เซลล์แอลคาไลน์
- เซลล์ปรอทมีหลักการเช่นเดียวกับเซลล์แอลคาไลน์ แต่ใช้ HgO แทน MnO2เป็นเซลล์ที่มีขนาดเล็กใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ หรือใช้ใน นาฬิกาข้อมือ เครื่องคิดเลข กล้องถ่ายรูป เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ ให้กระแสไฟฟ้าต่ำ แต่สามารถให้ค่าศักย์ไฟฟ้าคงที่ตลอดอายุการใช้งาน
- เซลล์เงินมีส่วนประกอบเช่นเดียวกับเซลล์ปรอท แต่ใช้ซิลเวอร์ออกไซด์แทนเมอร์คิวรี (II) ออกไซด์ เซลล์เงินให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ มีขนาดเล็กและมีอายุการใช้งานได้นานมากแต่มีราคาแพง จึงใช้กับอุปกรณ์หรือเครื่องใช้ไฟฟ้าบางชนิด เช่น นาฬิกา เครื่องคิดเลข
2.เซลล์ทุติยภูมิ (secondary cell)คือ เซลล์กัลวานิกชนิดที่เมื่อปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นและดำเนินไปแล้ว ปฏิกิริยาจะเกิดขึ้นอย่างสมบูรณ์และทำให้เกิดปฏิกิริยาย้อนกลับได้ หรือนำมาอัดไฟใหม่ได้ เซลล์ทุติยภูมิได้แก่
- เซลล์นิกเกิล – แคดเมียม (Nickel-cadmium)หรือเซลล์นิแคด มีโลหะแคดเมียมเป็นแอโนด นิกเกิล (IV) ออกไซด์เป็นแคโทด และมีสารละลายเบสเป็นอิเล็กโทรไลต์ เซลล์นิแคดให้ศักย์ไฟฟ้าประมาณ 1.4 โวลต์ เมื่อใช้งานจนศักย์ไฟฟ้าลดต่ำลงแล้วสามารถนำมาประจุไฟได้ใหม่ ปฏิกิริยาในระหว่างการประจุไฟจะเกิดย้อนกลับกับปฏิกิริยาการจ่ายไฟ เซลล์นิแคดจึงมีข้อดีที่สามารถใช้ได้เป็นระยะเวลานาน
- เซลล์สะสมไฟฟ้าแบบตะกั่ว (Lead Storage Battery)ใช้เป็นแหล่งพลังงานไฟฟ้าในรถยนต์หรือจักรยานยนต์เรียกกันทั่วไปว่า แบตเตอรี่ ถึงแม้ว่าเซลล์สะสมไฟฟ้าแบบตะกั่วจะอัดไฟใหม่ได้ แต่ก็มีการเสื่อมสภาพ เพราะ PbSO4ที่เกิดขึ้นที่ขั้วทั้งสองบางส่วนหลุดร่วงอยู่ที่ก้นภาชนะ ทำให้ขั้วทั้งสองสึกกร่อน และทำให้เสื่อมสภาพในที่สุด
การเขียนแผนภาพของเซลล์กัลวานิกมีหลักดังนี้
1. เขียนครึ่งเซลล์ที่เกิดปฏิกิริยาออกซิเดชันไว้ทางซ้ายมือ โดยเขียนขั้วไฟฟ้าไว้ทางซ้ายสุด ตามด้วยไอออนในสารละลาย และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Zn(s)/Zn2+(aq)
2. เขียนครึ่งเซลล์เซลล์ที่เกิดปฏิกิริยารีดักชันไว้ทางขวามือ โดยเขียนไอออนในสารละลายก่อน ตามด้วยขั้วไฟฟ้าไว้ทางขวาสุด และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Cu2+(aq)/Cu(s)
3. สำหรับครึ่งเซลล์ที่ประกอบด้วยโลหะกับแก๊ส ใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับแก๊สและระหว่างไอออนในสารละลาย เช่น Pt(s)/H2(g,1 atm)/H+(aq)
4. เขียนเส้นคู่ขนาน // แทนสะพานไอออนกั้นระหว่างครึ่งเซลล์ทั้งสอง เช่น
Zn(s)/Zn2+(aq)// Cu2+(aq)/Cu(s)
Pt(s)/H2(g,1 atm)/H+(1 mol/dm3)// Cu2+(1 mol/dm3)/Cu(s)
5. สำหรับครึ่งเซลล์ที่มีสารสถานะเดียวกันมากกว่าหนึ่งชนิด ให้ใช้เครื่องหมายจุลภาคคั่นระหว่างไอออนทั้งสอง เช่น
Fe(s)/Fe2+(aq),Fe3+(aq)// Cu2+(aq)/Cu(s)
การสร้างเซลล์กัลวานิก
นำโลหะต่างชนิดกันจุ่มในภาชนะทีบรรจุสารละลายที่มีอิออนของโลหะนั้นเช่น โลหะ A จุ่มใน A2+และโลหะ B จุ่มใน B2+เป็นต้น และภาชนะ 2 ใบนี้มีสะพานอิออนเชื่อมถึงกัน แล้วต่อลวดตัวนำจากขั้วทั้งสองเข้ากับโวลต์มิเตอร์ (volt meter) ซึ่งมีเข็มแสดงทิศทางการไหลของอิเล็กตรอน พบว่าเข็มกระดิกแสดงว่าอิเล็กตรอนไหล
จากรูปพบว่า
เข็มของโวลต์มิเตอร์เบนจาก A ไปยัง B แสดงว่าอิเล็กตรอนไหลจาก A ไปยัง B เราต้องการทราบสิ่งต่อไปนี้
1. ขั้วบวกและขั้วลบ
1.1 ขั้วบวก คือ ขั้วที่มีอิเล็กตรอนหนาแน่นน้อยกว่า หรือขั้ว e ไหลเข้า ได้แก่ ขั้ว B
1.2 ขั้วลบ คือ ขั้วที่มีอิเล็กตรอนหนาแน่นมากกว่า หรือขั้ว e ไหลออก ได้แก่ ขั้ว A
2. ขั้วแอโนด (Anode) และขั้วแคโทด (Cathode)
2.1 แอโนด คือขั้วที่เกิดปฏิกิริยาออกซิเดชัน ได้แก่ ขั้ว A เพราะให้ e
2.2 แคโทด คือขั้วที่เกิดปฏิกิริยารีดักชัน ได้แก่ ขั้ว B เพราะรับ e
3. แผนภาพเซลล์กัลวานิก เขียนได้ดังนี้
3.1 เขียนครึ่งเซลล์แอโนดไว้ทางซ้าย ครึ่งเซลล์แคโทดไว้ทางขวา คั่นกลางด้วยสะพานอิออน ซึ่งใช้เครื่องหมาย || หรือ //
3.2 สำหรับครึ่งเซลล์แอโนดและแคโทดเขียนอิเล็กโทรดไว้ซ้ายสุดและขวาสุด ภายในครึ่งเซลล์ถ้าต่างวัฏภาคกันใช้เครื่องหมาย / คั่น
3.3 สารละลายที่ทราบความเข้มข้นให้เขียนระบุไว้ในวงเล็บ
3.4 ถ้าครึ่งเซลล์ที่เป็นก๊าซให้ระบุความดันลงในวงเล็บด้วย
4. ปฏิกิริยาที่เกิดในเซลล์ไฟฟ้าเคมี
ปฏิกิริยาครึ่งเซลล์
4.1 แอโนด เกิดปฏิกิริยา Oxidation
4.2 แคโทด เกิดปฏิกิริยา Reduction
ปฏิกิริยาทั้งเซลล์ เป็นปฏิกิริยา Redox
5. สมการแสดงปฏิกิริยา
สมการแสดงปฏิกิริยาครึ่งเซลล์
แอโนด (Oxidation) A ----> A2+ + 2e ........ (1)
แคโทด (Reduction) B2++ 2e ------> B ........ (2)
สมการแสดงทั้งเซลล์เป็น Redox (ทำให้ e หมดไป) (1) + (2)
6. สารใดให้อิเล็กตรอนง่ายกว่าหรือเป็นตัวรีดิวซ์ดีกว่า โลหะ A > โลหะ B
7. สารใดเป็นตัวชิงอิเล็กตรอนดีกว่าหรือเป็นตัวออกซิไดซ์ดีกว่า B2+> A2+
8. ศักย์ไฟฟ้าใครสูงกว่าศักย์ไฟฟ้าที่ขั้วบวกสูงกว่าศักย์ไฟฟ้าที่ขั้วลบคือ B > A ดังนั้น กระแสจะไหลจาก B ไปยัง A สวนทางกับการเคลื่อนที่ของอิเล็กตรอน
ความต่างศักย์ = ศักย์ที่ขั้วบวก - ศักย์ที่ขั้วลบ
9. เข็มจะไม่กระดิกในกรณีที่ศักย์ทั้งสองขั้วเท่ากัน
กลับไปที่เนื้อหา
ประเภทของเซลล์ไฟฟ้าเคมี (เซลล์อิเล็กโทรไลต์)
เซลล์อิเล็กโทรไลต์คือ เซลล์ไฟฟ้าเคมีที่ใช้พลังงานไฟฟ้าให้เปลี่ยนเป็นพลังงานเคมี หรือเกิดปฏิกิริยาเคมีขึ้น นั่นเองปฏิกิริยาที่เกิดขึ้นก็จะเป็นปฏิกิริยารีดอกซ์ ซึ่งเซลล์ประเภทนี้จะมีค่า E0cell ติดลบ
เซลล์อิเล็กโทรไลต์ประกอบด้วยภาชนะที่บรรจุสารเคมีที่จะเกิดปฏิกิริยา และมีขั้วไฟฟ้าซึ่งต่ออยู่กับแหล่งไฟฟ้ากระแสตรง โดยทั่วไปมักเป็นขั้วเฉื่อยที่ไม่มีส่วนร่วมกับปฏิกิริยา ดังรูป
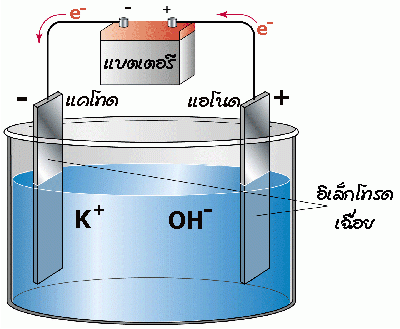
จากรูปใช้สารละลายโพแทสเซียมไฮดรอกไซด์เป็นสารละลายอิเล็กโทรไลต์ ขณะที่ผ่านไฟฟ้ากระแสตรงเข้าไป ไอออนบวก (Cation) จะเคลื่อนที่ไปยังขั้วลบ (แคโทด) และไอออนลบ (Anion) จะเคลื่อนที่ไปยังขั้วบวก (แอโนด) เพื่อให้อิเล็กตรอนถูกออกซิไดส์
ส่วนประกอบของเซลล์อิเล็กโทรไลต์
1. ขั้วไฟฟ้า(Electrode)เป็นโลหะหรือแกรไฟต์ที่นำไฟฟ้าได้ดี โดยทั่วไปมักจะใช้ขั้วเฉื่อย เช่น ขั้ว Pt สามารถจำแนกขั้วไฟฟ้าได้ดังนี้
จำแนกตามการเกิดปฏิกิริยา
1.1 ขั้วแอโนด (Anode)เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน
1.2 ขั้วแคโทด (Cathode)เป็นขั้วที่เกิดปฏิกิริยารีดักชัน
จำแนกขั้วตามการต่อเข้ากับแหล่งกำเนิดไฟฟ้า
1.1 ขั้วบวกเป็นขั้วที่ต่อเข้ากับขั้วบวกของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
1.2 ขั้วลบเป็นขั้วที่ต่อเข้ากับขั้วลบของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
2. สารอิเล็กโทรไลต์คือ สารที่มีสถานะของเหลวประกอบด้วยไอออนที่เคลื่อนที่ และนำไฟฟ้าได้
2.1 สารประกอบไอออนิกหลอมเหลวเช่น สารละลายโซเดียมคลอไรด์ที่หลอมเหลว
2.2 สารละลายอิเล็กโทรไลต์เช่น สารละลายกรด เบส เกลือ
หลักการของเซลล์อิเล็กโทรไลต์สามารถนำไปใช้ประโยชน์ได้มากมาย ดังต่อไปนี้
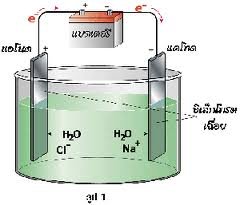
1.การแยกน้ำด้วยไฟฟ้า
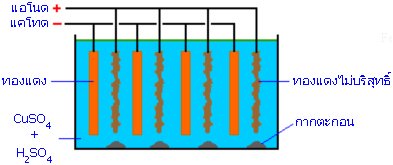
2.การทำโลหะให้บริสุทธิ์
การทำโลหะให้บริสุทธิ์ เป็นขั้นตอนหนึ่งในกระบวนการถลุงแร่ โดยทั่วไปโลหะที่ถลุงได้จากแร่มักจะมีมลทินปนอยู่เล็กน้อย เพื่อทำให้โลหะนี้บริสุทธิ์มากขึ้นจะใช้กรบวนการอิเล็กโทรลิซิส ที่เรียกว่า Electrorefining ซึ่งมีหลักการดังนี้
1) นำโลหะที่จะทำให้บริสุทธิ์ต่อเข้ากับขั้วแอโนด (ขั้วบวก)
2) ใช้โลหะบริสุทธิ์อีกแท่งหนึ่งต่อเข้ากับขั้วแคโทด (ขั้วลบ)
3) ในสารละลายอิเล็กโตรไลต์ต้องมีไอออนบวกของโลหะที่ต้องการทำให้บริสุทธิ์ประกอบอยู่ด้วย
4) ต่อเข้ากับแหล่งกำเนิดไฟฟ้ากระแสตรง และจัดให้มีศักย์ไฟฟ้าของเซลล์ที่เหมาะสม
3.การชุบโลหะ
การชุบโลหะ เป็นการทำให้โลหะมีความคงทนและสวยงาม โดยอาศัยหลักการของเซลล์อิเล็กโทรไลต์ โดยกระบวนการชุบโลหะจะใช้กระแสไฟฟ้าผ่านเข้าที่แคโทด ทำให้ไอออนของโลหะในสารละลายจะรับอิเล็กตรอน เกิดเป็นอะตอมของโลหะเกาะอยู่ที่แคโทดนั้น ขณะเดียวกันอะตอมของโลหะที่เป็นแอโนดจะเสียอิเล็กตรอนเกิดเป็นไอออนละลายในสารละลาย เพื่อชดเชยไอออนที่เสียไป ในการชุบโลหะไฟฟ้าจึงพบว่า โลหะที่เป็นแอโนดจะกร่อนไป และที่แคโทดจะมีโลหะมาเกาะเพิ่มขึ้น ดังนั้น จึงสรุปได้ว่า ในการชุบโลหะด้วยไฟฟ้านั้น ถ้าต้องการชุบด้วยโลหะใดให้จัดโลหะนั้นเป็นแอโนด สารละลายอิเล็กดทรไลต์ที่ใช้ต้องมีไอออนของโลหะชนิดเดียวกับโลหะที่เป็นแอโนด
เปรียบเทียบเซลล์กัลวานิกกับเซลล์อิเล็กโทรไลต์
| เซลล์แกลแวนิก |
เซลล์อิเล็กโทรไลต์ |
| 1. จากปฏิกิริยาเคมีเป็นพลังงานไฟฟ้า | 1. จากพลังงานไฟฟ้าเป็นปฏิกิริยาเคมี |
| 2. เป็นปฏิกิริยาที่สามารถเกิดขึ้นได้เอง | 2. เป็นปฏิกิริยาที่ไม่สามารถเกิดขึ้นได้เอง ต้องใช้พลังงานไฟฟ้าทำให้เกิดปฏิกิริยา |
| 3. ค่าศักย์ไฟฟ้าของเซลล์เป็นบวกเสมอ | 3. ค่าศักย์ไฟฟ้าของเซลล์เป็นลบ |
|
4. ขั้วแอโนดเกิดปฏิกิริยาออกซิเดชันเป็นขั้วลบ ขั้วแคโทดเกิดปฏิกิริยารีดักชันเป็นขั้วบวก |
4. ขั้วแอโนดเกิดปฏิกิริยาออกซิเดชันเป็นขั้วบวก ขั้วแคโทดเกิดปฏิกิริยารีดักชันเป็นขั้วลบ |
กลับไปที่เนื้อหา
ความก้าวหน้าทางเทคโนโลยีที่เกี่ยวข้องกับเซลล์ไฟฟ้าเคมี
สามารถนำความรู้เรื่องไฟฟ้าเคมีทั้งเซลล์กัลวานิกและเซลล์อิเล็กโทรไลต์ไปประยุกต์ใช้เพื่อพัฒนาเครื่องมือเครื่องใช้และวัสดุอุปกรณ์ต่าง ๆ ที่เกี่ยวข้องกับโลหะและสารละลายอิเล็กโทรไลต์ได้ดังตัวอย่างต่อไปนี้
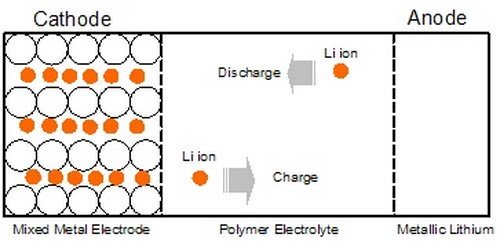
1. แบตเตอรี่อิเล็กโทรไลต์ของแข็ง
แบบเตอรี่อิเล็กโทรไลต์ของแข็ง (Solid electrolyte battery) เป็นเซลล์สะสมไฟฟ้าที่ใช้โลหะลิเทียมเป็นแอโนดและเทเนียมไดซัลไฟด์ (TiS2) เป็นแคโทด โดยอิเล็กโทรไลต์เป็นสารพวกพอลิเมอร์จึงเรียกว่าอิเล็กโทรไลต์แข็งซึ่งมีสมบัติยอมให้ไอออนผ่านได้ดี แต่ไม่ยอมให้อิเล็กตรอนผ่าน
1.1โลหะลิเทียมให้อิเล็กตรอนแล้วเปลี่ยนเป็นLi+ผ่านอิเล็กโทรไลต์ไปยังแคโทด ซึ่งมีTiS2ทำหน้าที่รับอิเล็กตรอนกลายเป็นTiS2–จากนั้นLi+กับTiS2–จะรวมกันเป็นLiTiS2อิเล็กโทรไลต์แข็งจะเป็นฉนวนต่ออิเล็กตรอน จึงทำให้เซลล์ไฟฟ้านี้ใช้งานได้โดยไม่ลัดวงจร ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
แอโนด:Li(s) →Li+(ในอิเล็กโทรไลต์แข็ง) + e–
แคโทด:TiS2(s) + e–→TiS2–(s)
ปฏิกิริยารวม:Li(s) + TiS2(s) →Li+(ในอิเล็กโทรไลต์แข็ง) + TiS2–(s)
เซลล์ชนิดนี้มีศักย์ไฟฟ้าประมาณ 3Vและเป็นเซลล์ทุติยภูมิ ปัจจุบันมีการนำไปใช้กับรถยนต์ซึ่งมีข้อดีคือไม่ต้องเติมน้ำกลั่น แต่ราคายังแพงเมื่อเปรียบเทียบกับเซลล์สะสมไฟฟ้าแบบตะกั่ว
1.2 แบตเตอรี่อิเล็กโทรไลต์แข็งอีกชนิดหนึ่งใช้โลหะลิเทียมเป็นแอโนด และใช้โลหะออกไซด์ เช่นMnO2หรือV6O13เป็นแคโทดส่วนอิเล็กโทรไลต์เป็นพอลิเมอร์ที่ยอมให้Li+ผ่านได้ แต่อิเล็กตรอนผ่านไม่ได้ ปฏิกิริยาที่เกิดขึ้นภายในเซลล์เป็นดังนี้
แอโนด:Li(s) → Li+(ในอิเล็กโทรไลต์แข็ง)+e
แคโทด:MnO2(s)+Li++e–→LiMnO2(s)
ปฏิกิริยารวม:Li(s)+MnO2(s)→LiMnO2(s)
เซลล์ชนิดนี้มีศักย์ไฟฟ้าประมาณ 3Vและเป็นเซลล์ทุติยภูมิ ออกแบบให้มีทั้งขนาดเล็กและใหญ่ เซลล์เล็กเท่าเม็ดกระดุมใช้กับเครื่องคิดเลขขนาดเล็ก นาฬิกา กล้องถ่ายรูป เซลล์ขนาดใหญ่ใช้กับเครื่องคอมพิวเตอร์
2. แบตเตอรี่อากาศ
รถยนต์ไฟฟ้าได้มีการพัฒนาขึ้นเพื่อให้สามารถเก็บสะสมปริมาณไฟฟ้าได้มากขึ้น แบตเตอรีอากาศเป็นพัฒนาการอย่างหนึ่งซึ่งใช้ออกซิเจนในอากาศเป็นตัวออกซิไดส์ใช้โลหะ เช่นZnหรือAlเป็นตัวรีดิวซ์และอาจใช้สารละลายNaOHเข้มข้นเป็นอิเล็กโทรไลต์
2.1แบตเตอรี่อะลูมิเนียม–อากาศ
ใช้Alเป็นแอโนด เมื่อต่อเซลล์โลหะAlจะเกิดปฏิกิริยาออกซิเดชันได้Al3+แต่ในสารละลายมีความเข้มข้นของOH–มาก จึงเกิดไอออนเชิงซ้อนของ[Al(OH)4]–ส่วนที่แคโทดซึ่งแท่งคาร์บอนเป็นขั้วไฟฟ้า แก๊สออกซิเจนและน้ำเกิดปฏิกิริยารีดักชันได้OH–ปฏิกิริยาที่เกิดขึ้นภายในเซลล์เป็นดังนี้
แอโนด:4 {Al(s)+4OH–(aq)→[Al(OH)4]–(aq) +3e–
แคโทด:3 {O2(g)+2H2O(l)+4e–→4OH–(aq)
ปฏิกิริยารวม:4Al(s)+O2(s)+6H2O(l)+4OH–(aq) →[Al(OH)4]–(aq)
จะเปลี่ยนไปเป็นAl(OH)3เคลือบอะลูมิเนียม ดังนั้นหลังจากใช้งานในรถยนต์ได้ระยะทางประมาณ200 กิโลเมตรต้องมีการกำจัดAl(OH)3เนื่องจากAl(OH)3เป็นฉนวนไฟฟ้า
2.2แบตเตอรี่สังกะสี–อากาศ
ใช้สังกะสีเป็นแอโนด ปฏิกิริยาที่เกิดขึ้นภายในเซลล์เป็นดังนี้
แอโนด:Zn(s)→Zn2+(aq)+2e–
แคโทด:O2(g)+2e–→O2–(g)
ปฏิกิริยารวม:Zn(s)+O2(g)→ZnO(s)
เมื่อนำแบตเตอรีไปประจุไฟ แก๊สออกซิเจนจะถูกปล่อยออกจากแบตเตอรี ส่วนZnOจะถูกรีดิวซ์ไปเป็นสังกะสี
3.การทำอิเล็กโทรไดอะลิซิสน้ำทะเล

อิเล็กโทรไดอะลิซิสเป็นเซลล์อิเล็กโทรไลต์ที่ใช้แยกไอออนจากสารละลายโดยให้ไอออนเคลื่อนที่ผ่านเยื่อแลกเปลี่ยนไอออน ซึ่งเป็นเยื่อบาง ๆ ไปยังขั้วไฟฟ้าที่มีขั้วตรงกันข้าม สารละลายจึงมีความเข้มข้นลดลง ใช้หลักการนี้ในการผลิตน้ำจืดจากน้ำทะเล
เมื่อผ่านน้ำทะเลเข้าทางช่องABและCไอออนบวกในน้ำทะเลที่ผ่านเข้าทางช่องBเช่นNa+หรือMg2+จะเคลื่อนที่ผ่านเยื่อแลกเปลี่ยนไอออนบวกเข้าหาขั้วลบ ส่วนไอออนลบ เช่นCl–SO42–จะเคลื่อนที่ผ่านเยื่อแลกเปลี่ยนไอออนลบเข้าหาขั้วบวก ดังนั้นน้ำที่ไหลออกทางช่องBจึงมีไอออนน้อยลง และถ้าไม่มีNa+ไม่มี น้ำที่ผ่านออกทางช่องBจึงเป็นน้ำจืด
อุปกรณ์ทำอิเล็กโทรไดอะลิซิสน้ำทะเล

กลับไปที่เนื้อหา
ตัวอย่างเซลล์กัลวานิก ประเภทเซลล์ปฐมภูมิ
เซลล์ปฐมภูมิมีหลายชนิด ได้แก่
1. เซลล์แห้ง (Dry Cell) หรือเซลล์เลอคลังเช (LeClanche Cell)
เซลล์ไฟฟ้าชนิดนี้ถูกเรียกว่า เซลล์แห้ง เพราะไม่ได้ใช้ของเหลวเป็นอิเล็กโทรไลต์ เป็นเซลล์ที่ใช้ในไฟฉาย หรือใช้ในประโยชน์อื่น ๆ เช่น ในวิทยุ เครื่องคิดเลข ฯลฯ ซึ่งมีลักษณะตามรูป

ส่วนประกอบของเซลล์แห้ง
กล่องของเซลล์ทำด้วยโลหะสังกะสีซึ่งทำหน้าที่เป็นขั้วแอโนด (ขั้วลบ) ส่วนแท่งคาร์บอนหรือแกรไฟต์อยู่ตรงกลางทำหน้าที่เป็นขั้วแคโทด (ขั้วบวก) ระหว่างอิเล็กโตรดทั้งสองบรรจุด้วยของผสมชื้นของแอมโมเนียมคลอไรด์ (NH4Cl) แมงกานีส (IV) ออกไซด์ (MnO2) ซิงค์คลอไรด์ (ZnCl2) ผงคาร์บอน ตอนบนของเซลล์ผนึกด้วยวัสดุที่สามารถรักษาความชื้นภายในเซลล์ให้คงที่ มีปฏิกิริยาเกิดขึ้นดังนี้
ที่ขั้วแอโนด (Zn-ขั้วลบ) Zn ถูกออกซิไดซ์กลายเป็น Zn2+
Zn(s)![]() Zn2+(aq) + 2e-
Zn2+(aq) + 2e-
ที่ขั้วแคโทด (C-ขั้วบวก) MnO2จะถูกรีดิวซ์ ไปเป็น Mn2O3
2MnO2(s) + 2NH4++(aq) + 2e-![]() Mn2O3(s) + H2O(l) + 2NH3(aq)
Mn2O3(s) + H2O(l) + 2NH3(aq)
ดังนั้นปฏิกิริยารวมจึงเป็น
Zn(s) + 2MnO2(s) + 2NH4+(aq)![]() Zn2+(aq) + Mn2O3(s) + 2NH3(aq) + H2O(l)
Zn2+(aq) + Mn2O3(s) + 2NH3(aq) + H2O(l)
แก๊ส NH3ที่เกิดขึ้นจะเข้าทำปฏิกิริยากับ Zn2+เกิดเป็นไอออนเชิงซ้อนของ [Zn(NH3)4]2+และ [Zn(NH3)2(H2O)2]2+การเกิดไอออนเชิงซ้อนนี้จะช่วยรักษาความเข้มข้นของ Zn2+ไม่ให้สูงขึ้น จึงทำให้ศักย์ไฟฟ้าของเซลล์เกือบคงที่เป็นเวลานานพอสมควร จากปฏิกิริยารวมจะสังเกตว่ามีน้ำเป็นผลิตภัณฑ์ด้วย ดังนั้นเซลล์ที่เสื่อมสภาพจึงบวมและมีน้ำไหลออกมา และเซลล์แห้งนี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์
2.เซลล์แอลคาไลน์ (Alkaline Cell)
เซลล์แอลคาไลน์มีส่วนประกอบของเซลล์เหมือนกับเซลล์เลอคลังเช แต่มีสิ่งที่แตกต่างกันคือเซลล์แอลคาไลน์ใช้เบสซึ่งได้แก่โพแตสเซียมไฮดรอกไซด์ (KOH) เป็นอิเล็กโทรไลต์แทนแอมโมเนียมคลอไรด์ (NH4Cl) และเนื่องจากใช้สารละลายเบสนี่เองเซลล์ชนิดนี้จึงถูกเรียกว่าเซลล์แอลคาไลน์
ที่ขั้วแอโนด (Zn-ขั้วลบ) Zn ถูกออกซิไดซ์
Zn(s) + 2OH-(aq)![]() ZnO(s) + H2O(l) + 2e-
ZnO(s) + H2O(l) + 2e-
ที่ขั้วแคโทด (C-ขั้วบวก) MnO2จะถูกรีดิวซ์ ไปเป็น Mn2O3
2MnO2(s) + H2O(l) + 2e-![]() Mn2O3(s) + 2OH-(aq)
Mn2O3(s) + 2OH-(aq)
สมการรวม Zn(s) + 2MnO2(s)![]() ZnO(s) + Mn2O3(s)
ZnO(s) + Mn2O3(s)
เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ แต่ให้กระแสไฟฟ้าได้มากกว่าและนานกว่าเซลล์แห้ง เพราะ OH-ที่เกิดขึ้นที่ขั้วคาร์บอนสามารถนำกลับไปใช้ที่ขั้วสังกะสีได้
3. เซลล์ปรอท (Mercury Cell)
มีหลักการเช่นเดียวกับเซลล์แอลคาไลน์ แต่ใช้เมอร์คิวรี (II) ออกไซด์ (HgO) แทนแมงกานีส (IV) ออกไซด์ (MnO2) เป็นเซลล์ที่มีขนาดเล็กใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ หรือใช้ในอุปกรณ์อื่น เช่น นาฬิกาข้อมือ เครื่องคิดเลข เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ ให้กระแสไฟฟ้าต่ำ แต่สามารถให้ค่าศักย์ไฟฟ้าคงที่ตลอดอายุการใช้งาน มีปฏิกิริยาเคมีดังนี้
ที่ขั้วแอโนด Zn(s) + 2OH-(aq)![]() ZnO(s) + H2O(l) + 2e-
ZnO(s) + H2O(l) + 2e-
ที่ขั้วแคโทด HgO(s) + H2O(l) + 2e-![]() Hg(l) + 2OH-(aq)
Hg(l) + 2OH-(aq)
ปฏิกิริยารวม Zn(s) + HgO(s)![]() ZnO(s) + Hg(l)
ZnO(s) + Hg(l)

ส่วนประกอบของเซลล์ปรอท
* ขั้ว+ และ - นี้เป็นขั้วของเซลล์ ซึ่งแสดงทิศทางของกระแสไฟฟ้า
เซลล์เชื้อเพลิง
หลักการทำงาน
องค์ประกอบสำคัญของเซลล์เชื้อเพลิงได้แก่
แอโนด (anode)เป็นขั้วไฟฟ้าที่ให้ประจุลบกับเซลล์เชื้อเพลิง มีหน้าที่ส่งผ่านประจุอิเล็กตรอนหรือประจุไฟฟ้าลบออกไปทางขั้วไฟฟ้า เมื่อต่อสายไฟกับขั้วไฟฟ้า ประจุไฟฟ้าจะไหลออกไป ส่วนแก๊สไฮโดรเจนที่ถูกดึงอิเล็กตรอนออกไป จะแสดงประจุบวก เรียกว่า โปรตอน
แคโทด (Cathode)เป็นขั้วไฟฟ้าที่ให้ประจุบวกกับเซลล์เชื้อเพลิง มีหน้าที่ต่อเข้ากับสายไฟภายนอก รับอิเล็กตรอนมารวมกับอะตอมของแก๊สออกซิเจนกับไฮโดรเจนกลายเป็นโมเลกุลของน้ำ
อิเล็กโทรไลต์ (Electrolyte)ทำจากวัสดุต่าง ๆ เช่น สารละลาย, แผ่นพลาสติก มีหน้าที่คือยอมให้ประจุบวกหรือโปรตอนเคลื่อนที่ผ่าน
เซลล์เชื้อเพลิงแบบเมมเบรนแลกเปลี่ยนโปรตรอน

หลักการทำงาน
เซลล์เชื้อเพลิงประกอบด้วยขั้วไฟฟ้า 2 ขั้วคือขั้วแอโนด(ขั้วลบ) และขั้วแคโทด(ขั้วบวก) รอบสารละลายอิเล็กโทรไลต์
ที่ขั้วแอโนด ให้แก๊สไฮโดรเจนเข้าไป แก๊สไฮโดรเจนแพร่ผ่านแอโนด แก๊สไฮโดรเจนถูกเร่งด้วยตัวเร่งปฏิกิริยาให้ไฮโดรเจนไอออนกับอิเล็กตรอน อิเล็กตรอนถูกส่งผ่านเข้าไปในสายไฟ เกิดกระแสไฟฟ้า จากนั้นเคลื่อนที่ไปยังขั้วแคโทด ดังสมการ
2H2![]() 4H++ 4e-
4H++ 4e-
ที่ขั้วแคโทด ให้แก๊สออกซิเจนจากอากาศเข้าไปที่ขั้วแคโทด เมื่อไฮโดรเจนไอออนกับอิเล็กตรอนซึ่งเคลื่อนที่มายังขั้วแคโทดทำปฏิกิริยากับแก๊สออกซิเจนจากอากาศที่ให้เข้าไปเกิดเป็นโมเลกุลของน้ำ โดยอาศัยตัวเร่งปฏิกิริยาซึ่งทำจากแพลตินัม จะเกิดปฏิกิริยารีดักชันได้น้ำบริสุทธิ์ออกมา ดังสมการ
4H++ 4e-+ O2![]() 2H2O
2H2O
แรงดันไฟฟ้าที่ได้ต่อหนึ่งเซลล์มีค่าประมาณ 1 โวลต์และได้กระแสออกมาประมาณ 10 แอมแปร์ ซึ่งถ้านำมาต่ออนุกรมกัน (fuel cell stack) 12 เซลล์ ก็จะได้แรงดันไฟฟ้า 12 โวลต์เหมือนกับแบตเตอรี่ ปฏิกิริยารวมของเซลลเชื้อเพลิงเป็นการรวมตัวของไฮโดรเจนและออกซิเจนเกิดเป็นน้ำ ดังสมการ
2H2+ O2![]() 2H2O
2H2O
กลับไปที่เนื้อหา
ตัวอย่างเซลล์กัลวานิก ประเภทเซลล์ทุติยภูมิ
แบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว (Lead Storage Battery)
แบตเตอรี่คือเซลล์ไฟฟ้าหลาย ๆ เซลล์ต่อกันเป็นอนุกรม แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วนี้เป็นแบตเตอรีที่ใช้ในรถยนต์ โดยประกอบด้วยเซลล์ไฟฟ้า 6 เซลล์ แต่ละเซลล์จะมีศักย์ไฟฟ้า 2 โวลต์ ดังนั้นแบตเตอรี่ในรถยนต์มีศักย์ไฟฟ้า 12 โวลต์

ส่วนประกอบของแบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว
|
|
|
|
|
|
เซลล์สะสมไฟฟ้าแบบตะกั่ว
1) เมื่ออัดไฟครั้งแรก 2) เมื่อจ่ายไฟ 3) เมื่ออัดไฟครั้งต่อไป
* ขั้วบวก และ ลบ ของแบตเตอรี่ รูปที่ 1) และ 3) พิจารณาตามขั้วของแบตเตอรี่ภายนอก
รูปที่ 2) พิจารณาจากทิศทางการไหลของอิเล็กตรอน
แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วจะประกอบด้วยอิเล็กโทรดคือแผ่นตะกั่ว มีกรดซัลฟิวริกเจือจางเป็นอิเล็กโทรไลต์ เมื่อมีการอัดไฟครั้งแรกแผ่นตะกั่วที่ต่อกับขั้วบวกของแบตเตอรี (ขั้วแอโนด) จะถูกออกซิไดซ์เป็นเลด (II) ไอออน ดังสมการ
Pb(s)![]() Pb2+(aq) + 2e-
Pb2+(aq) + 2e-
เมื่อรวมกับออกซิเจนที่เกิดขึ้นจะกลายเป็นเลด (IV) ออกไซด์
Pb2+(aq) + O2(g)![]() PbO2(s)
PbO2(s)
ดังนั้นที่ขั้วแอโนด (ขั้วบวก) แผ่นตะกั่วจะถูกเปลี่ยนเป็นเลด (IV) ออกไซด์ขั้วไฟฟ้าจึงแตกต่างกัน (ขั้วแอโนด-ขั้วบวก: PbO2และขั้วแคโทด-ขั้วลบ: Pb) ทำให้สามารถเกิดกระแสไฟฟ้าได้หรือจ่ายไฟได้นั่นเอง
การจ่ายไฟเกิดขึ้น ดังสมการ
ขั้วแอโนด-ขั้วลบ: Pb(s) + SO42-(aq)![]() PbSO4(s) + 2e-
PbSO4(s) + 2e-
ขั้วแคโทด-ขั้วบวก: PbO2(s) + SO42-(aq) + 4H+(aq) + 2e-![]() PbSO4(s) + 2H2O(l)
PbSO4(s) + 2H2O(l)
อิเล็กตรอนจะเคลื่อนที่จากขั้วแอโนดหรือขั้วลบผ่านวงจรภายนอกไปยังขั้วแคโทดหรือขั้วบวก จากสมการจะสังเกตได้ว่ามีผลิตภัณฑ์คือ PbSO4(s) เกิดขึ้นเหมือนกัน ดังนั้นเมื่อใช้แบตเตอรี่ไประยะหนึ่งความต่างศักย์จะลดลง และจะลดลงไปเรื่อย ๆ จนกระทั่งเป็นศูนย์ ทั้งนี้เนื่องจากขั้วไฟฟ้าทั้งคู่เหมือนกัน จึงไม่มีความแตกต่างของศักย์ไฟฟ้าระหว่างขั้วทั้งสอง
ปฏิกิริยาของเชลล์ข้างบนเป็นผันกลับได้ ดังนั้นถ้าต้องการให้เกิดการผันกลับจึงจำเป็นต้องมีการอัดไฟฟ้าใหม่ โดยการต่อขั้วบวกของเซลล์กับขั้วบวกของแบตเตอรี่และขั้วลบกับขั้วลบของแบตเตอรี่ ปฏิกิริยาข้างบนก็จะเปลี่ยนทิศทางเป็นจากขวาไปซ้าย ในลักษณะนี้เลด(II) ซัลเฟตที่ขั้วลบก็จะเปลี่ยนเป็นตะกั่ว ส่วนอีกขั้วหนึ่ง เลด (II) ซัลเฟตจะเปลี่ยนเป็นเลด (IV) ออกไซด์ ดังสมการ
ขั้วแอโนด-ขั้วบวก: PbSO4(s) + 2H2O(l)![]() PbO2(s) + SO42-(aq) + 4H+(aq) + 2e-
PbO2(s) + SO42-(aq) + 4H+(aq) + 2e-
ขั้วแคโทด-ขั้วลบ: PbSO4(s) + 2e-![]() Pb(s) + SO42-(aq)
Pb(s) + SO42-(aq)
จากปฏิกิริยาในขณะที่มีการจ่ายไฟฟ้า ความเข้มข้นของกรดจะลดลงเรื่อย ๆ จากปกติที่มีความถ่วงจำเพาะ ประมาณ 1.25 ถึง 1.30 แล้วแต่อุณหภูมิในขณะนั้น ๆ ถ้าหากเมื่อใดมีความถ่วงจำเพาะต่ำกว่า 1.20 ที่อุณหภูมิของห้องก็ควรจะมีการอัดไฟฟ้าใหม่ได้
เซลล์นิกเกิล-แคดเมียม หรือเซลล์นิแคด (Nickel-Cadmium Cell)

ที่ขั้วแอโนด:Cd(s)+ 2OH-(aq)![]() Cd(OH)2(s) + 2e-
Cd(OH)2(s) + 2e-
ที่ขั้วแคโทด: NiO2(s) + 2H2O(l) + 2e-![]() Ni(OH)2(s) + 2OH-(aq)
Ni(OH)2(s) + 2OH-(aq)
ปฏิกิริยารวม:Cd(s)+ NiO2(s) + 2H2O(l)![]() Cd(OH)2(s)+ Ni(OH)2(s)
Cd(OH)2(s)+ Ni(OH)2(s)
เซลล์ลิเทียมไอออน (Lithium Ion Cell)


เซลล์ลิเทียมอาจให้ศักย์ไฟฟ้าสูงถึง 3 โวลต์เป็นเซลล์ที่ใช้อิเล็กโทรไลต์เป็นของแข็งได้แก่สารพอลิเมอร์ที่ยอมให้ไอออนผ่านแต่ไม่ยอมให้อิเล็กตรอนผ่าน ขั้วแอโนดคือลิเทียมซึ่งเป็นธาตุที่มีค่าศักย์ไฟฟ้ารีดักชันมาตรฐานต่ำที่สุด มีความสามารถในการให้อิเล็กตรอนได้ดีที่สุด ส่วนแคโทดใช้สารที่เรียกว่าสารประกอบแทรกชั้น (Insertion Compound) ได้แก่ TiS2หรือV6O13
กลับไปที่เนื้อหา
-
7181 เซลล์ไฟฟ้าเคมี /lesson-chemistry/item/7181-2017-06-05-14-40-23เพิ่มในรายการโปรด






