สารและการจำแนก
ความหมายของสสารและสารและการเปลี่ยนแปลง
ความหมายของสสารและสาร
- สสาร (matter ) คือ สิ่งที่มีมวล ต้องการที่อยู่และสามารถสัมผัสได้ หรืออาจหมายถึงสิ่งต่างๆที่อยู่รอบตัวเรา มีตัวตน ต้องการที่อยู่ สัมผัสได้ อาจมองเห็นหรือมองไม่เห็นก็ได้ เช่น อากาศ หิน เป็นต้น นักวิทยาศาสตร์เรียกสสารที่รู้จักว่า สาร
- สาร (substance ) คือ สสารที่ศึกษาค้นคว้าจนทราบสมบัติและองค์ประกอบที่แน่นอน
- สมบัติของสาร หมายถึง ลักษณะเฉพาะตัวของสาร เช่น เนื้อสาร สี กลิ่น รส การนำไฟฟ้า การละลายน้ำ จุดเดือด จุดหลอมเหลว ความเป็นกรด–เบส เป็นต้น แบ่งสมบัติของสารออกเป็น 2 ประเภท คือ
1) สมบัติทางกายภาพ หรือสมบัติทางฟิสิกส์ ( physical properties ) หมายถึง สมบัติของสารที่สามารถสังเกตได้จากลักษณะภายนอก หรือจากการทดลองที่ไม่เกี่ยวข้องกับปฏิกิริยาเคมี เข่น สถานะ เนื้อสาร สี กลิ่น รส ความหนาแน่น จุดเดือด จุดหลอมเหลว การนำไฟฟ้า การละลายน้ำ ความแข็ง ความเหนียว เป็นต้น
2) สมบัติทางเคมี ( chemical properties ) หมายถึง สมบัติที่เกี่ยวข้องกับการเกิดปฏิกิริยาเคมีและองค์ประกอบทางเคมีของสาร เช่น การติดไฟ การผุกร่อน การทำปฏิกิริยากับน้ำ การทำปฏิกิริยากับกรด – เบส เป็นต้น
- การเปลี่ยนแปลงของสสาร สามารถแบ่งการเปลี่ยนแปลงออกได้เป็นสอง ประเภท คือ การเปลี่ยนแปลงทางกายภาพ (Physical Change) และการเปลี่ยนแปลงทางเคมี (Chemical Change)
1) การเปลี่ยนแปลงทางกายภาพ เป็นการเปลี่ยนแปลงที่สามารถสังเกตได้โดย ที่ไม่มีการเปลี่ยนแปลงองค์ประกอบภายในของสสาร แต่เกิดการจัดเรียงตัวของอนุภาคใหม่เท่านั้น ดังรูปที่ 1 การเปลี่ยนสถานะของน้ำ โดยเมื่อน้ำแข็งได้รับความร้อนจะหลอมเหลวกลายเป็นน้ำในรูปของเหลว และเมื่อได้รับความร้อนต่อไปอีกสามารถเปลี่ยนเป็นไอน้ำได้ โดย ที่ไม่มีการเปลี่ยนแปลงองค์ประกอบภายในของน้ำแต่อย่างใด
2) การเปลี่ยนแปลงทางเคมี เป็นการเปลี่ยนแปลงองค์ประกอบภายในของสสาร เกิดเป็นสารใหม่ขึ้นมา ทั้งนี้เพราะมีปฏิกิริยาเคมีเกิดขึ้นนั่นเอง การเปลี่ยนแปลงทางเคมี ได้แก่ การเผาไหม้ การย่อยอาหาร การเกิดสนิม การรวมตัวของโมเลกุลของสารต่างๆ เป็นต้น การเปลี่ยนแปลงทางเคมี ทำให้ได้สารใหม่เกิดขึ้นเสมอ ซึ่งสามารถเขียนเป็นสมการเคมีขึ้นแทนปฏิกิริยาเคมีที่เกิดขึ้นได้ ตัวอย่างของการเปลี่ยนแปลงทางเคมี เช่น การเกิดนมเปรี้ยว การปิ้งขนมปัง การเกิดสนิมของตะปู การจุดประกายของน้ำมันในเครื่องยนต์ การเกิดฟองของไฮโดรเจนเปอร์ออกไซด์ (H2O2) ในบาดแผล การจุดไม้ขีดไฟ การกินยาลดกรด เป็นต้น
- สถานะของสาร สารแบ่งออกเป็น 3 สถานะ คือ
1) ของแข็ง ( solid ) หมายถึง สารที่มีลักษณะรูปร่างไม่เปลี่ยนแปลง และมีรูปร่างเฉพาะตัว เนื่องจากอนุภาคในของแข็งจัดเรียงชิดติดกันและอัดแน่นอย่างมีระเบียบไม่มีการเคลื่อนที่หรือเคลื่อนที่ได้น้อยมาก ไม่สามารถทะลุผ่านได้และไม่สามารถบีบหรือทำให้เล็กลงได้ เช่น ไม้ หิน เหล็ก ทองคำ ดิน ทราย พลาสติก กระดาษ เป็นต้น
2) ของเหลว ( liquid ) หมายถึง สารที่มีลักษณะไหลได้ มีรูปร่างตามภาชนะที่บรรจุ เนื่องจากอนุภาคในของเหลวอยู่ห่างกันมากกว่าของแข็ง อนุภาคไม่ยึดติดกันจึงสามารถเคลื่อนที่ได้ในระยะใกล้ และมีแรงดึงดูดซึ่งกันและกัน มีปริมาตรคงที่ สามารถทะลุผ่านได้ เช่น น้ำ แอลกอฮอล์ น้ำมันพืช น้ำมันเบนซิน เป็นต้น
3) แก๊ส ( gas ) หมายถึง สารที่ลักษณะฟุ้งกระจายเต็มภาชนะที่บรรจุ เนื่องจากอนุภาคของแก๊สอยู่ห่างกันมาก มีพลังงานในการเคลื่อนที่อย่างรวดเร็วไปได้ในทุกทิศทางตลอดเวลา จึงมีแรงดึงดูดระหว่างอนุภาคน้อยมาก สามารถทะลุผ่านได้ง่าย และบีบอัดให้เล็กลงได้ง่าย เช่น อากาศ แก๊สออกซิเจน แก๊สหุงต้ม เป็นต้น
ตารางที่ 1 แสดงความแตกต่างของสารในสถานะต่างๆ
|
ของแข็ง |
ของเหลว |
แก๊ส |
|
|
|
|
แหล่งที่มา
สถาส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือเรียนสาระการเรียนรู้พื้นฐาน วิทยาศาสตร์ ชั้นมัธยมศึกษาปีที่ 2 . กรุงเทพฯ :
โรงพิมพ์คุรุสภาลาดพร้าว , 2545
Return to contents
ระบบและการเปลี่ยนแปลงของสาร
ระบบ (system) หมายถึง สิ่งที่อยู่ภายในขอบเขตที่ต้องการศึกษา การกำหนดองค์ประกอบของระบบ ขึ้นอยู่กับจุดมุ่งหมายของการศึกษา ซึ่งต้องกำหนดหรือระบุให้ชัดเจน
สิ่งแวดล้อม (environment) หมายถึง สิ่งต่างๆ ที่อยู่นอกขอบเขตที่ต้องการศึกษา ตัวอย่างการกำหนดองค์ประกอบของระบบ เช่น การศึกษาการละลายของน้ำตาลทรายในน้ำ โดยสารละลายน้ำตาลทรายจะเป็นระบบ ส่วนบีกเกอร์ ภาชนะ และแท่งแก้วจัดเป็นสิ่งแวดล้อม
ภาวะของระบบ หมายถึง สมบัติต่าง ๆ ของสาร และปัจจัยที่มีผลต่อสมบัติของระบบ เช่น ความดันบรรยากาศ อุณหภูมิ ปริมาณของสาร เมื่อระบบเกิดการเปลี่ยนแปลงแล้วจะมีการถ่ายเทพลังงานระหว่างระบบกับสิ่งแวดล้อม ดังนี้
ก. ระบบที่มีการเปลี่ยนแปลงประเภทคายความร้อน คือ ระบบที่เมื่อเกิดการเปลี่ยนแปลงแล้ว ระบบจะถ่ายเทความร้อนให้แก่สิ่งแวดล้อม ทำให้สิ่งแวดล้อมร้อนขึ้น
ข. ระบบที่มีการเปลี่ยนแปลงประเภทดูดความร้อน คือ ระบบที่เมื่อเกิดการเปลี่ยนแปลงแล้ว ระบบจะดูดความร้อนจะสิ่งแวดล้อมทำให้สิ่งแวดล้อมนั้นเย็นลง
- ประเภทของระบบ
การเปลี่ยนแปลงพลังงานระหว่างระบบและสิ่งแวดล้อม จะใช้การถ่ายเทมวลของสารเป็นเกณฑ์ในการแบ่งประเภทของระบบ ดังนี้
- ระบบเปิด (open system) หมายถึง ระบบที่มีการถ่ายเทมวลให้กับสิ่งแวดล้อม
- ระบบปิด (close system) หมายถึง ระบบที่ไม่มีการถ่ายเทมวลให้กับสิ่งแวดล้อม
- ระบบโดดเดี่ยว ( lone system) หมายถึง ระบบที่ไม่มีการถ่ายเทมวลและพลังงานให้กับสิ่งแวดล้อม

ที่มา : http://www.nakhamwit.ac.th/pingpong_web/State&Changing.htm
- การเปลี่ยนแปลงพลังงานของระบบ มี 2 ประเภท คือ
- การเปลี่ยนแปลงประเภทคายความร้อนหรือประเภทคายพลังงาน คือ การเปลี่ยนแปลงที่ระบบคายพลังงานให้แก่สิ่งแวดล้อม เนื่องจากระบบมีอุณหภูมิสูงกว่าสิ่งแวดล้อม จึงถ่ายเทพลังงานจากระบบไปสู่สิ่งแวดล้อม เช่น การละลายของโซดาไฟในน้ำ อุณหภูมิของสารละลายสูงขึ้น จึงถ่ายเทพลังงานให้กับสิ่งแวดล้อม เพื่อทำให้อุณหภูมิของระบบลดลงจนอุณหภูมิของระบบเท่ากับอุณหภูมิของสิ่งแวดล้อม
- การเปลี่ยนแปลงประเภทดูดความร้อนหรือประเภทดูดพลังงาน คือ การเปลี่ยนแปลงที่ระบบดูดพลังงานจากสิ่งแวดล้อม เนื่องจากระบบมีอุณหภูมิต่ำกว่าสิ่งแวดล้อม ระบบจะปรับตัวโดยดูดพลังงานความร้อนจากสิ่งแวดล้อมเข้าสู่ระบบ เพื่อทำให้อุณหภูมิของระบบเท่ากับอุณหภูมิของสิ่งแวดล้อม เช่น การละลายของเกลือแกงในน้ำ อุณหภูมิของสารละลายต่ำลง จึงดูดพลังงานเข้าสู่ระบบ เพื่อทำให้อุณหภูมิของระบบสูงขึ้นจนอุณหภูมิของระบบเท่ากับอุณหภูมิของสิ่งแวดล้อม
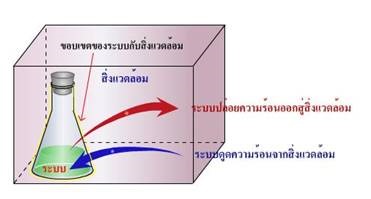
ภาพ การเปลี่ยนแปลงพลังงานของระบบ
ที่มา : http://www.nakhamwit.ac.th/pingpong_web/State&Changing.htm
- การเปลี่ยนสถานะของสาร
สารต่างๆ อาจอยู่ในสถานะก๊าซ ของเหลว หรือของแข็งก็ได้ ขึ้นอยู่กับชนิดของสาร สารแต่ละชนิดจะมีจุดเดือดและจุดหลอมเหลวต่างกัน ซึ่งเป็นคุณสมบัติเฉพาะตัวของสาร การเปลี่ยนแปลงอุณหภูมิจะมีผลต่อการเปลี่ยนแปลงสถานะของสาร โดยที่พิจารณาตามหลักการ ดังภาพ
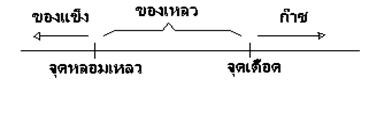 ภาพ การเปลี่ยนแปลงสถานะ
ภาพ การเปลี่ยนแปลงสถานะ
ที่มา อนุสิษฐ์ เกื้อกูล
- การเปลี่ยนแปลงของสารจากสถานะของแข็งเป็นของเหลว เรียกว่า การหลอมเหลว อุณหภูมิขณะนั้นจะคงที่เรียนกว่า จุดหลอมเหลว
- การเปลี่ยนสถานนะของสารจากของเหลวกลายเป็นไอ เรียกว่า การเดือด อุณหภูมิขณะนั้นจะคงที่เรียกว่า จุดเดือด
- พลังงานกับการเปลี่ยนแปลงของระบบ การเปลี่ยนแปลงของสารมี 3 ลักษณะ คือ การเปลี่ยนสถานะ , การละลาย และการเกิดปฏิกิริยาเคมี โดยการเปลี่ยนแปลงของสารจะ เกี่ยวข้องกับพลังงานดังต่อไปนี้
- พลังงานกับการเปลี่ยนสถานะ
การเปลี่ยนสถานะของสารเป็นการเปลี่ยนแปลงทางกายภาพ การเปลี่ยนสถานะของสารอาจเป็นการเปลี่ยนแปลงประเภทดูดพลังงานหรือคายพลังงาน ดังภาพ
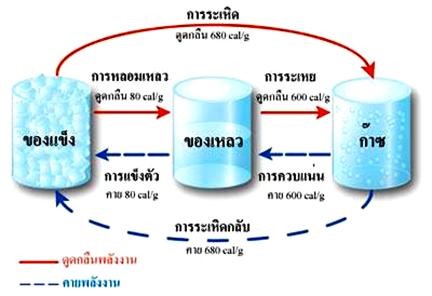
ภาพ การเปลี่ยนสถานะของสารเป็นการเปลี่ยนแปลงทางกายภาพ
ที่มา : http://www.nakhamwit.ac.th/pingpong_web/State&Changing.htm
เมื่อสารได้รับความร้อนขณะที่มีการเปลี่ยนสถานะ อุณหภูมิของสารจะไม่มีการเปลี่ยนแปลง โดยจะนำ ความร้อนที่ได้รับไปใช้เปลี่ยนสถานะ ซึ่งเรียกค่าพลังงานที่นำไปใช้ในการเปลี่ยนแปลงของสารว่า ความร้อนแฝงจำเพาะของสาร สารแต่ละชนิดจะมีค่าความร้อนแฝงจำเพาะ 2 ค่าด้วยกัน คือ
- ค่าความร้อนแฝงจำเพาะของการหลอมเหลวเป็นค่าพลังงานความร้อนที่นำมาใช้เปลี่ยนสถานะจากของแข็งเป็นของเหลว
- ค่าความร้อนแฝงจำเพาะของการกลายเป็นไอเป็นค่าพลังงานความร้อนที่นำไปใช้ในการเปลี่ยนสถานะจากของเหลวเป็นไอ
เราสามารถหาความร้อนที่ใช้ในการเปลี่ยนสถานะของสารได้จากสมการดังต่อไปนี้
ΔQ = mL
เมื่อ ΔQ คือ ความร้อนที่ใช้ในการเปลี่ยนสถานะ มีหน่วยเป็นจูล (J)
m คือ มวลของสารที่เปลี่ยนสถานะ มีหน่วยเป็นกิโลกรัม (kg)
L คือ ความร้อนแฝงจำเพาะของสาร มีหน่วยเป็น จูล/กิโลกรัม (J/kg)
ความร้อนที่ทำสารมีอุณหภูมิเปลี่ยนไป โดยสถานะของสารไม่เปลี่ยน หาได้จากสมการดังต่อไปนี้
ΔQ = cmΔT
เมื่อ ΔQ คือ ความร้อนที่ทำให้อุณหภูมิเปลี่ยน มีหน่วยเป็น จูล (J)
m คือ มวลของสารที่มีอุณหภูมิเปลี่ยนไป มีหน่วยเป็นกิโลกรัม (kg)
c คือ ความจุความร้อนจำเพาะของสาร มีหน่วยเป็น จูล/กิโลกรัมเคลวิน (J/kg K)
ΔT คือ อุณหภูมิที่เปลี่ยนไป มีหน่วยเป็น เคลวิน (K)
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือเรียนสาระการเรียนรู้พื้นฐาน วิทยาศาสตร์ชั้นมัธยมศึกษาปีที่ 2 . กรุงเทพฯ :
โรงพิมพ์คุรุสภาลาดพร้าว , 2545
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือเรียนสาระการเรียนรู้พื้นฐานและเพิ่มเติม เคมี เล่ม 2 . กรุงเทพฯ :
โรงพิมพ์คุรุสภาลาดพร้าว , 2545
Return to contents
พลังงานกับการละลายในการละลายและการเกิดปฏิกิริยาเคมี
พลังงานกับการละลายในการละลาย
เมื่อสารเกิดการละลายจะเกี่ยวข้องกับพลังงานทุกขั้น การละลายมี 2 ขั้นตอน ดังนี้
ก. อนุภาคของแข็งแยกตัวออกเป็นอนุภาคเล็ก ๆ ของแข็งมีจำนวนมากมายอยู่รวมกันโดยมีแรงยึดเหนี่ยวระหว่างกัน การแยกอนุภาคของแข็งออกจากเป็นอนุภาคเล็ก ๆ ต้องใช้พลังงาน (ดูดพลังงานจากสิ่งแวดล้อม) พลังงานนี้เรียกว่า " พลังงานแลตทิซ " (Lattice Energy)
ข. อนุภาคเล็ก ๆ ของของแข็งรวมตัวกับอนุภาคของเหลว เมื่อของแข็งแยกตัวออกเป็นอนุภาคเล็ก ๆ แล้ว อนุภาคเล็ก ๆ เหล่านี้จะกระจาย แทรกตัวอยู่ระหว่างอนุภาคของเหลว ทำให้อนุภาคเล็ก ๆ สร้างแรงยึดเหนี่ยวกับอนุภาคของเหลว การสร้างแรงยึดเหนี่ยวจะเกิดการคายพลังงานซึ่งพลังงานนี้เรียกว่า
" พลังงานโซลเวชัน " Solvation Energ ) ถ้าของเหลวที่เป็นตัวทำละลายคือ น้ำ พลังงานนี้เรียกว่า
" พลังงานไฮเดรชัน " (Hydration Energy)
ผลการละลายน้ำของสารมีการเปลี่ยนแปลงพลังงานแบบใดจะต้องพิจารณาจากพลังงานแลตทิซ และพลังงานไฮเดรชัน ดังนี้
- การเปลี่ยนแปลงแบบดูดความร้อนเมื่อพลังงานแลตทิซมากกว่าพลังงานไฮเดรชัน เช่น การละลายน้ำของโพแทสเซียมไนเตรด
- การเปลี่ยนแปลงแบบคายความร้อน เมื่อพลังงานไฮเดรชันมากกว่าพลังงานแลตทิซ เช่น การละลายน้ำของโซเดียมไฮดรอกไซด์
- พลังงานกับการเกิดปฏิกิริยาเคมี
เมื่อสารเกิดปฏิกิริยาเคมีจะต้องมีสารใหม่เกิดขึ้นทุกครั้ง วิธีพิจารณาสารใหม่ให้สังเกตการเปลี่ยนสี กลิ่น และสิ่งใหม่ที่เกิดขึ้น เช่น ฟองก๊าซ , ตะกอน หรือควัน เป็นต้น การเกิดปฏิกิริยาเคมีจะต้องเกิด 2 ขั้นตอนเหมือนกับการละลายคือ
ขั้นที่ 1 ต้องสลายแรงยึดเหนี่ยวของสารตั้งต้น ( สารเดิม ) ซึ่งจะต้องใช้พลังงาน ( ดูดพลังงาน ) แยกอนุภาคของสารออกจากกัน
ขั้นที่ 2 อนุภาคที่แยกตัวออกมาจะสร้างแรงยึดเหนี่ยวใหม่กับอนุภาคอื่น ซึ่งต้องคายพลังงานออกมาด้วย
ซึ่งปฏิกิริยาเคมีที่พลังงานขั้นที่ 1 มากกว่าขั้นที่ 2 จะเป็นการเปลี่ยนแปลงแบบดูดความร้อน เช่น ปฏิกิริยาระหว่างแอมโมเนียมคลอไรด์ ( NH4Cl ) กับ แคลเซียมไฮดรอกไซด์ ( Ca ( OH )2 ) แต่ถ้าปฏิกิริยาเคมีที่พลังงานขั้นที่ 1 น้อยกว่าขั้นที่ 2 จะเป็นการเปลี่ยนแปลง แบบคายความร้อน เช่น ปฏิกิริยาระหว่างด่างทับทิม ( KMnO4 ) , น้ำตาลทราย และน้ำ ปฏิกิริยาการเผาไหม้เชื้อเพลิง เป็นต้น
พลังงานกับการเกิดปฏิกิริยาพลังงานเคมี (Chemical energy)
เป็นพลังงานศักย์ที่แฝงอยู่ในโครงสร้างของสาร เช่น อยู่ในรูปของน้ำมันเชื้อเพลิง ไขมันซึ่งเมื่อเกิดการเผาไหม้จะปล่อยพลังงานเคมีออกมาและนำมาใช้ประโยชน์ได้พลังงานเคมีเป็นพลังงานที่มีส่วนเกี่ยวข้องและสำคัญกับสิ่งมีชีวิตมาก
ในการเกิดปฏิกิริยาของสารแต่ละปฏิกิริยานั้น ต้องมีพลังงานเข้ามาเกี่ยวข้องกับการเกิดปฏิกิริยาเคมี 2 ขั้นตอน ดังนี้
ขั้นที่ 1 เป็นขั้นที่ดูดพลังงานเข้าไปเพื่อสลายพันธะในสารตั้งต้น
ขั้นที่ 2 เป็นขั้นที่คายพลังงานออกมาเมื่อมีการสร้างพันธะในผลิตภัณฑ์
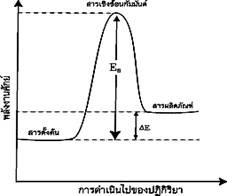
1.ปฏิกิริยาดูดความร้อน ( Endothermic reaction)
เป็นปฏิกิริยาที่ดูดพลังงานเข้าไปสลายพันธะมากกว่าที่คายออกมา เพื่อสร้าง พันธะ โดยในปฏิกิริยาดูดความร้อนนี้สารตั้งต้นจะมีพลังงานต่ำกว่าผลิตภัณฑ์ จึงทำให้สิ่งแวดล้อมเย็นลง อุณหภูมิลดลง เมื่อเอามือสัมผัสภาชนะจะรู้สึกเย็น ดังภาพ
 .
.
แผนภูมิพลังงานของปฏิกิริยาดูดความร้อน
ที่มา : http://www.atom.rmutphysics.com/charud/oldnews/231/ra_clip_image002_0000...
2.ปฏิกิริยาคายความร้อน ( Exothermic reaction)
เป็นปฏิกิริยาที่ดูดพลังงานเข้าไปสลายพันธะน้อยกว่าที่คายออกมาเพื่อสร้าง พันธะ โดยในปฏิกิริยาคายความร้อนนี้สารตั้งต้นจะมีพลังงานสูงกว่าผลิตภัณฑ์ จึงให้พลังงานความร้อนออกมาสู่สิ่งแวดล้อมทำให้อุณหภูมิสูงขึ้นเมื่อเอามือสัมผัสภาชนะจะรู้สึกร้อน ดังภาพ
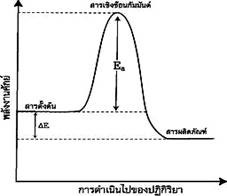
แผนภูมิพลังงานของปฏิกิริยาคายความร้อน
ที่มา : http://www.atom.rmutphysics.com/charud/oldnews/231/ra_clip_image004_0000...
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือเรียนสาระการเรียนรู้พื้นฐานและเพิ่มเติม เคมี เล่ม 3 . กรุงเทพฯ :
โรงพิมพ์คุรุสภาลาดพร้าว , 2545
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือเรียนสาระการเรียนรู้พื้นฐานและเพิ่มเติม เคมี เล่ม 1 . กรุงเทพฯ :
โรงพิมพ์คุรุสภาลาดพร้าว , 2545
Return to contents
ม.5
ม.6
นักเรียน
-
7872 สารและการจำแนก /lesson-chemistry/item/7872-2018-02-26-08-48-26เพิ่มในรายการโปรด
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.) กระทรวงศึกษาธิการ เป็นหน่วยงานของรัฐที่ไม่แสวงหากำไร ได้จัดทำเว็บไซต์คลังความรู้ SciMath เพื่อส่งเสริมการสอนวิทยาศาสตร์ คณิตศาสตร์และเทคโนโลยีทุกระดับการศึกษา โดยเน้นการศึกษาขั้นพื้นฐานเป็นหลัก หากท่านพบว่ามีข้อมูลหรือเนื้อหาใด ๆ ที่ละเมิดทรัพย์สินทางปัญญาปรากฏอยู่ในเว็บไซต์ โปรดแจ้งให้ทราบเพื่อดำเนินการแก้ปัญหาดังกล่าวโดยเร็วที่สุด
The Institute for the Promotion of Teaching Science and Technology (IPST), Ministry of Education, a non-profit organization under the Thai government, developed SciMath as a website that provides educational resources in Science, Mathematics and Technology. IPST invites visitors to use its online resources for personal, educational and other non-commercial purpose. If there are any problems, please contact us immediately.
Copyright © 2018 SCIMATH :: คลังความรู้ SciMath. Terms and Conditions. Privacy. , All Rights Reserved.
อีเมล: This email address is being protected from spambots. You need JavaScript enabled to view it. (ให้บริการในวันและเวลาราชการเท่านั้น)