อะตอม (Atom)
![]()
แนวคิดเรื่องอะตอม
การอ้างอิงถึงแนวคิดอะตอมยุคแรก ๆ สืบย้อนไปได้ถึงยุคอินเดียโบราณในศตวรรษที่ 6ก่อนคริสตกาลโดยปรากฏครั้งแรกในศาสนาเชนสำนักศึกษานยายะและไวเศษิกะได้พัฒนาทฤษฎีให้ละเอียดลึกซึ้งขึ้นว่าอะตอมประกอบกันกลายเป็นวัตถุที่ซับซ้อนกว่าได้อย่างไรทางด้านตะวันตก การอ้างอิงถึงอะตอมเริ่มขึ้นหนึ่งศตวรรษโดยลิวคิพพุ(Leucippus) ซึ่งต่อมาศิษย์ของเขาคือดีโมครีตุสได้นำแนวคิดของเขามาจัดระเบียบให้ดียิ่งขึ้น ราว 450 ปีก่อนคริสตกาล ดีโมครีตุสกำหนดคำว่าátomos(กรีก:ἄτομος) ขึ้น ซึ่งมีความหมายว่า "ตัดแยกไม่ได้" หรือ "ชิ้นส่วนของสสารที่เล็กที่สุดไม่อาจแบ่งแยกได้อีก" ทฤษฎีอะตอมเกิดขึ้นครั้งแรกโดยจอห์น ดาลตันได้ตั้งทฤษฎีเกี่ยวกับอะตอม นักวิทยาศาสตร์ในสมัยนั้นเข้าใจว่า 'อะตอม' ที่ค้นพบนั้นไม่สามารถแบ่งแยกได้อีกแล้ว ถึงแม้ต่อมาจะได้มีการค้นพบว่า 'อะตอม' ยังประกอบไปด้วย โปรตอน นิวตรอน และอิเล็กตรอน แต่นักวิทยาศาสตร์ในปัจจุบันก็ยังคงใช้คำเดิมที่ดีโมครีตุสบัญญัติเอาไว้
ในวิชาเคมีและฟิสิกส์ทฤษฎีอะตอมคือทฤษฎีที่ว่าด้วยธรรมชาติของสสาร ซึ่งกล่าวว่า สสารทุกชนิดประกอบด้วยหน่วยเล็กๆ ที่เรียกว่าอะตอม ซึ่งตรงกันข้ามกับแนวคิดดั้งเดิมที่แบ่งสสารออกเป็นหน่วยเล็กหลายชนิดตามแต่อำเภอใจ แนวคิดนี้เริ่มต้นเป็นแนวคิดเชิงปรัชญาของชาวกรีกโบราณ(ดีโมครีตุส) และชาวอินเดีย ต่อมาได้เข้ามาสู่วิทยาศาสตร์กระแสหลักในช่วงต้นคริสต์ศตวรรษที่ 19 เมื่อมีการค้นพบในสาขาวิชาเคมีซึ่งพิสูจน์ว่า พฤติกรรมของสสารนั้นดูเหมือนมันประกอบขึ้นด้วยอนุภาคขนาดเล็ก
คำว่า "อะตอม" (จากคำกริยาในภาษากรีกโบราณว่าatomos, 'แบ่งแยกไม่ได้) ถูกนำมาใช้เรียกอนุภาคพื้นฐานที่ประกอบกันขึ้นเป็นธาตุเคมี เพราะนักเคมีในยุคนั้นเชื่อว่ามันคืออนุภาคมูลฐานของสสาร อย่างไรก็ดี เมื่อเข้าสู่คริสต์ศตวรรษที่ 20 การทดลองจำนวนมากเกี่ยวกับแม่เหล็กไฟฟ้าและสารกัมมันตรังสีทำให้นักฟิสิกส์ค้นพบว่าสิ่งที่เราเรียกว่า "อะตอมซึ่งแบ่งแยกไม่ได้อีก" นั้นที่จริงแล้วยังประกอบไปด้วยอนุภาคที่เล็กกว่าอะตอมอีกจำนวนมาก (ตัวอย่างเช่นอิเล็กตรอน โปรตอน และนิวตรอน) ซึ่งสามารถแยกแยะออกจากกันได้ อันที่จริงแล้วในสภาวะแวดล้อมสุดโต่งดังเช่นดาวนิวตรอนนั้น อุณหภูมิและความดันที่สูงอย่างยิ่งยวดกลับทำให้อะตอมไม่สามารถดำรงอยู่ได้เลยด้วยซ้ำ เมื่อพบว่าแท้จริงแล้วอะตอมยังแบ่งแยกได้ ในภายหลังนักฟิสิกส์จึงคิดค้นคำว่า "อนุภาคมูลฐาน" (elementary particle) เพื่อใช้อธิบายถึงอนุภาคที่แบ่งแยกไม่ได้ วิทยาศาสตร์ที่ศึกษาเกี่ยวกับอนุภาคที่เล็กกว่าอะตอมนี้เรียกว่าฟิสิกส์อนุภาค (particle physics) ซึ่งนักฟิสิกส์ในสาขานี้หวังว่าจะสามารถค้นพบธรรมชาติพื้นฐานที่แท้จริงของอะตอมได้
ปี ค.ศ. 1803 อาจารย์ชาวอังกฤษและนักปรัชญาธรรมชาติจอห์น ดอลตัน(John Dalton) ใช้แนวคิดของอะตอมมาอธิบายว่าทำไมธาตุต่าง ๆ จึงมีปฏิกิริยาเป็นสัดส่วนของจำนวนเต็มเล็กที่สุดเสมอ คือกฎสัดส่วนพหุคูณ(law of multiple proportion) และทำไมก๊าซบางชนิดจึงสลายตัวในน้ำได้ดีกว่าสารละลายอื่น เขาเสนอว่าธาตุแต่ละชนิดประกอบด้วยอะตอมชนิดเดียวกันที่ไม่เหมือนใคร และอะตอมเหล่านี้สามารถรวมตัวเข้าด้วยกันได้กลายเป็นสารประกอบทางเคมีสิ่งที่ดอลตันกำลังคำนึงถึงนี้เป็นจุดกำเนิดแรกเริ่มของทฤษฎีอะตอมยุคใหม่
ทฤษฎีเกี่ยวกับอนุภาคอีกทฤษฎีหนึ่ง (ซึ่งเป็นส่วนขยายของทฤษฎีอะตอมด้วย) เกิดขึ้นในปี ค.ศ. 1827 เมื่อนักพฤกษศาสตร์ โรเบิร์ต บราวน์ใช้กล้องจุลทรรศน์ส่องดูเศษฝุ่นของเมล็ดข้าวที่ลอยอยู่ในน้ำ และพบว่ามันเคลื่อนที่ไปแบบกระจัดกระจายไม่แน่นอน นี่เป็นปรากฏการณ์ที่ต่อมารู้จักกันในชื่อการเคลื่อนที่แบบบราวน์ปี ค.ศ. 1877 J. Desaulx เสนอว่าปรากฏการณ์นี้มีสาเหตุมาจากการเคลื่อนของความร้อนในโมเลกุลน้ำ และในปี ค.ศ. 1905 อัลเบิร์ต ไอน์สไตน์ได้คิดค้นการวิเคราะห์ทางคณิตศาสตร์เกี่ยวกับการเคลื่อนที่ขึ้นได้เป็นครั้งแรกนักฟิสิกส์ชาวฝรั่งเศสฌอง แปร์แรงใช้งานของไอน์สไตน์เพื่อทำการทดลองระบุมวลและขนาดของอะตอม ซึ่งในเวลาต่อมาได้พิสูจน์ทฤษฎีอะตอมของดอลตัน
จากการค้นพบทฤษฎีทางวิทยาศาสตร์ข้างต้น ก่อให้เกิดทฤษฎีอะตอมขึ้นมามากมาย โดยทฤษฎีอะตอมของนักวิทยาศาสตร์แต่ละท่านล้วนพยายามคาดคะเน ทำนายรูปร่างอะตอม และสร้างแบบจำลองอะตอมขึ้นจากทฤษฎีเหล่านั้น
สรุปได้ว่า
กลับไปที่เนื้อหา
อะตอมประกอบด้วยอะไรบ้าง
แนวคิดเกี่ยวกับอะตอมกล่าวว่า"อะตอมเป็นอนุภาคที่ไม่สามารถแบ่งแยกต่อไปได้อีก"
เราเห็นด้วยกับคำกล่าวนี้หรือไม่ เพราะเหตุใด
อนุภาคในอะตอม
อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค ได้แก่
1.อิเล็กตรอน (electron)
2.โปรตอน (proton)
3.นิวตรอน (neutron)
อนุภาคขนาดเล็กคือโปรตอน, นิวตรอน และอิเล็กตรอน มีคุณสมบัติต่างกันดังตาราง
|
อนุภาค |
สัญลักษณ์ |
ประจุ(คูลอมบ์) |
น้ำหนัก(กิโลกรัม) |
|
โปรตอน |
p |
+1.60x10-19 |
1.67x10-27 |
|
นิวตรอน |
n |
ไม่มีประจุ |
1.67x10-27 |
|
อิเล็กตรอน |
e- |
-1.60x10-19 |
9.11x10-31 |
จากตาราง![]() อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ"เลขอะตอม"
อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ"เลขอะตอม"
จำนวนโปรตอน=จำนวนอิเล็กตรอน
![]() โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล"
โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล"
เลขมวล=จำนวนโปรตอน+จำนวนนิวตรอน
![]()
เมื่อ A แทน เลขมวล
Z แทน เลขอะตอม
X แทน สัญลักษณ์ของธาตุ
เช่น ![]()
เลขอะตอม=จำนวนโปรตอน=จำนวนอิเล็กตรอน
11=จำนวนโปรตอน=จำนวนอิเล็กตรอน
เลขมวล=จำนวนโปรตอน+จำนวนนิวตรอน
23=11+จำนวนนิวตรอน
จำนวนนิวตรอน=23-11=12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน, อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
จากที่กล่าวมาข้างต้น เราจะเห็นว่าอะตอมไม่ใช่ส่วนที่เล็กที่สุดของสสาร เพราะยังมีอนุภาคมูลฐานของอะตอมที่เล็กกว่า คือโปรตอนนิวตรอนและอิเล็กตรอน แต่ทราบหรือไม่ว่า...มีอนุภาคที่มีขนาดเล็กกว่าอนุภาคมูลฐานของอะตอมอีกหรือไม่ ภายในอะตอม จะประกอบด้วยอนุภาคมูลฐาน 3 ชนิด คืออิเล็กตรอน โปรตอน และนิวตรอน โดยมีแกนกลางที่ว่างขึ้น จากโปรตอนและนิวตรอน เรียกว่านิวเคลียส และมีอิเล็กตรอนที่ว่องไววิ่งอยู่รอบๆ อนุภาคเหล่านี้จะจับยึดกันอยู่ด้วยแรงสองชนิดคือ แรงแม่เหล็กไฟฟ้า และแรงนิวเคลียร์
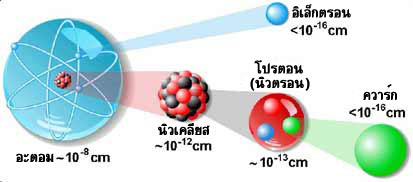
หลังปี ค.ศ. 1960 นักวิทยาศาสตร์ ได้ศึกษาพบว่า มีอนุภาคที่มีขนาดเล็กกว่าอยู่ในโปรตอนและนิวตรอน ซึ่งได้รับการตั้งชื่อภายหลังว่า"ควาร์ก" (quark)ควาร์กมีขนาดเล็กกว่าโปรตอนประมาณ 1,000 เท่า และมีพลังงานจากประจุไฟฟ้า ประมาณ 1/3 - 2/3 ของโปรตอนปัจจุบันเราพบควาร์กถึง 6 ชนิด ได้แก่ อัพ (up) ดาวน์ (down) สเตรนจ์ (Strenge) ชาร์ม (charm) ทอป (top) และบอททอม (bottom)
กลับไปที่เนื้อหา
การจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอน (electron configuration)
เมื่อพิจารณาโครงสร้างอะตอมของธาตุซึ่งมีจำนวนอิเล็กตรอนมากกว่า 1 อิเล็กตรอน การจัดเรียงตัวของอิเล็กตรอนที่เพิ่มเข้าไปต้องอาศัยหลักการดังต่อไปนี้ เข้าไปช่วยอธิบายเพราะการแก้สมการชเรอดิงเงอร์ทำได้ยาก
หลักการจัดเรียงอิเล็กตรอน
1.หลักการกีดกันของเพาลี (Pauli Exclusion Principle)
2.กฎของฮุนด์ (Hund’s Rule)
3.หลักเอาฟเบา (Aufbau principle)
สัญลักษณ์ที่ใช้ในการจัดเรียงอิเล็กตรอน![]() การจัดเรียงอิเล็กตรอนเขียนแทนด้วยแผนภาพออร์บิทัล เช่น ธาตุ He มี 2 อิเล็กตรอน เขียนแทนด้วยสัญลักษณ์ 1s2อ่านว่า หนึ่งเอสสอง
การจัดเรียงอิเล็กตรอนเขียนแทนด้วยแผนภาพออร์บิทัล เช่น ธาตุ He มี 2 อิเล็กตรอน เขียนแทนด้วยสัญลักษณ์ 1s2อ่านว่า หนึ่งเอสสอง
![]() ช่องสี่เหลี่ยมแทนออร์บิทัล โดยแต่ละออร์บิทัลบรรจุได้ 2 อิเล็กตรอน
ช่องสี่เหลี่ยมแทนออร์บิทัล โดยแต่ละออร์บิทัลบรรจุได้ 2 อิเล็กตรอน
![]() จะเห็นว่า ใน 1 ออร์บิทัลมีอิเล็กตรอน 2 ตัว เพื่อที่จะให้อิเล็กตรอนสองตัวต่างกันจึงกำหนดเลข ควอนตัมสปินจากภาพด้านบนนี้อิเล็กตรอนตัวที่ 1 สปินขึ้นส่วนตัวที่ 2 สปินลง
จะเห็นว่า ใน 1 ออร์บิทัลมีอิเล็กตรอน 2 ตัว เพื่อที่จะให้อิเล็กตรอนสองตัวต่างกันจึงกำหนดเลข ควอนตัมสปินจากภาพด้านบนนี้อิเล็กตรอนตัวที่ 1 สปินขึ้นส่วนตัวที่ 2 สปินลง
วิธีการจัดเรียงอิเล็กตรอนของธาตุที่ไม่มีประจุ
ตัวอย่างการจัดเรียงอิเล็กตรอนของธาตุนิเกิล (Ni) ซึ่งเป็นธาตุที่พบในทองเหลือง สัญลักษณ์ของธาตุคือ![]()
จากสัญลักษณ์ของธาตุ พบว่า Ni มีอิเล็กตรอน 28 ตัว จัดเรียงอิเล็กตรอนได้ดังนี้
1. จัดตามแผนผังการจัดเรียงอิเล็กตรอน
การจัดเรียงอิเล็กตรอนของ Ni ซึ่งมี 28 อิเล็กตรอน เขียนได้เป็น 1s22s22p63s23p64s23d8
2. จัดเรียงตามระดับพลังงาน
![]() การจัดเรียงอิเล็กตรอนของ Ni ซึ่งมี 28 อิเล็กตรอน เขียนได้เป็น 1s22s22p63s23p64s23d8
การจัดเรียงอิเล็กตรอนของ Ni ซึ่งมี 28 อิเล็กตรอน เขียนได้เป็น 1s22s22p63s23p64s23d8![]() จากการจัดเรียงอิเล็กตรอนของ Ni จะสังเกตเห็นว่า Ni มีอิเล็กตรอนเดี่ยวใน 3d ออร์บิทัล ทำให้มีสมบัติทางแม่เหล็กเป็น paramagnetic คือ สารที่แม่เหล็กดูด
จากการจัดเรียงอิเล็กตรอนของ Ni จะสังเกตเห็นว่า Ni มีอิเล็กตรอนเดี่ยวใน 3d ออร์บิทัล ทำให้มีสมบัติทางแม่เหล็กเป็น paramagnetic คือ สารที่แม่เหล็กดูด![]() บางธาตุมีสมบัติทางแม่เหล็กเป็น diamagnetic เช่น ธาตุนีออน(Ne) มีการจัดเรียงอิเล็กตรอนเป็น 1s22s22p6
บางธาตุมีสมบัติทางแม่เหล็กเป็น diamagnetic เช่น ธาตุนีออน(Ne) มีการจัดเรียงอิเล็กตรอนเป็น 1s22s22p6
1s22s22p6
จะเห็นว่าอิเล็กตรอนของ Ne จับคู่กันหมด จึงมีสมบัติทางแม่เหล็กเป็น diamagnetic ซึ่งจะถูกแม่เหล็กผลักเล็กน้อย
3. จัดโดยอาศัยตารางธาตุ

![]() ธาตุในคาบที่ 1, 2, 3, 4, 5, 6, 7 มีค่า n = 1, 2, 3, 4, 5, 6, 7 ตามลำดับ
ธาตุในคาบที่ 1, 2, 3, 4, 5, 6, 7 มีค่า n = 1, 2, 3, 4, 5, 6, 7 ตามลำดับ![]() ธาตุในหมู่ IA และ IIA อิเล็กตรอนตัวสุดท้ายอยู่ใน s ออร์บิทัล
ธาตุในหมู่ IA และ IIA อิเล็กตรอนตัวสุดท้ายอยู่ใน s ออร์บิทัล
ธาตุในหมู่ IIIA ถึง VIIIA อิเล็กตรอนตัวสุดท้ายอยู่ใน p ออร์บิทัล
ธาตุทรานสิชัน(transition) อิเล็กตรอนตัวสุดท้ายอยู่ใน d ออร์บิทัล
ธาตุทรานสิชันชั้นใน(inner transition) อิเล็กตรอนตัวสุดท้ายอยู่ใน f ออร์บิทัล![]() จำนวนอิเล็กตรอนคือลำดับของธาตุนั้นในกลุ่มออร์บิทัลว่าอยู่ธาตุที่เท่าใดนับจากซ้ายไปขวา
จำนวนอิเล็กตรอนคือลำดับของธาตุนั้นในกลุ่มออร์บิทัลว่าอยู่ธาตุที่เท่าใดนับจากซ้ายไปขวา
การจัดเรียงอิเล็กตรอนของธาตุในตารางธาตุ
จากแผนภาพการจัดเรียงอิเล็กตรอนของธาตุต่าง ๆ จะเห็นว่า![]() จากเลขควอนตัมแม่เหล็ก(ml) เราทราบจำนวนออร์บิทัลใน s, p, d, f ว่ามี 1, 3, 5 และ 7 ออร์บิทัล ตามลำดับ
จากเลขควอนตัมแม่เหล็ก(ml) เราทราบจำนวนออร์บิทัลใน s, p, d, f ว่ามี 1, 3, 5 และ 7 ออร์บิทัล ตามลำดับ![]() การบรรจุอิเล็กตรอนให้จัดเรียงในออร์บิทัลที่มีพลังงานต่ำก่อน ตามหลักเอาฟบาว
การบรรจุอิเล็กตรอนให้จัดเรียงในออร์บิทัลที่มีพลังงานต่ำก่อน ตามหลักเอาฟบาว![]() การบรรจุอิเล็กตรอนในออร์บิทัลที่มีพลังงานเท่ากัน ให้จัดเรียงอิเล็กตรอนเดี่ยวในออร์บิทัลให้เต็มก่อน ตามหลักของฮุนด์
การบรรจุอิเล็กตรอนในออร์บิทัลที่มีพลังงานเท่ากัน ให้จัดเรียงอิเล็กตรอนเดี่ยวในออร์บิทัลให้เต็มก่อน ตามหลักของฮุนด์![]() จะสังเกตเห็นว่า ธาตุในคอลัมน์เดียวกันจะมีจำนวนเวเลนซ์อิเล็กตรอน(อิเล็กตรอนวงนอกสุด)เท่ากัน เช่น
จะสังเกตเห็นว่า ธาตุในคอลัมน์เดียวกันจะมีจำนวนเวเลนซ์อิเล็กตรอน(อิเล็กตรอนวงนอกสุด)เท่ากัน เช่น
O [He] 2s22p4
S [He] 3s23p4
ทำให้ธาตุ O กับ S มีสมบัติทางเคมีส่วนใหญ่คล้ายกัน มีส่วนที่ต่างกันเล็กน้อย เพราะอิเล็กตรอนวงนอกสุดของ O อยู่ในระดับพลังงานที่ 2 แต่ของ S อยู่ในระดับพลังงานที่ 3
วิธีการจัดเรียงอิเล็กตรอนของไอออนของธาตุ
1. จัดเรียงอิเล็กตรอนของธาตุหลัก เช่น Ni จัดเรียงอิเล็กตรอนเป็น1s22s22p63s23p64s23d9
2. ถ้าไอออนของธาตุนั้นมีประจุบวก คือ เสียอิเล็กตรอนไปเท่ากับจำนวนประจุ เช่น Li+เสีย 1 อิเล็กตรอน, Ni2+เสีย 2 อิเล็กตรอน เป็นต้น โดยอิเล็กตรอนที่เสียไป คือ อิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุด
Ni :1s22s22p63s23p64s23d8
Ni2+:1s22s22p63s23p63d8
3. ถ้าไอออนของธาตุนั้นมีประจุลบ คือ รับอิเล็กตรอนมาเท่ากับจำนวนประจุ เช่น Cl-รับ 1 อิเล็กตรอน, O2-รับ 2 อิเล็กตรอน เป็นต้น
Cl :1s22s22p63s23p5
Cl-:1s22s22p63s23p6
กลับไปที่เนื้อหา
แบบจำลองอะตอม (Atomic model)
เป็นภาพทางความคิดที่แสดงให้เห็นรายละเอียดของโครงสร้างอะตอมที่สอดคล้องกับผลการทดลองและใช้อธิบายปรากฎการณ์ของอะตอมได้ ซึ่งหลังจากสมัยของดาลตัน ผลการทดลองของนักวิทยาศาสตร์ในรุ่นต่อมาได้ค้นพบว่าอะตอมมีโครงสร้างที่สลับซับซ้อน มีธรรมชาติที่เป็นไฟฟ้าเกี่ยวข้องอยู่ด้วย และสามารถแบ่งแยกให้เล็กลงได้อีกในบางอะตอม ดังนั้นจึงมีแบบจำลองอะตอมของนักวิทยาศาสตร์เกิดขึ้นมาอีกหลายแบบ ได้แก่
แบบจำลองอะตอมของดอลตัน
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมเพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1.ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า“อะตอม”ซึ่งแบ่งแยกไม่ได้ และทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน เช่นมีมวลเท่ากัน แต่จะมีสมบัติต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อย ๆ
ในปลายคริสต์ศตวรรษที่ 19 ได้มีการค้นพบรังสีชนิดหนึ่ง ซึ่งเรียกว่า รังสีแคโทด (cathode ray) ที่ได้จากการทดลองของนักวิทยาศาสตร์ชื่อ Julius Plicker ซึ่งใช้หลอดแก้วที่สูบอากาศออก และมีอิเล็กโตรด 2 อันอยู่คนละข้าง (แอโนดเป็นขั้วไฟฟ้าบวก และแคโทดเป็นขั้วไฟฟ้าลบ) ของหลอดแก้ว และต่อไปยังไฟฟ้าที่มีศักย์สูง ทำให้เกิดรังสีขึ้นภายในหลอดแก้ว เรียกว่า รังสีแคโทด

ภาพหลอดรังสีแคโทด
และในปี 1897 ได้มีผู้ทำการทดลองเกี่ยวกับรังสีแคโทดนี้ โดยค้นพบว่ามีอนุภาคที่มีประจุไฟฟ้าลบ ซึ่งต่อมาเรียกว่า "อิเล็กตรอน" จากรังสีแคโทด เขาผู้นี้คือเซอร์โจเซฟ จอห์น ทอมสัน ( Sir Joseph John Thomson )ดังนั้นความเชื่อที่เข้าใจกันว่าอะตอมแบ่งแยกอีกไม่ได้ จึงไม่ถูกต้องอีกต่อไป และ ทอมสันได้เสนอแบบจำลองอะตอมขึ้นใหม่ ดังนี้"อะตอมมีลักษณะเป็นรูปทรงกลมประกอบด้วยอนุภาคที่มีประจุบวก และมีอิเล็กตรอนซึ่งมีประจุไฟฟ้าลบ อะตอมโดยปกติอยู่ในสภาพเป็นกลางทางไฟฟ้าซึ่งทำให้ทั้งสองประจุนี้มีจำนวนเท่ากันและกระจายอยู่ทั่วไปอย่างสม่ำเสมอภายในอะตอมโดยมีการจัดเรียงที่ทำให้อะตอมมีสภาพเสถียรมากที่สุด" ดังรูป

แต่แบบจำลองอะตอมของทอมสันนี้ยังไม่สามารถอธิบายข้อสงสัยบางอย่างได้ เช่น ประจุไฟฟ้าบวกอยู่กันได้อย่างไรในอะตอม และ ไม่สามารถอธิบายคุณสมบัติอื่นๆของอะตอม ตัวอย่างเช่น สเปกตรัมที่แผ่ออกมาจากธาตุ จึงมีนักวิทยาศาสตร์รุ่นต่อมาค้นคว้าและทดลองเพื่อหาข้อเท็จจริงต่อมา และปัจจุบันก็ได้ทราบว่าแบบจำลองนี้ไม่ถูกต้องแบบจำลองอะตอมของรัทเทอร์ฟอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด (Ernest Rutherford)ได้ทำการทดลองยิงอนุภาคแอลฟา( นิวเคลียสของอะตอมฮีเลียม ) ไปที่แผ่นโลหะบาง ในปี พ.ศ.2449 และพบว่าอนุภาคนี้สามารถวิ่งผ่านได้เป็นจำนวนมาก แต่จะมีเพียงส่วนน้อยที่เป็นอนุภาคที่กระเจิง(การที่อนุภาคเบนจากแนวการเคลื่อนที่จากที่เดิมไปยังทิศทางต่างๆกัน) ไปจากแนวเดิมหรือสะท้อนกลับทางเดิม


จากการทดลองนี้ รัทเธอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมว่า "อะตอมมีลักษณะโปร่ง ประกอบด้วยประจุไฟฟ้าบวกที่รวมกันอยู่ที่ศูนย์กลางเรียกว่า นิวเคลียส ซึ่งถือว่าเป็นที่รวมของมวลเกือบทั้งหมดของอะตอมโดยมีอิเล็กตรอนเคลื่อนที่รอบๆนิวเคลียสด้วยระยะห่างจากนิวเคลียสมาก เมื่อเทียบกับขนาดของนิวเคลียส และระหว่างนิวเคลียสกับอิเล็กตรอนเป็นที่ว่างเปล่า"
แต่แบบจำลองนี้ยังมีข้อกังขาที่ยังไม่สามารถหาคำตอบได้คือ
1.อิเล็กตรอนที่เคลื่อนที่โดยมีความเร่งจะแผ่คลื่นแม่เหล็กไฟฟ้าออกมา ทำให้พลังงานจลน์ลดลง ทำไมอิเล็กตรอนวิ่งวนรอบนิวเคลียสตามแบบจำลองของรัทเธอร์ฟอร์ด จึงไม่สูญเสียพลังงาน และไปรวมอยู่ที่นิวเคลียส
2. อะตอมที่มีอิเล็กตรอนมากกว่าหนึ่งตัว เมื่อวิ่งวนรอบนิวเคลียสจะจัดการเรียงตัวอย่างไร
3. ประจุบวกที่รวมกันอยู่ในนิวเคลียส จะอยู่กันได้อย่างไร ทั้งๆที่เกิดแรงผลักแบบจำลองอะตอมของโบร์นักวิทยาศาสตร์ได้พยายามศึกษาเรื่องเกี่ยวกับอะตอมโดยได้เสนอแบบจำลองอะตอมจากการทดลองที่เกิดขึ้นซึ่งแบบจำลองของรัทเธอร์ฟอร์ดได้รับการยอมรับแต่ก็ยังไม่สมบูรณ์ จึงมีผู้พยายามหาคำอธิบายเพิ่มเติม
โดยในปี 1913นีล โบร์ (Niels Bohr) ได้นำทฤษฎีกลศาสตร์ควอนตัมมาประยุกต์ใช้ในการทดลอง เพื่อพัฒนาแบบจำลองอะตอมของรัทเธอร์ฟอร์ดแต่ในการทดลองของเขาสามารถอธิบายได้เฉพาะอะตอมของไฮโดรเจนที่มีอิเล็กตรอนเพียงตัวเดียว โดยได้เสนอแบบจำลองอะตอมของไฮโดรเจนว่า
1. อิเล็กตรอนจะวิ่งวนเป็นวงกลมรอบนิวเคลียส โดยมีวงโคจรบางวงที่มีอิเล็กตรอนไม่แผ่คลื่นแม่เหล็กไฟฟ้าออกมาในวงโคจรดังกล่าว
2. อิเล็กตรอนจะรับหรือปล่อยพลังงานออกมา เมื่อมีการเปลี่ยนวงโคจรที่กล่าวในข้อที่ 1 พลังงานที่อิเล็กตรอนรับหรือปล่อยออกมาจะอยู่ในรูปคลื่นแม่เหล็กไฟฟ้า


ซึ่งสมมติฐานของโบร์ สามารถอธิบายปัญหาปรากฏการณ์ของอะตอมไฮโดรเจนได้ คือ1. เหตุผลที่อิเล็กตรอนโคจรรอบนิวเคลียสของไฮโดรเจนได้โดยไม่แผ่คลื่นแม่เหล็กไฟฟ้า เพราะอิเล็กตรอนโคจรในระดับพลังงานของอะตอมบางวง ซึ่งวงในสุดจะเสถียร2. สเปกตรัมของไฮโดรเจนเกิดจากการเปลี่ยนระดับพลังงานของอิเล็กตรอนจากสถานะกระตุ้นมายังสถานะต่ำกว่า หรือสถานะพื้น จะแผ่คลื่นแม่เหล็กไฟฟ้าออกมา อาจเห็นเป็นเส้นสว่างที่ไม่ต่อเนื่อง และอาจมีความถี่อื่นๆ อีกที่ตามองไม่เห็น
แบบจำลองอะตอมของซัมเมอร์ฟิลด์
ซัมเมอร์ฟิลด์ (Summerfield) กล่าวว่า "อิเล็กตรอนจะโคจรรอบนิวเคลียส ซึ่งวงแรกจะเป็นทรงกลม วงต่อๆไปจะเป็นวงรี"

แบบจำลองอะตอมของกลุ่มหมอก
อะตอมจะประกอบด้วย กลุ่มหมอกของอิเล็กตรอนรอบ ๆ นิวเคลียส โดยมีทิศทางไม่แน่นอน โอกาสที่จะพบอิเล็กตรอนบริเวณใกล้นิวเคลียสมีมากกว่าบริเวณที่อยู่ห่างจากนิวเคลียส
เนื่องจากแบบจำลองอะตอมของโบร์ใช้อธิบายได้ดีเฉพาะธาตุไฮโรเจนซึ่งมีอิเล็กตรอนเพียงตัวเดียว ดังนั้นถ้าธาตุมีหลายอิเล็กตรอน ทฤษฏีของโบร์ไม่สามารถอธิบายได้ นักวิทยาศาสตร์จึงค้นคว้า ทดลองจนเกิดเป็นแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีลักษณะดังนี้
- อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสด้วยความเร็วสูง วงโคจรไม่จำเป็นต้องเป็นวงกลมเสมอ
- ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้
- บริเวณกลุ่มหมอกหนาทึบ แสดงว่ามีโอกาสพบอิเล็กตรอนบริเวณนั้นมาก และบริเวณที่กลุ่มหมอกจาง แสดงว่ามีโอกาสพบอิเล็กตรอนน้อย

กลับไปที่เนื้อหา
-
7168 อะตอม (Atom) /index.php/lesson-chemistry/item/7168-atomเพิ่มในรายการโปรด






