สสารและการเปลี่ยนแปลง ระดับชั้น ป.5
การเปลี่ยนสถานะของสาร
เนื่องจากนักวิทยาศาสตร์ได้แบ่งสมบัติของสารออกเป็น 2 ประเภท ได้แก่ สมบัติทางกายภาพ และสมบัติทางเคมี ดังนั้นการเปลี่ยนแปลงของสารจึงแบ่งออกเป็น 2 ประเภท ได้แก่
การเปลี่ยนแปลงทางกายภาพ ( Physical Change ) เป็นการเปลี่ยนแปลงที่ทำให้ลักษณะของสารเปลี่ยนแต่องค์ประกอบของสารยังคงเดิม นั่นคือ สารที่เปลี่ยนแปลงนั้นยังคงเป็นสารเดิมไม่ได้เปลี่ยนเป็นสารใหม่ และการเปลี่ยนแปลงนี้สามารถเปลี่ยนกลับสภาพเดิมได้โดยวิธีง่าย ๆ เช่น น้ำเปลี่ยนสถานะจากของเหลวกลายเป็นไอน้ำ องค์ประกอบก็ยังเป็น H2O และไอน้ำก็ควบแน่นกลายเป็นน้ำได้โดยวิธีง่าย ๆ
การเปลี่ยนแปลงทางเคมี ( Chemical Change ) เป็นการเปลี่ยนแปลงที่มีสารใหม่เกิดขึ้น ซึ่งสารใหม่จะมีสมบัติต่างไปจากสารเดิมและการทำสารใหม่ให้กลับไปเป็นสารเดิมทำได้ยาก เช่น การเผาแก๊สไฮโดรเจนในอากาศ แก๊สไฮโดรเจนจะทำปฏิกิริยากับแก๊สออกซิเจนเกิดเป็นน้ำซึ่งมีสมบัติต่างจากแก๊สไฮโดรเจนและแก๊สออกซิเจน และเมื่อต้องการทำให้น้ำเปลี่ยนไปเป็นแก๊สไฮโดรเจนและแก๊สออกซิเจนก็ทำได้ยาก ซึ่งการเปลี่ยนแปลงทางเคมีสามารถเขียนแทนด้วยสมการเคมีดังเช่นตัวอย่าง
2H2 + O2 - > 2H2O
จากตัวอย่างจะเห็นว่าสมการเคมีประกอบด้วยสารตั้งต้นอยู่ทางซ้ายมือแล้วตามด้วยลูกศร ซึ่งหมายถึงเกิดการเปลี่ยนแปลงทางเคมีได้เป็นผลิตภัณฑ์ซึ่งเป็นสารใหม่ทางขวามือ
บทเรียนนี้จะกล่าวถึงการเปลี่ยนแปลงทางกายภาพ นั่นก็คือ การเปลี่ยนสถานะของสสารซึ่งเป็นเรื่องที่เป็นพื้นฐานที่นักเรียนต้องทำความเข้าใจ เพื่อเป็นพื้นฐานสำคัญในการเรียนในขั้นต่อไป และสามารถอธิบายปรากฏการณ์ต่าง ๆ ของสสารรอบตัวได้
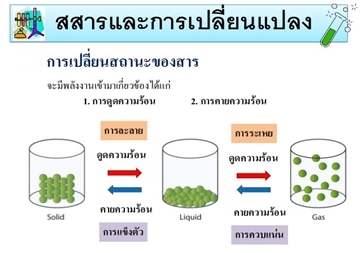
ภาพที่ 1 แผนภาพแสดงการเปลี่ยนสถานะของสาร
ที่มา: http://www.sittichok2890.wordpress.com
การหลอมเหลว ( Melting )
กระบวนการที่เกิดขึ้นเมื่อเพิ่มความร้อนให้กับของแข็ง อนุภาคภายในของแข็ง จะมีพลังงานจลน์เพิ่มขึ้น อนุภาคเกิดการสั่นมากขึ้นและมีการถ่ายเทพลังงานให้กับอนุภาคข้างเคียงอย่างต่อเนื่อง จนกระทั่งบางอนุภาคเหล่านั้นมีพลังงานสูงกว่าแรงยึดเหนี่ยวระหว่างอนุภาค อนุภาคของของแข็งจึงเคลื่อนที่และอยู่ห่างกันมากขึ้น ของแข็งจึงเปลี่ยนสถานะเป็นของเหลว

ภาพที่ 2 น้ำแข็งกำลังหลอมเหลว
ที่มา: https://pixabay.com, wolfBlur
การกลายเป็นไอ (Evaporation)
เป็นกระบวนการที่เกิดขึ้นเมื่อเพิ่มความร้อนให้กับของเหลว ทำให้อนุภาคของของเหลวมีพลังงานเพิ่มขึ้น เมื่ออนุภาคเหล่านั้นมีพลังงานสูงกว่าแรงยึดเหนี่ยวระหว่างอนุภาค จะทำให้อนุภาคของของเหลวแยกออกจากกัน ของเหลวจะเปลี่ยนเป็นแก๊สในที่สุด กระบวนการนี้เรียกว่า การกลายเป็นไอ
เรียกอุณหภูมิที่ทำให้อนุภาคชนะแรงยึดเหนี่ยวของของเหลวได้ว่า จุดเดือด ( boiling point )

ภาพที่ 3 ของเหลวกำลังกลายเป็นไอ
ที่มา: https://sites.google.com/site/karpeliynepelng/
การควบแน่น ( Condensation )
เป็นกระบวนการที่เกิดขึ้นเมื่อลดความอุณหภูมิ และเพิ่มความดันของแก๊ส จนถึงระดับหนึ่ง อนุภาคของแก๊สจะมีพลังงานจลน์น้อยลง ทำให้อนุภาคเคลื่อนที่ช้าลงและเคลื่อนที่เข้าใกล้กันมากขึ้น ทำให้เกิดแรงยึดเหนี่ยวระหว่างโมเลกุลมากขึ้น และในที่สุดจะสามารถทำให้โมเลกุลรวมกันเป็นสารในสถานะของเหลว
การแข็งตัว ( Fleezing )
เป็นกระบวนการการเปลี่ยนแปลงสถานะของสสาร จากของเหลวเปลี่ยนสถานะเป็นของแข็ง ซึ่งจำเป็นต้องถ่ายเทพลังงานภายในออกมาในรูปของการคายความร้อน เช่น น้ำ เปลี่ยนสถานะเป็น น้ำแข็ง มีการคายความร้อนเพื่อลดแรงสั่นสะเทือนของโมเลกุล เพื่อให้พันธะไฮโดรเจนสามารถยึดเหนี่ยวโมเลกุลให้จับตัวกันเป็นโครงสร้างผลึก
การระเหิด ( Sublimation )
เป็นกระบวนการที่ของแข็งมีการดูดความร้อนเข้าไปถึงระดับหนึ่งแล้วมีเปลี่ยนสถานะไปเป็นแก๊สโดยไม่ผ่านการเป็นของเหลวก่อน เรียกว่า การระเหิด ซึ่งสารดังกล่าวต้องเป็นสารประกอบที่มีความดันไอสูง สมบัติเฉพาะตัวของสารนี้สามารถนำไปใช้แยกสารเนื้อผสมที่เป็นของแข็งออกจากกัน โดยของแข็งชนิดหนึ่งมีสมบัติระเหิดได้ เช่น การบูรกับเกลือแกง เมื่อให้ความร้อนการบูรจะกลายเป็นไอแยกออกจากเกลือแกง เมื่อดักไอของการบูรด้วยภาชนะที่เย็นจะได้การบูรเป็นของแข็งแยกออกมา

ภาพที่ 4 การระเหิดของน้ำแข็งแห้ง
ที่มา: https://sites.google.com/site/krufonkuiwit/home/bth-thi-1-kar-canaek-sar/
การระเหิดกลับ ( Deposition )
เป็นกระบวนการการเปลี่ยนแปลงสถานะของสสาร จากแก๊ส กลายเป็นของแข็ง โดยไม่ผ่านสถานะของเหลว ใช้ความเย็นในการก่อตัว
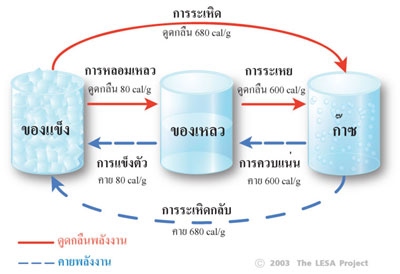
ภาพที่ 5 การเปลี่ยนสถานะของน้ำ
ที่มา: http://www.lesa.biz/earth/atmosphere/state-of-water
จากความรู้ที่กล่าวมาทั้งหมด ขอยกตัวอย่างการเปลี่ยนสถานะของน้ำ เพื่อให้นักเรียนได้เข้าใจชัดเจนยิ่งขึ้น ดังนี้
จากภาพที่ 5 เมื่อเพิ่มพลังงานความร้อนให้แก้วซึ่งบรรจุน้ำแข็ง น้ำแข็งจะดูดกลืนความร้อนนี้ไว้ โดยยังคงรักษาอุณหภูมิ 0 °C คงที่ไม่เปลี่ยนแปลง จนกว่าน้ำแข็งจะละลายหมดก้อน ความร้อนที่ถูกดูดกลืนเข้าไปจะทำลายพันธะไฮโดรเจนในโครงสร้างผลึกน้ำแข็ง ทำให้น้ำแข็งเปลี่ยนสถานะเป็นของเหลว โดยมีอัตราการดูดกลืนความร้อนแฝง 80 แคลอรี/กรัม และเมื่อเพิ่มพลังงานความร้อนให้แก้วซึ่งบรรจุน้ำ น้ำจะดูดกลืนความร้อนนี้ไว้ โดยยังคงรักษาอุณหภูมิ 100°C คงที่ไม่เปลี่ยนแปลง จนกว่าน้ำจะระเหยกลายเป็นไอน้ำหมดแก้ว โดยใช้อัตราการดูดกลืนความร้อนแฝง 600 แคลอรี/กรัม เรียกว่า การกลายเป็นไอ หรือการระเหย แต่เมื่อลดความร้อนลงถึงระดับหนึ่ง แก๊สจะเปลี่ยนสถานะเป็นของเหลว เรียกว่า การควบแน่นซึ่งน้ำจำเป็นต้องถ่ายเทพลังงานภายในออกมาในรูปของการคายความร้อนแฝง 600 แคลอรี/กรัม เพื่อลดแรงดันของระหว่างโมเลกุล
และถ้าลดความร้อนต่อไปอีกจนถึงระดับหนึ่ง ของเหลวจะเปลี่ยนสถานะเป็นของแข็ง เรียกว่า การแข็งตัว ซึ่งน้ำจำเป็นต้องถ่ายเทพลังงานภายในออกมาในรูปของการคายความร้อนแฝง 80 แคลอรี/กรัม เพื่อลดแรงสั่นสะเทือนของโมเลกุล เพื่อให้พันธะไฮโดรเจนสามารถยึดเหนี่ยวโมเลกุลให้จับตัวกันเป็นโครงสร้างผลึก การที่น้ำเปลี่ยนจากสถานะจากของแข็งเป็นแก๊สโดยตรง โดยไม่ผ่านการเป็นของเหลวก่อน เรียกว่า การระเหิด ซึ่งต้องการดูดกลืนความร้อนแฝง 680 แคลอรี/กรัม การที่น้ำเปลี่ยนจากสถานะแก๊สเป็นของแข็ง โดยไม่ผ่านการเป็นของเหลวก่อน เรียกว่า การระเหิดกลับ ซึ่งน้ำจำเป็นต้องถ่ายเทพลังงานภายในออกมาในรูปของการคายความร้อนแฝง 680 แคลอรี/กรัม
แหล่งที่มา
กระทรวงศึกษาธิการ. บทเรียนอิเล็กทรอนิกส์วิทยาศาสตร์ ป.6 เทอม 1. สืบค้นเมื่อวันที่ 12 สิงหาคม 2561. จาก http://www.mcp.ac.th/e-learning456.php
สิทธิโชค ศิริ. สารและการเปลี่ยนแปลง. สืบค้นเมื่อ 19 สิงหาคม 2561. จาก https://sittichok2890.wordpress.com/
ศูนย์การเรียนรู้วิทยาศาสตร์โลกและดาราศาสตร์. การเปลี่ยนแปลงสถานะของน้ำ. สืบค้นเมื่อ 19 สิงหาคม 2561. จาก http://www.lesa.biz/earth/atmosphere/state-of-water



