การเปลี่ยนแปลงทางเคมี
การเกิดปฏิกิริยาเคมีหรือการเปลี่ยนแปลงทางเคมีของสาร เป็นการเปลี่ยนแปลงที่ทำให้เกิดสารใหม่ โดยสารที่เข้าทำปฏิกิริยา เรียกว่า สารตั้งต้น ( Reactant ) สารใหม่ที่เกิดขึ้นจากปฏิกิริยา เรียกว่า ผลิตภัณฑ์ ( Product ) โดยการเปลี่ยนแปลงดังกล่าวมีลักษณะดังต่อไปนี้
- เป็นการเปลี่ยนแปลงที่ทำให้เกิดสารชนิดใหม่ และไม่สามารถทำให้กลับมาเป็นสารเดิมได้
- มีการเปลี่ยนแปลงองค์ประกอบของสาร โดยอะตอมของสารตั้งต้นจะมีการจัดเรียงตัวใหม่ได้เป็นผลิตภัณฑ์ ซึ่งมีสมบัติแตกต่างจากสารตั้งต้น และอะตอมแต่ละชนิดก่อนและหลังเกิดปฏิกิริยาเคมีมีจำนวนเท่ากัน
- เมื่อเกิดปฏิกิริยาเคมี มวลรวมของสารตั้งต้นเท่ากับมวลรวมของผลิตภัณฑ์ ซึ่งเป็นไปตามกฎทรงมวล

ภาพที่ 1 การเกิดปฏิกิริยาเผาไหม้
ที่มา: https://pixabay.com, Alexas_Fotos
การเกิดปฏิกิริยาเคมีสามารถเขียนแทนได้ด้วยสมการข้อความ ซึ่งแสดงชื่อของสารตั้งต้นและผลิตภัณฑ์ เช่น
เราสามารถเขียนปฏิกิริยาเผาไหม้ได้ ดังนี้ เชื้อเพลิง + ออกซิเจน -- > คาร์บอนไดออกไซด์ + น้ำ
ปฏิกิริยาการเผาไหม้เป็นปฏิกิริยาระหว่างสารกับออกซิเจน สารที่เกิดปฏิกิริยาการเผาไหม้ส่วนใหญ่เป็นสารประกอบที่มีคาร์บอนและไฮโดรเจนเป็นองค์ประกอบ ซึ่งถ้าเกิดการเผาไหม้อย่างสมบูรณ์ จะได้ผลิตภัณฑ์เป็นคาร์บอนไดออกไซด์และน้ำ
การเกิดปฏิกิริยาเคมี โดยทั่วไปจะพบได้ 2 ลักษณะ ได้แก่
-
ปฏิกิริยาที่ผันกลับไม่ได้ ( Irreversible reaction ) เป็นปฏิกิริยาที่ดำเนินไปทิศทางเดียวคือจากสารตั้งต้นเปลี่ยนแปลงไปเป็นผลิตภัณฑ์และเกิดขึ้นอย่างสมบูรณ์ ปฏิกิริยาจะยุติเมื่อสารตั้งต้นสารได้สารหนึ่งหมดและเป็นปฏิกิริยาที่ไม่ย้อนกลับ เช่น การเผาไหม้น้ำมันเชื้อเพลิง ปฏิกิริยาที่โลหะสังกะสีทำปฏิกิริยากับกรดไฮโดรคลอริก เกิดก๊าซไฮโดรเจน การเผาไหม้ลวดแมกนีเซียม การเกิดสนิมเหล็ก เป็นต้น
-
ปฏิกิริยาผันกลับได้ ( Reversible reaction ) เป็นปฏิกิริยาที่สารตั้งต้นทำปฏิกิริยากัน ได้ผลิตภัณฑ์ และในขณะเดียวกัน ผลิตภัณฑ์ที่เกิดขึ้นบางส่วนทำปฏิกิริยากันกลับเป็นสารตั้งต้นใหม่ ทำให้ปฏิกิริยาเกิดไม่สมบูรณ์ ไม่ว่าจะใช้เวลานานเท่าใดก็ตาม ภายในระบบยังคงมีทั้งสารตั้งต้นทุกชนิดเหลือ และผลิตภัณฑ์เกิดขึ้นทุกชนิด และระบบจะมีทั้งการเกิดปฏิกิริยาไปข้างหน้า และปฏิกิริยาย้อนกลับ เช่น ปฏิกิริยาของ CuSO4 กับกรดไฮโดรคลอริก
ข้อสังเกตเกี่ยวกับปฏิกิริยาผันกลับได้
-
เป็นผลิตภัณฑ์ที่เกิดขึ้นจากสารผลผลิตจากปฏิกิริยาทำปฏิกิริยากัน ได้ผลผลิตที่เป็นสารผลิตภัณฑ์
-
ปฏิกิริยาไปข้างหน้า และปฏิกิริยาผันกลับเกิดขึ้นพร้อมกัน
-
ถ้าเริ่มต้นจากปฏิกิริยาด้านใด ให้ถือว่าปฏิกิริยานั้นเป็นปฏิกิริยาไปข้างหน้า
-
เขียนลูกศรคู่ (⇌) ในสมการ เพื่อแสดงว่าปฏิกิริยาผันกลับได้
-
พบในปฏิกิริยาการสลายตัว ปฏิกิริยารวมตัวและปฏิกิริยาแทนที่
-
ปฏิกิริยาผันกลับเกิดขึ้นได้หรือไม่นั้น ขึ้นอยู่กับภาวะของปฏิกิริยา เช่น อุณหภูมิ ความดัน สภาพละลายได้ และค่าคงที่สมดุลของปฏิกิริยา
-
ปฏิกิริยาจะผันกลับได้มากน้อยเพียงใด ขึ้นอยู่กับค่าคงที่สมดุลของปฏิกิริยานั้น
ปฏิกิริยาเคมีที่พบในชีวิตประจำวันมีหลายชนิด เช่น ปฏิกิริยาการเผาไหม้ การเกิดสนิมของเหล็ก
ปฏิกิริยาของกรดกับโลหะ ปฏิกิริยาของกรดกับเบส ปฏิกิริยาของเบสกับโลหะ การเกิดฝนกรด การสังเคราะห์ด้วยแสง เป็นต้น

ภาพที่ 2 ปฏิกิริยาการเกิดสนิมเหล็กทำให้วัตถุที่เป็นเหล็กผุพัง
ที่มา: https://pixabay.com, Brian 60174
และเมื่อเกิดปฏิกิริยาเคมี จะมีการเปลี่ยนแปลงพลังงานเกิดขึ้น อาจเป็นการดูดพลังงาน หรือคายพลังงานโดยมีรายละเอียดดังนี้
- ปฏิกิริยาดูดความร้อน ( Endothermic reaction ) เป็นปฏิกิริยาที่มีการดูดพลังงานเข้าไปสลายพันธะมากกว่าที่คายออกมาตอนสร้างพันธะหรือจัดเรียงอะตอมใหม่ โดยปฏิกิริยาแบบนี้สารตั้งต้นจะมีพลังงานต่ำกว่าผลิตภัณฑ์ มีการดูดพลังงานความร้อนจากสิ่งแวดล้อมเข้าไป ทำให้อุณหภูมิสูงขึ้น แต่สิ่งแวดล้อมอุณหภูมิต่ำลง เมื่อเอามือสัมผัสภาชนะจะรู้สึกเย็น เช่น ปฏิกิริยาการสังเคราะห์ด้วยแสงของพืช การละลายของเกลือในน้ำ
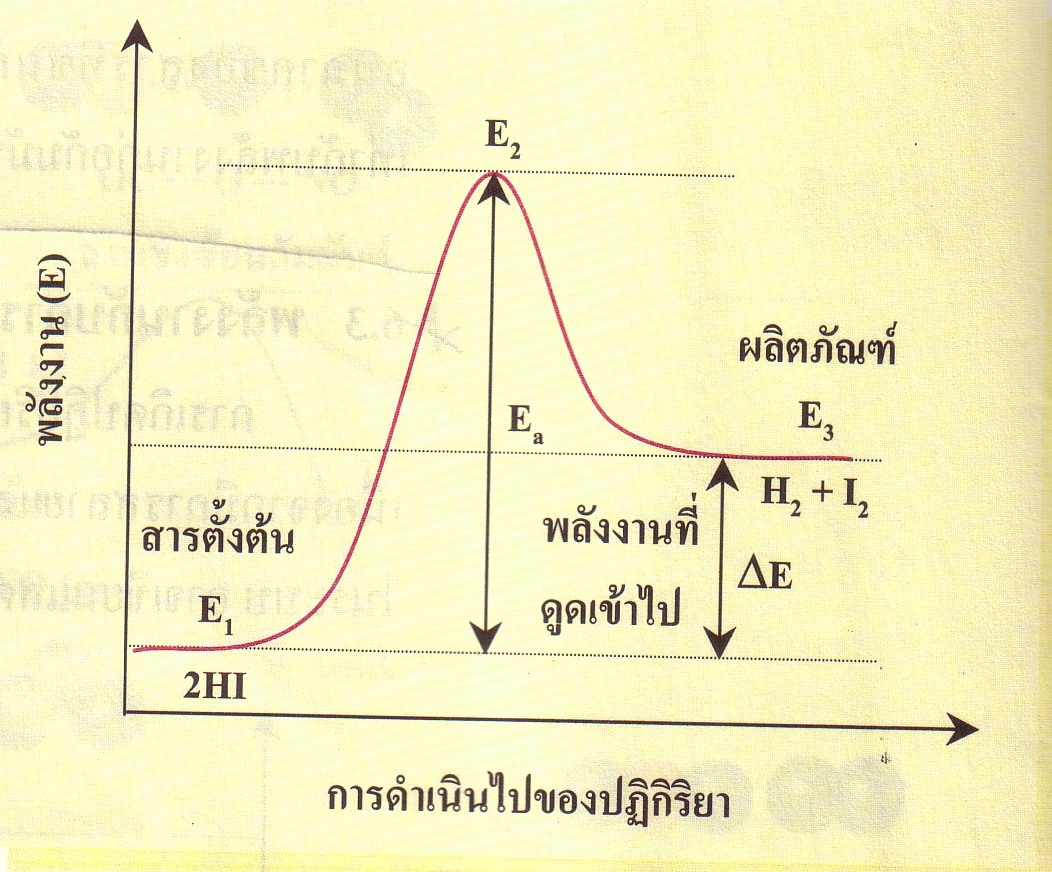
ภาพที่ 3 กราฟแสดงความสัมพันธ์ระหว่างพลังงานกับการดำเนินไปของปฏิกิริยาดูดความร้อน
ที่มา : www.thaigoodview.com/library/teachershow/nongkhai/onuma-b/chemical/sec01p09.html
จากกราฟจะเห็นว่า สารตั้งต้นมีพลังงานเท่ากับ E1 และผลิตภัณฑ์ที่เกิดขึ้นมีพลังงานเท่ากับ E3 ซึ่งมีค่าสูงกว่า E1 ระบบจึงต้องดูดพลังงานเข้าไปมีค่าเท่ากับ E3 - E1 = +ΔE ปฏิกิริยานี้จึงเป็นปฏิกิริยาดูดพลังงาน
- ปฏิกิริยาคายความร้อน ( Exothermic reaction ) เป็นปฏิกิริยาที่มีการดูดพลังงานเข้าไปสลายพันธะน้อยกว่าที่คายออกมาตอนสร้างพันธะหรือจัดเรียงอะตอมใหม่ เมื่อเกิดปฏิกิริยาแล้วจะให้ความร้อนออกมา ทำให้สิ่งแวดล้อมมีอุณหภูมิสูงขึ้น แต่อุณหภูมิของสารลดลง เช่น ปฏิกิริยาการเผาไหม้ของเชื้อเพลิง ปฏิกิริยาระหว่างโซดาไฟ ( NaOH (s) ) กับน้ำ
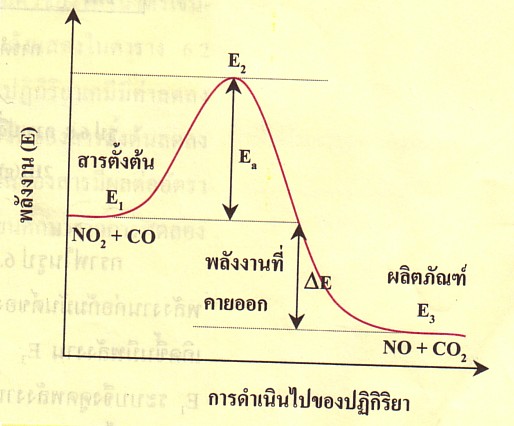
ภาพที่ 4 กราฟแสดงความสัมพันธ์ระหว่างพลังงานกับการดำเนินไปของปฏิกิริยาดูดความร้อน
ที่มา : www.thaigoodview.com/library/teachershow/nongkhai/onuma-b/chemical/sec01p08.html
จากกราฟจะเห็นว่า สารตั้งต้นมีพลังงานเท่ากับ E1 และผลิตภัณฑ์ที่เกิดขึ้นมีพลังงานเท่ากับ E3 เนื่องจากผลิตภัณฑ์มีพลังงานต่ำกว่าสารตั้งต้น ระบบจึงต้องคายพลังงานออกมามีค่าเท่ากับ E3 - E1 = -ΔE ปฏิกิริยานี้จึงเป็นปฏิกิริยาคายพลังงาน ปฏิกิริยาเคมีที่พบในชีวิตประจำวันมีทั้งประโยชน์และโทษต่อสิ่งมีชีวิตและสิ่งแวดล้อม เราจึงต้องระมัดระวังผลจากปฏิกิริยาเคมี ตลอดจนรู้จักวิธีป้องกันและแก้ปัญหาที่เกิดจากปฏิกิริยาเคมีที่พบ
ในชีวิตประจำวัน ตัวอย่างปฏิกิริยาและการนำความรู้ไปใช้ประโยชน์ในชีวิตประจำวันของเรา ได้แก่
-
แอปเปิลที่ปอกทิ้งไว้ทำปฏิกิริยากับออกซิเจนในอากาศเกิดสีน้ำตาล การป้องกันไม่ให้เนื้อของแอปเปิลเปลี่ยนเป็นสีน้ำตาล ทำได้โดยการเก็บในกล่องสุญญากาศ หรือแช่ในสารละลายน้ำตาล น้ำเกลือ เพื่อเป็นการป้องกันไม่ให้เนื้อแอปเปิลสัมผัสกับออกซิเจนในอากาศนั่นเอง และอีกวิธีหนึ่ง คือการยับยั้งเอนไซม์โพลีฟีนอลออกซิเดส ซึ่งเป็นตัวเร่งปฏิกิริยาทำให้สารประกอบฟีนอลในแอปเปิลกลายเป็น Ortho-quinones หรือ O-quinones จากนั้น quinones จะทำปฏิกิริยากับกรดอะมิโนหรือโปรตีน ได้เป็นเมลานิน ที่เป็นสาเหตุของสีน้ำตาลบนเนื้อแอปเปิล เราสามารถยับยั้งการทำงานของเอนไซม์ชนิดนี้ได้โดย การแช่ในน้ำมะนาว หรือ แช่ในน้ำเดือด 2-3 นาที
-
ปฏิกิริยาการเผาไหม้น้ำมันเชื้อเพลิง หรือแก๊สหุงต้ม ที่สมบูรณ์ จะได้แก๊สคาร์บอนไดออกไซด์ ไอน้ำ และความร้อน คาร์บอนไดออกไซด์เป็นตัวการดูดซึมรังสีอินฟาเรด ( คลื่นยาว ) ซึ่งโลกแผ่กลับสู่บรรยากาศ ดังนั้นถึงแม้จะเกิดการเผาไหม้แบบสมบูรณ์ก็ตาม ก็เกิดผลเสียต่อโลกคือ ทำให้โลกไม่สามารถสะท้อนรังสีและความร้อนกลับออกนอกโลกได้ จึงทำให้โลกของเรามีอุณหภูมิสูงมากขึ้น เกิดเป็นภาวะโลกร้อน หากเกิดการเผาไหม้ที่ไม่สมบูรณ์ จะเกิดเขม่าควัน แก๊สคาร์บอนมอนออกไซด์ และไอน้ำ ซึ่งแก๊สคาร์บอมอนออกไซด์เป็นแก๊สพิษที่เป็นอันตรายต่อสุขภาพมนุษย์เนื่องจากเป็นแก๊สที่ไม่มีกลิ่น ทำให้เข้าสู่ร่างกายได้โดยที่เราไม่รู้ตัวและเมื่อแก๊สชนิดนี้เมื่อเข้าสู่ร่างกายสามารถสะสมอยู่ในร่างกายได้โดยจะไปรวมตัวกับฮีโมโกลบินในเม็ดเลือดแดงได้ดีกว่าออกซิเจนประมาณ 200-250 เท่า ทำให้การลำเลียงออกซิเจนไปสู่เซลล์ต่างๆ ของร่างกายลดน้อยลง ส่งผลให้ร่างกายเกิดอาการอ่อนเพลีย สมองขาดออกซิเจน และถ้าได้รับก๊าซคาร์บอนมอนอนไซด์ในปริมาณมากอาจทำให้ร่างกายเกิดอาการขาดออกซิเจนเฉียบพลันถึงขึ้นเสียชีวิตได้
-
การทำปฏิกิริยาของกรดในน้ำยาล้างห้องน้ำกับปูนยากระเบื้อง ซึ่ง น้ำยาล้างห้องน้ำทุกชนิดจะมีส่วนประกอบหลักที่สำคัญ คือ กรดไฮโดรคลอริก ( Hydrochloric Acid ) ซึ่งเป็นกรดแก่ มีฤทธิ์กัดก่อนโลหะ ทำปฏิกิริยากับโลหะหรือสารเคมีอื่นจะทำให้เกิดแก๊สไฮโดรเจนคลอไรด์ ที่มีฤทธิ์ระคายเคืองต่อระบบหายใจ และทำปฏิกิริยากับหินปูนทำให้เกิดแก๊สคาร์บอนไดออกไซด์ ดังนั้นเราควรศึกษาวิธีการใช้ให้เข้าใจเพื่อความปลอดภัยของผู้ใช้เอง ในขณะใช้ควรสวมถุงมือยาง รองเท้าบูท แว่นตากันสารเคมี และสวมผ้าปิดจมูกทุกครั้ง เพื่อป้องกันการสัมผัสโดยตรง และก่อนใช้ควรผสมน้ำ เพื่อให้ลดความเข้มข้นของกรดไฮโดรคลอกริก
-
การทำปฏิกิริยาระหว่างเหล็กและออกซิเจนในความชื้นทำให้เกิดสนิมเหล็ก ทำให้วัตถุที่ทำจากเหล็กเก่า ผุพัง วิธีการป้องกัน ได้แก่ การทาสี การรมดำ ทาน้ำมัน การเคลือบพลาสติก เป็นการป้องกันผิวของวัตถุสัมผัสกับออกซิเจนและความชื้น
แหล่งที่มา
Learning Innovation Center. การเปลี่ยนแปลงที่ผันกลับได้. สืบค้นเมื่อวันที่ 24 กุมภาพันธ์ 2562 . จาก https://www.youtube.com/watch?v=8fBfSAKdpB8
วิชัย ลิขิตพรรักษ์. ปฏิกิริยาเคมี. สืบค้นเมื่อวันที่ 2 มีนาคม 2562 .จาก https://www.slideshare.net/meemahidol/2-2-48873855
Generalic, Eni. Aug 29, 2017. Retardation factor. Croatian-English Chemistry Dictionary & Glossary. Retrieved Oct 15, 2018. From https://glossary.periodni.com
อรอุมา บวรศักดิ์. อัตราการเกิดปฏิกิริยาเคมี. สืบค้นเมื่อวันที่ 2 มีนาคม 2562. จาก http://www.thaigoodview.com/library/teachershow/nongkhai/onuma-b/chemical/sec01p08-p09.html



