สมบัติของธาตุตามตารางธาตุ
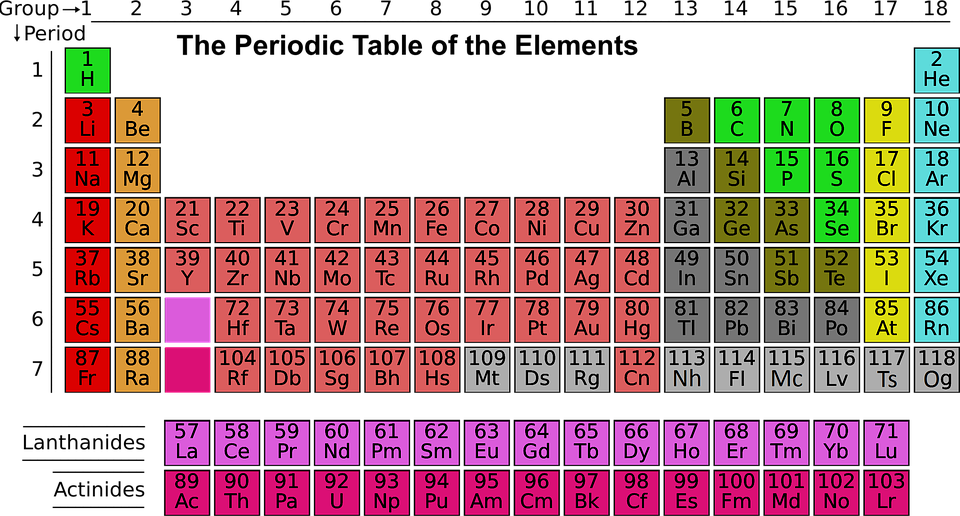
ภาพที่ 1 ตารางธาตุในปัจจุบัน
ที่มา: https://pixabay.com , ExplorersInternational
ธาตุจัดเป็นหมวดหมู่ได้อย่างเป็นระบบ โดยอาศัยตารางธาตุ ซึ่งในปัจจุบันจัดเรียงตามเลขอะตอม และความคล้ายคลึงของสมบัติ แบ่งออกเป็นหมู่ซึ่งเป็นแถวในแนวตั้งจำนวน 18 หมู่ และคาบซึ่งเป็นแถวในแนวนอนจำนวน 7 คาบ ธาตุทุกตัวนับตั้งแต่มีเลขอะตอมเท่ากับ 1 ( ไฮโดรเจน ) จนถึง 118 ( ออกาเนสซอน ) ถูกค้นพบหรือมีการสังเคราะห์ขึ้นมา ทำให้ตารางธาตุในปัจจุบันมีครบทั้ง 7 คาบ โดยธาตุ 98 ตัวแรกพบได้ในธรรมชาติถึงแม้ว่าบางตัวจะมีปริมาณน้อย และถูกสังเคราะห์ขึ้นก่อนที่จะพบในธรรมชาติก็ตาม ส่วนธาตุที่มีเลขอะตอมเท่ากับ 99 ถึง 118 ถูกสังเคราะห์ขึ้นทั้งสิ้นในห้องปฏิบัติการทางวิทยาศาสตร์หรือในเตาปฏิกรณ์นิวเคลียร์
ธาตุในแนวตั้ง แบ่งเป็น 2 กลุ่มใหญ่ ๆ คือกลุ่ม A และ B ซึ่งกลุ่ม A มี 8 หมู่ คือ IA ถึง VIIIA มีรายละเอียดของแต่ละหมู่ ดังนี้
- หมู่ IA มีชื่อว่า โลหะอัลคาไล ( alkalai metals ) มีสมบัติเป็นโลหะที่มีความว่องไวในปฏิกิริยามาก มีอิเล็กตรอนวงนอกสุด 1 ตัว
- หมู่ IIA มีชื่อว่า โลหะอัลคาไลน์เอิร์ท ( alkalaine earth metals ) มีสมบัติเป็นโลหะ มีอิเล็กตรอนวงนอกสุด 2 ตัว ธาตุที่ว่องไวในปฏิกิริยาที่สุดในหมู่นี้คือ เรเดียม ( Ra )
- หมู่ IIIA ประกอบด้วยโลหะและอโลหะ มีอิเล็กตรอนวงนอกสุด 3 ตัว
- หมู่ IVA มีอิเล็กตรอนวงนอกสุด 4 ตัว
- หมู่ VA มีอิเล็กตรอนวงนอกสุด 5 ตัว
- หมู่ VIA ตอนต้นหมู่จะมีธาตุที่มีสมบัติเป็นอโลหะ แล้วค่อย ๆ เป็นโลหะ
- หมู่ VIIA มีชื่อว่า แฮโลเจน ( Halogens ) ธาตุหมู่นี้เป็นอโลหะที่ว่องไวต่อปฏิกิริยามาก
กลุ่ม B มี 8 หมู่ คือ IB ถึง VIIIB เรียกว่า ธาตุทรานซิชัน ( Transition elements ) ได้แก่
- Lanthanide series ประกอบด้วยธาตุที่มีเลขอะตอม 57 – 71 เป็นธาตุที่หายากมาก
- Actinide series ประกอบด้วยธาตุที่มีเลขอะตอม 89 – 103 ธาตุหมู่นี้มีคุณสมบัติเป็นสารกัมมันตรังสี
หลังจากที่ได้ทำความรู้จักกับตารางธาตุที่ใช้ในปัจจุบันกันแล้ว ในบทนี้จะขอกล่าวถึงสมบัติของธาตุตามตารางธาตุ ในเรื่องขนาดอะตอม ขนาดไอออน พลังงานไอออไนเซชัน ( IE ) ค่าอิเล็กตรอนอัฟฟินิตี ( EA ) และค่าอิเล็กโตรเนกาติวิตี้ ( EN ) ดังรายละเอียดที่จะกล่าวต่อไปนี้
ขนาดอะตอม
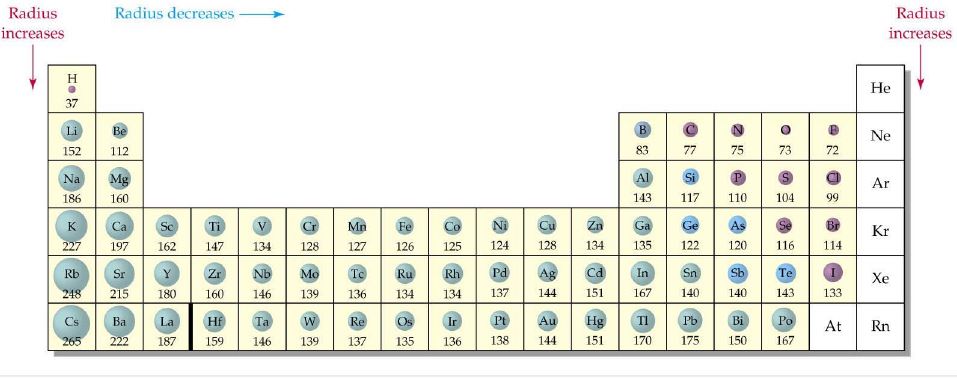
ถ้าพิจารณาธาตุทุก ๆ หมู่ และทุก ๆ คาบในตารางธาตุ สามารถแสดงแนวโน้มของขนาดอะตอมได้ดังภาพที่ 2
ภาพที่ 2 ขนาดอะตอมของธาตุและรัศมีอะตอมของธาตุตามตารางธาตุ
ที่มา: สุนทร พรจำเริญ
จากภาพที่ 2 แสดงขนาดอะตอมและรัศมีอะตอมของธาตุตามตารางธาตุ สามารถสรุปได้ว่า
- ธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้น ขนาดอะตอมจะใหญ่ขึ้น เพราะธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้น จะมีระดับพลังงานเพิ่มขึ้น แม้ว่าจำนวนโปรตอนจะเพิ่มขึ้นด้วยก็ตาม แต่แรงดึงดูดต่อเวเลนซ์อิเล็กตรอนมีน้อย จึงทำให้ขนาดใหญ่ขึ้น ในกรณีนี้การเพิ่มระดับพลังงานมีผลมากกว่าการเพิ่มจำนวนโปรตอน
- ธาตุในคาบเดียวกัน เมื่อเลขอะตอมเพิ่มขึ้น ขนาดอะตอมจะเล็กลง เนื่องจากธาตุในคาบเดียวกันมีจำนวนระดับพลังงานเท่ากัน แต่เมื่อเลขอะตอมเพิ่มขึ้น จำนวนโปรตอนจะเพิ่มขึ้นด้วย แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนเพิ่มขึ้น ขนาดจึงลดลง
ขนาดไอออน
- ไอออนของโลหะ
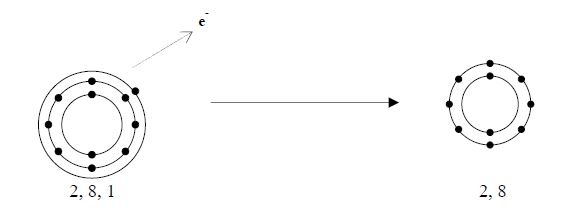
ไอออนของโลหะเกิดจากอะตอมให้อิเล็กตรอน แล้วเกิดเป็นไอออนบวก เช่น 11Na มีการจัดเรียงอิเล็กตรอนเป็น 2, 8, 1 ให้อิเล็กตรอน 1 ตัว เหลืออิเล็กตรอนเป็น 2, 8 ดังรูป
การเกิดไอออนบวกนั้น ขนาดของไอออนเล็กกว่าอะตอมเดิม เพราะ ระดับพลังงานลดลง จำนวนโปรตอนมากกว่าอิเล็กตรอน ส่งผลให้แรงดึงดูดของนิวเคลียสต่ออิเล็กตรอนมีค่าสูงขึ้น อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากขึ้น ขนาดของไอออนจึงเล็กลง
ไอออนของโลหะในหมู่เดียวกันจะมีขนาดใหญ่ขึ้นเมื่อเลขอะตอมเพิ่มขึ้น และไอออนของโลหะในคาบเดียวกันจะมีขนาดเล็กลงเมื่อเลขอะตอมเพิ่มขึ้น
- ไอออนของอโลหะ
ไอออนของอโลหะเกิดจากอะตอมรับอิเล็กตรอน แล้วเกิดไอออนลบซึ่งใหญ่กว่าอะตอมเดิม เพราะอิเล็กตรอนที่รับเพิ่มเข้ามาจะผลักกับอิเล็กตรอนเดิม ทำให้อิเล็กตรอนอยู่ไกลจากนิวเคลียสมากขึ้น ขนาดไอออนจึงใหญ่ขึ้น เช่น 17Cl มีการจัดเรียงอิเล็กตรอนเป็น 2, 8, 7 รับอิเล็กตรอน 1 ตัว มีการจัดเรียงอิเล็กตรอนเป็น 2, 8, 8 ดังรูป
ไอออนของอโลหะในหมู่เดียวกันจะมีขนาดใหญ่ขึ้นเมื่อเลขอะตอมเพิ่มขึ้น และไอออนของอโลหะในคาบเดียวกันจะมีขนาดเล็กลง เมื่อเลขอะตอมเพิ่มขึ้น
พลังงานไอออไนเซชัน ( IE )
พลังงานไอออไนเซชัน ( IE ) เป็นพลังงานที่ใช้ดึงอิเล็กตรอนวงนอกสุดให้หลุดออกจากอะตอมในสถานะแก๊ส โดยมีหลักการว่า อะตอมใดมีขนาดเล็ก แรงดึงดูดของนิวเคลียสต่ออิเล็กตรอนมาก จึงทำให้อิเล็กตรอนหลุดออกยาก ค่า IE จึงมีค่าน้อยและอะตอมใดมีขนาดใหญ่ แรงดึงดูดของนิวเคลียสต่ออิเล็กตรอนน้อย จึงทำให้อิเล็กตรอนหลุดออกง่าย ค่า IE จึงมีค่ามาก
แนวโน้มของค่าพลังงานไอออไนเซชัน ในตารางธาตุ ดังแสดงในภาพที่ 3
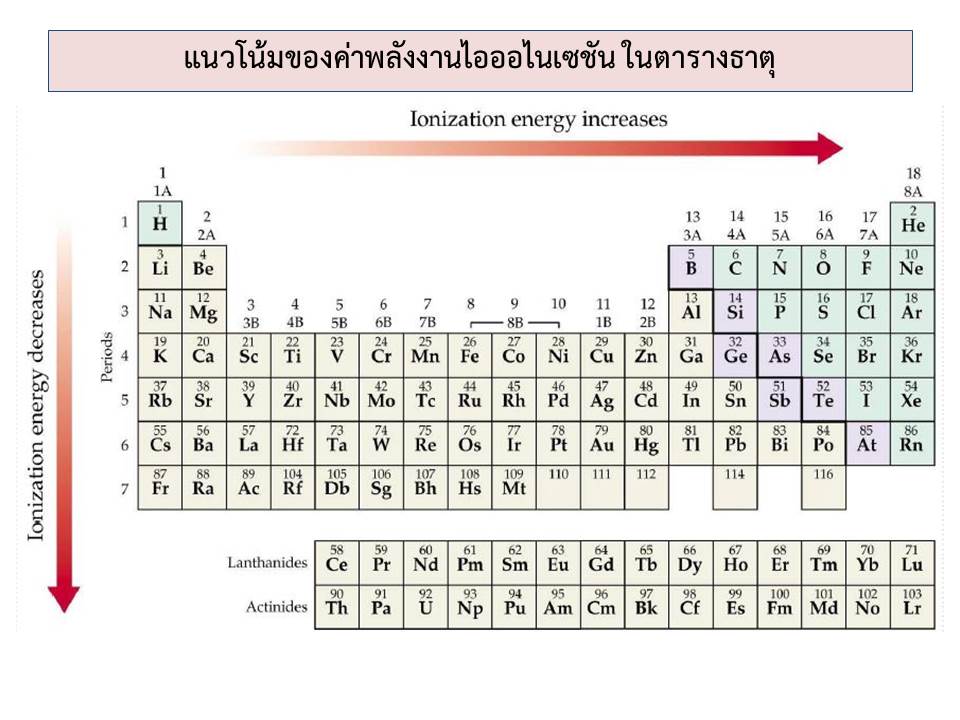
ภาพที่ 3 แนวโน้มของค่าพลังงานไอออไนเซชัน ในตารางธาตุ
ที่มา: ศุภาวิตา จรรยา ดัดแปลงจากภาพของ สุนทร พรจำเริญ
จากภาพที่ 3 แสดงแนวโน้มของค่าพลังงานไอออไนเซชัน ในตารางธาตุ สามารถสรุปได้ว่า
- ธาตุในหมู่เดียวกัน ค่า IE จะลดลงเมื่อเลขอะตอมเพิ่มขึ้น ทั้งนี้เพราะธาตุในหมู่เดียวกัน เมื่อเลขอะตอมเพิ่มขึ้น ขนาดของอะตอมจะใหญ่ขึ้น การดึงอิเล็กตรอนออกจากอะตอมขนาดใหญ่ ซึ่งมีแรงดึงดูดระหว่างอิเล็กตรอนวงนอกสุดกับนิวเคลียสน้อย ย่อมง่ายกว่าการดึงอิเล็กตรอนจากอะตอมเล็ก ที่มีแรงดึงดูดระหว่างอิเล็กตรอนวงนอกสุดกับนิวเคลียสมาก
- ธาตุในคาบเดียวกัน ค่า IE จะเพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น ทั้งนี้เพราะขนาดอะตอมเล็กลงการดึงดูดระหว่างอิเล็กตรอนวงนอกสุดกับนิวเคลียสเพิ่มขึ้น การดึงอิเล็กตรอนออกจากอะตอมจึงทำได้ยากขึ้น ค่าพลังงานไอออไนเซชันจึงสูงขึ้น
อิเล็กตรอนอัฟฟินิตี ( EA )
อิเล็กตรอนอัฟฟินิตี ( Electron Affinity ) หมายถึง พลังงานที่คายออกมาเมื่ออะตอมที่เป็นกลางในสถานะแก๊ส รับอิเล็กตรอน 1 ตัว กลายเป็นไอออนลบในสภาวะแก๊ส ดังสมการ
X (g) + e - X- (g) + พลังงานอิเล็กตรอนอัฟฟินิตี
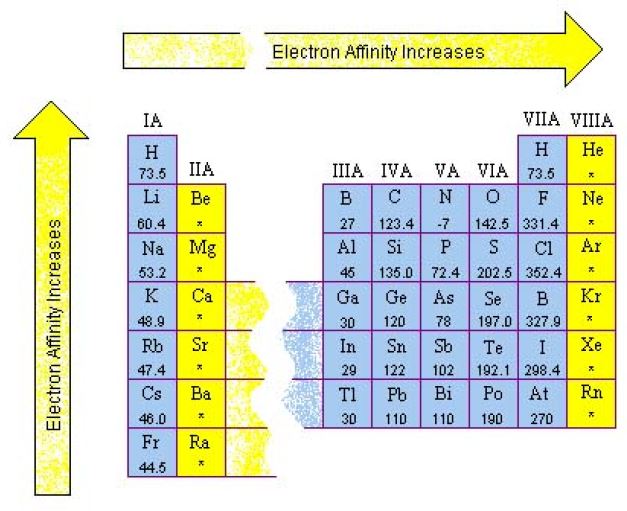
ภาพที่ 4 แนวโน้มของค่าอิเล็กตรอนอัฟฟินิตี ในตารางธาตุ
ที่มา: สุนทร พรจำเริญ
จากภาพที่ 4 สามารถสรุปได้ว่า
- ธาตุในหมู่เดียวกัน ค่า EA ลดลงจากบนลงล่าง เพราะธาตุข้างบนมีขนาดเล็กกว่าธาตุข้างล่าง จึงมีแรงดึงดูดระหว่างประจุบวกที่นิวเคลียสกับอิเล็กตรอนที่เพิ่มเข้าในอะตอมได้มากกว่า ระยะทางจากนิวเคลียสถึงขอบเขตของอะตอมสั้นกว่าอะตอมที่มีขนาดใหญ่ที่อยู่ข้างล่างของหมู่ ธาตุข้างบนรับอิเล็กตรอนได้ดีกว่าธาตุข้างล่าง EA จึงมากกว่า
- ธาตุในคาบเดียวกัน ค่า EA เพิ่มขึ้นจากซ้ายไปขวาของตารางธาตุ เพราะธาตุทางขวามีขนาดเล็กกว่าธาตุทางซ้ายมือ จะรับอิเล็กตรอนได้ดีกว่า อิเล็กตรอนที่เข้ามาใหม่จะถูกดึงดูดด้วยนิวเคลียสได้มาก EA จะสูง
อิเล็กโตรเนกาติวิตี้ ( EN )
อิเล็กโตรเนกาติวิตี้ ( Electronegativity ) เป็นค่าสมมติที่แสดงความสามารถในการดึงดูดอิเล็กตรอนคู่ร่วมพันธะ โดยอิเล็กตรอนคู่ร่วมพันธะของอะตอมที่มีขนาดเล็ก จะได้รับแรงดึงดูดจากนิวเคลียสมาก ค่า EN จึงสูง ส่วนอิเล็กตรอนคู่ร่วมพันธะของอะตอมที่มีขนาดใหญ่ จะได้รับแรงดึงดูดจากนิวเคลียสน้อย ค่า EN จึงต่ำ
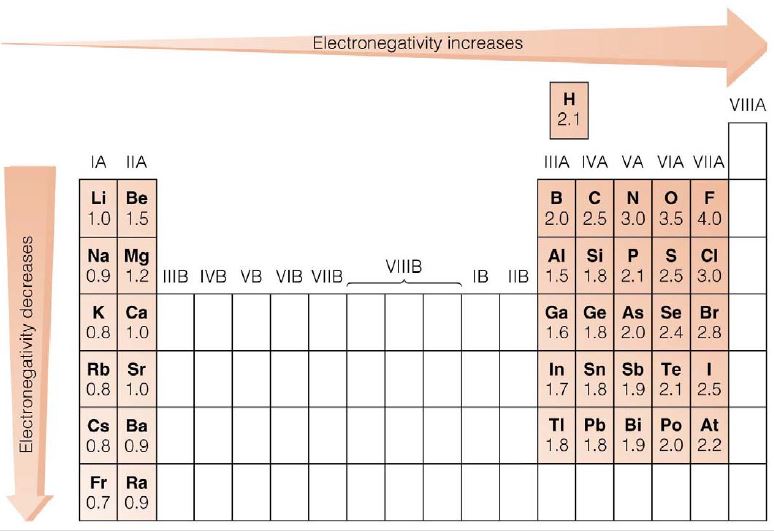
ภาพที่ 5 แนวโน้มของค่าอิเล็กโตรเนกาติวิตี้ ในตารางธาตุ
ที่มา: สุนทร พรจำเริญ
จากภาพที่ 5 สามารถสรุปได้ว่า
- ธาตุในหมู่เดียวกัน ค่า EN จะลดลงจากบนลงล่าง เพราะขนาดอะตอมใหญ่ขึ้นทำให้นิวเคลียสมีโอกาสดึงดูดอิเล็กตรอนได้น้อยกว่าอะตอมที่มีขนาดเล็ก EN จึงต่ำลง
- ธาตุในคาบเดียวกัน ค่า EN จะเพิ่มขึ้นจากซ้ายไปขวา เพราะขนาดของอะตอมเล็กลงทำให้ได้รับแรงดึงดูดจากนิวเคลียสมากกว่าอะตอมที่มีขนาดใหญ่ EN จึงสูงขึ้น
แหล่งที่มา
วิกิพีเดีย สารานุกรมเสรี. ตารางธาตุ. สืบค้นเมื่อวันที่ 28 เมษายน 2562 . จาก https:// th.wikipedia.org/wiki/ตารางธาตุ
สุนทร พรจำเริญ. ตารางธาตุ. สืบค้นเมื่อวันที่ 28 เมษายน 2562 . จาก www.rmutphysics.com/charud/PDF-learning/5/periodic/periodic%20table.pdf
Vop. (2018, 21, 6). ตารางธาตุที่ใช้งานกันอยู่ทุกวันนี้ ใกล้ถึงต้องเพิ่มแถวขึ้นมาใหม่. สืบค้นเมื่อวันที่ 28 เมษายน 2562 . จาก https://jimmysoftwareblog.com/node/8695
Witold Nazarewicz et al. (2018, 20, Jun). Researchers Explore Limits of the Periodic Table of Elements. Retrieved April 27, 2019, from www.sci-news.com/physics/periodic-table-limits-06118.html
-
10319 สมบัติของธาตุตามตารางธาตุ /lesson-chemistry/item/10319-2019-05-13-05-56-00เพิ่มในรายการโปรด