เซลล์ไฟฟ้าเคมีและความก้าวหน้าทางเทคโนโลยีที่เกี่ยวข้อง
เซลล์อิเล็กโตรไลต์ คือ เซลล์ไฟฟ้าเคมีชนิดหนึ่งที่ใช้พลังงานไฟฟ้าทำให้เกิดปฏิกิริยาเคมี กล่าวคือ เมื่อผ่านกระแสไฟฟ้าเข้าไปในเซลล์ จะทำให้เกิดปฏิกิริยารีดอกซ์ขึ้นในเซลล์นั้น เซลล์ประเภทนี้จะมีค่า <0(เครื่องหมายติดลบ) และภายในเซลล์จะมีสารอิเล็กโทรไลต์ ซึ่งสารนี้สามารถจะแตกตัวเป็นไอออนบวก และไอออนลบ และทำให้เกิดนำไฟฟ้าได้

ภาพประกอบบทเรียน เซลล์ไฟฟ้าเคมีและความก้าวหน้าทางเทคโนโลยีที่เกี่ยวข้อง
ที่มา ดัดแปลงจาก https://pixabay.com , Clker-Free-Vector-Images
ส่วนประกอบของเซลล์อิเล็กโทรไลต์
- ขั้วไฟฟ้า (Electrode) เป็นโลหะหรือแกร์ไฟต์ที่นำไฟฟ้าได้ โดยทั่วไปมักจะใช้ขั้วเฉื่อยในเซลล์หนึ่ง ๆ จำแนกขั้วตามเกณฑ์ต่าง ๆ ดังนี้
การจำขั้วตามสมการการเกิดปฏิกิริยาเคมี
ก. ขั้วแอโนด (Anode) เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน
ข. ขั้วแคโทด (Cathode) เป็นขั้วที่เกิดปฏิกิริยารีดักชัน
การจำแนกขั้วตามการต่อเข้ากับแหล่งกำเนิดไฟฟ้า
ก. ขั้วบวก เป็นขั้วที่ต่อเข้ากับขั้วบวกของแหล่งกำเนิดไฟฟ้า [ ซึ่งขั้วนี้จะเกิดปฏิกิริยาออกซิเดชัน คือไอออนลบในสารละลายจะให้ อิเล็กตรอนแก่ขั้วไฟฟ้าบวก) ]
ข. ขั้วลบ เป็นขั้วที่ต่อเข้ากับขั้วลบของแหล่งกำเนิดไฟฟ้า [ ซึ่งขั้วนี้จะเกิดปฏิกิริยารีดักชันเกิดขึ้น คือ ไอออนบวกในสารละลายจะมารับอิเล็กตรอนที่ขั้วนี้ ]
- สารอิเล็กโตรไลต์ คือ สารที่มีสถานะเป็นของเหลวประกอบด้วยไอออนที่เคลื่อนที่ และนำไฟฟ้าได้ เช่น

กระบวนการอิเล็กโทรลิซิส (Electrolysis)
คือ กระบวนการแยกสารอิเล็กโตรไลต์โดยการผ่านไฟฟ้ากระแสตรงลงไปในสารละลาย อิเล็กโตรไลต์ แล้วทำให้เกิดปฏิกิริยาเคมีเกิดขึ้นที่ขั้วบวก และขั้วลบของเซลล์อิเล็กโทรไลต์นั้น
ลักษณะสำคัญของอิเล็กโทรลิซิส
- กระแสไฟฟ้าที่ใช้ผ่านลงไปในเซลล์ ต้องเป็นไฟฟ้ากระแสตรง (D.C.) คือ กระแสอิเล็กตรอน
- ปฏิกิริยาเคมีที่เกิดขึ้น เป็นปฏิกิริยารีดอกซ์
- ขั้วไฟฟ้าที่ใช้ในเซลล์นี้นิยมใช้ขั้วเฉื่อย เพราะถ้าใช้ขั้วว่องไว ขั้วอาจจะมีส่วนร่วมในการเกิดปฏิกิริยาเคมีก็ได้
ประโยชน์ของกระบวนการอิเล็กโทรลิซิส
ก. การแยกสารประกออบไอออนิกหลอมเหลวด้วยไฟฟ้า เช่น เกลือ NaCl เมื่อถูกทำให้หลอมเหลว จะเกิดเป็นไอออนบวก และไอออนลบ ซึ่งเมื่อผ่านกระแสไฟฟ้าลงไป จะทำให้ ไอออนบวกเคลื่อนที่เข้าหาขั้วลบ เพื่อเข้าไปรับอิเล็กตรอนหรือเกิดปฏิกิริยารีดักชัน ส่วนไอออนลบ จะเคลื่อนที่เข้าหาขั้วบวก เพื่อจ่ายอิเล็กตรอน หรือเกิดปฏิกิริยาออกซิเดชัน
ข. การแยกสารละลายอิเล็กโตรไลต์ด้วยไฟฟ้า
สารละลายอิเล็กโตรไลต์จะประกอบด้วยตัวถูกละลายชนิดต่าง ๆ ที่เป็นสารอิเล็กโทรไลต์ และ น้ำ ซึ่งทำหน้าที่เป็นตัวทำละลาย เช่น สารละลายของ NaCl (aq) จะมี ไอออนบวกคือ Na+ (aq) และไอออนลบ คือ Cl- (aq) ซึ่งไอออนทั้งสองถูกน้ำล้อมรอบอยู่ (aq = aqueous มีน้ำล้อมรอบ) ดังนั้น ในสารละลายนี้จึงมีองค์ประกอบ 3 ชนิด ได้แก่ น้ำ (ตัวทำละลาย) , Na+ (aq) และ Cl- (aq) (ตัวถูกละลาย)
การแยกสารละลายอิเล็กโตรไลต์ด้วยไฟฟ้า ที่เกิดขึ้นคือ น้ำและไอออนลบของตัวถูกละลายจะเคลื่อนที่เข้าหาขั้วบวก เพื่อไปให้อิเล็กตรอน เกิด ปฏิกิริยาออกซิเดชัน ซึ่งสารใดจะเป็นตัวให้อิเล็กตรอนหรือเกิดปฏิกิริยาออกซิเดชัน พิจารณาจากค่า E0 ถ้ามีค่า E0 ต่ำ สารนั้นจะเป็นตัวเกิด ปฏิกิริยาออกซิเดชัน คือ เกิดการให้อิเล็กตรอนที่ขั้วบวกนั้นได้ดีกว่า ที่เหลือก็ไม่เกิดปฏิกิริยาใด ๆ
ส่วนน้ำและไอออนบวกของตัวถูกละลาย จะเคลื่อนที่เข้าหาขั้วบวก ไปรับอิเล็กตรอน เกิดปฏิกิริยารีดักชัน ในทำนองเดียวกัน สารใดจะสามารถรับอิเล็กตรอนได้ก็ให้พิจารณาจากค่า E0 โดยถ้ามีค่า E0 สูงกว่าสารนั้นก็จะสามารถรับอิเล็กตรอนได้ดีกว่า สารที่เหลือก็จะไม่เกิดปฏิกิริยา
ตัวอย่างอิเล็กโทรลิซิส
- การแยกเกลือ NaCl หลอมเหลวด้วยไฟฟ้า
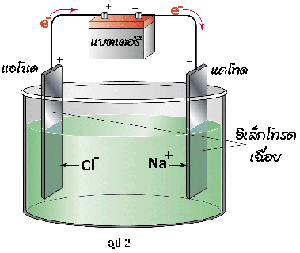
ภาพอิเล็กโทรลิซิสโซเดียมคลอไรด์ที่หลอมเหลว
ที่มา : https://il.mahidol.ac.th/e-media/electrochemistry/web/electrolysis.htm
ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
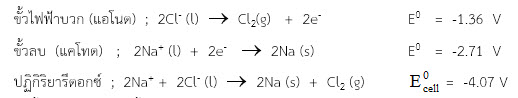
ดังนั้นผลิตภัณฑ์ที่เกิดขึ้นคือ
ที่ขั้วแอโนด เกิด Cl2 ที่ขั้วแคโทด เกิด Na (s)
ในอุตสาหกรรมเตรียมโซเดียม ก็ใช้วิธีการอิเล็กโทรลิซิสโซเดียมคลอไรด์หลอมเหลว โดยใช้เซลล์
อิเล็กโตรไลต์ที่สร้างขึ้นเฉพาะ เรียกว่า Downs cell ดังรูปที่ 2
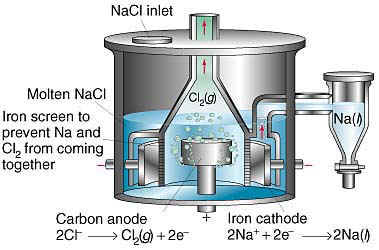
ภาพ เซลล์อิเล็กโตรไลต์เฉพาะ เรียกว่า Downs cell
ที่มา : https://corrosion-doctors.org/Electrowinning/Sodium.htm
- การแยกสารละลายโซเดียมซัลเฟตด้วยไฟฟ้า
ปฏิกิริยาที่เกิดขึ้นอธิบายได้ดังนี้
ที่ขั้วแอโนด (ขั้วบวก) โมเลกุลของน้ำและ S2O82- เคลื่อนที่เข้าไปให้อิเล็กตรอน สารใดจะสามารถให้ได้พิจารณาจากค่า E0 ดังนี้
S2O82- (aq) + 2e- ----> 2SO42- (aq) E0 = +2.01 V …………… (1)
O2 (g) + 4H+ (aq) + 4e- ----> 2H2O (l) E0 = +1.23 V …………… (2)
จากการพิจารณาค่า E0 พบว่า E0 ของปฏิกิริยาในสมการ (2) ต่ำกว่าปฏิกิริยาในสมการ (1) แสดงว่า เกิดสารตามสมการที่ (2) ได้ง่ายกว่าเกิดสารในสมการที่ (1) ดังนั้นปฏิกิริยาที่เกิดขึ้นที่ขั้วบวก หรือขั้วแอโนดคือ
2H2O (l) ----> O2 (g) + 4H+ (aq) + 4e- E0 = -1.23 V …………… (3)
ที่ขั้วแคโทด (ขั้วลบ)
โมเลกุลของน้ำและ Na+ เคลื่อนที่เข้าไปรับอิเล็กตรอน สารใดจะสามารถรับอิเล็กตรอนได้พิจารณาจากค่า E0 ดังนี้
Na+ (aq) + e- ----> Na (s) E0 = -2.71 V …………… (4)
2H2O (l) + 2e- ----> H2 (g) + 2OH- (aq) E0 = -0.83 V …………… (5)
จากการพิจารณาค่า E0 พบว่า E0 ของปฏิกิริยาในสมการ (5) สูงกว่าปฏิกิริยาในสมการ (4) แสดงว่า เกิดสารตามสมการที่ (5) ได้ง่ายกว่าเกิดสารในสมการที่ (4) ดังนั้นปฏิกิริยาที่เกิดขึ้นที่ขั้วบวก หรือขั้วแอโนดคือ
2H2O (l) + 2e- ----> H2 (g) + 2OH- (aq) E0 = -0.83 V …………… (6)
(5) x 2 ; 4H2O (l) + 4e- ----> 2H2 (g) + 4OH- (aq) E0 = -0.83 V …………… (6)
นำสมการที่ (3) + (6) จะได้
4H2O (l) + 2H2O (l) ---->2H2 (g) + O2 (g) + 4OH- (aq) + 4H+ (aq)
6H2O (l) ---->2H2 (g) + O2 (g) + 4H2O (l) E0 รวม = (-0.83)+(-1.23) = -2.06 V
2H2O (l) ---->2H2 (g) + O2 (g) E0 รวม = -2.06 V
เพราะฉะนั้นผลิตภัณฑ์ที่เกิดขึ้นเป็นดังนี้
ที่ขั้วแคโทด เกิด ก๊าซไฮโดรเจน ที่ขั้วแอโนด เกิดก๊าซออกซิเจน
แหล่งที่มา
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์องค์ประกอบพื้นฐานทางเคมี. กรุงเทพฯ: เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนเคมีพื้นฐานและเพิ่มเติม ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 4 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
ศรีลักษณ์ พลวัฒนะ, และคณะ.(2551). หนังสือเรียนเสริมฯ เคมีไฟฟ้า ม.4-6 ช.4 สำนักพิมพ์ แม็ค บจก. สนพ.
กลับไปที่เนื้อหา
การผุกร่อนของโลหะ คือ กระบวนการของปฏิกิริยารีดอกซ์ที่เกิดจากโลหะถูกออกซิไดส์เป็นสาร ประกอบในภาวะแวดล้อมต่างๆกัน เช่น การเกิดสนิม(Iron rust Fe2O3.nH2O)โลหะเงินเกิดความหมอง (Tranishedsilver , Ag2S) การเกิดสารสีเขียว(Green patina CuCO3) เคลือบบนโลหะทองแดง ทองเหลือง ทองบรอนซ์
ลักษณะสำคัญของการผุกร่อนของโลหะ
- การผุกร่อนของโลหะเกิดจากปฏิกิริยารีดอกซ์โดยโลหะให้อิเล็กตรอนเกิดปฏิกิริยาออกซิเดชัน ส่วนสารอื่นที่รับอิเล็กตรอนจะเกิดปฏิกิริยารีดักชัน หรือเป็นตัวออกซิไดซ์
- เหล็กทำปฏิกิริยากับก๊าซออกซิเจน และน้ำ เกิดออกไซด์ Fe2O3 เรียกว่า การเกิดสนิมเหล็ก (Rust)
- สนิมของโลหะต่างชนิดกันจะเกิดสีต่างกัน เช่น สนิมเหล็ก Fe2O3 มีสีน้ำตาล สนิมทองแดง CuO มีสีดำ หรือสีน้ำตาลดำ ส่วนสนิมอลูมิเนียมคือ Al2O3 มีสีขาว
- สนิมของโลหะมักเกิดในรูปของออกซิได์ เช่น Fe2O3 , Al2O3 , CuO
- โลหะที่ผุกร่อนง่าย ได้แก่ โลหะที่มีค่า E0 ต่ำ เช่น โลหะอัลคาไลน์ (หมู่ 1A) และโลหะ อัลคาไลน์เอิร์ท (หมู่ 2A)
- ปัจจัยที่จะทำให้โลหะทั่วไปผุกร่อนสรุปได้ดังนี้
6.1 โลหะจุ่มในกรด (ยกเว้นโลหะมีตระกูล Au , Ag , Pt) จะผุกร่อนเกิดการไฮโดรเจน เช่น
Mg (s) + 2H+ (aq) ---- > Mg2+ (aq) + H2 (g)
6.2 โลหะจุ่มอยู่อยู่ในไอออนบวกของโลหะที่มีค่า E0 สูงกว่า จะเกิดการผุกร่อนได้ เช่น โลหะเห,กจะเกิดการผุกร่อนได้เมื่อจุ่มอยู่ในสารละลาย Cu2+ (aq) ซึ่งเกิดปฏิกิริยาขึ้นดังนี้
Fe (s) + Cu2+(aq) ---- > Fe2+ (aq) + Cu (s)
6.3 โลหะทำปฏิกิริยากับ O2 และน้ำพร้อมกันจะเกิดออกไซด์ เรียกกระบวนการนี้ว่า การเกิดสนิม
การศึกษาการผุกร่อนของโลหะเหล็ก
- เหล็กจะเป็นสนิมอย่างช้า ๆ เมื่อสัมผัสกับอากาศแห้ง เพราะอะตอมของเหล็กที่ผิวหน้าจะทำปฏิกิริยาอย่างช้า ๆ กับก๊าซออกซิเจนในบรรยากาศ เกิดออกไซด์ของเหล็กหลายชนิดปนกัน ดังนี้
2Fe (s) + O2 (g) ---- > 2FeO (s)
4Fe (s) + 3O2 (g) ---- > 2Fe2O3 (s)
3Fe (s) + 2O2 (g) ---- > Fe3O4 (s)
โลหะที่เกิดสนิมขึ้นจะเกิดรูจำนวนมากที่ผิวของโลหะ ทำให้อะตอมของออกซิเจนและน้ำสามารถเข้าไปทำปฏิกิริยากับโลหะ ทำให้เกิดกระบวนการผุกร่อนต่อ ๆ ไป
2. เหล็กจุ่มในสารละลายกรดเกิดปฏิกิริยาการผุกร่อน ได้ไอออนของเหล็กและก๊าซไฮโดรเจน ดังนี้
Fe (s) + 2H+ (aq) ---- > Fe2+ (aq) + H2 (g)
2Fe (s) + 6H+ (aq) ---- > 2Fe3+ (aq) + 3 H2 (g)
ถ้ามี O2 อยู่ด้วย Fe2+ จะถูกออกซิไดซ์เป็น Fe3+ ไอออนดังนี้
4Fe2+ (aq) + O2 (g) + 4H+ (aq) ---- > 4Fe3+ (aq) + 2 H2O (l )
ทุกปฏิกิริยาข้างต้นนี้สามารถเกิดขึ้นได้เองตามธรรมชาติ
-
เหล็กจะไม่เป็นสนิมเมื่อสัมผัสกับน้ำที่ไม่มีออกซิเจนละลายอยู่
-
เหล็กจะเป็นสนิม เมื่อสัมผัสกับน้ำที่มีออกซิเจนละลายน้ำ ได้ดีกว่าการสัมผัสกับอากาศแห้ง ๆ ที่ปราศจากน้ำ
เมื่อโลหะเหล็กอยู่ในน้ำที่มีก๊าซออกซิเจนละลายอยู่จะเกิดปฏิกิริยารีดอกซ์เกิดขึ้นดังนี้
ปฏิกิริยาออกซิเดชัน
Fe (s) ---- > Fe2+ (aq) + 2e-
ปฏิกิริยารีดักชัน
O2 (g) + 2H2O (l) + 2e- ---- > 4OH- (aq)
ปฏิกิริยาสุทธิ ;
2Fe (s) + O2 (g) + 2H2O(l) ---- > 2Fe2+(aq)+4OH-(aq)
Fe2+ และ OH- ที่เกิดขึ้นจะรวมตัวกันเกิดเป็นตะกอน Fe(OH)2 แล้วถูกออกซิไดส์ด้วย H2O และ O2 เป็นสนิมในที่สุด
4Fe(OH)2 (s) + O2 (g) + 2H2O (l) ---- > 4Fe (OH)3 (s)
2Fe (OH)3 (s) ---- > Fe2O3 . H2O (s) + 2H2O (l)
- เหล็กจะเกิดสนิมเร็วขึ้นเมื่อสัมผัสกับโลหะทองแดง
อธิบายได้ในรูปเซลล์กัลวานิกที่จุด 2 จุดโลหะ เหล็กสัมผัสกับโลหะทองแดง โดยโลหะเหล็กทำหน้าที่แอโนดให้อิเล็กตรอนเกิด Fe2+ ไอออน
แอโนด ; Fe (s) ---- > Fe2+ (aq) + 2e- E0 = 0.409 V
แคโทด ; O2 (g) + 2H2O (l) + 2e- ---- > 4OH- (aq) E0 = 0.401 V
Fe2+ ไอออนที่เกิดขึ้นที่แอโนดแพร่มารวมตัวกับ OH- ไอออนที่แคโทดเกิดตะกอนแล้วถูก ออกซิไดซ์ไปเป็นสนิมเหล็กในที่สุด เรียกกระบวนการนี้ว่า galvanic corrosions เพราะปฏิกิริยาสุทธิคล้ายปฏิกิริยาที่เกิดขึ้นในเซลล์กัลวานิก
โลหะทองแดงจะไม่ผุกร่อนเมื่อสัมผัสกับเหล็ก เพราะว่าทองแดงเป็นตัวรีดิวซ์อ่อนกว่าเหล็ก ถ้าเซลล์กัลวานิกประกอบด้วยโลหะทองแดงเป็นแอโนด เกิดปฏิกิริยาออกซิเดชันจะพบว่าอิเล็กตรอนไหลไปยังโลหะเหล็กที่เป็นแคโทดโดยมี O2 ละลายอยู่ในน้ำ และก๊าซ O2 ถูกรีดิวซ์
แอโนด ; Cu (s) ---- > Cu2+ (aq) + 2e- E0 = -0.34 V
แคโทด ; O2 (g) + 2H2O (l) + 2e- ---- > 4OH- (aq) E0 = 0.401 V
ศักย์ไฟฟ้าสุทธิของปฏิกิริยานี้มีค่าน้อยกว่า ศักย์ไฟฟ้าสุทธิของปฏิกิริยาที่เกิดเหล็กเป็นแอโนด
Cu (s) + O2 (g) + 2H2O (l) ---- > Cu2+ (aq) + 4OH- (aq) E0 cell = 0.061 V
Fe (s) + O2 (g) + 2H2O (l) ---- > Fe2+ (aq) + 4OH- (aq) E0 cell = 0.810 V
ดังนั้น เหล็กจึงผุกร่อนง่ายกว่าทองแดง
- เหล็กจะไม่เป็นสนิมเมื่อสัมผัสกับโลหะสังกะสี หรือแมกนีเซียม
โลหะที่เป็นตัวรีดิวซ์ที่ดีกว่าเหล็ก ( คือ โลหะที่มี E0 ต่ำกว่า เช่น Zn ,Mg) สัมผัสกับเหล็กจะสามารถป้องกันการผุกร่อนได้ดังรูป 3 กระบวนการนี้เรียกว่า Cathodic protection ซึ่งสามารถอธิบายในรูปเซลล์กัลวานิกคือ โลหะเหล็กเป็นแคโทด ส่วนโลหะสังกะสีหรือแมกนีเซียมจะเป็นแอโนด เกิดปฏิกิริยาดังนี้
แอโนด ; Zn (s) ---- > Zn2+ (aq) + 2e- E0 = 0.763 V
แคโทด ; O2 (g) + 2H2O (l) + 2e- ---- > 4OH- (aq) E0 = 0.401 V
ปฏิกิริยารวม ; Zn (s) + O2 (g) + 2H2O (l) ---- > Zn2+ (aq) + 4OH- (aq) , E0 cell = 1.164 V
ศักย์ไฟฟ้าสุทธิสำหรับปฏิกิริยานี้มีค่ามากกว่าศักย์ไฟฟ้าสุทธิ สำหรับปฏิกิริยาที่มีเหล็กเป็นแอโนด ดังนั้นโลหะสังกะสีจะผุกร่อนแทนเหล็ก โดยหลักการนี้ได้นำมาใช้ทำสังกะสีมุงหลังคา กล่าวคือใช้โลหะสังกะสีเคลือบแผ่นเหล็กเพื่อป้องกันการผุกร่อนของแผ่นเหล็ก
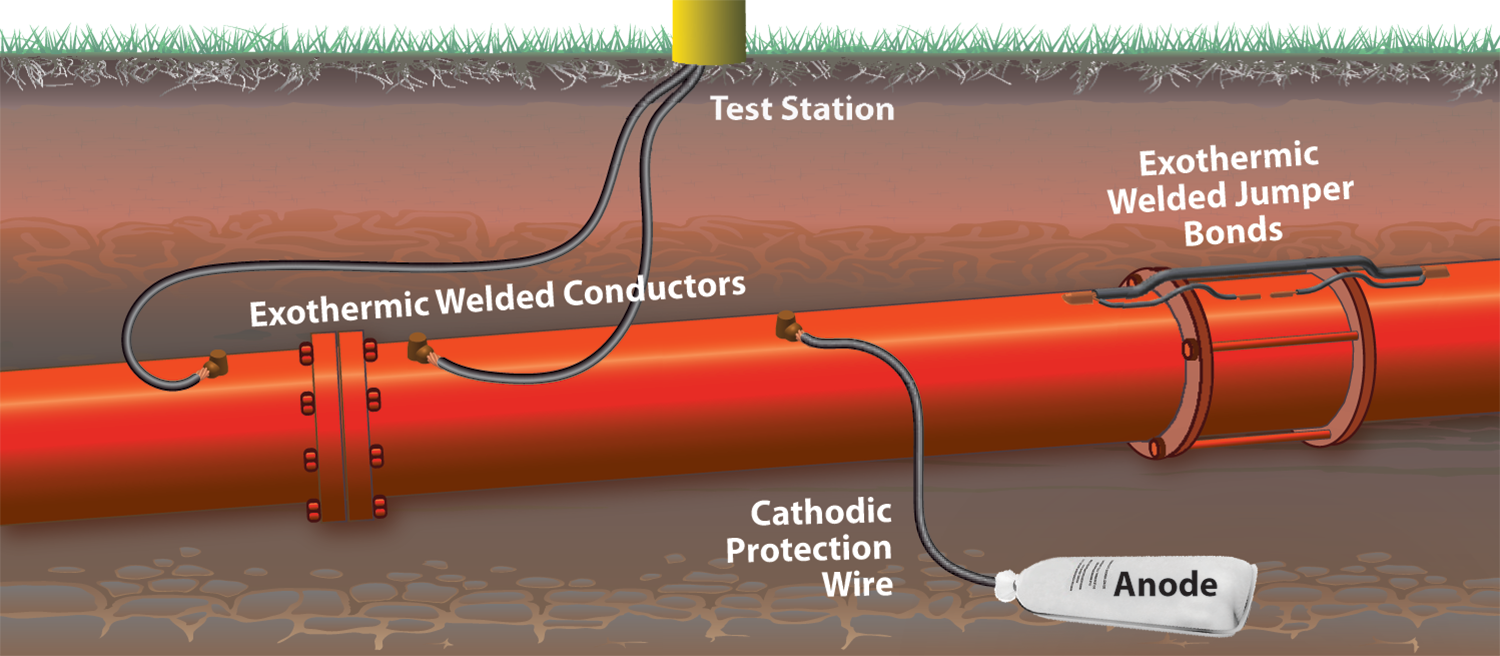
ภาพการผุกร่อนของเหล็กสามารถป้องกันโดยวิธี Cathodic protection
ที่มา : https://www.hubbell.com/continentalindustries/en/cathodic-market
แหล่งที่มา
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์องค์ประกอบพื้นฐานทางเคมี. กรุงเทพฯ:เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนเคมีพื้นฐานและเพิ่มเติม ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 4 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
ศรีลักษณ์ พลวัฒนะ, และคณะ.(2551). หนังสือเรียนเสริมฯ เคมีไฟฟ้า ม.4-6 ช.4 สำนักพิมพ์ แม็ค บจก. สนพ.
กลับไปที่เนื้อหา
ความก้าวหน้าทางเทคโนโลยีที่เกี่ยวข้องกับเซลล์ไฟฟ้าเคมี
หลักการของเซลล์ไฟฟ้าเคมีสามารถนำมาใช้ประโยชน์ต่าง ๆ ได้มากมาย และปัจจุบันมีการพัฒนาเทคโนโลยีให้ก้าวหน้าเพิ่มขึ้นอยู่ตลอดเวลา เช่น การทำอิเล็กโทรไดอะลิซิส และการทำเซลล์เชื้อเพลิง
- การทำอิเล็กโทรไดอะลิซีสน้ำทะเล
เนื่องจากน้ำทะเลมีอยู่ประมาณ 72 % ของพื้นที่โลก ดังนั้น จึงพบส่วนที่เป็นน้ำจืดน้อย น้ำทะเลในมหาสมุทรมีเกลือละลายอยู่ 3.5 % โดยมวล และความเข้มข้นจะเพิ่มขึ้นทุกปี ไอออนต่าง ๆ ที่พบในน้ำทะเลแสดงได้ดังนี้
ตารางที่ 1 ไอออนที่พบในน้ำทะเลที่ความเข้มข้นมากกว่า 0.001 g / kg
|
ไอออน |
ปริมาณที่พบ (g / kg) |
|
Cl- Na+ SO42- Mg2+ Ca2+ K+ HCO3- , CO32- Br- H2BO3- Sr2+ F- |
19.35 10.76 2.71 1.29 0.41 0.40 0.106 0.067 0.027 0.008 0.001 |
การทำน้ำทะเลให้เป็นน้ำจืดมี 3 วิธี คือ
- Electrodialysis เป็นการแยกไอออนของเกลือออกจากน้ำทะเลด้วยไฟฟ้ากระแสตรง
- Solar Distillation เป็นการกลั่นน้ำทะเลด้วยพลังงานแสงอาทิตย์
- Reverse Osmosis เป็นกระบวนการให้โมเลกุลของน้ำผ่านเยื่อบาง ๆ ไปมาด้วยแรงดันออสโมซิส
การทำอิเล็กโทรไดอะลิซิสน้ำทะเล
อิเล็กโทรไดอะลิซิส เป็นเซลล์อิเล็กโทรไลต์ชนิดหนึ่งที่ใช้แยกไอออนออกจากสารละลาย โดยให้ไอออนผ่านแผ่นเยื่อบาง ๆ (Semipermeable membrane) ไปยังขั้วไฟฟ้าที่มีประจุตรงข้าม ทำให้สารละลายที่อยู่ระหว่างขั้วไฟฟ้าจะมีความเข้มข้นของไอออนลดลง โดยหลักการนี้สามารถนำไปใช้แยกโซเดียมไอออน และคลอไรด์ไอออนออกจากน้ำทะเลได้ ซึ่งเป็นวิธีในการผลิตน้ำจืดจากน้ำทะเลวิธีหนึ่ง
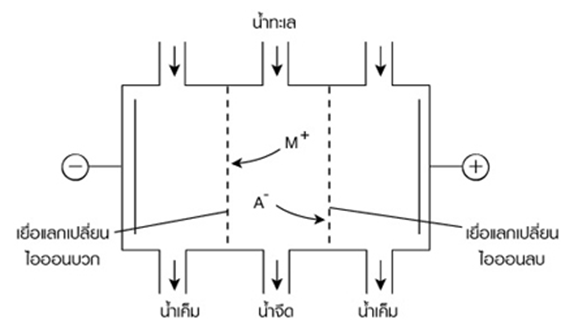
ภาพ เซลล์อิเล็กโทรไดอะลิซิสทำน้ำทะเลให้เป็นน้ำจืด
ที่มา : http://119.46.166.126/self_all/selfaccess12/m6/704/lesson2/index4.php
- เซลล์เชื้อเพลิง (Fuel cell) เป็นเซลล์กัลวานิกชนิดหนึ่งที่ใช้สารเชื้อเพลิงทำปฏิกิริยากับก๊าซออกซิเจนแล้วได้กระแสไฟฟ้า เขียนเป็นแผนภาพดังนี้
สารเชื้อเพลิง + ก๊าซออกซิเจน ® สารผลิตภัณฑ์
สารเชื้อเพลิง เช่น ก๊าซไฮโดรเจน ,ไฮโดรคาร์บอน เช่น CH4 , C3H8 , เมทานอล (CH3OH)
ส่วนประกอบของเซลล์เชื้อเพลิง
- ขั้วไฟฟ้า ใช้ขั้วเฉื่อย
1.1 ขั้วแอโนด เป็นขั้วเฉื่อยที่ผ่านสารที่เป็นเชื้อเพลิงลงไปแล้วเกิดปฏิกิริยาออกซิเดชัน ที่ขั้วนี้อิเล็กตรอนจะไหลออก จัดเป็นขั้วลบ
1.2 ขั้วแคโทด เป็นขั้วเฉื่อยที่ผ่านก๊าซออกซิเจน ลงไป และเกิดปฏิกิริยารีดักชัน มีอิเล็กตรอนไหลเข้า จัดเป็นเป็นขั้วบวก
- สารละลายอิเล็กโทรไลต์ ส่วนมากเป็นสารละลายกรดแก่ และเบสแก่
ประโยชน์ของเซลล์เชื้อเพลิง
- เป็นแหล่งพลังงานในยานอวกาศ
- ทางการแพทย์ใช้เซลล์เชื้อเพลิงเป็นแหล่งให้กระแสไฟฟ้าในเครื่องมือที่ช่วย ทำให้หัวใจเต้นเป็นปกติสำหรับผู้ที่เป็นโรคหัวใจ และใช้เป็นแหล่งกระแสไฟฟ้าในเครื่องช่วยการฟังของผู้พิการทางหู
- ให้พลังงานที่มีประสิทธิภาพสูงกว่าพลังงานที่ได้จากเครื่องยนต์สันดาปภายใน เพราะไม่มีการสูญเสียพลังงานไปกับแรงเสียดทานจากเครื่องยนต์
เซลล์เชื้อเพลิงไฮโดรเจน - ออกซิเจน
เซลล์เชื้อเพลิงชนิดนี้ทำให้เกิดกระแสไฟฟ้าขึ้นจากปฏิกิริยาระหว่างก๊าซไฮโดรเจนที่เป็นเชื้อเพลิง กับก๊าซออกซิเจน ทำให้เกิดพลังงานไฟฟ้าและน้ำขึ้น
ส่วนประกอบของเซลล์
1.ขั้วไฟฟ้า
1.1 แอโนด เป็นขั้วเฉื่อยที่มีรูพรุน ๆ ที่ผสมด้วย Pt หรือ Pd เป็นตัวเร่งปฏิกิริยา แล้วผ่านก๊าซไฮโดรเจนลงไป เกิดปฏิกิริยาออกซิเดชันกับ OH- ให้อิเล็กตรอนไหลออก จัดเป็นขั้วลบ
1.2 แคโทด เป็นขั้วเฉื่อยมีรูพรุน ๆ ที่ผสมด้วย C , Pt หรือ Ag เป็นตัวเร่งปฏิกิริยาแล้ว
ผ่านก๊าซออกซิเจน ลงไปเกิดปฏิกิริยารีดักชันกับน้ำ ทำให้อิเล็กตรอนไหลเข้า จัดเป็นขั้วบวก
2.สารละลายอิเล็กโทรไลต์ เช่น สารละลาย KOH หรือ NaOH 25% โดยมวล
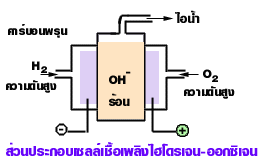
ภาพแผนภาพเซลล์เชื้อเพลิง
ที่มา : https://web.ku.ac.th/schoolnet/snet5/topic9/fuel.html
เซลล์เชื้อเพลิงนี้อาศัยหลักการให้ ก๊าซไฮโดรเจนทำปฏิกิริยากับก๊าซออกซิเจน เกิดเป็น น้ำ ปฏิกิริยาที่เกิดขึ้นแสดงให้เห็นได้ดังนี้
แอโนด ; H2 (g) จะแพร่ผ่านเข้าที่ผิวของขั้ว โดยมีตัวเร่งปฏิกิริยาทำให้ก๊าซไฮโดรเจนแตดตัวเป็น H อะตอม แล้วทำปฏิกิริยากับ OH- ของสารอิเล็กโทรไลต์เกิดน้ำขึ้น
H2 (g) 2H (g)
2H (g) + 2OH- (aq) ® 2H2O + 2e-
ปฏิกิริยารวมที่ขั้วแอโนด ; H2 (g) +2OH- (aq) ® 2H2O + 2e- E0 = 0.83 V
แคโทด ; อิเล็กตรอนที่เกิดขึ้นผ่าจากขั้วแอโนดไปตลอดยังขั้วแคโทด ก๊าซออกซิเจน ถูกดูดเข้าไปที่ผิวแคโทด และถูกรีดิวซ์ เป็น OH- ดังนี้
O2 (g) + 2H2O (l) + 4e- ® 4OH- (aq) E0 = 0.40 V
ปฏิกิริยาสุทธิของเซลล์คือ
H2 (g) + O2 (g) ® 2H2O E0 = 1.23 V
เซลล์เชื้อเพลิงชนิดนี้ไม่ก่อให้เกิดมลภาวะแก่สิ่งแวดล้อม เพราะเกิดไอน้ำ มีประสิทธิภาพในการใช้งานสูงมาก ใช้ประโยชน์ในยานอวกาศ เพราะให้พลังงานได้อย่างต่อเนื่อง และน้ำที่เกิดขึ้นสามารถใช้ดื่มได้
เซลล์เชื้อเพลิงโพรเพน - ออกซิเจน
เป็นเซลล์เชื้อเพลิงที่ทำให้เกิดกระแสไฟฟ้าขึ้นจากปฏิกิริยาระหว่างก๊าซโพรเพน (C3H8 ) กับก๊าซออกซิเจน เกิด CO2 และ น้ำ
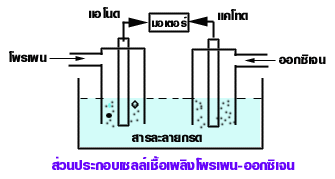
ภาพแผนภาพแสดงเซลล์เชื้อเพลิงโพรเพน – ออกซิเจน
ที่มา : https://web.ku.ac.th/schoolnet/snet5/topic9/fuel.html
ส่วนประกอบของเซลล์
1.ขั้วไฟฟ้าเฉื่อย
1.1 เป็นขั้วเฉื่อยที่ C3H8 เกิดปฏิกิริยาออกซิเดชันชันกับ H2O ได้ CO2 และ H+ ทำให้เกิดอิเล็กตรอนไหลออกจากขั้ว จัดเป็นขั้วลบ
1.2 แคโทด เป็นขั้วเฉื่อย ออกซิเจนเกิดปฏิกิริยารีดักชันกับ H+ ได้ น้ำ (อิเล็กตรอนไหลเข้า จัดเป็นขั้วบวก)
- สารละลายอิเล็กโทรไลต์ ได้แก่ กรดแก่เข้มข้น เช้น H2SO4 หรือ H3PO4
ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
แอโนด ; C3H8 (g) + 6H2O ® 3CO2 (g) + 20H- + 20e-
แคโทด ; 5O2 (g) + 20H- (aq) + 20e- ® 10H2O (l)
ปฏิกิริยาสุทธิ ; C3H8 (g) + 5O2 (g) ® 3CO2 (g) + 10H2O (l)
เซลล์เชื้อเพลิงนี้มีประสิทธิภาพเป็น 70 % และประสิทธิภาพในการทำงานสูงประมาณ 2 เท่าของเครื่องยนต์สันดาปภายใน แต่เซลล์ชนิดนี้ก่อให้เกิดมลพิษต่ออากาศ คือเกิดก๊าซ CO2 (g)
แหล่งที่มา
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์องค์ประกอบพื้นฐานทางเคมี. กรุงเทพฯ: เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนเคมีพื้นฐานและเพิ่มเติม ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 4 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
ศรีลักษณ์ พลวัฒนะ, และคณะ.(2551). หนังสือเรียนเสริมฯ เคมีไฟฟ้า ม.4-6 ช.4 สำนักพิมพ์แม็ค บจก. สนพ.
กลับไปที่เนื้อหา



