ของแข็ง (Solid)
ลักษณะของของแข็ง
ของแข็ง (solid) เป็นสถานะของสสารที่มีลักษณะแตกต่างจากแก๊สหรือของเหลว คือ มีรูปร่างที่แน่นอน ไม่ขึ้นอยู่กับภาชนะที่บรรจุ เนื่องจากอนุภาคของของแข็งมีพลังงานจลน์น้อยมาก ไม่สามารถเคลื่อนที่ไปมาได้ เพียงแค่สั่นสะเทือนอยู่กับที่ การแพร่ของของแข็งเกิดขึ้นช้ามากเมื่อเทียบกับแก๊สหรือของเหลว นอกจากนี้อนุภาคในของแข็งจะมีแรงดึงดูดระหว่างโมเลกุลหรือไอออนที่สูงกว่าในของเหลวหรือแก๊ส ทําให้อนุภาคเหล่านี้อยู่ชิดกัน ทําให้มีความหนาแน่นสูงและแข็งมากกว่าของเหลวและแก๊ส เมื่อถูกบีบอัดจะไม่ทําให้ปริมาตรเปลี่ยนแปลงหรือถ้าเปลี่ยนแปลงจะเปลี่ยนแปลงน้อยมาก
ประเภทของของแข็ง
โดยทั่วไปของแข็งแบ่งเป็น 2 ประเภท ได้แก่
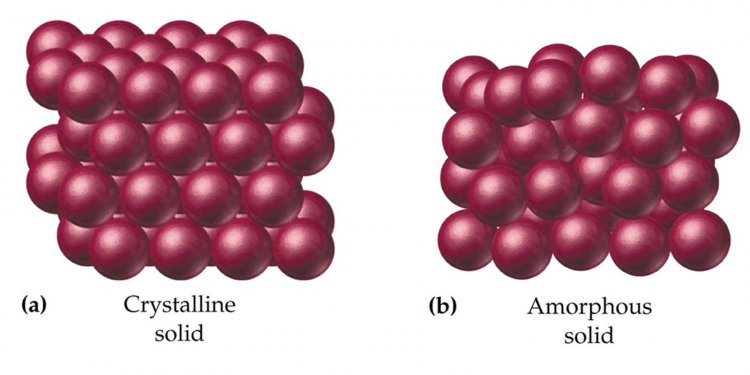
1. ของแข็งที่มีลักษณะเป็นผลึก (crystalline solid) เป็นของแข็งที่มีพื้นผิวที่ทํามุมกันด้วยค่าที่แน่นอน ซึ่งแสดงถึงการจัดเรียงเป็นระเบียบของอนุภาคของของแข็ง ผลึกที่มีขนาดใหญ่เมื่อทําให้เล็กลงก็ยังคงรักษาลักษณะรูปผลึกเดิมอยู่ สารบางอย่างอาจมีรูปผลึกได้หลายแบบซึ่งเราจะเรียกว่าปรากฏการณ์อัญรูป (polymorphism) เช่น เพชร แกรไฟต์ สารบางชนิดอาจจะมีรูปร่างผลึกที่เหมือนกันได้ ซึ่งจะเรียกปรากฏการณ์นี้ว่า ภาวะรูปร่างเหมือน (isomorphism) เช่น NaCl, KCl, RbBr และ CaS นอกจากนี้ ผลึกยังมีสมบัติที่เรียกว่าanisotropy อันได้แก่ความแข็งแรงทนทานทางกล ดรรชนีหักเห และการนําไฟฟ้า ถ้าวัดในทิศทางที่ต่างกันค่าที่ได้จะไม่เท่ากัน
2. ของแข็งอสัณฐาน (amorphous solid) หรือของแข็งที่ไม่มีรูปผลึก อนุภาคเรียงตัวไม่เป็นระเบียบเช่น แก้ว โพลิเมอร์ ยางธรรมชาติ ฯลฯ มีสมบัติทั่วๆ ไปคล้ายผลึก แตกต่างกันที่ไม่มีรูปทรงเรขาคณิตที่แน่นอน ดังนั้นจึงมีสมบัติที่เรียกว่าisotropy คือ ค่าดรรชนีหักเห การนําไฟฟ่า และคุณสมบัติอื่นๆ จะเหมือนกันหมดทุกทิศทาง นอกจากนี้ของแข็งอสัณฐานจะมีจุดหลอมเหลวไม่เด่นชัด เมื่อได้รับความร้อนจะค่อยๆ อ่อนตัวจนกระทั่งไหลได้ อุณหภูมิที่ของแข็งชนิดนี้หลอมตัวจึงอยู่ในช่วงที่ยาว ต่างจากผลึกซึ่งจะมีจุดหลอมเหลวที่เด่นชัดและอุณหภูมิที่ของแข็งชนิดนี้หลอมตัวอยู่ในช่วงที่แคบ


Rose des Sables (กุหลาบทราย) , ผลึกยิปซัม
กลับไปที่เนื้อหา
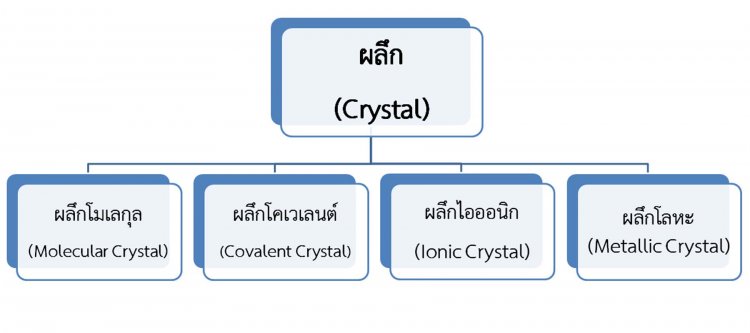
ชนิดของของแข็ง (ผลึก)
ในกรณีกล่าวถึงของแข็งที่มีลักษณะเป็นผลึกเท่านั้น โดยผลึกประกอบจากการเรียงตัวของอะตอม ไอออน หรือโมเลกุลอย่างเป็นระเบียบสม่ำเสมอในสามมิติ และยึดกันอยู่ด้วยแรงยึดเหนี่ยวระหว่างอนุภาคชนิดต่างๆ ดังนั้น เราอาจจำแนกผลึกออกได้เป็น 4 ชนิด ตามชนิดของอนุภาคองค์ประกอบและแรงยึดเหนี่ยวระหว่างอนุภาค ดังนี้
1. ผลึกโมเลกุล (Molecular Crystal) หน่วยอนุภาคของผลึกชนิดนี้ คือ โมเลกุล และแรงยึดเหนี่ยวระหว่างโมเลกุลเหล่านี้เป็น แรงแวนเดอร์วาลส์ (van der Waals) และ/หรือพันธะไฮโดรเจน ซึ่งมีค่าน้อยกว่าแรงยึดเหนี่ยวของพันธะโคเวเลนต์ ผลึกโมเลกุลจึงหลอมเหลวได้ง่ายกว่าผลึกโคเวเลนต์และผลึกไอออนิกมาก นั่นคือ มีจุดหลอมเหลวและจุดเดือดต่ำ มีความดันไอสูง โดยทั่วไปผลึกโมเลกุลจะมีลักษณะค่อนข้างอ่อน ไม่เปราะนัก และเป็นตัวนำไฟฟ้าที่ไม่ดีหรืออาจเป็นฉนวนเลย เพราะแต่ละโมเลกุลไม่มีประจุและไม่มีอิเล็กตรอนเคลื่อนที่ระหว่างโมเลกุลภายในผลึก สำหรับโมเลกุลที่ไม่มีขั้ว แรงยึดเหนี่ยวระหว่างโมเลกุลเป็นแรงแวนเดอร์วาลส์ประเภท แรงลอนดอน (London Force) เช่น แนฟทาลีน น้ำแข็งแห้ง ส่วนกรณีของโมเลกุลที่มีขั้ว แรงยึดเหนี่ยวระหว่างโมเลกุลเป็นแรงประเภท แรงไดโพล (dipole-dipole interaction) เช่น SO2ไอโอดีน (I2) กำมะถัน (S8) และกรณีของน้ำแข็ง แอมโมเนียและไฮโดรเจนฟลูออไรด์ (HF) โมเลกุลจะอยู่ด้วยกันโดยพันธะไฮโดรเจน
ภาพแสดงตัวอย่างผลึกโมเลกุล เช่น หิมะ (H2O)
2. ผลึกโคเวเลนต์(Covalent Crystal) หน่วยอนุภาคของผลึกชนิดนี้ คือ อะตอม โดยที่อะตอมจะสร้างพันธะโคเวเลนต์ยึดเหนี่ยวกันลักษณะโครงข่ายสามมิติเป็นร่างแห หรือตาข่าย การยึดเหนี่ยวกันกันระหว่างอะตอมจะมีทิศทางที่แน่นอน ตัวอย่างของแข็งประเภทนี้ ได้แก่ เพชร แกรไฟต์ และฟุลเลอรีน ซึ่งเป็นอัญรูปของคาร์บอน
3. ผลึกไอออนิก (Ionic Crystal) หน่วยอนุภาคของผลึกชนิดนี้ คือ ไอออน ประกอบด้วยไอออนบวก (cations) และไอออนลบ (anions) พันธะระหว่างไอออนเกิดจากแรงดึงดูดระหว่างประจุไฟฟ้า ซึ่งเรียกว่าแรงดึงดูดไฟฟ้าสถิต (Electrostatic force) จึงมีความแข็งแรง และจุดเดือด จุดหลอมเหลวสูง เนื่องจากต้องใช้พลังงานในการแยกไอออนออกจากกันมาก ลักษณะโดยทั่วไปของผลึกไอออนิกจะแข็งแกร่งและเปราะ ไม่เป็นตัวนำไฟฟ้า เนื่องจากไอออนไม่มีการเคลื่อนที่ แต่เมื่อผลึกกลายเป็นของเหลว ไอออนจะสามารถเคลื่อนที่ได้ ดังนั้น ผลึกไอออนิกที่หลอมเหลวจึงเป็นตัวนำไฟฟ้าได้ ตัวอย่างผลึกชนิดนี้ ได้แก่ NaCl CsCl ZnS CaF2 CuSO4 เป็นต้น
4. ผลึกโลหะ (Metallic Crystal) ผลึกประเภทนี้มีโครงสร้างที่ง่ายที่สุด ในโครงผลึกจะมีไอออนของโลหะ(ไอออนบวก) ล้อมรอบด้วยกลุ่มอิเล็กตรอนที่เคลื่อนที่ได้อย่างอิสระหรือทะเลอิเล็กตรอน ดังนั้นจึงทำให้ผลึกโลหะมีสมบัตินำไฟฟ้าได้ และเนื่องจากอิเล็กตรอนสามารถเคลื่อนที่ได้อย่างอิสระ แต่ละอิเล็กตรอน จึงไม่เป็นสมบัติของอะตอมหนึ่งอะตอมใด ระนาบของอะตอมอาจเคลื่อนที่บนระนาบอื่นๆ ได้ง่าย จึงทำให้โลหะมีสมบัติที่หักงอได้โดยไม่แตกหรือหักออกจากกัน นอกจากนี้ ผลึกโลหะยังมีความวาวจากการสะท้อนแสง จุดเดือด จุดหลอมเหลวสูง (ยกเว้นปรอท)
กลับไปที่เนื้อหา
ระบบผลึก
ผลึกประกอบขึ้นจากการเรียงตัวของอะตอม ไอออน หรือโมเลกุล อย่างเป็นระเบียบสม่ำเสมอในสามมิติ และมีโครงสร้างเรขาคณิตที่แน่นอน โดยทั่วไปการอธิบายเกี่ยวกับผลึก เราจะใช้แนวคิดที่เรียกว่าแลตทิซ (Lattice) โดยคิดว่าผลึกสร้างจากจุดแลตทิซ (lattice point) ที่ติดต่อแบบซ้ำๆ กัน และแต่ละจุดแลตทิซต้องมีสิ่งแวดล้อมเหมือนจุดอื่นๆ ในทุกทิศทาง ในโครงสร้างของผลึกจุดแลตทิซอาจเป็นตำแหน่งของอะตอม ไอออน โมเลกุล หรือกลุ่มของไอออนก็ได้ แลตทิซในสามมิติเรียกว่า โครงผลึก (crystal lattice) ซึ่งในโครงผลึกจะประกอบด้วยหน่วยเซลล์ (unit cell) ที่มีโครงแบบซ้ำๆ กัน ดังนั้น หน่วยเซลล์แต่ละหน่วยจะมีหน้า ขอบ และมุมร่วมกับหน่วยเซลล์ที่อยู่ติดกันเหมือนกกองอิฐที่จัดวางเรียงและซ้อนกันอย่างเป็นระเบียบ
เนื่องจากผลึกมีรูปทรงเรขาคณิตที่แน่นอน ในการบอกรูปทรงของผลึกอาจทำได้โดยการตั้งแกนให้มีความสัมพันธ์กับรูปร่างภายนอกของผลึกนั้นๆ เรียกแกนทั้งสามว่า crystallographic axes และเมื่อพิจารณาหลักเกณฑ์ทางเรขาคณิต หรือรูปร่างจากหน่วยเซลล์ จะสามารถแบ่งผลึกได้เป็น 7 ระบบ โดยอาศัยความแตกต่างกันทางความยาวของผลึก (a, b, c) และมุมระหว่างแกน (α, β, γ)

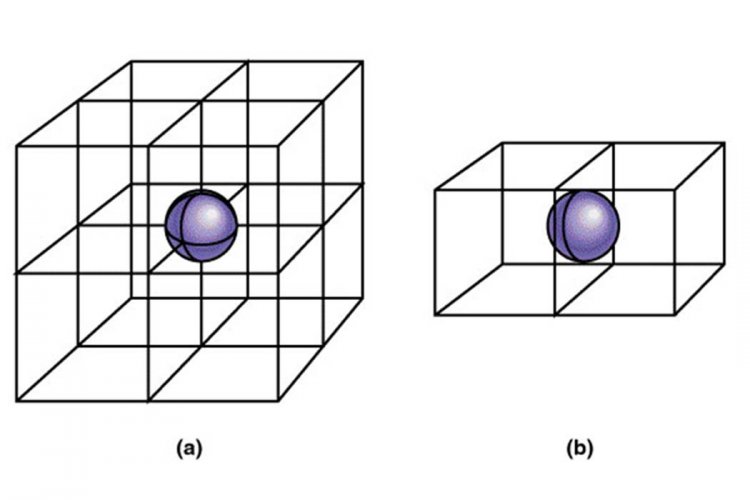
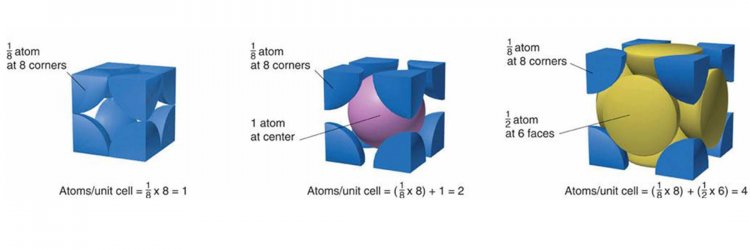
ในระบบลูกบาศก์ นอกจากจะมีอะตอมหรือไอออนตามมุมทั้งแปดของหน่วยเซลล์แล้ว อาจมีอะตอมหรือไอออนที่จุดศูนย์กลางของพื้นผิวทั้งหก หรือตรงใจกลางของลูกบาศก์ด้วยก็ได้ เพราะฉะนั้นสำหรับระบบลูกบาศก์จึงมีแลตทิซ หรือหน่วยเซลล์ลูกบาศก์ 3 แบบ คือ เซลล์ลูกบาศก์อย่างง่าย (simple cubic cell, scc) เซลล์ลูกบาศก์กลางตัว (body-centered cubic cell, bcc) และเซลล์ลูกบาศก์กลางหน้า (face-center cubic cell, fcc) ดังรูป
รูป เซลล์ลูกบาศก์ทั้ง 3 แบบ โดยทรงกลมแทนอะตอม ไอออน โมเลกุล
ที่มา : http://cwx.prenhall.com
นอกจากนี้ยังมีระบบผลึกอีกประเภทหนึ่ง ซึ่งในปี ค.ศ. 1848 Bravais ได้จําแนกโครงผลึกออกเป็น 14 แบบ เรียกว่า แลตทิซบราแวส์ (Bravais lattices) โดยมีที่มาจากผลึกใน 7 ระบบข้างต้น แต่มีการเพิ่มประเภทของโครงผลึกตามแบบเซลล์ลูกบาศก์อย่างง่าย (simple cubic cell, scc) เซลล์ลูกบาศก์กลางตัว (body-centered cubic cell, bcc) และเซลล์ลูกบาศก์กลางหน้า (face-center cubic cell, fcc) ดังนั้น ผลึกที่เกิดตามธรรมชาติจะต้องมีโครงผลึกแบบใดแบบหนึ่งในจํานวน 14 แบบนี้ ถ้าผลึกของสารที่มีหน่วยอนุภาคเป็นกลุ่มที่ซับซ้อน หน่วยเซลล์ก็จะมีโครงสร้างภายในที่สลับซับซ้อนด้วย โครงผลึกทั้ง 14 แบบ ได้แก่
กลับไปที่เนื้อหา
การนับจำนวนอะตอมในหน่วยเซลล์
การนับจำนวนอนุภาคในหน่วยเซลล์ต้องพิจารณาตำแหน่งของอนุภาคที่อยู่ตามมุม (corner), ตามขอบ (edge), ตามผิวหน้า (face) หรือตรงกลาง (center) ของหน่วยเซลล์ว่าแต่ละอนุภาคในหน่วยเซลล์หนึ่งๆ เป็นสัดส่วนเท่าใด แล้วจึงนำอนุภาคทั้งหมดมารวมกัน ทั้งนี้เพราะหน่วยเซลล์ต่างก็อยู่ติดกัน จึงใช้อนุภาคตามมุม ขอบ หรือผิวหน้ารวมกัน
หลักการนับจำนวนอะตอมหรือไอออนในหน่วยเซลล์
1. อะตอมที่อยู่ที่มุมนับ 1/8
2. อะตอมที่อยู่ที่พื้นผิวนับ 1/2
3. อะตอมที่อยู่ตามขอบนับ 1/4
4. อะตอมที่อยู่ตรงกลางนับเต็มคือ 1
เราสามารถคำนวณหาจำนวนอะตอมหรือไอออนในหน่วยเซลล์ได้จากสมการ
n = nint + nf/2 + ne/4 + nc/8
เมื่อ n = จำนวนอะตอมในหน่วยเซลล์
nint = จำนวนอะตอมที่อยู่ภายใน
nf = จำนวนอะตอมตามผิวหน้า
ne = จำนวนอะตอมตามริมขอบ
nc = จำนวนอะตอมตามมุม
กลับไปที่เนื้อหา
การจัดเรียงอนุภาคในผลึก
ในการศึกษาการจัดเรียงอนุภาคในผลึก เราจะพิจารณาผลึกของโลหะ ซึ่งมีลักษณะของอะตอมเรียงติดต่อกันเป็นแถวและซ้อนทันกันเป็นชั้นๆ ในกรณีของโลหะบริสุทธิ์ทุกอะตอมจะมีขนาดเท่ากัน เพื่อทำความเข้าใจเกี่ยวกับโครงสร้างผลึกได้ที่ขึ้น เราอาจใช้ทางกลมที่มีขนาดเท่าๆ กัน เช่น ลูกปิงปอง หรือดินน้ำมัน มาจัดเรียงให้เป็นโครงสร้างแบบต่างๆ ซึ่งจากการทดลองพบว่า ในผลึกโลหะนั้นจะมีการบรรจุทรงกลมในลักษณะที่มีการสัมผัสกันมากที่สุดเท่าที่จะเป็นไปได้ เรียกว่า การเรียงตัวชิดที่สุด (closet-packed structure) การเรียงทรงกลมให้ได้โครงสร้างที่ชิดที่สุด อาจเรียงได้ 2 แบบ คือ
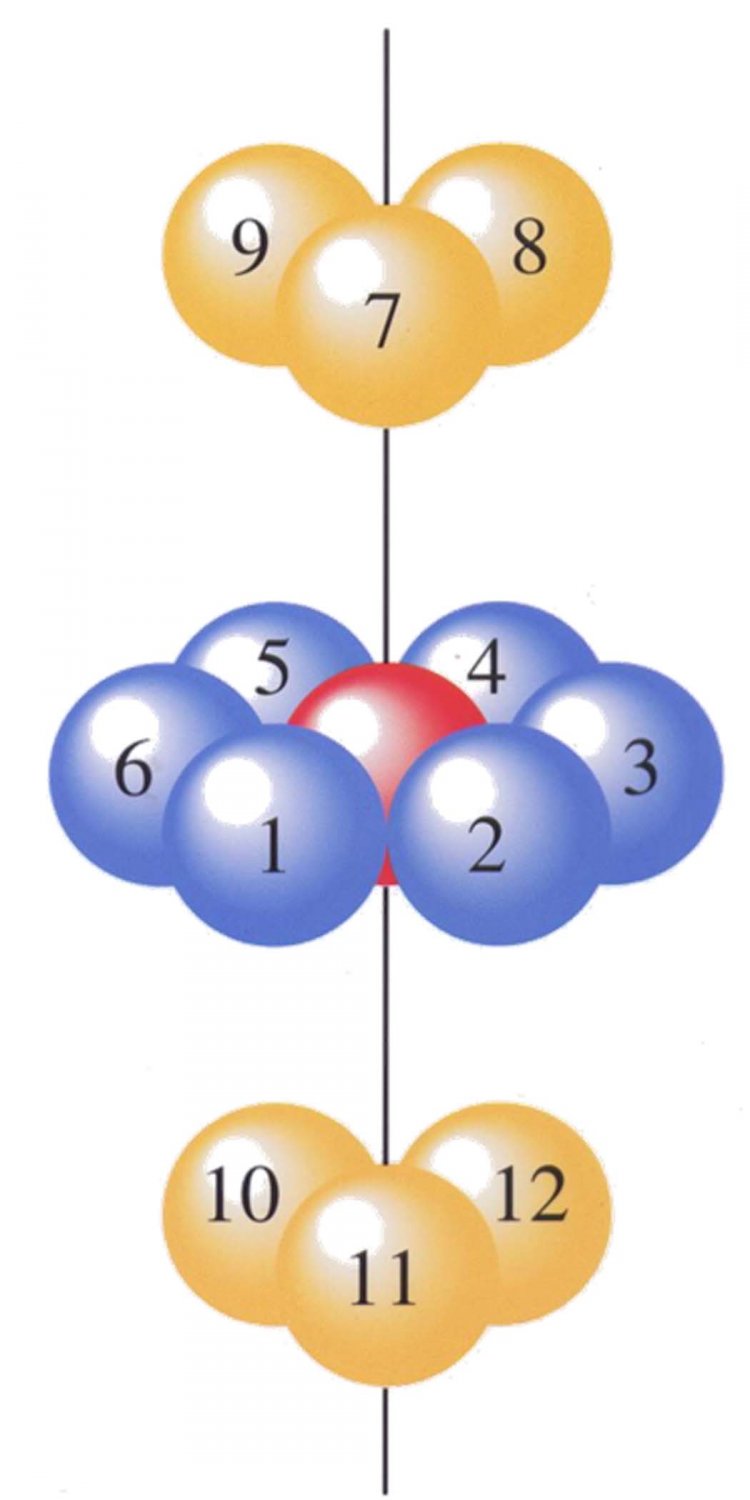
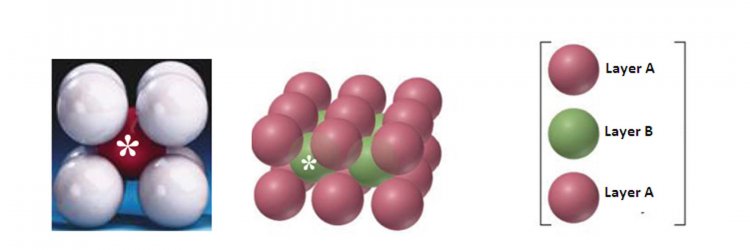
1. โครงสร้างชิดที่สุดแบบเฮกซะโกนอล (hexagonal closet-packed structure, hcp) เป็นการบรรจุอนุภาคโดยมีลักษณะการซ้อนของชั้นต่างๆ เป็น AB AB … หมายความว่ามีการจัดเรียงอนุภาค 2 ชั้นที่ไม่เหมือนกันซ้ำๆ กันไปเรื่อยๆ คือชั้นที่ 1 ซึ่งเป็นชั้น A จะไม่มีการจัดเรียงอนุภาคซ้ำกับชั้นที่ 2 ซึ่งเป็นชั้น B (จัดเรียงอนุภาคแบบเหลื่อมกัน) แต่จะเหมือนกับชั้นที่ 3 ดังรูป
2. โครงสร้างชิดที่สุดแบบลูกบาศก์ (cubic closet-packed structure, ccp) เป็นการบรรจุอนุภาคโดยมีลักษณะเป็น ABC ABC… หมายความว่ามีการจัดเรียงอนุภาค 3 ชั้นที่ไม่เหมือนกันซ้ำๆ กันไปเรื่อยๆ ดังแสดงในรูปที่ 16 การจัดเรียงตัวแบบนี้จะมีหน่วยเซลล์เป็นแบบ fcc
เมื่อพิจารณาเลขโคออร์ดิเนชัน (Coordination number) หรือจำนวนอนุภาคที่ล้อมรอบอนุภาคหนึ่งจะพบว่า การบรรจุอนุภาคแบบโครงสร้างชิดที่สุดทั้ง 2 แบบ ทรงกลมแต่ละลูกจะถูกล้อมรอบด้วยทรงกลมอื่นอีก 12 ลูก นั่นคือ เลขโคออร์ดิเนชันของการบรรจุแบบ hcp และ cpp มีค่าเท่ากับ 12 นอกจากนี้ เมื่อคำนวณหาการใช้พื้นที่ของอะตอมต่างๆ ในผลึกของการบรรจุอนุภาคแบบโครงสร้างชิดที่สุดทั้ง 2 แบบ จะพบว่า อะตอมต่างๆ ใช้พื้นที่ในผลึก 74 เปอร์เซ็นต์ และเป็นช่องว่าง 26 เปอร์เซ็นต์ ในกรณีที่มีการเรียงทรงกลมในการบรรจุอนุภาคแบบอื่นๆ เช่น การบรรจุแบบ body-centered cubic จะพบว่า อะตอมใช้เนื้อที่เพียง 68 เปอร์เซ็นต์และเป็นเนื้อที่ว่างถึง 32 เปอร์เซ็นต์ หรือการบรรจุแบบ simple cubic พบว่า อะตอมใช้เนื้อที่เพียง 52.4 เปอร์เซ็นต์
รูปการบรรจุแบบ body-centered cubic มีเลขโคออร์ดิเนชันเป็น 8

รูปการบรรจุแบบ simple cubic มีเลขโคออร์ดิเนชันเป็น 6
ตารางแสดงลักษณะทั่วไปของอนุภาคในหน่วยเซลล์
|
ชนิดของหน่วยเซลล์ |
สัดส่วนการครอบครองของอนุภาคในหน่วยเซลล์ (%) |
เลขโคออร์ดิเนชัน |
|
hcp |
74 |
12 |
|
ccp |
74 |
12 |
|
bcc |
68 |
8 |
|
sc |
52.4 |
6 |
กลับไปที่เนื้อหา
ความไม่สมบูรณ์ของผลึก
ความสมบูรณ์ของผลึกหรือผลึกที่ไม่มีตำหนิ คือ ผลึกที่มีอนุภาคของผลึกอยู่ตามตำแหน่งที่ถูกต้องมีระเบียบแบบแผนที่สมบูรณ์ตามลักษณะของผลึกนั้นๆ ซึ่งผลึกที่มีความสมบูรณ์จริงๆ นั้น จะเกิดขึ้นได้ที่อุณหภูมิ 0 K เท่านั้น เมื่ออุณหภูมิสูงกว่า 0 K ความเป็นระเบียบแบบแผนของผลึกก็จะน้อยลง เรียกว่าความไม่สมบูรณ์ของผลึก (defect) ทั้งนี้เนื่องจากอนุภาคมีการสั่น อะตอมอยู่ผิดที่หรือมีอะตอมอื่นเข้าไปอยู่ตามที่ว่างในผลึก ซึ่งอาจจะทำให้เกิดความไม่สมบูรณ์ของผลึกแบบต่างๆ หากจำแนกตามลักษณะทางเรขาคณิต จะแบ่งได้เป็น 2 แบบ คือ ความไม่สมบูรณ์ของผลึกแบบจุด แความไม่สมบูรณ์ของผลึกแบบเส้นหรือบนพื้นผิวของผลึก
1. ความไม่สมบูรณ์ของผลึกแบบจุด (point defect) เกิดขึ้นจากสาเหตุที่สําคัญ 4 ประการ ดังแสดงในรูป
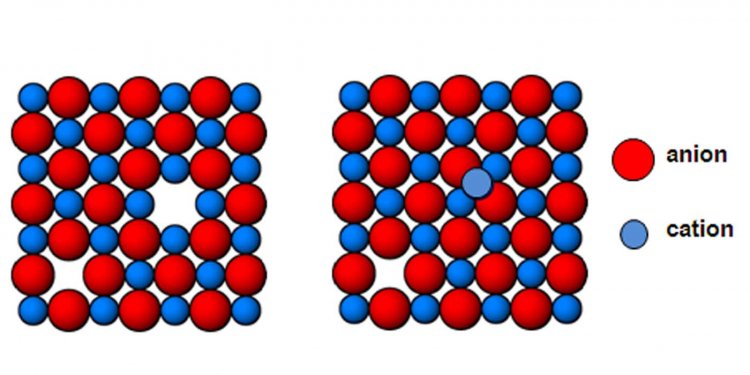
- ถ้าอะตอมไม่มีหรือขาดหายไปจากตำแหน่งทำให้ตำแหน่งนั้นเป็นที่ว่าง (vacancy)
- ถ้าอะตอมเลื่อนจากตำแหน่งไปอยู่ในที่ว่างอื่น คือ “การเข้าไปอยู่ในช่องว่างเสียเอง” (self-interstitial defect)
- ถ้าอะตอมอื่นที่ไม่ใช่อะตอมของผลึกนั้นไปอยู่ในช่องว่าง เพื่อแทนที่อะตอมที่มีในผลึกเรียกว่า “substitutional impurity”
- ถ้าอะตอมอื่นที่มีขนาดเล็กเข้าไปอยู่ในช่องว่าง (interstice) ที่มีตามธรรมชาติของผลึกเรียกว่า “interstitial impurity”
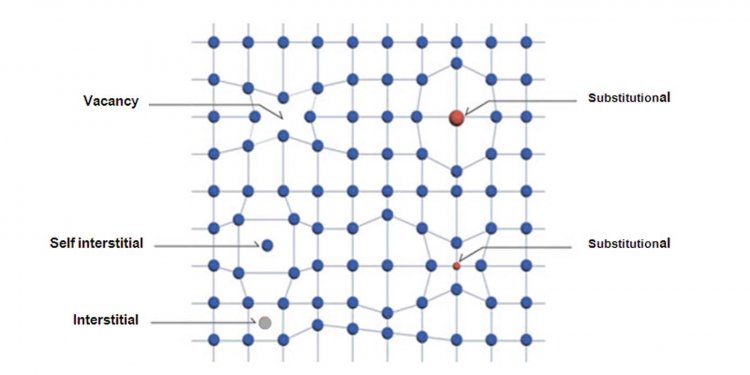
รูปแสดงความไม่สมบูรณ์ของผลึกแบบจุด
นอกจากความไม่สมบูรณ์ของผลึกแบบจุด แล้วยังมีความไม่สมบูรณ์ของผลึกแบบจุดในกรณีของผลึกไอออนิกที่จัดเป็นกรณีพิเศษอีก 2 ชนิด คือ
- ความไม่สมบูรณ์แบบชอตกี (Schottky defect) เกิดจากอนุภาคที่เป็นไอออนบวกและไอออนลบหายไปเป็นจำนวนเท่าๆ กัน ทำให้ไม่เกิดการเปลี่ยนแปลงคุณสมบัติทางไฟฟ้า นั่นคือ ความเป็นกลางทางไฟฟ้า
- ความไม่สมบูรณ์แบบเฟรนเกล (Frenkel defect) เกิดจากอนุภาคที่เป็นไอออนเข้าไปอยู่ผิดที่ โดยแทรกอยู่กับไอออนอื่น ทำให้ตำแหน่งของไอออนบางส่วนในผลึกบิดเบี้ยวไป ส่วนใหญ่จะพบในกรณีผลึกที่มีขนาดไอออนบวกและไอออนลบต่างกันมาก เช่น ผลึก AgCl AgBr หรือผลึกที่มีโครงสร้างแบบไม่ชิดกัน เช่น CaF2
2. ความไม่สมบูรณ์ของผลึกแบบเส้น (line defect) มี 2 แบบ ได้แก่
- edge dislocation ผลึกประกอบด้วยการซ้อนทับของแผ่นหรือชั้นของอะตอมหรือไอออน ซึ่งการซ้อนทับของชั้นต่างๆโดยที่ความยาวของชั้นหนึ่งสั้นกว่าของชั้นอื่นๆทำให้เกิดการบิดเบี้ยวภายในผลึก
- screw dislocation สมมติผลึกที่สมบูรณ์จะมีชั้นของอะตอมตามแนวนอน จากนั้นปาดผลึกตามแนวดิ่งตามระนาบ ถ้าเคลื่อนส่วนหนึ่งหลังจากปาดแล้วให้สูงขึ้นหนึ่งหรือสองระนาบ จะเห็นเป็นรูปขั้นบันไดวนรอบ
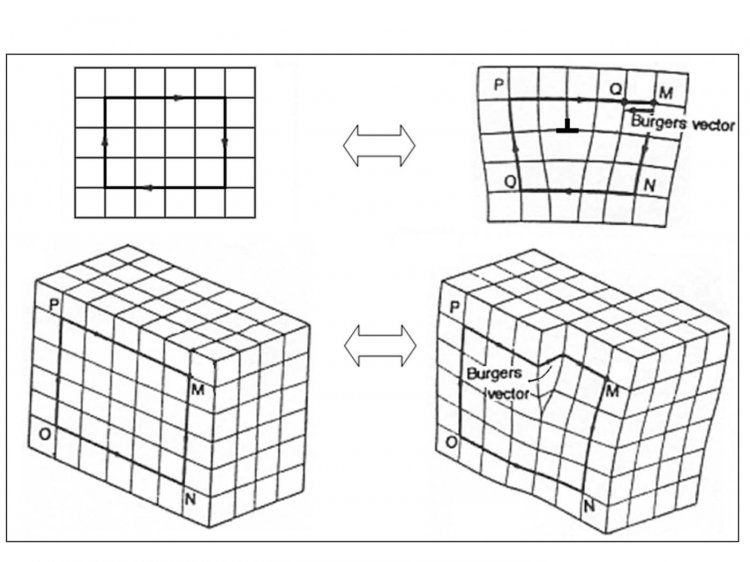
กลับไปที่เนื้อหา
ผลึกเหลว คืออะไร ???
ผลึกเหลว (Liquid Crystal) คือ สสารที่อยู่ในสถานะพิเศษระหว่าง ของแข็งกับของเหลว โดยจะมีความเป็นระเบียบในการจัดเรียงโมเลกุลในบางทิศทางซึ่งคล้ายกับของแข็ง แต่ขณะเดียวกันสามารถไหลตัวไปได้ในบางทิศทางซึ่งคล้ายกับของเหลว
นักพฤกษศาสตร์ชาวออสเตรียชื่อ ฟรีดริช ไรนิทเซอร์ (Fredrich Reinitzer) ทำงานมหาวิทยาลัยชาร์ลส์ในปรากเป็นผู้ค้นพบผลึกเหลวเป็นครั้งแรกเมื่อปี ค.ศ. 1860 ในสารอินทรีย์ คอเลสตรี เบนโซเอท (Cholestry benzoate) เมื่อความร้อนกับสารนี้ มันจะเปลี่ยนสถานะจากของแข็ง ไปเป็นก้อนยุ่งเหยิงคล้ายหมอก ซึ่งก็คือผลึกเหลวนั้นเอง และเมื่อให้ความร้อนต่อไปก็จะกลายเป็นของเหลว ปัจจุบันผลึกเหลวที่พบส่วนใหญ่เป็นสารอินทรีย์ ออกไซด์ของโลหะบางชนิดที่มีน้ำอยู่ด้วย เช่น สนิมเหล็ก (Fe2O3.xH2O) ก็จัดว่าเป็นผลึกเหลวชนิดหนึ่งเช่นเดียวกัน
ผลึกเหลวแบ่งได้เป็น 2 กลุ่มตามวิธีการเกิด คือ
1. ผลึกเหลวชนิดเทอร์โมทรอปิก (thermotropic liquid crystal) เกิดจากการให้ความร้อน อย่างเช่นคอเลสตรี เบนโซเอท เป็นต้น ผลึกเหลวชนิดนี้ยังแบ่งได้เป็นอีก 2 ชนิด คือ
-ชนิดเส้นด้าย (nemetic)
-ชนิดไขหรือเมือก (smetic)
2. ผลึกเหลวชนิดที่สองคือผลึกเหลวชนิดไลโอทรอปิก (lyotropic liquid crystal) ทำให้เกิดขึ้นโดยการผสมสารบางชนิด เช่น สบู่หรือผงซักฟอก, กรดไขมัน, เกลือของกรดไขมัน ฯลฯ ลงในน้ำหรือตัวทำละลายที่มีขั้ว
สมบัติที่น่าสนใจอย่างมากของผลึกเหลวก็คือ เมื่อให้พลังงานจากภายนอก เช่น ความร้อน, แรงดัน หรือสนามแม่เหล็กไฟฟ้า กับผลึกเหลว จะทำให้การจัดเรียงตัวของ โมเลกุลของผลึกเหลวเกิดการเปลี่ยนแปลง ส่งผลทำให้สมบัติทางแสง เช่น สี, ความโปร่งแสง รวมถึงการยอมให้แสงที่มีขั้ว (polarized light) ผ่านได้เปลี่ยนไปด้วยเช่นกัน ซึ่งสามารถนำไปใช้ประโยชน์ได้หลายประการ ที่เรารู้จักกันดีก็คือ ใช้ทำเป็นจอแสดงผลในอุปกรณ์อิเลกทรอนิกส์หรือที่เราเรียกกันติดปากว่าจอ LCD ซึ่งมีทั้งแบบสีเดียว อย่างเครื่องคิดเลขหรือนาฬิกา และแบบที่มีแม่สี 3 สีผสมกัน เช่น จอโทรทัศน์ชนิดแบน เป็นต้น นอกจากนั้นแล้ว ผลึกเหลวยังสามารถใช้งานทางการแพทย์ เพื่อตรวจความผิดปกติในร่างกาย รวมถึงในการตรวจสอบชิ้นส่วนโลหะแบบไม่ทำลาย (nondestructive testing) ได้อีกด้วย
ที่มา : http://www.material.chula.ac.th/RADIO45/April/radio4-3.htm
กลับไปที่เนื้อหา



