สารอินทรีย์
- 1. การแนะนำ
- 2. บทเรียนที่ 2 สารประกอบไฮโดรคาร์บอน(2)
- 3. บทเรียนที่ 3 สารประกอบอะโรมาติกไฮโดรคาร์บอน
- 4. บทเรียนที่ 4 หมู่ฟังก์ชัน
- 5. บทเรียนที่ 5 ปฏิกิริยาของแอลเคน แอลคีนและอแอลไคน์
- 6. บทเรียนที่ 6 ปฏิกิริยาของสารอินทรีย์
- 7. บทเรียนที่ 7 กรดอินทรีย์และแอลกอฮอล์
- 8. บทเรียนที่ 8 แอลดีไฮน์
- 9. บทเรียนที่ 9 คีโตน เอมีนและเอไมด์
- 10. บทเรียนที่ 10 กรดอะมิโนและพันธะเปบไทด์
- 11. บทเรียนที่ 11 ไขมันและกรดไขมัน
- 12. บทเรียนที่ 12 คาร์โบไฮเดรต
- 13. บทเรียนที่ 13 สารชีวโมเลกุล
- - ทุกหน้า -

บทเรียนที่ 1 สารประกอบไฮโดรคาร์บอน(1)
สารประกอบไฮโดรคาร์บอน (Hydrocarbon compound)
สารอินทรีย์ที่โมเลกุลประกอบด้วยธาตุคาร์บอนและไฮโดรเจนเท่านั้นเรียกว่า สารประกอบไฮโดรคาร์บอน และสารประกอบไฮโดรคาร์บอนที่โมเลกุลประกอบด้วยพันธะเดี่ยวระหว่างคาร์บอน-คาร์บอนเพียงอย่างเดียว เรียกว่า ไฮโดรคาร์บอนอิ่มตัว(Saturated hydrocarbon) ส่วนสารประกอบไฮโดรคาร์บอนที่โมเลกุลมีพันธะคู่หรือพันธะสามระหว่างคาร์บอน-คาร์บอนรวมอยู่ด้วย เรียกว่า ไฮโดรคาร์บอนไม่อิ่มตัว(Unsaturated hydrocarbon)
โมเลกุลของสารประกอบไฮโดรคาร์บอนที่อะตอมของคาร์บอนต่อกันเป็นสายยาวหรือต่อกันเป็นโซ่ตรง(Straight chain) หรือต่อกันเป็นสายยาวที่มีกิ่งสาขาแยกออกจากโซ่ตรง(Branch chain) โดยไม่มีวงของคาร์บอนในโมเลกุลนั้นเลยเรียกว่า อะลิฟาติกไฮโดรคาร์บอน (Aliphatic hydrocarbon) หรือแบบโซ่เปิด โมเลกุลของสารประกอบไฮโดรคาร์บอนที่อะตอมของคาร์บอนต่อกันเป็นวงและอาจจะมีกิ่งแยกออกจากวงของคาร์บอนเรียกโมเลกุลประเภทนี้ว่าไฮโดรคาร์บอนแบบโซ่ปิด หรืออะลิไซคลิกไฮโดรคาร์บอน(Alicyclic hydrocarbon) และโมเลกุลของสารประกอบไฮโดรคาร์บอนที่มีวงแหวนของเบนซีนเป็นโครงสร้างหลักเรียกว่า อะโรมาติกไฮโดรคาร์บอน(Aromatic hydrocarbon)
สารประกอบไฮโดรคาร์บอนอิ่มตัว (Saturated hydrocarbon)
1. แอลเคน (Alkane)
นักเคมีอินทรีย์เห็นว่าแอลเคนเป็นโครงสร้างของคาร์บอนที่ยึดอะตอมไฮโดรเจนไว้และโครงสร้างที่ง่ายที่สุดจะเป็นโซ่ของคาร์บอนอะตอมติดต่อกันโดยไม่มีโซ่กิ่ง สารประกอบเหล่านี้มีสูตรทั่วไป CnH2n+2 ดังนี้
ตาราง 3.1 แสดงโครงสร้าง ชื่อ และสมบัติทางกายภาพของ n-alkane
|
โครงสร้าง |
ชื่อ |
จุดหลอมเหลว(°C) |
จุดเดือด(°C) |
|
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3 CH3(CH2)3CH3 CH3(CH2)4CH3 CH3(CH2)5CH3 CH3(CH2)6CH3 CH3(CH2)7CH3 CH3(CH2)8CH3 |
Methane Ethane Propane n – butane n – pentane n – hexane n – heptane n – octane n – nonane n – decane |
-183 -172 -187 -135 -130 -94 -91 -57 -54 -30 |
-162 -89 -42 0 36 69 98 126 151 174 |
อย่างไรก็ตามเมื่อจำนวนคาร์บอนอะตอมเพิ่มขึ้นจำนวนไอโซเมอร์ก็เพิ่มขึ้นด้วย เช่น เฮกเซนจะมี 5 ไอโซเมอร์ เฮปเทนมี 8 ไอโซเมอร์ ทำให้การเรียกชื่อมีปัญหามากขึ้นเรื่อย ๆ จึงมีความจำเป็นต้องตั้งระบบการเรียกชื่อขึ้น
ระบบ IUPAC นักเคมีกลุ่มหนึ่งได้ประชุมกันที่เจนีวาในปี ค.ศ.1892 และได้ช่วยกันร่างกฎการเรียกชื่อขึ้นมา เรียกว่าระบบ IUPAC (International Union of Pure and Applied Chemistry) ซึ่งมีขั้นตอนในการเรียกดังนี้
- เลือกโซ่คาร์บอนที่ยาวที่สุดเป็นโซ่หลัก (parent name)
- กำหนดตำแหน่งของคาร์บอนอะตอมในโซ่หลัก โดยให้ตำแหน่งของคาร์บอนที่มีหมู่แทนที่(substituent) มีตัวเลขต่ำสุด
- หมู่แทนที่ต่ออยู่กับตำแหน่งใดของคาร์บอนอะตอมในโซ่หลักการอ่านชื่อก็จะระบุตำแหน่งของคาร์บอนอะตอมนั้นแล้วตามด้วยชื่อของหมู่แทนที่
- ในการเรียกชื่อจะเริ่มด้วยชื่อของหมู่แทนที่เรียงตามลำดับตัวอักษรแล้วตามด้วยชื่อหลัก ถ้าในโมเลกุลมีหมู่แทนที่ชนิดเดียวกันมากกว่า 1 หมู่ ให้เติมคำว่า di, tri, tetra ฯลฯ เพื่อบอกถึงจำนวนของหมู่แทนที่ด้วย และถ้าหมู่แทนที่ชนิดเดียวกันแทนที่อยู่ที่คาร์บอนอะตอมเดียวกันทั้ง 2 หมู่ให้ระบุตัวเลขของตำแหน่งนั้นซ้ำด้วย เช่น
สำหรับหมู่แอลคิล (alkyl group) ซึ่งเป็นหมู่แทนที่นั้น เกิดจากการลดจำนวนอะตอมของไฮโดรเจนในแอลเคนลง 1 อะตอม จึงมีสูตรทั่วไป CnH2n+1
2. ไซโคลแอลเคน(Cycloalkane)
การเรียกชื่อไซโคลแอลเคนจะเรียกทำนองเดียวกับแอลเคน ยกเว้นแต่ชื่อหลักซึ่งบอกจำนวนคาร์บอนในวงนั้นจะต้องนำหน้าด้วยคำว่า ไซโคล – (cyclo - )
การเขียนสูตรแสดงโมเลกุลของไซโคลแอลเคนนิยมเขียนเป็นรูปเรขาคณิตเพราะเขียนง่าย แต่การใช้สูตรแบบนี้จะต้องระลึกเสมอว่าแต่ละอะตอมของคาร์บอน(ซึ่งเขียนแสดงเพียงมุมของรูปเหลี่ยมเท่านั้น) จะต้องสร้างพันธะกับไฮโดรเจน 2 อะตอม และจากตาราง 3.3 จะเห็นว่าไซโคลแอลเคนมีจุดเดือดสูงกว่า n – alkane ที่มีจำนวนคาร์บอนเท่ากัน
ไซโคลแอลเคนที่มีหมู่แอลคิลแทนที่จะเรียกชื่อเป็นอนุพันธ์ของไซโคลแอลเคน โดยถ้ามีการแทนที่เพียง 1 หมู่ ก็ไม่จำเป็นต้องระบุตำแหน่งที่แทนที่ เพราะทุก ๆ ตำแหน่งในวงจะสมมาตรกันหมด
กลับไปที่เนื้อหา
บทเรียนที่ 2 สารประกอบไฮโดรคาร์บอน(2)
ไซโคลแอลเคน (Cycloalkane)
การเรียกชื่อไซโคลแอลเคนจะเรียกทำนองเดียวกับแอลเคน ยกเว้นแต่ชื่อหลักซึ่งบอกจำนวนคาร์บอนในวง
นั้นจะต้องนำหน้าด้วยคำว่า ไซโคล – (cyclo - )
การเขียนสูตรแสดงโมเลกุลของไซโคลแอลเคนนิยมเขียนเป็นรูปเรขาคณิตเพราะเขียนง่าย แต่การใช้สูตรแบบนี้จะต้องระลึกเสมอว่าแต่ละอะตอมของคาร์บอน(ซึ่งเขียนแสดงเพียงมุมของรูปเหลี่ยมเท่านั้น) จะต้องสร้างพันธะกับไฮโดรเจน 2 อะตอม และจากตาราง 3.3 จะเห็นว่าไซโคลแอลเคนมีจุดเดือดสูงกว่า n – alkane ที่มีจำนวนคาร์บอนเท่ากัน
ไซโคลแอลเคนที่มีหมู่แอลคิลแทนที่จะเรียกชื่อเป็นอนุพันธ์ของไซโคลแอลเคน โดยถ้ามีการแทนที่เพียง 1 หมู่ ก็ไม่จำเป็นต้องระบุตำแหน่งที่แทนที่ เพราะทุก ๆ ตำแหน่งในวงจะสมมาตรกันหมด เช่น
CH3 CH2CH3
methylcyclobutane ethylcyclohexane
แต่ถ้ามีการแทนที่ตั้งแต่ 2 ตำแหน่งขึ้นไป จำเป็นต้องระบุตำแหน่งที่มีการแทนที่ด้วย โดยทั่วไปให้มีการนับตำแหน่งที่มีการแทนที่ใด ๆ เป็นตำแหน่งที่ 1 แล้วนับวนไปจนรอบวงในทิศทางที่ทำให้หมู่แทนที่มีตัวเลขน้อยที่สุด เช่น
CH3 CH3
CH3 CH2CH3
1, 3 – dimethylcyclopentane 1 – ethyl – 3 – methylcyclohexane
ถ้าวงของไซโคลแอลเคนต่ออยู่กับหมู่แอลคิลที่มีโครงสร้างซับซ้อน มักนิยมเรียกหมู่ไซโคลแอลคิลเป็นหมู่แทนที่ต่อกับแอลเคน เช่น
CH3 CH3
CH3 CH CH CH2 CH CH3
3 – cyclopentyl – 2, 5 - dimethylhexane
สารประกอบไฮโดรคาร์บอนไม่อิ่มตัว (Unsaturated hydrocarbon)
- 1. แอลคีน (Alkene)
เป็นสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวที่มีพันธะคู่ พันธะคู่ในแอลคีนจัดเป็นหมู่ฟังก์ชัน (functional
group) ซึ่งการเรียกชื่อโดยระบบ IUPAC นั้น ถ้ามีหมู่ฟังก์ชันจะต้องพิจารณาถึงหมู่ฟังก์ชันของสารประกอบเพื่อใช้เป็นชื่อหลัก ในกรณีของแอลคีนมีขั้นตอนดังนี้
- เลือกโซ่คาร์บอนที่ยาวที่สุดและมีพันธะคู่อยู่ในโซ่นั้นด้วยเป็นชื่อหลัก แต่ในกรณีที่มีพันธะคู่มากกว่า 1
พันธะ ให้เลือกโซ่ที่มีพันธะคู่มากที่สุดเป็นชื่อหลัก แม้ว่าจะไม่ใช่โซ่ที่ยาวที่สุดก็ตาม
2 กำหนดตำแหน่งคาร์บอนอะตอมในโซ่หลัก โดยให้พันธะคู่อยู่ในตำแหน่งที่มีเลขน้อยที่สุด
3 ถ้ามีพันธะคู่เพียง 1 พันธะ ให้ลงท้ายชื่อว่า – อีน ( - ene) ถ้ามี 2 พันธะใช้ – ไดอีน ( - diene) ฯลฯ
4 ตำแหน่งของพันธะคู่ให้ระบุด้วยตัวเลขของคาร์บอนอะตอมแรกที่สร้างพันธะคู่นั้น
5 ถ้ามีโซ่กิ่งให้ระบุทำนองเดียวกันกับสารประกอบแอลเคน
1.1 สมบัติทางกายภาพ
โดยทั่วไปสมบัติทางกายภาพของแอลคีนคล้ายคลึงกับของแอลเคนที่มีขนาดใกล้เคียงกัน แอลคีนที่มีคาร์บอน 2-4 อะตอมมีสถานะเป็นก๊าซ คาร์บอน 5-18 อะตอมมีสถานะเป็นของเหลวและคาร์บอนมากกว่า 18 อะตอมมีสถานะเป็นของแข็ง แอลคีนเป็นโมเลกุลไม่มีขั้วจึงไม่ละลายในน้ำแต่จะละลายได้ดีในตัวทำละลายไม่มีขั้ว เช่น เบนซีน คาร์บอนเตตระคลอไรด์ เป็นต้น สมบัติบางประการของแอลคีนดังแสดงในตาราง 3.5
ตาราง 3.5 แสดงสมบัติทางกายภาพบางประการของแอลคีน
|
สูตรโครงสร้าง |
ชื่อ IUPAC |
จุดหลอมเหลว(°C) |
จุดเดือด(°C) |
ความหนาแน่น (g/cm3) ที่ 25°C |
|
CH2 = CH2 CH2 = CHCH3 CH2 = CHCH2CH3 CH3CH = CHCH3 CH3(CH2)7CH = CH3 |
ethene propene 1 – butene 2 – butene 1 - decene |
-169 -185.2 -185 -139 -66.3 |
-104 -47 -6.0 3.7 171 |
- - - 0.621 0.741 |
1.2 ปฏิกิริยาเคมี
แอลคีนเกิดปฏิกิริยาเคมีแตกต่างจากแอลเคนมาก แอลเคนเป็นสารประกอบที่เฉื่อย แต่แอลคีนมีความว่องไวต่อปฏิกิริยาสูง ปฏิกิริยาที่สำคัญของแอลคีนได้แก่
1.2.1 ปฏิกิริยาการเติม(Addition)
C = C + A – B – C – C –
A B
เป็นปฏิกิริยาที่รีเอเจนต์ A – B เติมลงไปที่ปลายทั้งสองข้างของพันธะคู่แล้วเกิดผลิตภัณฑ์เป็นสารประกอบอิ่มตัว ซึ่งประกอบด้วยอะตอมทุกอะตอมของตัวทำปฏิกิริยาที่สองตัว ปฏิกิริยาการเติมแบ่งได้ดังนี้
1.2.1.1 ปฏิกิริยาการเติมไฮโดรเจนโดยใช้ตัวเร่งปฏิกิริยา(Catalytic hydrogenetion)
ไฮโดรเจนโมเลกุลสามารถเติมลงไปที่พันธะคู่ของแอลคีนได้เมื่อใช้ตัวเร่งที่เหมาะสมได้ผลิตภัณฑ์เป้นแอลเคนปฏิกิริยาเกิดขึ้นได้โดยละลายแอลคีนในตัวทำละลายที่เหมาะสม เช่น เอทานอล เมทานอล และมีตัวเร่งปฏิกิริยาอาจจะเป็นแพลตินัม(Pt) นิกเกิล(Ni) หรือแพลเลเดียม(Pd) ที่เป้นผงละเอียดจากนั้นจึงผ่านก๊าซไฮโดรเจนเข้าไปในส่วนผสมของปฏิกิริยาภายใต้ความดันต่ำ ไฮโดรเจนจะไม่สามรถเติมลงไปที่พันธะคู่ได้ถ้าไม่ใช้ตัวเร่ง แม้ว่าปฏิกิริยานี้จะเป็นปฏิกิริยาคายความร้อนอย่างมากก็ตาม ทั้งนี้เนื่องจากพลังงานที่ใช้ในการสลายพันธะของไฮโดรเจนโมเลกุลมีค่าสูงมาก ตัวเร่งจะดูดซับโมเลกุลของไฮโดรเจนและของแอลคีนเป็นชั้นบาง ๆ เคลือบไว้ที่ผิวของตัวเร่งเป็นการช่วยให้ไฮโดรเจนแตกตัวออกเป็นอะตอมและเกิดปฏิกิริยากับแอลคีนที่ผิวของตัวเร่ง
1.2.1.2 ปฏิกิริยาการเติมฮาโลเจน (Halogenetion)
CH3CH = CH2 + Br2/CCl4 CH3CH CH2
Br Br
สีส้ม(สีน้ำตาลแดง) ไม่มีสี
แอลคีนทำปฏิกิริยากิริยากับสารละลายโบรมีน หรือคลอรีนในคาร์บอนเตตระคลอไรด์ที่อุณหภูมิห้องได้ ไอโอดีนมีความว่องไวน้อยจึงไม่สามารถเกิดปฏิกิริยากับแอลคีนได้ ส่วนฟลูออไรด์นั้นว่องไวมากเกิดปฏิกิริยารุนแรงจึงเป็นรีเอเจนต์ที่ไม่เหมาะสม ปฏิกิริยาการเติมโบรมีนสามารถใช้ทดสอบความไม่อิ่มตัวของสารประกอบได้โดยการสังเกตสีที่เปลี่ยนไปเมื่อเกิดปฏิกิริยา โบรมีนเป็นของเหลวสีส้มหรือสีน้ำตาลแดงเข้มเมื่อเกิดปฏิกิริยากับแอลคีนจะได้ผลิตภัณฑ์ที่ไม่มีสี ดังนั้นสารประกอบไม่อิ่มตัวจึงฟอกสีโบรมีนได้
1.2.1.3 ปฏิกิริยาการเติมกรด
HX – C – C – (HX : HCl, HBr, HI)
H X
(แอลคิลเฮไลด์)
C = C H2SO4 – C – C –
H OSO3H
(แอลคิลไฮโดรเจนซัลเฟต)
H2O, H+ – C – C –
H OH
1.2.2 ปฏิกิริยาออกซิเดชัน(Oxidation)
แอลคีนสามารถถูกออกซิไดซ์ที่พันธะคู่ได้หลายแบบขึ้นอยู่กับชนิดของตัวออกซิไดซ์และสภาวะ
ของปฏิกิริยา ปฏิกิริยาออกซิไดซ์ของแอลคีนเมื่อใช้ตัวออกซิไดซ์ที่อ่อน ได้แก่สารละลายโพแตสเซียมเปอร์แมงกาเนตที่เป็นกลางหรือด่างเจือจางที่เย็นจะได้ผลิตภัณฑ์เป็นไกลคอล
3CH2 = CH2 + 2KMnO4 + H2O 3 CH2 – CH2 + 2MnO2 + 2KOH
OH OH
(ไกลคอล)
ปฏิกิริยานี้ใช้เป็นวิธีทดสอบความไม่อิ่มตัวของสารประกอบได้อีกวิธีหนึ่งเรียกว่า เบเยอร์เทสท์(Baeyer test) สารละลายโพแตสเซียมเปอร์แมงกาเนตมีสีม่วงเมื่อเกิดปฏิกิริยากับแอลคีนสีม่วงจะหายไปและมีตะกอนสีน้ำตาลของแมงกานีส(IV)ออกไซด์เกิดขึ้น ส่วนไกลคอลเป็นสารประกอบไม่มีสี ปฏิกิริยานี้ถ้าเกิดในสภาวะที่รุนแรง เช่นในสารละลายกรด(pH ต่ำ) และให้ความร้อน ไกลคอลที่เกิดขึ้นจะแตกตัวออก ผลิตภัณฑ์ที่ได้อาจเป็นก๊าซคาร์บอนไดออกไซด์ กรดคาร์บอกซิลิก หรือคีโตนก็ได้ขึ้นอยู่กับโครงสร้างของแอลคีนในปฏิกิริยา
1.2.3 พอลิเมอไรเซชัน(Polymerization) หรือปฏิกิริยาการเกิดพอลิเมอร์
สมบัติที่สำคัญอย่างหนึ่งของแอลคีนคือ ความสามารถในการสร้างโมเลกุลขนาดใหญ่เรียกว่า
พอลิเมอร์ พอลิเมอไรเซชันเป็นกระบวนการที่โมเลกุลเล็ก ๆ เรียกว่า มอนอเมอร์(monomer) เกิดปฏิกิริยารวมตัวกันเป็นโมเลกุลขนาดใหญ่ เรียกว่า พอลิเมอร์(polymer) เช่น การเกิดพอลิเอธิลีน
CH2 = CH2 + CH2 = CH2 + CH2 = CH2 +………… [ CH2 – CH2 ]n
- 2. ไซโคลแอลคีน(Cycloalkene)
ถ้าในวงของสารประกอบมีพันธะคู่เพียง 1 พันธะ ให้นับคาร์บอนอะตอมที่สร้างพันธะคู่เป็นตำแหน่งที่ 1
และไม่จำเป็นจะต้องระบุตำแหน่งของพันธะคู่นั้น แต่ถ้ามีพันธะคู่ 2 พันธะจะต้องระบุตำแหน่งของพันธะทั้งสองด้วย
- 3. แอลไคน์ (Alkyne)
เป็นสารประกอบไฮโดรคาร์บอนที่มีพันธะสามในโมเลกุลและถือว่าพันธะสามคือหมู่ฟังก์ชันของแอลไคน์
การเรียกชื่อแอลไคน์จะเหมือนกับแอลคีนแต่ให้เปลี่ยนคำลงท้ายชื่อเป็น – ไอน์ ( - yne) ในกรณีที่ในโมเลกุลมีทั้งพันธะคู่และพันธะสาม โซ่หลักจะต้องมีทั้งพันธะคู่และพันธะสาม และคำลงท้ายชื่อจะเป็น - อีนไอน์ ( - enyne)
ส่วนในการนับตำแหน่งจะต้องให้พันธะคู่มีตัวเลขน้อยกว่า เช่น
CH3 1 2 3 4 5 6
HC C – CH – CH2 – CH3 CH2 = CH – CH2 – CH2 – C CH
1 2 3 4 5
3 – methyl – 1 – pentyne 1 – hexene – 5 – yne
แม้ว่าชื่อ IUPAC ของสารประกอบตัวแรกของแอลไคน์จะเป็นอีไทน์ (ethyne) แต่มักนิยมเรียกว่า อะเซทิลีน
(acetylene) และสารประกอบตัวแรก ๆ ของแอลไคน์ก็นิยมเรียกเป็นอนุพันธ์ของอะเซทิลีน โดยพิจารณาว่าสารนั้น ๆ เกิดจากการแทนที่ไฮโดรเจนของอะเซทิลีนด้วยหมู่แอลคิล เช่น
HC CH CH3C CH CH3C CCH3
acetylene methylacetylene dimethylacetylene
3.1 สมบัติทางกายภาพ
แอลไคน์มีสมบัติทางกายภาพคล้ายคลึงกับแอลเคนและแอลคีน แอลไคน์ไม่ละลายน้ำ แต่ละลายได้ในตัว
ทำละลายอินทรีย์ เช่น เบนซีน คาร์บอนเตตระคลอไรด์ มีความหนาแน่นน้อยกว่าน้ำ จุดเดือดเพิ่มขึ้นตามมวลโมเลกุล และมีค่าใกล้เคียงกับจุดเดือดของแอลเคนและแอลคีนที่มีโครงสร้างเหมือนกัน แอลไคนืที่มีคาร์บอน 2-4 อะตอมมีสถานะเป็นก๊าซ 5-18 อะตอมมีสถานะเป็นของเหลว และคาร์บอนมากกว่า 18 อะตอมเป็นของแข็ง สมบัติบางประการของแอลไคน์ดังแสดงในตาราง 3.6
ตาราง 3.6 แสดงสมบัติทางกายภาพของแอลไคน์บางชนิด
|
สูตรโครงสร้าง |
ชื่อ IUPAC |
จุดหลอมเหลว(°C) |
จุดเดือด(°C) |
ความหนาแน่น (g/cm3) ที่ 25°C |
|
CH CH CH CCH3 CH CCH2CH3 CH CHCH2CH2CH3 |
ethyne propyne 1 – butyne 1 - pentyne |
-82 -101.5 -122 -98 |
-75 -23 - 40 |
- - - - |
3.2 ปฏิกิริยาเคมี
แอลไคน์เกิดปฏิกิริยาทำนองเดียวกับแอลคีน คือสามารถเกิดปฏิกิริยาการเติมที่พันธะสามด้วยรีเอเจนต์
ประเภทเดียวกันกับปฏิกิริยาการเติมที่พันธะคู่ของแอลคีน ต่างกันตรงปริมาณของรีเอเจนต์ที่ใช้ในการเกิดปฏิกิริยา
3.2.1 ปฏิกิริยาการเติมไฮโดรเจนโดยใช้ตัวเร่งปฏิกิริยา
3.2.2 ปฏิกิริยาการเติมฮาโลเจน
3.2.3 ปฏิกิริยาการเติมไฮโดรเจนเฮไลด์
3.2.4 ปฏิกิริยาไฮเดรชัน
กลับไปที่เนื้อหา
บทเรียนที่ 3 สารประกอบอะโรมาติกไฮโดรคาร์บอน
อะโรมาติกไฮโดรคาร์บอน (Aromatic hydrocarbon)
สารประกอบที่เป็นวงของคาร์บอน 6 อะตอม และมีพันธะคู่กับพันธะเดี่ยวสลับกันไปเป็นสารประกอบที่มีเสถียรภาพสูงและทำปฏิกิริยาแตกต่างไปจากสารประกอบแอลคีน สารประกอบเหล่านี้หลาย ๆ สารที่พบในตอนแรกยังมีกลิ่นหอมอีกด้วยจึงจัดสารประกอบในกลุ่มนี้เป็นสารประกอบอะโรมาติกไฮโดรคาร์บอน
เบนซีน (Benzene) และอนุพันธ์ของเบนซีน
ในปี ค.ศ. 1825 Michael Faraday ได้แยกสารตัวอย่างออกจากก๊าซที่ได้จากการจุดไฟให้แสงสว่าง ต่อมาเรียกว่า เบนซีน เนื่องจากสามารถสังเคราะห์ได้จากการกลั่นกรดเบนโซอิกกับแคลเซียมออกไซด์ นับเป็นตัวอย่างของสารอะโรมาติกตัวแรก ต่อมาในปี ค.ศ 1834 ได้ค้นพบสูตรโมเลกุลของเบนซีนเป็น C6H6 จากสูตรนี้แสดงให้เห็นว่าเบนซีนเป็นสารประกอบไม่อิ่มตัว แต่ในขณะนั้นไม่มีผู้ใดเสนอสูตรโครงสร้างที่แท้จริงของเบนซีนว่าเป็นอย่างไร จนกระทั่งในปี ค.ศ. 1865 Kekule/ ได้พยายามค้นคว้าและเสนอสูตรโครงสร้างของเบนซีน โดยตั้งสมมติฐานว่าเบนซีนต้องประกอบด้วยวงรูปหกเหลี่ยมที่แบนราบมีคาร์บอน 6 อะตอมต่อกันด้วยพันธะเดี่ยวและคาร์บอนแต่ละอะตอมต่างก็สร้างพันธะกับไฮโดรเจน 1 อะตอมดังรูป
และจากการศึกษาโครงสร้างของเบนซีนพบว่า ความยาวพันธะระหว่างคาร์บอนอะตอมทุกพันธะมีความยาวเท่ากันคือ 1.39 แองสตรอม (A°) ซึ่งเป็นค่าที่อยู่ระหว่างคาร์บอนอะตอมพันธะคู่ ( 1.34 A°) และพันธะสาม ( 1.54 A°) นั่นหมายความว่าพันธะระหว่างคาร์บอนอะตอมในโมเลกุลของเบนซีนไม่ได้เป็นพันธะเดี่ยวหรือพันธะคู่อย่างใดอย่างหนึ่ง แต่ประกอบด้วยพันธะคู่ที่มีการเคลื่อนที่ไปรอบวงจริง และจากการวัดมุมระหว่างพันธะของคาร์บอนแต่ละอะตอมเป็น 120 ° นักวิทยาศาสตร์เรียกปรากฎการณ์ทำนองนี้ว่า เรโซแนนซ์ (resonamce) หมายถึงปรากฎการณ์ที่ไม่สามารถแสดงสูตรโครสร้างที่แท้จริงของสารได้
อนุพันธ์ของเบนซีน เกิดจากไฮโดรเจนอะตอมในโมเลกุลของเบนซีนถูกแทนที่ด้วยธาตุใดธาตุหนึ่ง หรือหมู่ธาตุใดหมู่ธาตุหนึ่ง สารประกอบอะโรมาติกไฮโดรคาร์บอนที่เป็นอนุพันธ์ของเบนซีนจึงมีอยู่มากมายและการเรียกชื่อ IUPAC ของอนุพันธ์เหล่านี้จะอ่านโดยใช้เบนซีนเป็นชื่อหลัก ดังต่อไปนี้
ถ้าเบนซีนมีหมู่แทนที่เพียงหมู่เดียวให้อ่านหมู่แทนที่แล้วตามด้วยชื่อหลักเบนซีน สารประกอบเหล่านี้โดยมากมีชื่อสามัญ และบางครั้งชื่อสามัญมักนิยมเรียกมากกว่าชื่อ IUPAC เช่น
ถ้าหมู่ที่ต่อกับเบนซีนเป็นหมู่ที่ซับซ้อนมาก ๆ อาจจะเรียกชื่อเป็นสารประกอบของแอลเคน หรือแอลคีน หรืออื่น ๆ แล้วเรียกเบนซีนเป็นหมู่แทนที่ เป็นหมู่ฟีนิล (phenyl group)
การระบุตำแหน่งทั้งสองที่หมู่เอทิลแทนที่อยู่อาจระบุแป้นตัวเลขก็ได้ หรือที่สะดวกและนิยมมากกว่าคือใช้คำนำหน้าว่า ortho – สำหรับตำแหน่ง 1, 2 meta – สำหรับตำแหน่ง 1, 3 และ para – สำหรับตำแหน่ง 1, 4 โดยมักใช้เป็นตัวย่อ o – m – และ p – แทน ortho – meta – และ para – ตามลำดับ แต่ถ้ามีหมู่แทนที่มากกว่า 2 หมู่ขึ้นไปจะระบุตำแหน่งที่แทนที่ด้วยตัวเลขอย่างปกติ เช่น
ถ้ามีวงอะโรมาติกมาเชื่อมต่อกันโดยมีด้านใดด้านหนึ่งร่วมกันเรียกว่าพอลินิวเคลียร์อะโรมาติกไฮโดรคาร์บอน ( polynuclear aromatic hydrocarbon ) เช่น
ประโยชน์ของเบนซีนและอนุพันธ์
เบนซีนเป็นตัวทำละลายและเป็นสารตั้งต้นในการสังเคราะห์สารประกอบต่าง ๆ แต่การสูดดมเบนซีนในปริมาณมาก ๆ ทำให้เกิดอาการคลื่นเหียนและอาจถึงตายเนื่องจากระบบหายใจล้มเหลว นอกจากนี้การที่ต้องสัมผัสกับเบนซีนต่อเนื่องกันนาน ๆ จะทำให้ไขอ่อนในโพรงกระดูกซึ่งทำหน้าที่สร้างเม็ดเลือดถูกทำลาย ดังนั้นห้องปฏิบัติการเกี่ยวกับเบนซีนจึงต้องมีระบบถ่ายเทอากาศอย่างดี และถ้าไม่จำเป็นควรใช้โทลูอีนเป็นตัวทำละลายแทน
ในทางอุตสาหกรรมใช้โทลูอีนเป็นตัวทำละลายสำหรับแล็คเกอร์ ใช้ทำสี ยาและวัตถุระเบิด ส่วนไซลีนนิยมใช้เป็นตัวทำละลายสำหรับน้ำมัน นอกจากนี้ยังใช้ทำความสะอาดสไลด์และเลนส์กล้องจุลทรรศน์ ใช้ไนโตรเบนซีนในการผลิตอนิลีน ซึ่งเป็นสารตั้งต้นในการผลิตสีย้อมและยาต่าง ๆ ฟีนอลใช้ในการผลิตสีย้อม ยารักษาโรค พลาสติก
กลับไปที่เนื้อหา
บทเรียนที่ 4 หมู่ฟังก์ชัน
คือ หมู่อะตอม หรือกลุ่มอะตอมของธาตุที่แสดงสมบัติเฉพาะของสารอินทรีย์ชนิดหนึ่ง เช่น CH3OH (เมทานอล) CH3CH2OH(เอทานอล) ซึ่งต้องเป็นสารอินทรีย์พวกแอลกอฮอล์ เพราะสารแต่ละชนิดต่างก็มีหมู่ -OH เป็นองค์ประกอบ แสดงหมู่ -OH เป็นหมู่ฟังก์ชันของแอลกอฮอล์ HCOOH (กรดเมทาโนอิก) และ CH3COOH (กรดเอทาโนอิก) ซึ่งต่างเป็นกรดอินทรีย์ เพราะสารทั้งสองต่างก็มีหมู่ -COOH เป็นองค์ประกอบ แสดงหมู่ -COOH เป็นฟังก์ชันของกรดอินทรีย์
อนึ่งสารอินทรีย์โดยทั่วไปประกอบด้วยองค์ประกอบ 2 ส่วน ส่วนหนึ่งเป็นอะตอมไฮโดรคาร์บอนหรือหมู่อะตอม อื่น ๆ อีก ส่วนหนึ่งเป็นหมู่ฟังก์ชัน ซึ่งแสดงสมบัติเฉพาะของสารอินทรีย์นั้นและเป็นส่วนที่มีความว่องไวทางเคมี กล่าวคือ ปฏิกิริยาเคมีที่เกิดกับสารอินทรีย์มักจะเกิดตรงส่วนของหมู่ฟังก์ชัน เช่น
| CH3OH + Na | ----------> | CH3O-Na+ + 1/2H2 |
ตาราง หมู่ฟังก์ชันบางชนิดและสารประกอบที่มีหมู่ฟังก์ชันเป็นองค์ประกอบ
| ชนิดของสารอินทรีย์ | หมู่ฟังก์ชัน | ชื่อของหมู่ฟังก์ชัน | สูตรทั่วไป | ตัวอย่าง |
|---|---|---|---|---|
| แอลเคน | - | - | R-H | CH3CH2CH3 โพรเพน |
| แอลคีน | พันธะคู่ | 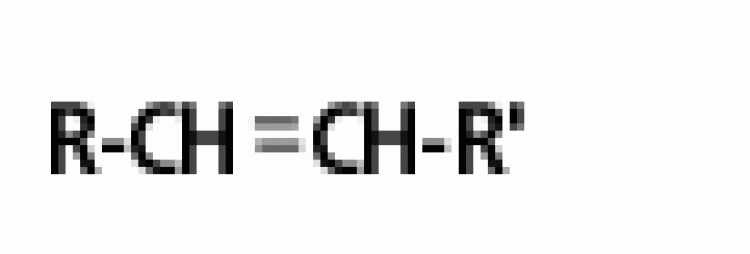 |
 |
|
| แอลไคน์ | 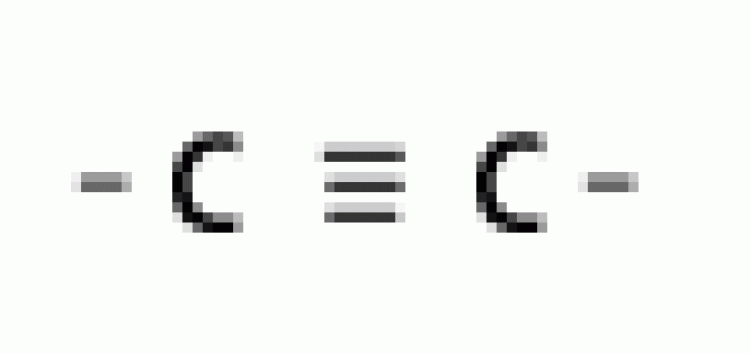 |
พันธะสาม | 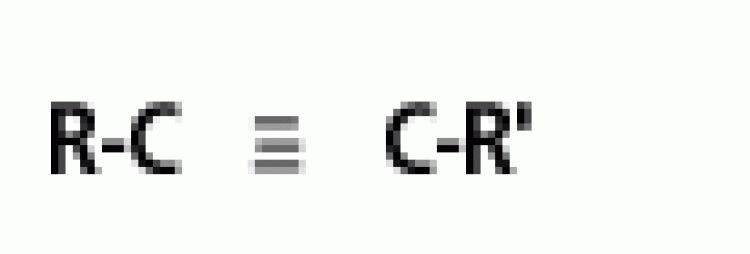 |
 |
| แอลกอฮอล์ | -OH | ไฮดรอกซิล | R-OH | CH3CH2OH เอทานอล |
| อีเทอร์ | -O- | ออกซี | R-O-R' | CH3-O-CH3 ไดเมทิลอีเทอร์ (เมทอลซิลมีเทน) |
| แอลดีไฮด์ | 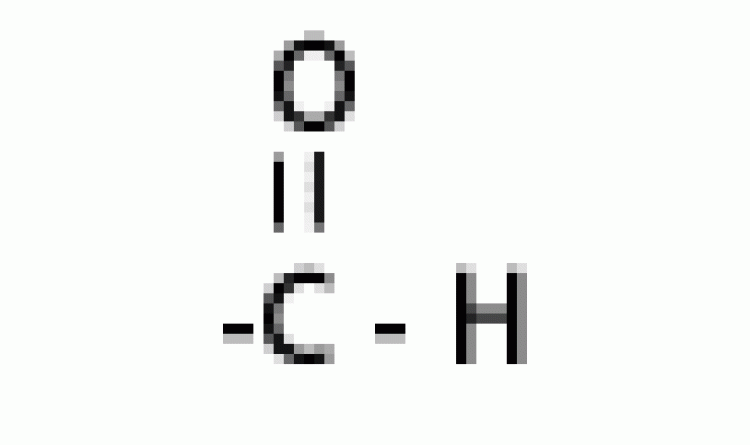 |
ฟอร์มิล หรือคาร์บอกซาลดีไฮด์ |
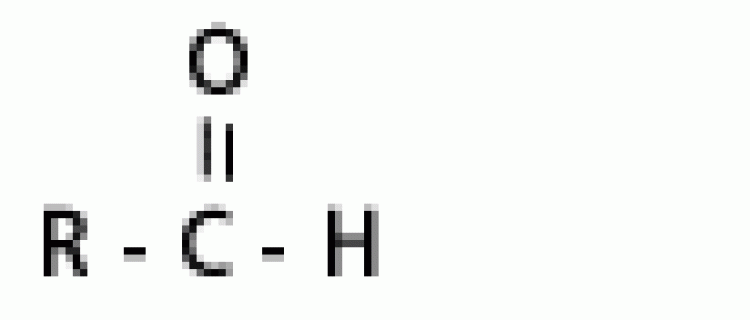 |
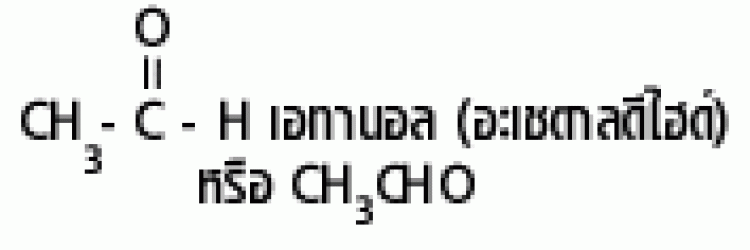 |
| คีโตน | 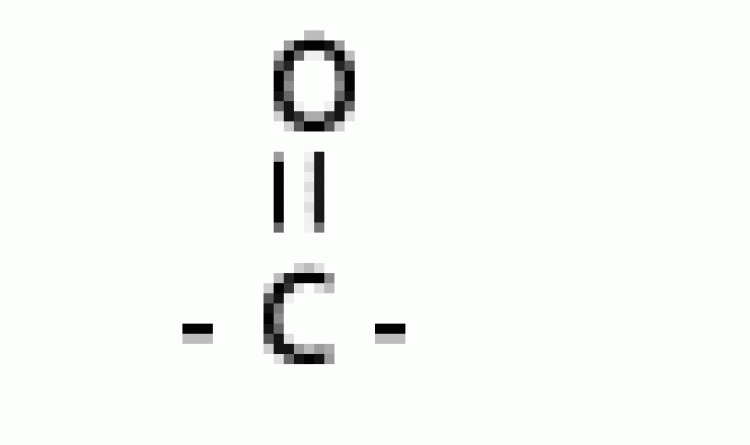 |
คาร์บอนิล | 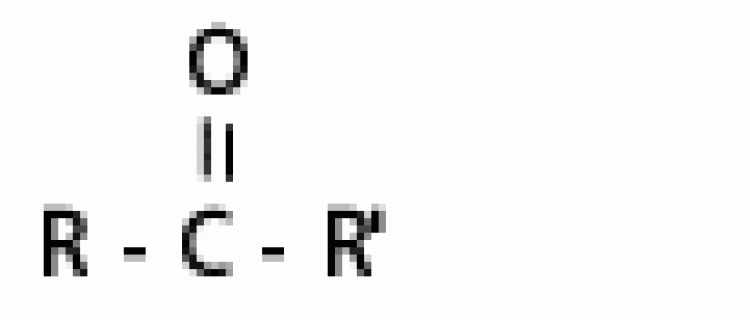 |
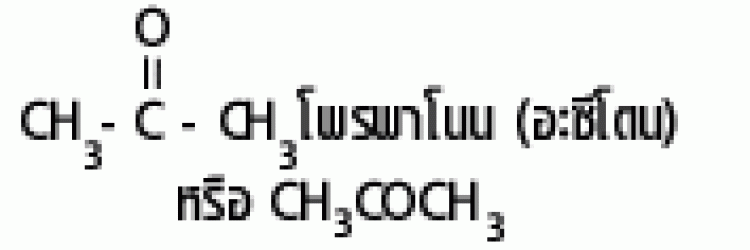 |
| กรดอินทรีย์ | 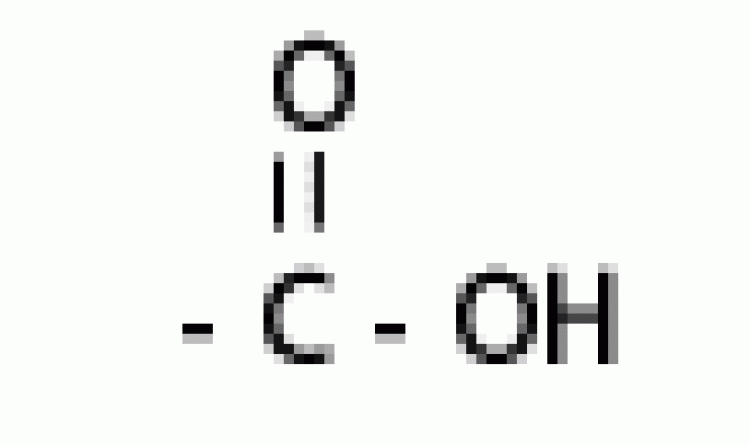 |
คาร์บอกซิล | 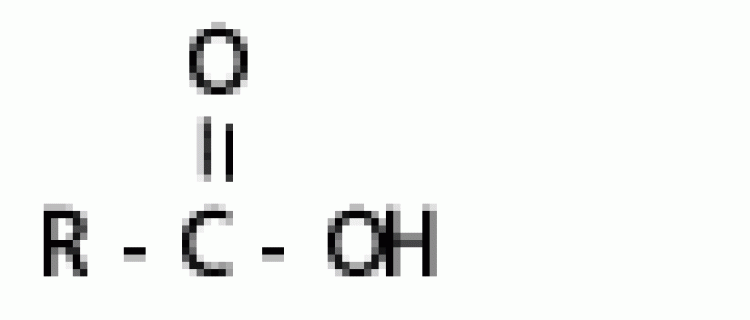 |
 |
| เอสเทอร์ | 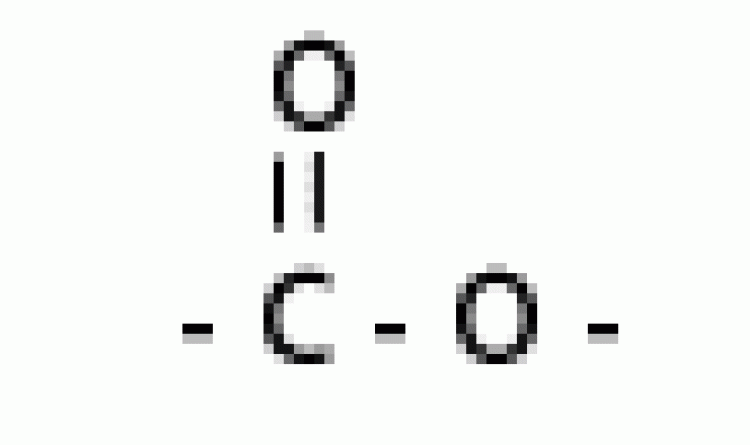 |
แอลคอกซิคาร์บอนิล | 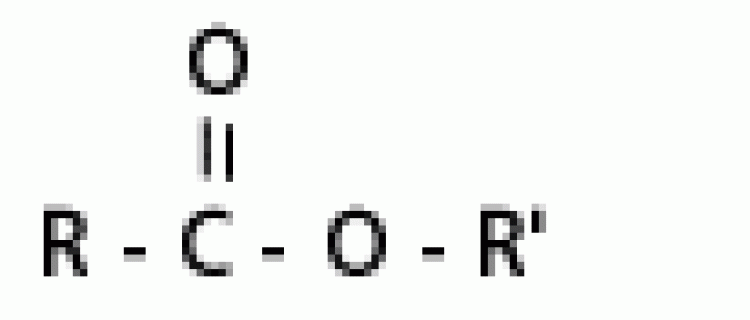 |
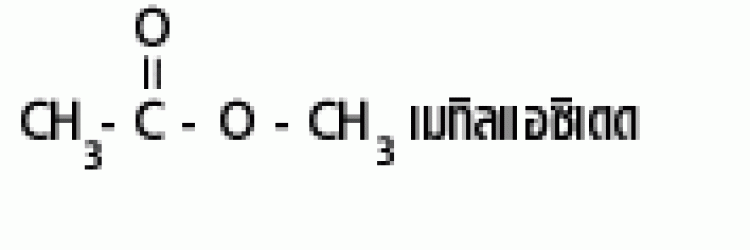 |
| เอมีน | - NH2 | อะมิโน | R- NH2 | CH3- NH2 เมทิลเอมีน(อมิโนมีเทน) |
| เอไมด์ | เอไมด์ | 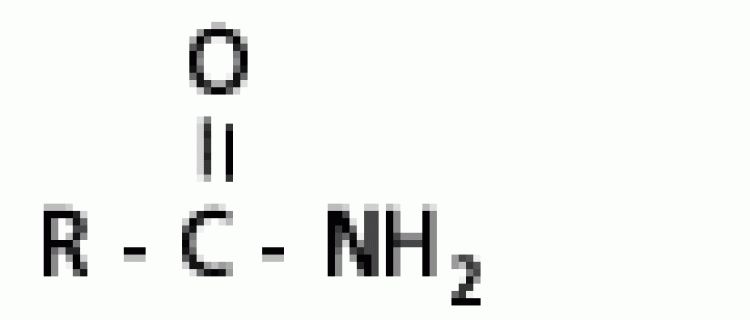 |
 |
กลับไปที่เนื้อหา
บทเรียนที่ 5 ปฏิกิริยาของแอลเคน แอลคีนและอแอลไคน์
- อัลเคน (Alkane)
| ปฏิกิริยาที่สำคัญของอัลเคน |
|
|
อันคีนและอัลไคน์ ( Alkenes and Alkynes ) |
|
ปฏิกิริยาของอัลคีน |
|
|
ตารางเปรียบเทียบข้อแตกต่างระหว่างแอลเคน แอลคีนและแอลไคน์ |
|
ความหมาย |
แอลเคน(CnH2n+2) |
แอลคีน(CnH2n) |
แอลไคน์(CnH2n-2) |
|
ชนิดพันธะ |
พัีนธะเดียวทั้งหมด |
มีพันธะคู่อย่างน้อย 1 พันธะ |
มีพันธะ 3 อย่างน้อย 1 พันธะ |
|
จำนวน C อะตอมในโมเลกุล |
CH4 Methane |
C2H4 Ethylene |
C2H2 Ethyne |
|
สมบัติ |
C1-C4 -ก๊าซ , |
เหมือนแอลเคน |
|
|
2.การละลายน้ำ |
ไม่ละลาย |
ไม่ละลาย |
ไม่ละลาย |
|
3.ความหนาแน่น |
น้อยกว่าน้ำ |
น้อยกว่าน้ำ |
น้อยกว่าน้ำ |
|
4.การเผาไหม้ |
ติดไฟให้เปลวไฟสว่าง ไม่มีเขม่า |
ติดไฟให้เปลวไฟสว่าง แต่มีควันเขม่า |
ติดไฟให้เปลวไฟสว่าง แต่มีควันเขม่ามากกว่า |
|
5.จุดเดือด |
ต่ำ |
ต่ำ |
ต่ำ |
|
6.แรงยึดเหนี่ยวระหว่างโมเลกุล |
แรงแวนเดอร์วาลส์ |
แรงแวนเดอร์วาลส์ |
แรงแวนเดอร์วาลส์ |
|
7.ทำปฏิกิริยา X2 |
เกิดปฏิกิริยาการแทนที่ในภาวะ |
เกิดปฏิกิริยาการเติม |
เกิดปฏิกิริยาการเติม |
|
8.ทำปฏิกิริยา H2 |
ไม่เกิด |
เกิด แต่ใช้ Ni หรือ Pd หรือ Pt |
เกิด ต้องใช้ตัวเร่งปฏิกิริยา |
|
9.ทำปฏิกิริยา KMnO4/H+ |
ไม่ทำ |
ทำให้เกิดสารพวกไกลคอล |
ทำให้เกิดกรดอินทรีย์และอื่นๆ |
|
10.เกิดพอลีเมอ-ไรเซซัน |
ไม่เกิด |
เกิดได้เฉพาะโมเลกุลเล็กๆ เท่านั้น |
เกิดยาก |
กลับไปที่เนื้อหา
บทเรียนที่ 6 ปฏิกิริยาของสารอินทรีย์
ชนิดของปฏิกิริยาเคมีอินทรีย์
การศึกษาปฏิกิริยาเคมีอินทรีย์ คือ การศึกษาถึงเรื่องการเกิดพันธะและการแตกพันธะ ของสารประกอบคาร์บอน ซึ่ง เรามักจะคำนึงถึงองค์ประกอบ 3 ประการด้วยกัน คือ ประเภทของการแตกพันธะ ประเภทของสารที่เข้าทำปฏิกิริยา และประเภทของปฏิกิริยาที่เกิดขึ้น ดังรายละเอียดต่อไปนี้
- ประเภทของการแตกพันธะ แบ่งออกเป็น 2 ชนิด คือ
- การแตกพันธะแบบโอโมไลติก ( hemolytic cleavage ) พันธะ x - y แตกออกโดย แบ่งอิเล็กตรอนคู่ที่ใช้ร่วมกันไปอะตอมละหนึ่งอนุภาค ผลที่ได้เป็นแรดิคัลอิสระ (free radical ) ตามสมการ ( 2 - 2 )

- การแตกพันธะแบบเฮเทโรไลติก ( heterolytic cleavage ) พันธะ x - y แตกออกโดยให้อิเล็กตรอนคู่กับ x หรือ y ตามสมการ ( 2 - 3 ) หรือ ( 2 - 4 ) ส่วนที่ได้รับอิเล็กตรอนจะมีประจุลบ และส่วนที่ให้อิเล็กตรอนไปจะมีประจุบวก ดังนั้นส่วนที่แตกออกต่างก็มีขั้วไฟฟ้า
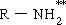
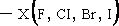
ประเภทของสารที่เข้าทำปฏิกิริยา โดยปกติปฏิกิริยาเคมีจะเป็นไปตามสมการ ( 2 - 5 ) โดยที่สารตั้งต้นซึ่งเป็นสารอินทรีย์ เปลี่ยนไปเป็นผลิตภัณฑ์ ( product ) โดยสารที่เข้าทำปฏิกิริยา เป็นตัวที่ทำให้เกิดการเปลี่ยนแปลง เราอาจแยกประเภทของสารที่เข้าทำปฏิกิริยาต่าง ๆ ในปฏิกิริยาเคมีอินทรีย์ ได้ 3 ประเภท คือ
- สารชอบนิวเคลียส ( nucleophile , nucleus - loving ) คือ อิออนหรือโมเลกุล ที่สามารถให้อิเล็กตรอนคู่เพื่อใช้สร้างพันธะ ปกติสารของนิวเคลียสมักเป็นลิวอิสเบส (Lewis base ) เช่น
![]()
สารชอบอิเล็กตรอน ( electro;hile , electron - loving ) คือ อิออนหรือโมเลกุลที่สามารถสร้างพันธะใหม่ได้โดยได้รับอิเล็กตรอนคู่หนึ่ง สารชอบอิเล็กตรอนส่วนใหญ่ เป็นกรดลิวอิส (lewis acid ) เช่น
![]()
ก. ปฏิกิริยาการแทนที่ ( substitution reaction ) เป็นปฏิกิริยาที่อะตอมหรือ หมู่อะตอมที่เกาะอยู่กับคาร์บอนถูกแทนที่ด้วยอะตอมหรือหมู่อะตอมอื่น ดังตัวอย่างตามสมการ ( 2 - 6 ) และ ( 2 - 7 )
![]()
![]()
ข. ปฏิกิริยาการเติม ( addition reaction ) คือ ปฏิกิริยาที่มีการเพิ่มอะตอมหรือหมู่อะตอมของสารประกอบไม่อิ่มตัว ดังตัวอย่างตามสมการ ( 2 - 8 )
![]()
ค. ปฏิกิริยาการดึงออก ( elimination reaction ) คือ ปฏิกิริยาที่มีการดึงอะตอมหรือ หมู่ของอะตอมที่เกาะอยู่กับคาร์บอนออกไปเป็นโมเลกุล ดังตัวอย่างตามสมการ ( 2 - 9 )
![]()
กลับไปที่เนื้อหา
บทเรียนที่ 7 กรดอินทรีย์และแอลกอฮอล์
| ความหมาย | แอลกอฮอล์(R - OH) | กรดอินทรีย์(R - COOH) |
|---|---|---|
| สารอินทรีย์ที่มีหมู่ OH กับหมู่ไฮโดรคาร์บอน | สารอินทรีย์ที่มีหมู่ COOH กับหมู่ไฮโดรคาร์บอน | |
| สูตรทั่วไป | CnH2n+2O | CnH2nO2 |
| การอ่านชื่อ | พยางค์หน้าบอกจำนวน C อะตอม พยางค์หลังบอกแอลกอฮอล์ ลงท้ายด้วย "ol" CH3OH Methanol CH2CH2OH Ethanol |
พยางค์หน้าบอกจำนวน C อะตอม พยางค์หลังบอกกรดอินทรีย์ ลงท้ายด้วย "oic acid" CH3COOH Ethanoic acid CH3CH2CH2COOH Butanoic acid |
| สมบัติ 1.สถานะ |
ของแข็ง | ของเหลว,ของแข็ง |
| 2.การละลายน้ำ | โมเลกุลเล็กละลายน้ำดี C1-C3โมเลกุลที่มี C มากขึ้น การละลายน้ำลดลง ไม่ละลายในที่สุด | โมเลกุลเล็กละลายน้ำดี C1-C3โมเลกุลที่มี C มากขึ้น ละลายน้ำลดลง ถ้า C มากๆ ไม่ละลายน้ำ |
| กรดอินทรีย์ละลายน้ำได้ดีกว่าแอลกอฮอล์ที่มี C เท่ากัน | ||
| 3.แรงยึดเหนี่ยว ระหว่างโมเลกุล |
พันธะไฮโดรเจนและแรงแวนเดอร์วาลส์ R - O --- โมเลกุลเกิดพันธะไฮโดรเจน 3 แห่ง |
พันธะไฮโดรเจนและแรงแวนเดอร์วาลส์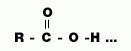
|
| 4.ความเป็นกรด-เบส | (กรด-เบส) แต่มีความเป็นกรดมากกว่าความเป็นเบส ภาวะปกติแอลกอฮอล์ไม่เปลี่ยนสีกระดาษลิตมัส | กรดเปลี่ยนสีกระดาษลิตมัสจากน้ำเงินเป็นแดง |
| 5.จุดเดือด(C ํ) ซึ่งมวลโมเลกุล ใกล้เคียงกัน |
สูงปานกลาง | สูงมาก |
| จุดเดือดของสาร พวกเดียวกันเอง |
เพิ่มขึ้นตามจำนวน C อะตอมที่เพิ่มขึ้น | เพิ่มขึ้นตามจำนวน C อะตอมที่เพิ่มขึ้น |
| 6.ความหนาแน่น | น้อยกว่าน้ำเฉพาะโมเลกุลเล็ก | มากกว่าน้ำส่วนใหญ่ |
| 7.ทำปฏิกิริยากับ (หมู่ IA) |
 |
(M = โลหะใดๆ ยกเว้นโลหะมีตระกูล) ได้เร็ว เกิดก๊าซ H2 |
| 8.กลิ่น | กลิ่นเฉพาะตัว(กลิ่นเหล้า) | กลิ่นฉุน |
| 9.ทำปฏิกิริยากับ NaHCO3 |
ไม่ทำ | 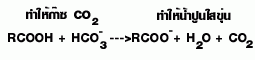 |
| 10.ทำปฏิกิริยากับ แอลกอฮอล์ |
ไม่ทำ | ทำให้เกิดเอสเทอร์ (ต้องมีตัวเร่งปฏิกิริยา H2SO4(conc)) |
| 11.ทำปฏิกิริยากับ กรดอินทรีย์ |
ทำให้เกิดเอสเทอร์ | ไม่ทำ |
| 12.จำนวนไอโซเมอร์ | C 3 อะตอมขึ้นไป เกิดไอโซเมอร์พวกเดียวกันเอง |
C 4 อะตอมขึ้นไป เกิดไอโซเมอร์พวกเดียวกันเอง |
| จำนวน C อะตอมเท่ากันแอลกอฮอล์จะเกิดไอโซเมอร์กันเองได้มากกว่ากรออินทรีย์ | ||
กลับไปที่เนื้อหา
บทเรียนที่ 8 แอลดีไฮน์
| หมู่ฟังก์ชัน | หมู่คาร์บอกซาดีไฮด์ | |
| สูตรและเงื่อนไข | R = แทน H หรือ ไฮโดรคาร์บอน | |
| สูตรโมเลกุล | CnH2nO |
C ใน R เป็นพันธะเดี่ยวหมด |
| ตัวอย่าง และการอ่านชื่อ | CH2O |
Meth/an/al |
| C2H4O |
Eth/an/al | |
| การอ่านชื่อ | อ่านจำนวนคาร์บอนอะตอมต่อด้วย an (ถ้า C ใน R เป็นพันธะเดี่ยว) ลงท้าย _al | |
| การเตรียม | 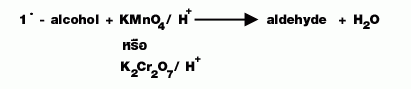 |
|
| สมบัติ | 1. C1 - C2ละลายน้ำได้ไม่จำกัด C มากขึ้นไม่ละลายน้ำ 2. 3. แอลดีไฮด์ + สารละลายเบเนดิกซ์ เกิดตะกอนสีแดงอิฐ 4. 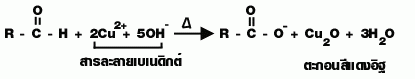 |
|
กลับไปที่เนื้อหา
บทเรียนที่ 9 คีโตน เอมีนและเอไมด์
| หมู่ฟังก์ชัน |  |
หมู่คาร์บอนิล |
| สูตรและเงื่อนไข |  |
R และ R' แทนด้วยหมู่ไฮโดรคาร์บอน |
| สูตรโมเลกุล | CnH2nO |
C ใน R ทุกอะตอมเป็นพันธะเดี่ยวหมด |
| ตัวอย่าง และการอ่านชื่อ | C3H6O |
Prop/an/one |
C4H8O |
But/an/one | |
| การอ่านชื่อ | อ่านจำนวนคาร์บอนอะตอมต่อด้วย an (ถ้า C ใน R เป็นพันธะเดี่ยว) ลงท้าย _one | |
| การเตรียม |   |
|
| สมบัติ | ละลายน้ำได้เฉพาะโมเลกุลเล็ก ๆ โมเลกุลใหญ่ไม่ละลายน้ำ ความหนาแน่นน้อยกว่าน้ำ เป็นของเหลว โมเลกุลเล็กจุดเดือดสูงกว่าแอลดีไฮด์ | |
เอมีน
| หมู่ฟังก์ชัน | - NH2 | หมู่อะมิโน |
| สูตรและเงื่อนไข | R - NH2 | R แทนไฮโดรคาร์บอน |
| สูตรโมเลกุล | CnH2n+1NH2 |
C ใน R ทุกอะตอมเป็นพันธะเดี่ยวหมด |
| ตัวอย่าง และการอ่านชื่อ | C1H3NH2 CH3 - NH2 | amino methane |
| C2H5NH2 CH3 - CH2 - NH2 | amino ethane | |
| การอ่านชื่อ | อ่านตามอนุพันธ์ของแอลเคน โดยขึ้นต้นด้วย amino ลงท้ายด้วยการอ่านชื่อแอลแคน | |
| สมบัติ | C1 เป็นก๊าซมากขึ้นเป็นของเหลวและของแข็ง โมเลกุลเล็กเป็นก๊าซไม่มีสี มีกลิ่นเหม็นคล้าย ปลาเน่า เกิดพันธะไฮโดรเจนระหว่างโมเลกุล bp เพิ่มตามจำนวน C อะตอมที่เพิ่มขึ้น | |
เอไมด์
| หมู่ฟังก์ชัน |  |
|
| สูตรและเงื่อนไข |  |
R แทน H หรือไฮโดรคาร์บอน |
| สูตรโมเลกุล | CnH2n+1CONH2 | |
| ตัวอย่าง และการอ่านชื่อ | C2H5CONH2  |
Propnamide |
CH3CONH2  |
Ethanamide | |
| การอ่านชื่อ | อ่านจำนวนคาร์บอนอะตอมทั้งหมดต่อด้วย an (ถ้า C ใน R เป็นพันธะเดี่ยว) _amide | |
| การเตรียม |  |
|
| สมบัติ | จุดเดือดสูงกว่ากรดอินทรีย์และสารอินทรีย์อื่นที่มีมวลโมเลกุลใกล้เคียงกัน เป็นสารที่สามารถเกิด พันธะไฮโดรเจนได้ละลายน้ำได้เฉพาะในโมเลกุลเล็ก ๆ เท่านั้น โมเลกุลใหญ่ไม่ละลายน้ำ เอไมด์เกิดปฏิกิริยาไฮโดรลิซิสได้ ดังนี้  |
|
| หมายเหตุ | การเตรียมยูเรีย    |
|
กลับไปที่เนื้อหา
บทเรียนที่ 10 กรดอะมิโนและพันธะเปบไทด์

 ของกรดอะมิโนโมเลกุลหนึ่งยึดกับ N อะตอม ในหมู่อะมิโน (-NH2) ของกรดอะมิโนอีกโมเลกุลหนึ่ง
ของกรดอะมิโนโมเลกุลหนึ่งยึดกับ N อะตอม ในหมู่อะมิโน (-NH2) ของกรดอะมิโนอีกโมเลกุลหนึ่ง 



กลับไปที่เนื้อหา
บทเรียนที่ 11 ไขมันและกรดไขมัน
ลิปิด (Lipid)
ตัวอย่าง ไขมัน น้ำมัน wax สเตอรอยด์
- กรดไขมัน (Fatty acid)
- คือ กรดอินทรีย์ชนิดหนึ่งที่มีหมู่คาร์บอกซิลเป็นหมู่ฟังก์ชัน
สูตรทั่วไป
จำนวน C อะตอมเป็นเลขคู่ C ใน R ต่อกันเป็นสายยาวไม่ค่อยพบแตกกิ่งก้านสาขา และขดเป็นวงปิด- สมบัติ
- กรดไขมันส่วนมากมีจำนวน C อะตอม C12 - C18 ชนิดที่มีจำนวน C อะตอมน้อยกว่า 12 ได้แก่ กรกบิวทาโนอิก C3C7COOH ที่พบในเนย กรดไขมันไม่ละลายน้ำ กรดไขมันจะมีจุดเดือดและจุด หลอมเหลวสูงขึ้นตามจำนวนคาร์บอนอะตอมที่เพิ่มขึ้น และกรดไขมันอิ่มตัวมีจุดเดือดสูงกว่า กรดไขมันไม่อิ่มตัว ที่มีมวลโมเลกุลใกล้เคียงกัน
- ไขมัน และน้ำมัน (Fat and oil)
- คือ สารอินทรีย์ประเภทลิปิดชนิดหนึ่ง
มีสูตรทั่วไปดังนี้
ไขมันและน้ำมันมีหมู่ฟังก์ชันเหมือนเอสเทอร์จัดเป็นสารประเภทเอสเทอร์ชนิดหนึ่งได้- การเตรียม

ไขมัน เป็นของแข็ง มักพบในสัตว์ประกอบด้วยกรดไขมันอิ่มตัว มากกว่ากรดไขมันไม่อิ่มตัว เช่น ไขวัว ไขควาย
น้ำมัน เป็นของเหลว มักพบในพืชประกอบด้วยกรดไขมันไม่อิ่มตัวมากกว่ากรดไขมันอิ่มตัว เช่น น้ำมันมะกอก
สมบัต ไขมันมีจุดเดือดสูงกว่าน้ำมัน ไม่ละลายน้ำละลายได้ดีในตัวทำละลายไม่มีน้ำ เช่น เบนซีน ไขมันและน้ำมันเสีย จะเกิดกลิ่นเหม็นหืน
- การเกิดกลิ่นเหม็นหืน

การป้องกัน เติมสารกันเหม็นหืน (Antioxidiant) เช่น วิตามิน E วิตามิน C สาร BHT
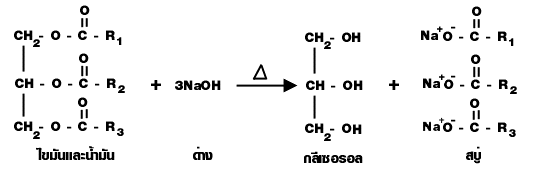
Saponification เป็นปฏิกิริยาไฮโดรลิซิสไขมันและน้ำมันด้วยเบส เป็นปฏิกิริยาที่เกิดจากไขมันและ น้ำมันกับด่าง เกิดเกลือของกรดไขมัน (สบู่) กับกลีเซอรอล ดังนี้
- การตรวจหาปริมาณกรดไขมันไม่อิ่มตัวในไขมันและน้ำมัน
- ไขมันและน้ำมันที่ประกอบด้วยกรดไขมันไม่อิ่มตัว (C = C) ทำปฏิกิริยากับสารละลาย Br2 หรือ I2 ได้เกิดปฏิกิริยาการเติมตรงบริเวณ C กับ C ที่จับกันด้วยพันธะคู่ของกรดไขมันไม่อิ่มตัวในไขมันและน้ำมันนั้น
- การตรวจหาปริมาณกรดไขมันไม่อิ่มตัวในไขมันและน้ำมัน
- ไขมันและน้ำมันชนิดใดสามารถฟอกจางสีของสารละลาย I2 มาก แสดงว่าไขมันและน้ำมันนั้น ประกอบด้วยกรดไขมันไม่อิ่มตัวปริมาณมาก
-
กลับไปที่เนื้อหา
บทเรียนที่ 12 คาร์โบไฮเดรต




กลับไปที่เนื้อหา
บทเรียนที่ 13 สารชีวโมเลกุล
สารชีวโมเลกุล
อาหาร คือ สารที่เข้าสู่ร่างกายไปแล้วจะทำให้สิ่งมีชีวิตเจริญเติบโต ให้พลังงานเพื่อความแข็งแรง และซ่อมแซมส่วนที่สึกหรอ
อาหารประเภทต่างๆ ที่รับประทานในแต่ละวัน จำแนกออกได้เป็นหมู่ใหญ่ๆ คือ
- หมู่ที่ 1 เนื้อสัตว์ต่าง ๆ ไข่ ถั่วเมล็ดแห้ง นม
- หมู่ที่ 2 ข้าว แป้ง น้ำตาล เผือก มัน และน้ำตาล
- หมู่ที่ 3 ผักใบเขียว และพืชผักอื่น ๆ
- หมู่ที่ 4 ผลไม้ต่าง ๆ
- หมู่ที่ 5 ไขมันจากสัตว์และพืช
สารอาหาร (Nutrient) คือ สารที่เป็นองค์ประกอบของอาหาร แบ่งตามหลักโภชนาการได้แก่ โปรตีน คาร์โบไฮเดรต มัน วิตามิน เกลือแร่ และน้ำ
ปริมาณสารอาหารประเภทต่างๆ ในร่างกายมนุษย์ประกอบด้วย ดังนี้
|
สารอาหาร |
ร้อยละในร่างกาย |
|
น้ำ |
65 |
|
โปรตีน |
20 |
|
ไขมัน |
10 |
|
คาร์โบไฮเดรต |
น้อยกว่า 1 |
|
เกลือแร่ |
4 |
(ที่มา : เสาวนีย์ จักรพิทักษ์, 2532 : 43 )
สารชีวโมเลกุล (Biomolicules) หมายถึง สารประกอบที่ทำหน้าที่ 2 อย่างในเซลล์ของสิ่งมีชีวิต คือ เป็นโครงสร้างและสารทำหน้าที่ของเซลล์ สารเหล่านี้ได้แก่ น้ำ เกลือแร่ โปรตีน คาร์โบไฮเดรต ลิปิด และกรดนิวคลีอิก อาจรวมถึงก๊าซออกซิเจนและก๊าซคาร์บอนไดออกไซด์ด้วย
คาร์โบไฮเดตร
คาร์โบไฮเดรต (Carbohydrate) คือ สารอินทรีย์ที่ประกอบด้วยธาตุ C H และ O อัตราส่วนโดยอะตอมของ H : O = 2 :1 เช่น C 3H 6O 3 C 6H 12O 6 (C 6H 10O 5) n โดยมีหมู่คาร์บอกซาลดีไฮด์ (-CHO) และหมู่ไฮดรอกซิล (-OH) หรือหมู่คาร์บอนิล (-CO) และหมู่ไฮดรอกซิล (-OH) เป็นหมู่ฟังก์ชัน
ประเภทของคาร์โบไฮเดรต
คาร์โบไฮเดรตสามารถแบงตามโครงสร้างออกเป็น 3 ประเภท คือ
1. มอนอแซ็กคาไรด์ (Monosaccharides) หรือน้ำตาลโมเลกุลเดี่ยว มีสูตรทั่วไปเป็น C n H2n O n ซึ่งจะมี 2 ประเภทคือ
- น้ำตาลอัลโดส (aldoses) เป็นน้ำตาลที่มีหมู่คาร์บอกซาลดีไฮด (
) เช่น กลูโคส กาแลกโตส และไรโบส เป็นต้น
- น้ำตาลคีโตส (ketoses) เป็นน้ำตาลที่มีหมู่คาร์บอนิล () ได้แก่ ฟรุกโตส เป็นต้น
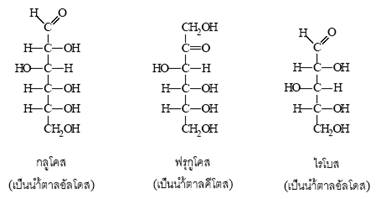
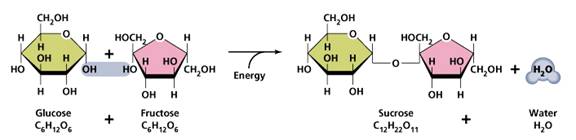
2. ไดแซ็กคาไรด (Disaccharides) หรือน้ำตาลโมเลกุลคู่ ได้แก่ แลคโตส มอลโตส และซูโครส ซึ่งเกิดจากการรวมตัวของ Monosacharide 2 โมเลกุล โดยกําจัดน้ำออกไป 1 โมเลกุล เช่น ซูโครส (C12H22O11) เกิดจากกลูโคสรวมตัวกับฟรุกโตส ดังภาพ

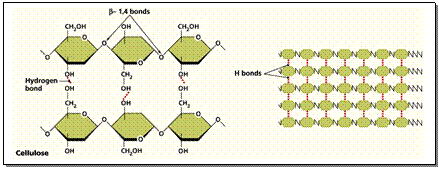
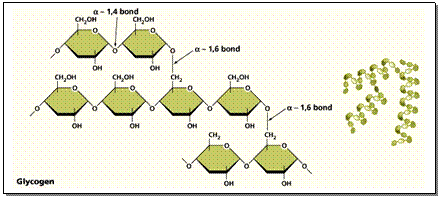
3 . พอลีแซ็กคาไรด (Polysaccharides) เช่น แป้ง เซลลูโลส ไกลโคเจน (ดังภาพข้างล่าง) เกิดจาก Monosacharide หลายๆ โมเลกุลจำนวนมากมายต่อรวมกันเป็นพอลิเมอร์ ดังสมการ
n C6H12O6 ---------------> ( C6H10O5 )n + n H 2O
Polysacharide แบ่งตามแหล่งที่พบได้ดังนี้
- จากพืช ได้แก่ แป้ง (Starch) เซลลูโลส (Cellulose) และอะไมโลส (Amylose)
- จากสัตว์ ได้แก่ ไกลโคเจน (Glycogen)
สมบัติของคาร์โบไฮเดรต
1. มอนอแซ็กคาไรด์ (Monosaccharides) มีสถานะเป็นของแข็ง ละลายน้ำ มีรสหวาน ทำปฏิกิริยากับสารละลายเบเนดิกต์เกิดตะกอนสีแดงอิฐ (Cu 2O)
2. ไดแซ็กคาไรด์ (Disaccharides)มีสถานะเป็นของแข็ง ละลายน้ำ มีรสหวาน สามารถเกิดการไฮโดรลิซิสได้ Monosaccharide 2 โมเลกุล และทำปฏิกิริยากับสารละลายเบเนดิกต์เกิดตะกอนสีแดงอิฐ (Cu 2O) ยกเว้นซูโครส
3. พอลีแซ็กคาไรด์ (Polysaccharides) มี สถานะเป็นของแข็ง ไม่ละลายน้ำ ไม่มีรสหวาน เกิดการไฮโดรลิซิสได้ Monosaccharide ที่เป็นกลูโคสจำนวนมากมาย
การทดสอบคาร์โบไฮเดรต
1. มอนอแซ็กคาไรด์และไดแซ็กคาไรด์ ซึ่งเป็น สารอินทรีย์ที่มีหมู่คาร์บอกซาลดีไฮด์ (-CHO) เมื่อต้มกับสารละลายเบเนดิกต์ (Cu 2+/ OH -)
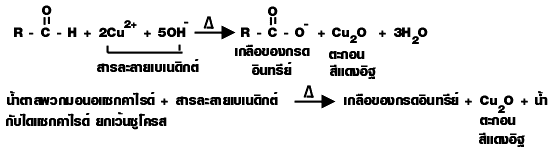
สารละลายเบเนดิกต์ (Benedict solution) เป็นสารละลายผสมระหว่าง CuSO 4 Na 2CO 3 และโซเดียมซิเตรด เป็น Cu 2+/ OH - มีสีน้ำเงิน
2. พอลีแซ็กคาไรด์
2.1 แป้ง : เติมสารละลายไอโอดีนจะได้ตะกอนสีน้ำเงิน แต่ไม่ให้ตะกอนสีแดงกับสารละลายเบเนดิกต์

2.2 น้ำตาลโมเลกุลใหญ่ เช่น แป้ง และสำลี ( เซลลูโลส) เมื่อนำมาเติมสารละลายเบเนดิกซ์ จะไม่เห็นการเปลี่ยนแปลง แต่ถ้าเติมกรดแล้วนำมาต้มจะเกิดปฎิกริยาไฮโดรลิซิส ซึ่งสามารถเกิดตะกอนสีแดงอิฐกับสารละลายเบเนดิกซ์ได้
![]()
ลิพิด
ลิปิด (Lipid) คือ สารประกอบอินทรีย์ที่ได้จากเนื้อเยื่อพืชและสัตว์ เป็นสารที่ละลายในตัวทำละลายอินทรีย์ เป็นโมเลกุลโควาเลนต์ไม่มีขั้ว เช่น เบนซีน เป็นสารที่ไม่ละลายน้ำ ตัวอย่าง ไขมัน น้ำมัน แว็กซ์ ( wax) สเตอรอยด์ เป็นต้น
กรดไขมัน (Fatty acid)
กรดไขมัน เป็นกรดที่เกิดในธรรมชาติจากการไฮโดรลิซิสไตรกลีเซอไรด์ ( เป็นปฏิกิริยาย้อนกลับของปฏิกิริยาเอสเทอริฟิเคชัน) กรดไขมันที่พบโดยทั่วไปจะมีจํานวนของคาร์บอนเป็นเลขคู่ ที่พบมาก คือ 16 หรือ 18 อะตอม และจะ ต่อกันเป็นสายยาวไม่ค่อยพบแตกกิ่งก้านสาขา และขดเป็นวงปิด กรดไขมัน แบ่งออกเป็น 2 ประเภทใหญ่ๆ คือ
1. กรดไขมันอิ่มตัว (saturated fatty acids) หมู่แอลคิลจะมีแต่พันธะเดี่ยว เช่น กรดไมริสติก กรดปาลิมิติก กรดสเตียริก
2. กรดไขมันไม่อิ่มตัว (unsaturated fatty acids) หมู่แอลคิลจะมีแต่พันธะคู่อยู่ด้วย เช่น กรดปาลิมิโตเลอิก กรดโอเลอิก กรดลิโนเลอิก กรดลิโนเลนิก
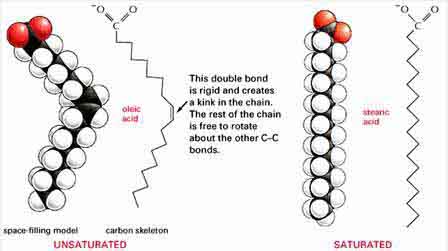
ภาพแสดงความแตกต่างของโครงสร้งระหว่าง กรดไขมันอิ่มตัวกับกรดไขมันไม่อิ่มตัว
สมบัติของกรดไขมัน
กรดไขมันส่วนมากมีจำนวน C อะตอม C 12 - C 18 ชนิดที่มีจำนวน C อะตอมน้อยกว่า 12 ได้แก่ กรกบิวทาโนอิก C 3C 7COOH ที่พบในเนย กรดไขมันไม่ละลายน้ำ กรดไขมันจะมีจุดเดือดและจุด หลอมเหลวสูงขึ้นตามจำนวนคาร์บอนอะตอมที่เพิ่มขึ้น และกรดไขมันอิ่มตัวมีจุดเดือดสูงกว่ากรดไขมันไม่อิ่มตัว ที่มีมวลโมเลกุลใกล้เคียงกัน
ไขมันและน้ำมัน
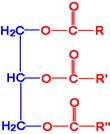
ไขมันและน้ำมัน (Fat and oil) คือ สารอินทรีย์ประเภทลิปิดชนิดหนึ่ง มีหมู่ฟังก์ชันเหมือนเอสเทอร์ จึงจัดเป็นสารประเภทเอสเทอร์ชนิดหนึ่งที่มีโมเลกุลขนาดใหญ พบทั้งในพืชและสัตว ซึ่งมีสูตรทั่วไปดังนี้
การเตรียม
เกิดจากกรดอินทรียที่เรียกว่ากรดไขมันรวมกับอัลกอฮอล์ทีมี -OH 3 หมู่ ที่เรียกว่า กรีเซอรอล จะได้สารที่เรียกว่า กลีเซอไรด์ (Glyceride) หรือกลีเซอริลเอสเทอร์ (Glyceryl Ester) ดังสมการ

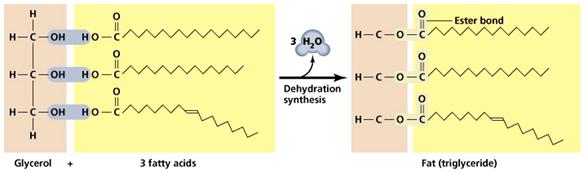
ไขมันเป็นของแข็งที่มักพบในสัตว์ประกอบด้วยกรดไขมันอิ่มตัว มากกว่ากรดไขมันไม่อิ่มตัว เช่น ไขวัว ไขควาย ส่วนน้ำมันเป็นของเหลวที่มักพบในพืชประกอบด้วยกรด ไขมันไม่อิ่มตัวมากกว่ากรดไขมันอิ่มตัว เช่น น้ำมันมะกอก ซึ่งไขมันมีจุดเดือดสูงกว่าน้ำมัน ไม่ละลายน้ำ แต่ละลายได้ดีในตัวทำละลายไม่มีน้ำ
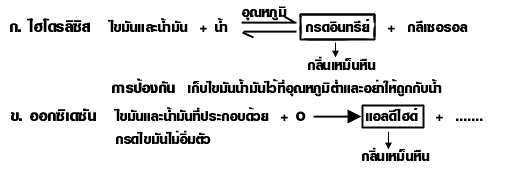
การป้องกัน : เติมสารกันเหม็นหืน (Antioxidiant) เช่น วิตามิน E วิตามิน C สาร BHT
ปฏิกิริยาสะปอนนิฟิเคชัน (sponification)
เป็นปฏิกิริยาไฮโดรลิซิสไขมันและน้ำมันด้วยเบส เป็นปฏิกิริยาที่เกิดจากไขมันและน้ำมันกับด่าง เกิดเกลือของกรดไขมัน (RCOO -Na +) ซึ่งก็คือ สบู่ กับกลีเซอรอล ดังนี้
การตรวจหาปริมาณกรดไขมันไม่อิ่มตัวในไขมันและน้ำมัน
ไขมันและน้ำมันที่ประกอบด้วยกรดไขมันไม่อิ่มตัว (C = C) ทำปฏิกิริยากับสารละลาย Br 2 หรือ I 2 ได้เกิดปฏิกิริยาการเติมตรงบริเวณ C กับ C ที่จับกันด้วยพันธะคู่ของกรดไขมันไม่อิ่มตัวในไขมันและน้ำมันนั้นถ้าไขมันและน้ำมันชนิดใดสามารถฟอกจางสีของสารละลาย I 2 มาก แสดงว่าไขมันและน้ำมันนั้น ประกอบด้วยกรดไขมันไม่อิ่มตัวปริมาณมาก
สบู่ (Soap)
สบู่ คือ เกลือของกรดไขมัน สูตรทั่วไปคือ
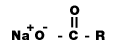
สบู่ละลายน้ำแตกตัวให้ไอออนบวก และไอออนลบส่วนที่เป็นไอออนลบจะเป็นตัวที่ใช้ชำระล้าง สิ่งต่าง ๆ ทั้งหลายได้ สามารถละลายในตัวทำละลายมีขั้วและไม่มีขั้วได้ เพราะไอออนลบของสบู่ประกอบ ด้วยส่วนประกอบ 2 ส่วนย่อยดังนี้
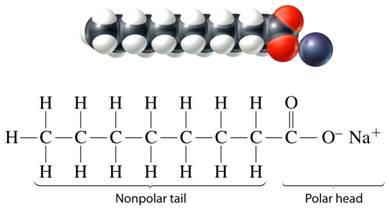
สบู่ที่ดีควรมีจำนวน C อะตอมในหมู่ R พอเหมาะ เป็นสบู่ที่ละลายน้ำได้ดี แต่ถ้ามีจำนวน C อะตอมมากเกินไปละลายน้ำได้ดี
สบู่สามารถใช้ทดสอบความกระด้างของน้ำได้
น้ำกระด้าง : เป็นน้ำที่ประกอบด้วย Fe 2+, Mg 2+ และ Ca 2+ ของ HCO - 3, Cl - และ SO 2- 4
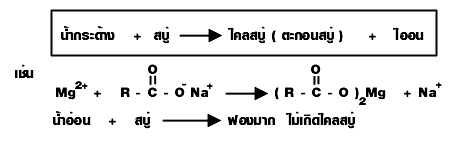
เราไม่นิยมใช้สบู่ซักผ้า แคลเซียม และ แมกนีเซียม อยู่ เมื่อทําปฏิกิริยากับสบู่จะเกิดเป็นเกลือแคลเซียม (ไคลสบู่) ย้อนกลับมาติดเสื้อผ้าเราได้
เนื่องจากสบู่จะเกิดตะกอนไอออนในน้ำกระด้างทำให้เกิดการสิ้นเปลืองในการใช้สบู่ จึงได้มี การสังเคราะห์สารอื่นใช้ชำระล้างซักฟอกได้เช่นเดียวกับสบู่ สารสังเคราะห์นั้นก็คือ ผงซักฟอก ซึ่งไม่ ตกตะกอนในน้ำกระด้าง
การละลายน้ำและการชำระล้างของสบู่
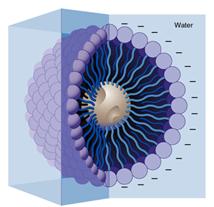
เมื่อสบู่ละลายน้ำจะแตกเป็นไอออน ไอออนบวกของโลหะจะถูกน้ำล้อมรอบ เกิดแรงดึงดูดระหว่างไอออนกับน้ำ เรียกว่าไฮเดรตชัน ส่วนไอออนลบของสบู่ประกอบด้วยส่วนที่เป็นคาร์บอกซิเลต (- COO -) เป็นส่วนที่มีขั้ว จะยึดกับน้ำโดยมีโมเลกุลน้ำล้อมรอบ และส่วนที่ไม่มีขั้วเป็นกลุ่มไฮโดรคาร์บอนจะหันเข้าหากัน แล้วจับกันเป็นกลุ่มก้อน เรียกว่า ไมเซลล์ (Micell) ดังภาพ
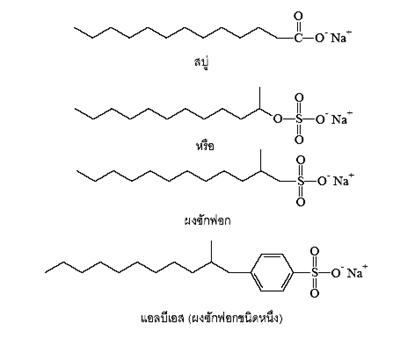
ผงซักฟอก
ผงซักฟอก (detergents) คือ เกลือของกรดซัลโฟนิก มีสมบัติชำระล้างสิ่งสกปรกทั้งหลายได้เช่นเดียวกับสบู่
สูตรทั่วไปของผงซักฟอก เป็นดังนี้
ส่วนประกอบของผงซักฟอก
1. บิลเดอร์ ฟอสเฟต ปนอยู่ประมาณ 30-50% มีประโยชน์และหน้าที่ดังนี้
- ทำให้น้ำมีสภาพเป็นเบส เป็นการเพิ่มประสิทธิภาพในการชำระล้างสิ่งสกปรกทั้งหลายได้ดี
- ฟอสเฟตจะรวมตัวกับไอออนของโลหะในน้ำกระด้างเป็นสารเชิงซ้อน ทำให้ไอออนของโลหะในน้ำกระด้างไม่สามารถขัดขวางการกำจัดสิ่งสกปรกของผงซักฟอกได้
2. สารลดแรงตึงผิว เป็นสารที่ใช้ชำระล้างสิ่งสกปรกทั้งหลายได้ ได้แก่ เกลือโซเดียมแอลคิล-ซัลโฟเนต โซเดียมแอลคิลเบนซิลซัลโฟเนต ผสมอยู่ประมาณ 30%
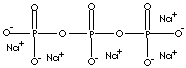
Sodium tripolyphosphate - STPP
ผลเสียที่เกิดจากการใช้ผงซักฟอก ทำให้เกิดมลภาวะของน้ำ
ผลเสียที่เกิดจากการใช้ผงซักฟอก ทำให้เกิดมลภาวะของน้ำ ดังนี้
1. สารพวกฟอสเฟตเป็นปุ๋ยจากผงซักฟอกเมื่อปล่อยลงสู่แหล่งน้ำ จะทำให้พืชน้ำเจริญเติบโต รวดเร็ว ทำให้ขวางทางคมนาคมทางน้ำ ทำลายทัศนียภาพ ทำให้ O 2 ละลายน้ำไม่ได้ สิ่งมีชีวิต ขาด O 2 ตายได้ และพืชน้ำเกิดมากอาจจะตาย เน่า ทำให้น้ำเสีย
2. ผงซักฟอกชนิด C ใน R แตกกิ่งก้านสาขาจุลินทรีย์ในน้ำสลายไม่ได้ ทำให้ตกค้างในน้ำ เมื่อ เข้าสู่ร่างกายของคนจะทำให้เกิดโรคภัยไข้เจ็บได้
โปรตีนและกรดอะมิโน
โปรตีน ( Protien) คือ สารชีวโมเลกุลประเภทสารอินทรีย์ที่ประกอบด้วยธาตุ C H O N เป็นองค์ประกอบสำคัญ นอกจากนั้นยังมีธาตุอื่น ๆ เช่น S P Fe Zn ทั้งนี้ขึ้นอยู่กับชนิดของโปรตีน โปรตีน เป็นสารพวกพอลิเมอร์ ประกอบด้วยกรดอะมิโนจำนวนมากมาย
กรดอะมิโน ( Amino Acid) คือ กรดอินทรีย์ชนิดหนึ่งที่มีหมู่คาร์บอกซิลและหมู่อะมิโนเป็นหมู่ฟังก์ชันสูตรทั่วไปดังนี้
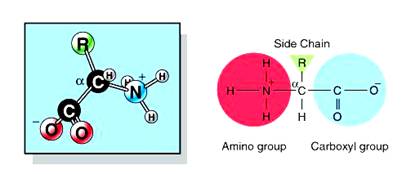
ชนิดกรดอะมิโน
กรดอะมิโนที่พบเป็นองค์ประกอบของโปรตีนมี 20 ชนิด จำแนกตามความจำเป็นแก่ร่างกาย คือ
1. กรดอะมิโนที่จำเป็นแก่ร่างกาย (Essential amino acid ) ได้แก่ กรดอะมิโนที่ร่างกายสังเคราะห์ไม่ได้ หรือสังเคราะห์ได้แต่ไม่เพียงพอกับความต้องการของร่างกาย จำเป็นต้องได้รับจากอาหาร กรดอะมิโนเหล่านี้ ได้แก่ อาร์จินีน ( Arginine ) ฮีสทิดีน (Histidine ) ไอโซลิวซีน (Isoleucine ) ลิวซีน (Leucine ) ไลซีน (Lysine ) เมทิโอนีน (Methionine ) เฟนิลอะลานีน (Phenylalanine ) เทรโอนีน (Threonine ) ทริปโทเฟน (Tryptophan ) และวาลีน (Valine ) เด็กต้องการกรดอะมิโนที่จำเป็นแก่ร่างกาย 9 ตัวยกเว้นอาร์จินีน สำหรับผู้ใหญ่ต้องการกรดอะมิโนที่จำเป็นแก่ร่างกาย 8 ชนิด ยกเว้น อาร์จินีน และฮีสทิดีน
2. กรดอะมิโนที่ไม่จำเป็นแก่ร่างกาย ( Nonessential amino acid ) ได้แก่ กรดอะมิโนที่ร่างกายสังเคราะห์ขึ้นได้เพียงพอกับความต้องการของร่างกายไม่จำเป็นต้อง ได้รับจากอาหาร คือ อาจสังเคราะห์ขึ้นจากสารประกอบพวกไนโตรเจน หรือจากกรดอะมิโน ที่จำเป็นแก่ร่างกาย หรือจากไขมันหรือจากคาร์โบไฮเดรต กรดอะมิโนพวกนี้ได้แก่ กรดกลูแทมิก ไกลซีน ซีสทีน ไทโรซีน เป็นต้น ในเรื่องนี้มักมีคนเข้าใจผิดว่ากรดอะมิโนที่ไม่จำเป็นแก่ร่างกาย เป็นกรดอะมิโนที่ร่างกายไม่จำเป็นต้องใช้ ความจริงนั้นร่างกายต้องใช้กรดอะมิโนทั้งสองพวกในการสร้างโปรตีน แต่ที่เราเรียกว่าเป็นกรดอะมิโนที่ไม่จำเป็นนั้นเพราะเราคิดในแง่ที่ว่าร่างกายสร้างเองได้เพียงพอ จากการวิเคราะห์พบว่าโปรตีนในเซลล์ และเนื้อเยื่อของร่างกายมีกรดอะมิโนพวกนี้อยู่ร้อยละ 40
สมบัติของกรดอะมิโน
1. สถานะ ของแข็ง ไม่มีสี
2. การละลายน้ำ ละลายน้ำ เกิดพันธะไฮโดรเจนและแรงแวนเดอร์วาลส์
3. จุดหลอมเหลว สูง อยู่ระหว่าง 150 - 300 0C เพราะเกิดพันธะไฮโดรเจน
4. ความเป็นกรด- เบส Amphoteric substance
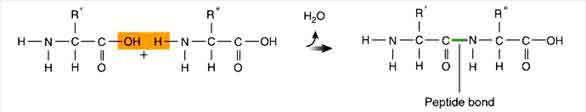
การเกิดพันธะเพปไทด์
พันธะเพปไทด์ คือ พันธะโคเวเลนต์ที่เกิดขึ้นระหว่าง C อะตอมในหมู่คาร์บอกซิล (![]() ) ของกรดอะมิโนโมเลกุลหนึ่งยึดกับ N อะตอม ในหมู่อะมิโน (-NH 2) ของกรดอะมิโนอีกโมเลกุลหนึ่ง ดังภาพสมการ
) ของกรดอะมิโนโมเลกุลหนึ่งยึดกับ N อะตอม ในหมู่อะมิโน (-NH 2) ของกรดอะมิโนอีกโมเลกุลหนึ่ง ดังภาพสมการ
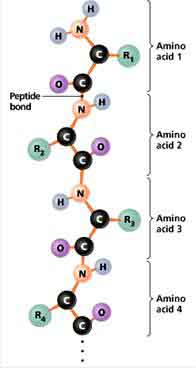
… สารที่ประกอบด้วยกรดอะมิโน 2 โมเลกุล เรียกว่า ไดเพปไทด์
… สารที่ประกอบด้วยกรดอะมิโน 3 โมเลกุล เรียกว่า ไตรเพปไทด์
… สารที่ประกอบด้วยกรดอะมิโนตั้งแต่ 100 โมเลกุลขึ้นไป เราเรียกพอลิเพปไทด์นี้ว่า โปรตีน
… อนึ่งสารสังเคราะห์บางชนิดก็เกิดพันธะเพปไทด์เหมือนกัน
… พวกเพปไทด์ที่เป็นโมเลกุลเปิดไม่ดูดเป็นวง จะหาจำนวนพันธะเพปไทด์ได้ดังนี้

… ถ้ากรดอะมิโน n ชนิด ชนิดละ 1 โมเลกุล มาทำปฏิกิริยาเกิดเป็นพอลิเพปไทด์แบบต่าง ๆ โดยที่พอลิเพปไทด์แต่ละแบบต่างประกอบด้วยกรดอะมิโนแต่ละชนิดเท่า ๆ กัน จะพบว่า

สมบัติของโปรตีน
1. การละลายน้ำ ไม่ละลายน้ำ บางชนิดละลายน้ำได้เล็กน้อย
2. ขนาดโมเลกุล และมวลโมเลกุล ขนาดใหญ่มีมวลโมเลกุลมาก
3. สถานะ ของแข็ง
4. การเผาไหม้ เผาไหม้มีกลิ่นไหม้
5. ไฮโดรลิซิส
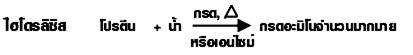
6. การทำลายธรรมชาติ โปรตีนบางชนิดเมื่อได้รับความร้อน หรือเปลี่ยนค่า pH หรือเติมตัวทำลายอินทรีย์บางชนิด จะทำให้เปลี่ยนโครงสร้างจับเป็นก้อนตกตะกอน
7. การทดสอบโปรตีน ใช้ทดสอบกับสารละลายไบยูเรต (เป็นสารละลายผสมระหว่าง CuSO 4 กับ NaOH มีสีฟ้า) ซึ่งได้สารเชิงซ้อนของ Cu 2+ กับโปรตีน และให้ละลายที่มีสี ดังสมการ
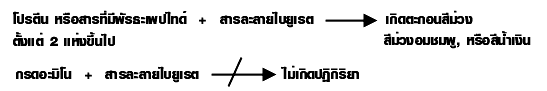
หน้าที่ของโปรตีน
- สร้างเนื้อเยื่อต่างๆ และซ่อมแซมส่วนที่สึกหรอในอวัยวะต่างๆ
- เป็นส่วนประกอบของน้ำย่อย และฮอร์โมน
- เป็นส่วนประกอบของสารเคมีที่สามารถต้านทานโรค
- ให้พลังงาน คือ โปรตีน 1 กรัม ให้พลังงานประมาณ 4 แคลอรี
- ร่างกายสามารถใช้โปรตีนแทนคาร์โบไฮเดรตได้
กรดนิวคลีอิก
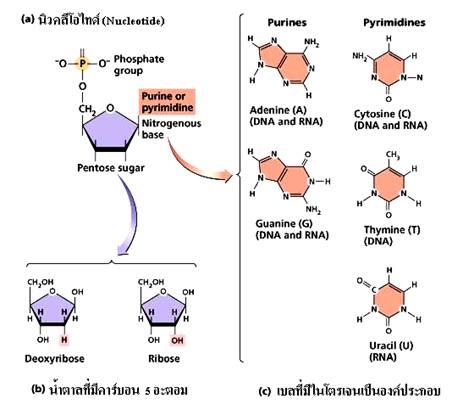
กรดนิวคลีอิก (Nucleic acid) เป็นสารชีวโมเลกุลที่มีขนาดใหญ่ทำหน้าที่เก็บและถ่ายทอดข้อมูลทางพันธุ์กรรมของสิ่งมีชีวิต จากรุ่นหนึ่งไปยังรุ่นต่อไปให้แสดงลักษณะต่างๆ ของสิ่งมีชีวิต นอกจากนี้ยังทำหน้าที่ควบคุมการเจริญเติบโตและกระบวนการต่าง ๆ ของสิ่งมีชีวิต กรดนิวคลีอิกมี 2 ชนิดคือ DNA (Deoxyribonucleic acid) และ RNA (Ribonucleic acid) โมเลกุลของกรดนิวคลีอิก ประกอบด้วยหน่วยย่อยที่เรียกว่า นิวคลีโอไทด์ (Nucleotide) โมเลกุลของนิวคลีโอไทด์ประกอบด้วยส่วนย่อย 3 ส่วน ได้แก่
- หมู่ฟอสเฟต
- น้ำตาลที่มีคาร์บอน 5 อะตอม
- เบสที่มีไนโตรเจนเป็นองค์ประกอบ นิวคลีโอไทด์มีอยู่ด้วยกัน 5 ชนิดแตกต่างกันที่องค์ประกอบที่เป็นเบส
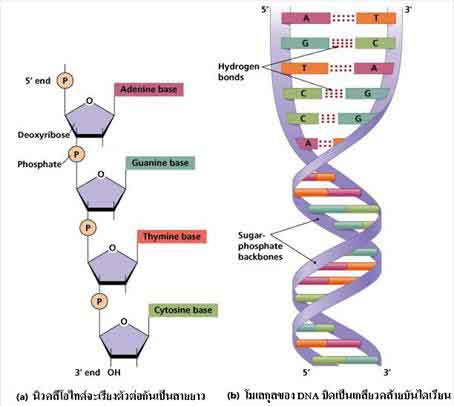
DNA และRNA มีน้ำตาลที่เป็นองค์ประกอบต่างกันใน DNA เป็นน้ำตาลดีออกซีไรโบส (Deoxyribose sugar) ส่วนใน RNA เป็นน้ำตาลไรโบส (Ribose sugar) เบสที่พบใน DNA และ RNA มีบางชนิดที่เหมือนกัน และบางชนิดต่างกัน ดังภาพ
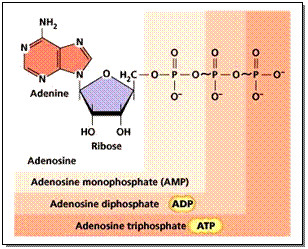
นอกจากนี้นิวคลีโอไทด์ยังเป็นสารให้พลังงานในกระบวนการเมตาบอลิซึม ( Metabolism) เช่น ATP (Adenosine Triphosphate) ADP (Adenosine Diphosphate) และ AMP (Adenosine Monophosphate) ซึ่งจะแตกต่างกันตามจำนวนของหมู่ฟอสเฟต ดังภาพ
นิวคลีโอไทด์จะเรียงตัวต่อกันเป็นสายยาว เรียกว่า พอลินิวพลีโอไทด์ (Polynucleotide) โมเลกุล DNA ประกอบด้วยพอลินิวคลีโอไทด์ 2 สายเรียงตัวสลับทิศทางกันและมีส่วนของเบสเชื่อมต่อกันด้วยพันธะไฮโดรเจน โมเลกุลบิดเป็นเกลียวคล้ายบันไดเวียน ดังภาพ ส่วน RNA เป็นพอลินิวคลีอิกเพียงสายเดียว
เอนไซม์
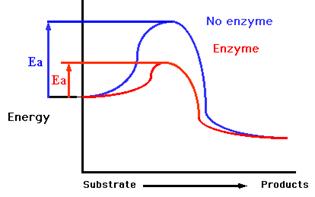
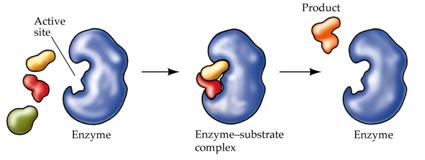
จากกราฟ การหาพลังงานก่อกัมมันต (Ea) จากกราฟระหว่างพลังงานกับการดําเนินไปของปฏิกิริยาสามารถหาได้ โดยนําเอาพลังงานของสารตั้งต้นไปลบออกจากพลังงานที่จุดสูงสุดของการเกิดปฏิกิริยานั้นๆ ซึ่งการทำงานของเอนไซม์ มีขั้นตอนดังภาพ
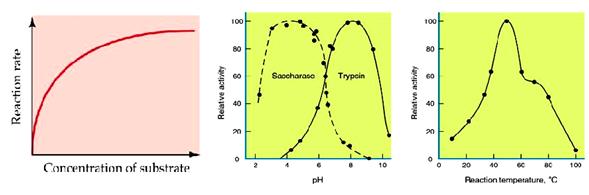
ปัจจัยที่มีผลต่อการทำงานของเอนไซม์ มีดังนี้
1. ชนิดของเอนไซม์
2. ความเข้มข้นของสารตั้งต้น ( Substrate)
3. ความเป็นกรด - เบสของสารละลาย
4. อุณหภูมิ
5. การยับยั้งปฏิกิริยาของเอนไซม์ (Enzyme Inhibitors)
การเรียกชื่อเอนไซม์
เอนไซม์จะเรียกตามชนิดของสับสเตรตแล้วลงท้ายด้วย “ เ – ส ”
ตัวอย่าง เช่น
- ยูรีเอส เป็นเอนไซม์ใชไฮโดรไลซ์ยูเรีย
- ไลเปส เป็นเอนไซม์ที่อยู่ในน้ำลายใช้ย่อยแป้งในปาก
<<<แต่เอ็นไซม์บางชนิดมีชื่อเฉพาะ เช่น เพปซิน ทริปซิน ปาเปน เป็นต้น>>>
กลับไปที่เนื้อหา



