ไฟฟ้าเคมี
- 1. การแนะนำ
- 2. บทเรียนที่ 2 ปฏิกิริยารีดอกซ์
- 3. บทเรียนที่ 3 เซลล์กัลวานิก(1)
- 4. บทเรียนที่ 4 เซลล์กัลวานิก(2)
- 5. บทเรียนที่ 5 การเขียนแผนภาพเซลล์กัลวานิก
- 6. บทเรียนที่ 6 เซลล์อิเล็กโทรไลต์(1)
- 7. บทเรียนที่ 7 การแยกสารละลายด้วยไฟฟ้า
- 8. บทเรียนที่ 8 เซลลืกัลวานิก(ทบทวน)
- 9. บทเรียนที่ 9 ศักย์ไฟฟ้าครึ่งเซลล์มาตรฐาน
- 10. บทเรียนที่ 10 ประโยชน์ของค่า E
- 11. บทเรียนที่ 11 เซลล์ปฐมภูมิ
- 12. บทเรียนที่ 12 การผุกร่อนของโลหะและการป้องกัน
- - ทุกหน้า -
บทเรียนที่ 1 เลขออกซิเดชัน
เลขออกซิเดชัน (Oxidation number หรือ Oxidation state)
เลขออกซิเดชัน ย่อว่า ON. คือค่าประจุไฟฟ้าที่สมมติขึ้นของไอออนหรืออะตอมของธาตุ โดยคิดจากจำนวนอิเล็กตรอนที่ให้หรือรับหรือใช้ร่วมกับอะตอมของธาตุตามเกณฑ์ที่กำหนดขึ้น เลขออกซิเดชันส่วนใหญ่เป็นเลขจำนวนเต็มบวกหรือลบหรือศูนย์ในสารประกอบไอออนิกอะตอมมีการให้และรับอิเล็กตรอนแล้วกลายเป็นไอออนบวกและไอออนลบ ดังนั้นเลขออกซิเดชันจึงตรงกับค่าประจุไฟฟ้าที่แท้จริง ซึ่งมีค่าเท่ากับประจุไฟฟ้าของไอออนนั้นๆ ในสารประกอบโคเวเลนต์ อะตอมของธาตุใช้อิเล็กตรอนร่วมกันไม่ได้มีการให้ และรับอิเล็กตรอนเหมือนกับในสารประกอบไอออนิก ดังนั้นในกรณีนี้เลขออกซิเดชันเป็นแต่เพียงประจุสมมติ ส่วนอะตอมของธาตุใดจะมีค่าเลขออกซิเดชันเป็นบวกหรือลบ ให้พิจารณาค่าอิเล็กโทรเนกาติวิตี อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงกว่าจะมีเลขออกซิเดชันเป็นลบ ส่วนอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่าจะมีเลขออกซิเดชันเป็นบวก ส่วนจะมีค่าบวกเท่าไรนั้นพิจารณาได้จากจำนวนเวเลนซ์อิเล็กตรอนที่อะตอมของธาตุนำไปใช้ร่วมกับอะตอมของธาตุอื่น
หลักเกณฑ์ในการกำหนดค่าเลขออกซิเดชัน
การกำหนดเลขออกซิเดชันมีเกณฑ์ดังนี้
1. เลขออกซิเดชันของธาตุอิสระทุกชนิดไม่ว่าธาตุนั้นหนึ่งโมเลกุลจะประกอบด้วย กี่อะตอมก็ตามมีค่าเท่ากับศูนย์ เช่น Na, Zn, Cu, He, H 2, N 2, O 2, Cl 2, P 4, S 8 ฯลฯ มีเลขออกซิเดชันเท่ากับศูนย์
2. เลขออกซิเดชันของไฮโดรเจนในสารประกอบโดยทั่วไป (H รวมตัวกับอโลหะ ) เช่น HCl , H 2O , H 2SO 4 ฯลฯ มีค่าเท่ากับ + 1 แต่ในสารประกอบไฮไดรด์ของโลหะ (H รวมตัวกับโลหะ ) เช่น NaH , CaH 2 ไฮโดรเจนมีเลขออกซิเดชันเท่ากับ -1
3. เลขออกซิเดชันของออกซิเจนในสารประกอบโดยทั่วไปเท่ากับ -2 แต่ในสารประกอบเปอร์ออกไซด์ เช่น H 2O 2 และ BaO 2 ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1 ในสารประกอบซุปเปอร์ออกไซด์ ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1/2 และในสารประกอบ OF 2 เท่านั้น ที่ออกซิเจนมีเลขออกซิเดชันเท่ากับ +2
4. เลขออกซิเดชันของไอออนที่ประกอบด้วยอะตอมชนิดเดียวกันมีค่าเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น Mg 2+ ไอออน มีเลขออกซิเดชันเท่ากับ +2 ,F - ไอออนมีเลขออกซิเดชันเท่ากับ -1 เป็นต้น
5. ไอออนที่ประกอบด้วยอะตอมมากกว่าหนึ่งชนิด ผลรวมของเลขออกซิเดชันของอะตอมทั้งหมดจะเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น SO 4 2- ไอออน เท่ากับ – 2 เลขออกซิเดชันของ NH 4 + ไอออนเท่ากับ + 1 เป็นต้น
6. ในสารประกอบใดๆ ผลบวกของเลขออกซิเดชันของอะตอมทั้งหมดเท่ากับศูนย์ เช่น H 2O H มีเลขออกซิเดชันเท่ากับ + 1 แต่มี H 2 อะตอม จึงมีเลขออกซิเดชันทั้งหมด เท่ากับ + 2 O มีเลขออกซิเดชันเท่ากับ – 2 เมื่อรวมกันจะเท่ากับศูนย์เป็นต้น
เพิ่มเติม
1. ธาตุหมู่ IA , IIA , IIIA ในสารประกอบต่างๆ มีเลขออกซิเดชันเท่ากับ +1 , + 2 , + 3 ตามลำดับ
2. ธาตุอโลหะส่วนใหญ่ในสารประกอบมีเลขออกซิเดชันได้หลายค่า เช่น Cl ใน HCl HClO HClO 2 HClO 3 และ HClO 4 มีเลขออกซิเดชันเท่ากับ - 1, +1, +3, +5 และ +7 ตามลำดับ
3. ธาตุแทรนซิชันส่วนใหญ่มีเลขออกซิเดชันได้มากกว่าหนึ่งค่า เช่น Fe ใน FeO และ Fe 2O 3 มีเลขออกซิเดชันเท่ากับ +2 และ +3 ตามลำดับ
การหาเลขออกซิเดชัน การหาเลขออกซิเดชันอาจทำได้โดยวิธีดังนี้
1. สมมติเลขออกซิเดชันของธาตุที่ต้องการหา
2. นำค่าเลขออกซิเดชันของธาตุที่ทราบแล้ว และเลขออกซิเดชันของธาตุที่ต้องการหาเขียนเป็นสมการตามข้อตกลงในข้อ 5 และข้อ 6 แล้วแก้สมการเพื่อหาเลขออกซิเดชันของธาตุ ดังกล่าว
3. สำหรับสารประกอบไอออนิก ที่ประกอบด้วยไอออนเชิงซ้อน และไม่ทราบค่า เลขออกซิเดชันของธาตุมากกว่า 1 ธาตุ เมื่อต้องการหาค่าเลขออกซิเดชันของธาตุ ควรแยกเป็นไอออนบวกและไอออนลบก่อน จึงสมมติค่าเลขออกซิเดชันของธาตุที่ต้องการหา แล้วนำ ค่าเลขออกซิเดชันของธาตุที่ทราบแล้วกับธาตุที่ต้องการทราบไปเขียนสมการตามข้อตกลงในข้อ 5 จากนั้นจึงแก้สมการเพื่อหาเลขออกซิเดชันของธาตุดังกล่าว
ตัวอย่างที่ 1 จงหาเลขออกซิเดชันของ Cr ใน [ Cr(H 2O) 4Cl 2]ClO 4
วิธีทำ H 2O มีเลขออกซิเดชันเท่ากับ 0
Cl - มีเลขออกซิเดชันเท่ากับ - 1
ClO 4 มีเลขออกซิเดชันเท่ากับ - 1
ให้ Cr มีเลขออกซิเดชันเท่ากับ A
A + ( 0 x 4 ) + ( - 1 x 2 ) + ( - 1 ) = 0
A = + 1 + 2 = + 3
ดังนั้น Cr มีเลขออกซิเดชันเท่ากับ + 3
กลับไปที่เนื้อหา
บทเรียนที่ 2 ปฏิกิริยารีดอกซ์
ไฟฟ้าเคมี เป็นการศึกษาเกี่ยวกับปฏิกิริยาเคมีที่ทำให้เกิดกระแสไฟฟ้า กระแสไฟฟ้าทำให้เกิดปฏิกิริยาเคมีหากใช้การถ่ายเทอิเล็กตรอนเป็นเกณฑ์แล้ว ปฏิกิริยาเคมีแบ่งเป็น 2 ประเภท
- ปฏิกิริยาที่มีการถ่ายเท e- เรียกว่าปฏิกิริยารีดอกซ์ (Redox Reaction)
- ปฏิกิริยาที่ไม่มีการถ่ายเทe- เรียกว่าปฏิกิริยานอนรีดอกซ์ (Nonredox Reaction)
ปฏิกิริยารีดอกซ์ (Redox Reaction หรือ Oxidation-reduction Reaction) หมายถึง ปฏิกิริยาที่มีการให้และรับอิเล็กตรอน ซึ่งประกอบด้วย 2 ครึ่งปฏิกิริยา ดังนี้
1) ปฏิกิริยาออกซิเดชัน (Oxidation reaction) เป็นปฏิกิริยาที่มีการให้อิเล็กตรอน ซึ่งสารที่ให้อิเล็กตรอนจะมีเลขออกซิเดชันเพิ่มขึ้น เรียกว่า เกิดออกซิเดชัน
Zn(s) ® Zn2+(s) + 2e–
Zn เป็นสารที่ให้อิเล็กตรอน เกิดเป็น Zn2+ สารที่ให้อิเล็กตรอนเรียกว่า ตัวรีดิวซ์ (Reducing agent)
2) ปฏิกิริยารีดักชัน (Reduction reaction) เป็นปฏิกิริยาที่มีการรับอิเล็กตรอน ซึ่งสารที่รับอิเล็กตรอนจะมีเลขออกซิเดชันลดลง เรียกว่า เกิดรีดักชัน
Cu2+(s) + 2e– ® Cu(s)
Cu2+ เป็นสารที่รับอิเล็กตรอน เกิดเป็น Cu สารที่รับอิเล็กตรอนเรียกว่า ตัวออกซิไดส์ (Oxidizing agent)
ปฏิกิริยาในออกซิเดชันและรีดักชันเกิดขึ้นพร้อมกันเสมอ Zn ให้อิเล็กตรอนจึงเป็นตัวรีดิวซ์ และ Cu2+ รับอิเล็กตรอนจึงเป็นตัวออกซิไดส์ หรือกล่าวได้ว่า Cu2+ ถูกรีดิวซ์ และ Zn ถูกออกซิไดส์
ตัวออกซิไดส์และตัวรีดิวซ์
- ตัวออกซิไดส์ หมายถึงสารที่รับอิเล็กตรอน ซึ่งเป็นสารที่ทำให้อะตอมอื่นมีเลขออกซิเดชันเพิ่มขึ้น
- ตัวรีดิวซ์หมายถึงสารที่ให้อิเล็กตรอน ซึ่งเป็นสารที่ทำให้อะตอมอื่นมีเลขออกซิเดชันลดลง
การพิจารณาว่าเป็นปฏิกิริยารีดอกซ์หรือไม่
- ในปฏิกิริยาที่เกิดขึ้นมีเลขออกซิเดชันเปลี่ยนไปหรือ ถ้าเลขออกซิเดชันเปลี่ยนแปลงโดยสารหนึ่งมีเลขออกซิเดชันเพิ่มขึ้น และอีกสารหนึ่งมีเลขออกซิเดชันลดลง แสดงว่าเป็นปฏิกิริยารัดอกซ์
- ถ้าในปฏิกิริยามรธาตุอิสระอยู่ด้วย ปฏิกิริยานั้นจะเป็นปฏิกิริยารีดอกซ์ เพราะธาตุอิสระมีเลขออกซิเดชันเท่ากับศูนย์ จะถูกเปลี่ยนให้มีเลขออกซิเดชันเพิ่มขึ้นหรือลดลง
ข้อสังเกต
- อโลหะอิสระมักจะเป็นตัวออกซิไดซ์ เพราะอโลหะชอบรักอิเล็กตรอน
- โลหะอิสระจะเป็นตัวรีดิวซ์ เพราะโลหะเสียอิเล็กตรอนได้ง่าย
- สารประกอบที่มีธาตุออกซิเจนเป็นองค์ประกอบมากกว่ามักจะเป็นตัวออกซิไดซ์ ส่วนสารที่มีออกซิเจนน้อยกว่า หรือไม่มีเลยมักจะเป็นตัวรีดิวซ์
- ไอออนบวกมักจะเป็นตัวออกซิไดซ์ ส่วนไอออนลบมักจะเป็นตัวรีดิวซ์
ตัวอย่าง เมื่อนำแผ่นโลหะทองแดง (Cu) จุ่มลงในสารละลายของ AgNO3 พบว่าที่แผ่นโลหะ Cu มีของแข็งสีขาวปนเทามาเกาะอยู่ และเมื่อนำมาเคาะจะพบว่าโลหะ Cu เกิดการสึกกร่อน ส่วนสีของสารละลาย AgNO3 ก็จะเปลี่ยนจากใสไม่มีสีเป็นสีฟ้า
การเปลี่ยนแปลงที่เกิดขึ้นนี้อธิบายได้ว่าการที่โลหะทองแดงเกิด การสึกกร่อนเป็นเพราะโลหะทองแดง(Cu) เกิดการเสียอิเล็กตรอนกลายเป็น Cu2+ ซึ่งมีสีฟ้าและเมื่อ Ag+ รับอิเล็กตรอนเข้ามาจะกลายเป็น Ag (โลหะเงิน) มาเกาะอยู่ที่แผ่นโลหะทองแดง
ปฏิกิริยาที่เกิดขึ้น เขียนในรูปสมการได้ดังนี้
Cu(s)----> Cu2+(aq) + 2 e- (ปฏิกิริยาออกซิเดชัน)
Ag+(aq) + e------> Ag(s) (ปฏิกิริยารีดักชัน)
e- ที่ถ่ายเทต้องเท่ากัน สมการเคมีที่เกิดขึ้นที่แท้จริงต้องเป็น
Cu(s)------> Cu2+(aq) + 2 e- (ปฏิกิริยาออกซิเดชัน)
2Ag+(aq) +2 e------> 2Ag(s) (ปฏิกิริยารีดักชัน)
ปฏิกิริยาที่เกิดขึ้นในแต่ละสมการเรียกว่าครึ่งปฏิกิริยา ซึ่งการเกิดปฏิกิริยาถ่ายเท e- จะเกิดขึ้นได้สมบูรณ์ก็ต่อเมื่อต้องนำครึ่งปฏิกิริยาทั้งสองมารวมกัน เขียนเป็นสมการได้ดังนี้
Cu(s) + Ag+(aq)-----> Cu2+(aq) + 2Ag(s) (ปฏิกิริยารีดอกซ์)
สรุปได้ว่าการเกิดปฏิกิริยารีดอกซ์จะต้องประกอบไปด้วย
- สารที่ให้ e- เรียกว่าตัวรีดิวซ์ เกิดปฏิกิริยาออกซิเดชัน (Oxidation Reaction)
- สารที่รับ e- เรียกว่าตัวออกซิไดซ์ เกิดปฏิกิริยารีดักชัน (Reduction Reaction)
กลับไปที่เนื้อหา
บทเรียนที่ 3 เซลล์กัลวานิก(1)
เซลล์กัลวานิก
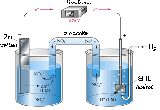
ได้กล่าวถึงปฏิกิริยารีดอกซ์ที่เกิดขึ้นเมื่อนำแผ่นสังกะสีจุ่มลงในสารละลายของทองแดง หรือตัวรีดิวซ์จุ่มลงในตัวออกซิไดซ์โดยตรงแล้วในบทนำ ปฏิกิริยาที่เกิดขึ้นทำให้เกิดพลังงานในรูปของความร้อน แต่ถ้าแยกตัวรีดิวซ์ออกจากตัวออกซิไดซ์ แล้วเชื่อมต่อวงจรภายนอกและสะพานเกลือ (salt bridge) อิเล็กตรอนก็จะถูกถ่ายโอนผ่านตัวกลางภายนอกจากขั้วไฟฟ้าที่เกิดปฏิกิริยาออกซิเดชันไปยังขั้วไฟฟ้าที่เกิดปฏิกิริยารีดักชัน จึงทำให้เกิดกระแสไฟฟ้าได้ เซลล์ไฟฟ้าที่เกิดจากปฏิกิริยาเคมีนี้เรียกว่าเซลล์กัลวานิก หรือเซลล์โวลตาอิก (galvanic cell or voltaic cell) ดังรูป
จากรูปเซลล์กัลวานิกประกอบด้วยสองครึ่งเซลล์ โดยแต่ละครึ่งเซลล์จะประกอบด้วยขั้วไฟฟ้าที่จุ่มลงไปในสารละลาย แท่งสังกะสีและแท่งทองแดงในเซลล์เป็นขั้วไฟฟ้าซึ่งเรียกว่า อิเล็กโทรด (electrode) ขั้วที่เกิดปฏิกิริยาออกซิเดชัน เรียกว่า ขั้วแอโนด (anode) และขั้วที่เกิดปฏิกิริยารีดักชัน เรียกว่าขั้วแคโทด (cathode)
ปฏิกิริยาออกซิเดชันที่แอโนด (Zn) Zn(s)-------> Zn2+(aq) + 2e-
ปฏิกิริยารีดักชันที่แคโทด (Cu) Cu2+(aq) + 2e------> Cu(s)
หมายเหตุ : ประจุที่สะสมจะทำให้ออกซิเดชันที่แคโทดและรีดักชันที่แอโนดเกิดยากขึ้น
ระหว่างที่เกิดปฏิกิริยาออกซิเดชันขึ้นที่ขั้วแอโนด Zn จะค่อย ๆ กร่อนแล้วเกิดเป็น Zn2+ ละลายลงมาในสารละลายที่มี Zn2+ และ SO42- ส่วนที่ขั้วแคโทด Cu2+ จากสารละลายเกิดปฏิกิริยารีดักชันกลายเป็นอะตอมของทองแดงเกาะอยู่ที่ผิวของขั้วไฟฟ้า เมื่อปฏิกิริยาดำเนินไปจะพบว่าในครึ่งเซลล์ออกซิเดชันสารละลายจะมีประจุบวก (Zn2+) มากกว่าประจุลบ (SO42-) และในครึ่งเซลล์รีดักชันสารละลายจะมีประจุลบ (SO42-) มากกว่าประจุบวก (Cu2+) จึงเกิดความไม่สมดุลทางไฟฟ้าขึ้น
ปัญหานี้สามารถที่จะแก้ไขได้โดยการใช้ สะพานเกลือ (salt bridge) เชื่อมต่อระหว่างสองครึ่งเซลล์ ซึ่งสะพานเกลือทำจากหลอดแก้วรูปตัวยู ภายในบรรจุอิเล็กโตรไลต์ที่ไม่ทำปฏิกิริยากับสารในเซลล์และมีไอออนบวก ไอออนลบเคลื่อนที่ด้วยความเร็วใกล้เคียงกัน หรือทำจากกระดาษกรองชุบอิเล็กโตรไลต์ โดยสะพานเกลือทำหน้าที่เป็นตัวกลางที่เชื่อมต่อระหว่างครึ่งเซลล์ทั้งสอง และเป็นสิ่งที่ป้องกันการเกิดการสะสมของประจุโดยไอออนบวกจากสะพานเกลือจะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุลบมาก ในทางตรงกันข้ามไอออนลบก็จะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุมาก จึงทำให้ปฏิกิริยาดำเนินต่อไปได้ในเวลาที่มากขึ้น
และเนื่องจากครึ่งเซลล์ทั้งสองเชื่อมต่อกับวงจรภายนอก ครึ่งเซลล์ที่มีศักย์รีดักชันสูงกว่าจะเกิดรีดักชัน และครึ่งเซลล์ที่มีศักย์รีดักชันต่ำกว่าจะ(ถูกบังคับให้)เกิดออกซิเดชัน ความต่างศักย์ระหว่างอิเล็กโทรดนี้ เรียกว่า แรงเคลื่อนไฟฟ้า (electromotive force: emf) และมีหน่วยเป็นโวลต์ (volt)
เซลล์กัลวานิกมีหลายประเภท
1.เซลล์ปฐมภูมิ
2.เซลล์ทุติยภูมิ
เซลล์ปฐมภูมิมีหลายชนิด เช่น
1. เซลล์แห้ง (Dry Cell) หรือเซลล์เลอคลังเช (LeClanche Cell)
เซลล์ไฟฟ้าชนิดนี้ถูกเรียกว่า เซลล์แห้ง เพราะไม่ได้ใช้ของเหลวเป็นอิเล็กโทรไลต์ เป็นเซลล์ที่ใช้ในไฟฉาย หรือใช้ในประโยชน์อื่น ๆ เช่น ในวิทยุ เครื่องคิดเลข ฯลฯ ซึ่งมีลักษณะตามรูป
เซลล์แห้ง
กล่องของเซลล์ทำด้วยโลหะสังกะสีซึ่งทำหน้าที่เป็นขั้วแอโนด (ขั้วลบ) ส่วนแท่งคาร์บอนหรือแกรไฟต์อยู่ตรงกลางทำหน้าที่เป็นขั้วแคโทด (ขั้วบวก) ระหว่างอิเล็กโตรดทั้งสองบรรจุด้วยของผสมชื้นของแอมโมเนียมคลอไรด์ (NH4Cl) แมงกานีส (IV) ออกไซด์ (MnO2) ซิงค์คลอไรด์ (ZnCl2) ผงคาร์บอน ตอนบนของเซลล์ผนึกด้วยวัสดุที่สามารถรักษาความชื้นภายในเซลล์ให้คงที่ มีปฏิกิริยาเกิดขึ้นดังนี้
ที่ขั้วแอโนด (Zn-ขั้วลบ) Zn ถูกออกซิไดซ์กลายเป็น Zn2+
Zn(s)------> Zn2+(aq) + 2e-
ที่ขั้วแคโทด (C-ขั้วบวก) MnO2จะถูกรีดิวซ์ ไปเป็น Mn2O3
2MnO2(s) + 2NH4++(aq) + 2e- -------> Mn2O3(s) + H2O(l) + 2NH3 (aq)
ดังนั้นปฏิกิริยารวมจึงเป็น
Zn(s) + 2MnO2(s) + 2NH4+(aq)-------------> Zn2+(aq) + Mn2O3(s) + 2NH3(aq) + H2O(l)
แก๊ส NH3 ที่เกิดขึ้นจะเข้าทำปฏิกิริยากับ Zn2+ เกิดเป็นไอออนเชิงซ้อนของ [Zn(NH3)4]2+ และ [Zn(NH3)2(H2O)2]2+ การเกิดไอออนเชิงซ้อนนี้จะช่วยรักษาความเข้มข้นของ Zn2+ ไม่ให้สูงขึ้น จึงทำให้ศักย์ไฟฟ้าของเซลล์เกือบคงที่เป็นเวลานานพอสมควร จากปฏิกิริยารวมจะสังเกตว่ามีน้ำเป็นผลิตภัณฑ์ด้วย ดังนั้นเซลล์ที่เสื่อมสภาพจึงบวมและมีน้ำไหลออกมา และเซลล์แห้งนี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์
กลับไปที่เนื้อหา
บทเรียนที่ 4 เซลล์กัลวานิก(2)
2. เซลล์แอลคาไลน์ (Alkaline Cell)
เซลล์แอลคาไลน์มีส่วนประกอบของเซลล์เหมือนกับเซลล์เลอคลังเช แต่มีสิ่งที่แตกต่างกันคือเซลล์แอลคาไลน์ใช้ เบสซึ่งได้แก่โพแตสเซียมไฮดรอกไซด์ (KOH ) เป็นอิเล็กโทรไลต์แทนแอมโมเนียมคลอไรด์ (NH 4Cl) และเนื่องจากใช้สารละลายเบสนี่เองเซลล์ชนิดนี้จึงถูกเรียกว่า เซลล์แอลคาไลน์
ที่ขั้วแอโนด (Zn -ขั้วลบ) Zn ถูกออกซิไดซ์
Zn(s) + 2OH-(aq) ------> ZnO(s) + H2O(l) + 2e-
ที่ขั้วแคโทด (C -ขั้วบวก) MnO2 จะถูกรีดิวซ์ ไปเป็น Mn2O3
2MnO2(s) + H2O(l) + 2e -------> Mn 2O 3(s) + 2OH -(aq)
สมการรวม Zn (s ) + 2MnO 2(s)------> ZnO(s) + Mn 2O 3(s)
เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ แต่ให้กระแสไฟฟ้าได้มากกว่าและนานกว่าเซลล์แห้ง เพราะ OH - ที่เกิดขึ้นที่ขั้วคาร์บอนสามารถนำกลับไปใช้ที่ขั้วสังกะสีได้
3. เซลล์ปรอท (Mercury Cell)
มีหลักการเช่นเดียวกับเซลล์แอลคาไลน์ แต่ใช้เมอร์คิวรี (II ) ออกไซด์ (HgO ) แทนแมงกานีส (IV ) ออกไซด์ (MnO 2) เป็นเซลล์ที่มีขนาดเล็กใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ หรือใช้ในอุปกรณ์อื่น เช่น นาฬิกาข้อมือ เครื่องคิดเลข เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ ให้กระแสไฟฟ้าต่ำ แต่สามารถให้ค่าศักย์ไฟฟ้าคงที่ตลอดอายุการใช้งาน มีปฏิกิริยาเคมีดังนี้
ที่ขั้วแอโนดZn (s ) + 2OH -(aq)------> ZnO(s) + H 2O(l) + 2e -
ที่ขั้วแคโทดHgO (s ) + H 2O(l) + 2e -------> Hg(l) + 2OH -(aq)
ปฏิกิริยารวม Zn (s ) + HgO (s )------> ZnO(s) + Hg(l)
ส่วนประกอบของเซลล์ปรอท
เซลล์ทุติยภูมิมีหลายชนิด เช่น
1. แบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว ( Lead Storage Battery)
แบตเตอรี่คือเซลล์ไฟฟ้าหลาย ๆ เซลล์ต่อกันเป็นอนุกรม แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วนี้เป็นแบตเตอรีที่ใช้ในรถยนต์ โดยประกอบด้วยเซลล์ไฟฟ้า 6 เซลล์ แต่ละเซลล์จะมีศักย์ไฟฟ้า 2 โวลต์ ดังนั้นแบตเตอรี่ในรถยนต์มีศักย์ไฟฟ้า 12 โวลต์
ส่วนประกอบของแบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว
เซลล์สะสมไฟฟ้าแบบตะกั่ว
1) เมื่ออัดไฟครั้งแรก 2) เมื่อจ่ายไฟ 3) เมื่ออัดไฟครั้งต่อไป
แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วจะประกอบด้วยอิเล็กโทรดคือแผ่นตะกั่ว มีกรดซัลฟิวริกเจือจางเป็นอิเล็กโทรไลต์ เมื่อมีการอัดไฟครั้งแรกแผ่นตะกั่วที่ต่อกับขั้วบวกของแบตเตอรี (ขั้วแอโนด) จะถูกออกซิไดซ์เป็นเลด (II ) ไอออน ดังสมการ
Pb(s)------> Pb 2+(aq) + 2e -
เมื่อรวมกับออกซิเจนที่เกิดขึ้นจะกลายเป็นเลด (IV ) ออกไซด์
Pb 2+(aq) + O 2(g)------>PbO2(s)
ดังนั้นที่ขั้วแอโนด (ขั้วบวก) แผ่นตะกั่วจะถูกเปลี่ยนเป็นเลด (IV ) ออกไซด์ขั้วไฟฟ้าจึงแตกต่างกัน (ขั้วแอโนด-ขั้วบวก: PbO2 และขั้วแคโทด-ขั้วลบ: Pb) ทำให้สามารถเกิดกระแสไฟฟ้าได้หรือจ่ายไฟได้นั่นเอง
การจ่ายไฟเกิดขึ้น ดังสมการ
ขั้วแอโนด-ขั้วลบ: Pb (s ) + SO4 2-(aq)------> PbSO4(s) + 2e-
ขั้วแคโทด-ขั้วบวก:PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e------> PbSO 4(s) + 2H 2O(l)
อิเล็กตรอนจะเคลื่อนที่จากขั้วแอโนดหรือขั้วลบผ่านวงจรภายนอกไปยังขั้วแคโทดหรือขั้วบวก จากสมการจะสังเกตได้ว่ามีผลิตภัณฑ์คือ PbSO 4(s) เกิดขึ้นเหมือนกัน ดังนั้นเมื่อใช้แบตเตอรี่ไประยะหนึ่งความต่างศักย์จะลดลง และจะลดลงไปเรื่อย ๆ จนกระทั่งเป็นศูนย์ ทั้งนี้เนื่องจากขั้วไฟฟ้าทั้งคู่เหมือนกัน จึงไม่มีความแตกต่างของศักย์ไฟฟ้าระหว่างขั้วทั้งสอง
ปฏิกิริยาของเชลล์ข้างบนเป็นผันกลับได้ ดังนั้นถ้าต้องการให้เกิดการผันกลับจึงจำเป็นต้องมีการอัดไฟฟ้าใหม่ โดยการต่อขั้วบวกของเซลล์กับขั้วบวกของแบตเตอรี่และขั้วลบกับขั้วลบของแบตเตอรี่ ปฏิกิริยาข้างบนก็จะเปลี่ยนทิศทางเป็นจากขวาไปซ้าย ในลักษณะนี้เลด(II ) ซัลเฟตที่ขั้วลบก็จะเปลี่ยนเป็นตะกั่ว ส่วนอีกขั้วหนึ่ง เลด (II ) ซัลเฟตจะเปลี่ยนเป็นเลด (IV ) ออกไซด์ ดังสมการ
ขั้วแอโนด-ขั้วบวก: PbSO 4(s) + 2H 2O(l)----->PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e -
ขั้วแคโทด-ขั้วลบ: PbSO 4(s) + 2e -------> Pb(s) + SO4 2-(aq)
จากปฏิกิริยาในขณะที่มีการจ่ายไฟฟ้า ความเข้มข้นของกรดจะลดลงเรื่อย ๆ จากปกติที่มีความถ่วงจำเพาะ ประมาณ 1.25 ถึง 1.30 แล้วแต่อุณหภูมิในขณะนั้น ๆ ถ้าหากเมื่อใดมีความถ่วงจำเพาะต่ำกว่า 1.20 ที่อุณหภูมิของห้องก็ควรจะมีการอัดไฟฟ้าใหม่ได้
2. ซลล์นิกเกิล-แคดเมียม หรือเซลล์นิแคด (Nickel-Cadmium Cell)
ที่ขั้วแอโนด: Cd(s) + 2OH -(aq)------>Cd(OH) 2(s) + 2e -
ที่ขั้วแคโทด: NiO 2(s) + 2H 2O(l) + 2e ------->Ni(OH) 2(s) + 2OH -(aq)
ปฏิกิริยารวม: Cd(s) + NiO 2(s) +2H 2O(l)------> Cd(OH) 2(s) + Ni(OH) 2(s)
3. เซลล์ลิเทียมไอออน ( Lithium Ion Cell)
เซลล์ลิเทียมอาจให้ศักย์ไฟฟ้าสูงถึง 3 โวลต์ เป็นเซลล์ที่ใช้อิเล็กโทรไลต์เป็นของแข็งได้แก่สารพอลิเมอร์ที่ยอมให้ไอออนผ่านแต่ไม่ยอมให้อิเล็กตรอนผ่าน ขั้วแอโนดคือลิเทียมซึ่งเป็นธาตุที่มีค่าศักย์ไฟฟ้ารีดักชันมาตรฐานต่ำที่สุด มีความสามารถในการให้อิเล็กตรอนได้ดีที่สุด ส่วนแคโทดใช้สารที่เรียกว่าสารประกอบแทรกชั้น (Insertion Compound ) ได้แก่ TiS 2 หรือ V 6O 13
กลับไปที่เนื้อหา
บทเรียนที่ 5 การเขียนแผนภาพเซลล์กัลวานิก
แผนภาพเซลล์กัลวานิก เขียนได้ดังนี้
3.1. เขียนครึ่งเซลล์ที่เกิดปฏิกิริยาออกซิเดชันไว้ทางซ้ายมือ โดยเขียนขั้วไฟฟ้าไว้ทางซ้ายสุด ตามด้วยไอออนในสารละลาย และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Zn(s)/Zn2+(aq)
3.2. เขียนครึ่งเซลล์ที่เกิดปฏิกิริยารีดักชันไว้ทางขวามือ โดยเขียนไอออนในสารละลายก่อน ตามด้วยขั้วไฟฟ้าไว้ทางขวาสุด และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Cu2+(aq)/Cu(s)
3.3. สำหรับครึ่งเซลล์ที่ประกอบด้วยโลหะกับก๊าซ ใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับก๊าซและระหว่างไอออนในสารละลาย เช่น Pt(s)/H2(g,1 atm)/H+(aq)
3.4. สำหรับครึ่งเซลล์ที่เป็นก๊าซ จะใช้ขั้วไฟฟ้าที่ทำจากวัสดุซึ่งไม่ทำปฏิกิริยากับก๊าซและสารอิเล็กโทรไลต์
3.5. เขียนเส้นคู่ขนาน // แทนสะพานไอออนกั้นระหว่างครึ่งเซลล์ที่เกิดปฏิกิริยาออกซิเดชันกับปฏิกิริยารีดักชัน เช่น Zn(s)/Zn2+(aq)// Cu2+(aq)/Cu(s) Pt(s)/H2(g,1 atm)/H+(1 mol/dm3)// Cu2+(1 mol/dm3)/Cu(s)
3.6. สำหรับครึ่งเซลล์ที่มีสารสถานะเดียวกันมากกว่าหนึ่งชนิด ให้ใช้เครื่องหมายจุลภาค (,) คั่นระหว่างไอออนทั้งสอง เช่น Fe(s)/Fe2+(aq),Fe3+(aq)// Cu2+(aq)/Cu(s)
3.7. การระบุความเข้มข้นของไอออนในสารละลายหรือสถานะของสาร ให้เขียนไว้ในวงเล็บ
ตัวอย่าง การเขียนแผนภาพเซลล์ไฟฟ้าเคมี
1. A | A2+(aq) || B2+(aq) | B หรือ A | A2+ || B2+ | B
2. Zn | Zn2+(0.1 M) || Cu2+(0.1 M) | Cu
3. Pt | H2(1 atm) | H+(1 M) || Cu2+ | Cu(s)
กลับไปที่เนื้อหา
บทเรียนที่ 6 เซลล์อิเล็กโทรไลต์(1)
เซลล์อิเล็กโทรไลต์ หมายถึง เซลล์ไฟฟ้าเคมีที่ทำหน้าที่เปลี่ยนพลังงานไฟฟ้าเป็นปฏิกิริยาเคมี หรือเป็นระบบที่เกิดกระบวนการอิเล็กโทรลิซีส
อิเล็กโทรลิซีส (Electrolysis) หมายถึงกระบวนการแยกสลายสารเคมีด้วยกระแสไฟฟ้า ซึ่งทำได้โดยผ่านกระแสไฟฟ้าลงในสารละลายอิเล็กโทรไลต์ หรือสารอิเล็กโทรไลต์ที่หลอมเหลว แล้วสารอิเล็กโทรไลต์เกิดการแยกสลายได้สารใหม่เกิดขึ้นที่ขั้วแอโนดและขั้วแคโทด
ส่วนประกอบของเซลล์อิเล็กโทรไลต์ เซลล์อิเล็กโทรไลต์ประกอบด้วยขั้วไฟฟ้าสองขั้ว จุ่มอยู่ในสารละลายอิเล็กโทรไลต์หรืออิเล็กโทรไลต์ที่หลอมเหลว ขั้วไฟฟ้าทั้งสองต่อกับขั้วบวกและขั้วลบของแบตเตอรี่ในเซลล์อิเล็กโทรไลต์ ขั้วไฟฟ้าที่ต่อกับขั้วบวกของแบตเตอรี่ เกิดปฏิกิริยาออกซิเดชัน เรียกขั้วไฟฟ้านี้ว่าแอโนด และเป็นขั้วบวก ส่วนขั้วไฟฟ้าที่ต่อกับขั้วลบของแบตเตอรี่เกิดปฏิกิริยารีดักชัน เรียกขั้วไฟฟ้านี้ว่าแคโทด และเป็นขั้วลบ
ขั้วไฟฟ้า (Electrode) คือแผ่นตัวนำที่จุ่มในสารละลายอิเล็กโทรไลต์ แล้าต่อกับเซลล์ไฟฟ้าหรือแบตเตอรี่ แบ่งเป็นแอโนด และ แคโทด
สารละลายอิเล็กโทรไลต์ คือสารละลายที่นำไฟฟ้าได้ เพราะมี Iron (+) + Iron(-)
Iron (+) วิ่งไปรับอิเล็กตรอนที่ขั้วลบ เกิดปฏิกิริยารีดักชัน จึงเรีบกขั้วลบว่า แคโทด และเรียกไอออนบวกว่า แคตไอออน (cathion)
Iron (-) วิ่งไปให้ e- ที่ขั้วบวกเกิดปฏิกิริยาออกซิเดชัน เรียกว่า แอโนด และเรียก Iron (-) ว่า แอนไอออน (Anion)
ดังนั้น ที่Anode มี Anion คือ ไอออนลบ และที่ Cathode มี Cathion คือ Ion บวก
Anode (oxidation) ตรงกับขั้วบวก Cathode (Reduction) ตรงกับขั้วลบ
กลับไปที่เนื้อหา
บทเรียนที่ 7 การแยกสารละลายด้วยไฟฟ้า
การแยกสารละลาย CuSO4 ด้วยแสไฟฟ้า
สารละลาย CuSO4เป็นอิเล็กโทรไลต์ ประกอบด้วย Cu2+และ มี H2O เป็นตัวทำละลายซึ่งอยู่ในรูปโมเลกุลที่เป็นกลางทางไฟฟ้า เมื่อผ่านกระแสไฟฟ้าจากแบตเตอรี เข้าไปในอุปกรณ์แยกสารละลายด้วยกระแสไฟฟ้า มีปฏิกิริยาเกิดขึ้นดังนี้
แคโทด (ขั้วที่ต่ออยู่กับขั้วลบของแบตเตอรี)
ทั้ง Cu2+และ H2O มีโอกาสรับอิเล็กตรอนจากแบตเตอรี แต่ค่า EO ของสองครึ่งปฏิกิริยาเป็นดังนี้
Cu2+(aq) + 2e–------> Cu(s) EO = +0.34 V
2H2O(l) + 2e–------> H2(g) + 2OH–(aq) EO = –0.83 V
จากค่า EO แสดงว่า Cu2+ในสารละลายรับอิเล็กตรอนได้ดีกว่า H2O ดังนั้น Cu2+ จึงเกิดปฏิกิริยารีดักชันได้โลหะ Cu
แอโนด (ขั้วที่ต่ออยู่กับขั้วบวกของแบตเตอรี)
ในสารละลายมี และ H2O ที่มีโอกาสให้อิเล็กตรอนหรือเกิดปฏิกิริยาออกซิเดชัน แต่ค่า EO ของสองครึ่งปฏิกิริยาเป็นดังนี้
S2O82-(aq) + e–(aq)------>SO42- EO = +2.01 V
O2(g) + 2H+(aq) + 2e–------> H2O(l) EO = +1.23 V
เมื่อเขียนสมการใหม่เป็นปฏิกิริยาออกซิเดชันเพื่อให้สอดคล้องกับปฏิกิริยาที่จะเกิดขึ้นที่แอโนด ค่าศักย์ไฟฟ้าของครึ่งเซลล์จะมีเครื่องหมายตรงข้ามกับ EO ของสมการเดิมดังนี้
SO42------->S2O82-(aq) + e–(aq) EO = –.2.01 V
H2O(l)------> O2(g) + 2H+(aq) + 2e– EO = –1.23 V
ศักย์ไฟฟ้าออกซิเดชันของ H2O มีค่าสูงกว่าของ แปลความหมายได้ว่า H2O ให้อิเล็กตรอนได้ดีกว่า ดังนั้นที่แอโนด H2O จึงให้อิเล็กตรอนเกิดเป็น H+กับแก๊ส O2ซึ่งเมื่อทดสอบแก๊สที่เกิดขึ้นจะช่วยให้ไฟติด
ถึงแม้ในปฏิกิริยาจะมี H+ เกิดขึ้นด้วย และอาจรับอิเล็กตรอนเกิดเป็นแก๊สไฮโดรเจน แต่เมื่อเปรียบเทียบค่า EO จากครึ่งปฏิกิริยาต่อไปนี้
Cu2+(aq) + 2e–------> Cu(s) EO = +0.34 V
2H+(aq) + 2e–-----> H2(aq) EO = 0.00 V
จากค่า EO แสดงว่า Cu2+รับอิเล็กตรอนได้ดีกว่า H+ดังนั้น H+ ไม่เกิดปฏิกิริยา ปฏิกิริยาการแยกสารละลาย CuSO4ด้วยกระแสไฟฟ้าสรุปได้ดังนี้
แอโนด : H2O(l)--------> O2(g) + 2H+(aq) + 2e–
แคโทด : Cu2+(aq) + 2e– ------> Cu(s)
ปฏิกิริยารวม :Cu2+(aq)+ H2O(l)------> Cu2+(aq)+O2(g)+2H+(aq)
เมื่อหาค่าศักย์ไฟฟ้าของเซลล์อิเล็กโทรไลต์ในการทำอิเล็กโทรลิซิสสารละลาย CuSO4โดยคิดจากผลต่างระหว่างศักย์ไฟฟ้ารีดักชันมาตรฐานที่แคโทดกับแอโนดจะได้ผลดังนี้
E0cell = E0cathode – E0anode
= (+0.34) – (+1.23)
= –0.89 V
ค่าศักย์ไฟฟ้าของเซลล์อิเล็กโทรไลต์มีค่าติดลบ แสดงว่าปฏิกิริยาเกิดเองไม่ได้ ต้องให้พลังงานเข้าไป ซึ่งก็คือใช้พลังงานไฟฟ้าทำให้เกิดปฏิกิริยาเคมี นั่นคือการแยกสารละลาย CuSO4 ด้วยกระแสไฟฟ้าต้องใช้พลังงานมากกว่า 0.89 V จึงจะมีปฏิกิริยาเคมีเกิดขึ้น
กลับไปที่เนื้อหา
บทเรียนที่ 8 เซลลืกัลวานิก(ทบทวน)

เป็นเซลล์ไฟฟ้าเคมีที่เกิดปฏิกิริยาเคมีแล้วให้กระแสไฟฟ้า ตัวอย่างเช่น เซลล์ไฟฟ้าเคมี ถ่านไฟฉาย แบตเตอรี่รถยนต์ และเซลล์เชื้อเพลิงที่มนุษย์อวกาศใช้ในการเดินทางไปสำรวจดวงจันทร์(เกิดปฏิกิริยาเคมี ได้กระแส)
การสร้างเซลล์กัลวานิก
นำโลหะต่างชนิดกันจุ่มในภาชนะทีบรรจุสารละลายที่มีอิออนของโลหะนั้น เช่น โลหะ A จุ่มใน A2+ และโลหะ B จุ่มใน B2+ เป็นต้น และภาชนะ 2 ใบนี้มีสะพานอิออนเชื่อมถึงกัน แล้วต่อลวดตัวนำจากขั้วทั้งสองเข้ากับโวลต์มิเตอร์ (volt meter) ซึ่งมีเข็มแสดงทิศทางการไหลของอิเล็กตรอน พบว่าเข็มกระดิกแสดงว่าอิเล็กตรอนไหล

จากรูปพบว่าเข็มของโวลต์มิเตอร์เบนจาก A ไปยัง B แสดงว่าอิเล็กตรอนไหลจาก A ไปยัง B เราต้องการทราบสิ่งต่อไปนี้
1. ขั้วบวกและขั้วลบ
1.1 ขั้วบวก คือ ขั้วที่มีอิเล็กตรอนหนาแน่นน้อยกว่า หรือขั้ว e ไหลเข้า ได้แก่ ขั้ว B
1.2 ขั้วลบ คือ ขั้วที่มีอิเล็กตรอนหนาแน่นมากกว่า หรือขั้ว e ไหลออก ได้แก่ ขั้ว A
2. ขั้วแอโนด (Anode) และขั้วแคโทด (Cathode)
2.1 แอโนด คือขั้วที่เกิดปฏิกิริยาออกซิเดชัน ได้แก่ ขั้ว A เพราะให้ e
2.2 แคโทด คือขั้วที่เกิดปฏิกิริยารีดักชัน ได้แก่ ขั้ว B เพราะรับ e
3. แผนภาพเซลล์กัลวานิก เขียนได้ดังนี้
3.1 เขียนครึ่งเซลล์แอโนดไว้ทางซ้าย ครึ่งเซลล์แคโทดไว้ทางขวา คั่นกลางด้วยสะพานอิออน ซึ่งใช้เครื่องหมาย || หรือ //
3.2 สำหรับครึ่งเซลล์แอโนดและแคโทดเขียนอิเล็กโทรดไว้ซ้ายสุดและขวาสุด ภายในครึ่งเซลล์ถ้าต่างวัฏภาคกันใช้เครื่องหมาย / คั่น
3.3 สารละลายที่ทราบความเข้มข้นให้เขียนระบุไว้ในวงเล็บ
3.4 ถ้าครึ่งเซลล์ที่เป็นก๊าซให้ระบุความดันลงในวงเล็บด้วย
ตัวอย่าง การเขียนแผนภาพเซลล์ไฟฟ้าเคมี
1. A | A2+(aq) || B2+(aq) | B หรือ A | A2+ || B2+ | B
2. Zn | Zn2+(0.1 M) || Cu2+(0.1 M) | Cu
3. Pt | H2(1 atm) | H+(1 M) || Cu2+ | Cu(s)
4. ปฏิกิริยาที่เกิดในเซลล์ไฟฟ้าเคมี
ปฏิกิริยาครึ่งเซลล์
4.1 แอโนด เกิดปฏิกิริยา Oxidation
4.2 แคโทด เกิดปฏิกิริยา Reduction
ปฏิกิริยาทั้งเซลล์ เป็นปฏิกิริยา Redox
5. สมการแสดงปฏิกิริยา
สมการแสดงปฏิกิริยาครึ่งเซลล์
แอโนด (Oxidation) A ----> A2+ + 2e ........(1)
แคโทด (Reduction) B2+ + 2e ------> B ........(2)
สมการแสดงทั้งเซลล์เป็น Redox (ทำให้ e หมดไป) (1) + (2)

6. สารใดให้อิเล็กตรอนง่ายกว่าหรือเป็นตัวรีดิวซ์ดีกว่า โลหะ A > โลหะ B
7. สารใดเป็นตัวชิงอิเล็กตรอนดีกว่าหรือเป็นตัวออกซิไดซ์ดีกว่า B2+ > A2+
8. ศักย์ไฟฟ้าใครสูงกว่า ศักย์ไฟฟ้าที่ขั้วบวกสูงกว่าศักย์ไฟฟ้าที่ขั้วลบคือ B > A ดังนั้น กระแสจะไหลจาก B ไปยัง A สวนทางกับการเคลื่อนที่ของอิเล็กตรอน
ความต่างศักย์ = ศักย์ที่ขั้วบวก - ศักย์ที่ขั้วลบ
9. เข็มจะไม่กระดิกในกรณีที่ศักย์ทั้งสองขั้วเท่ากัน
กลับไปที่เนื้อหา
บทเรียนที่ 9 ศักย์ไฟฟ้าครึ่งเซลล์มาตรฐาน

การหาค่าศักย์ไฟฟ้าครึ่งเซลล์มาตรฐานหาโดยตรงไม่ได้ต้องมีอิเล็กโทรดมาเปรียบเทียบ (Reference Electrode) ได้แก่
1. โลหะตะกั่ว
2. ก๊าซ H2 แล้วกำหนดให้ศักย์ของครึ่งเซลล์เปรียบเทียบเท่ากับศูนย์
แต่โดยทั่วไปไม่นิยมใช้โลหะเป็นอิเล็กโทรดเปรียบเทียบ เนื่องจากควบคุมความบริสุทธิ์ยากจึงหันมาให้ใช้ก๊าซ H2 แทน
การใช้ก๊าซ H2 เป็นอิเล็กโทรดเปรียบเทียบ ตามปกติก๊าซ H2 ไม่นำไฟฟ้าและเกิดปฏิกิริยายาก จึงต้องใช้โลหะ Pt เป็นขั้วไฟฟ้าปละมี Pt Black เคลือบอยู่เพื่อช่วยให้เกิดปฏิกิริยาง่ายขึ้น จุ่มในสารละลายของกรด HCl และมีท่อก๊าซ H2 ผ่านลงไป
 |
จากรูป ขั้วลบ(Anode) คือ H2 ขั้วบวก(Cathode) คือ Cu แผนภาพเซลล์ไฟฟ้าเคมี Pt(s) | H2(g) | H+(aq) || Cu2+(aq) | Cu(s) ศักย์ไฟฟ้าของเซลล์ = ศักย์ไฟฟ้าที่แคโทด(ขั้วบวก) - ศักย์ที่แอโนด(ขั้วลบ) E(เซลล์) = ศักย์ Cu - ศักย์ H2 E(เซลล์) = ศักย์ Cu - 0 |
ดังนั้น ศักย์ครึ่งเซลล์ของ Cu = + (มีค่าเป็นบวกแสดงว่า Cu2+ ชิง e ดีกว่า H+) แต่ค่าศักย์ไฟฟ้าครึ่งเซลล์ (E) ขึ้นอยู่กับองค์ประกอบหลายอย่างคือ
1. ความเข้มข้นของสารละลาย
2. อุณหภูมิ
3. ความดัน (ถ้าเป็นก๊าซ)
4. ชนิดของขั้ว
จากองค์ประกอบทั้ง 5 ข้อ จึงต้องกำหนดมาตรฐานโดยใช้ความดัน 1 โมล/ลิตร , T = 0.25 0C, ความดัน = 1 บรรยากาศ (E -> E0)
ดังนั้น เราจึงเรียกศักย์ไฟฟ้าครึ่งเซลล์ ณ ภาวะมาตรฐานว่า ศักย์ไฟฟ้าครึ่งเซลล์มาตรฐาน (E0) และค่า E0 ไม่ขึ้นกับปริมาณ
สรุป
1. ถ้า E0 เป็นบวกแสดงว่าครึ่งเซลล์นั้นชิง e- ได้ดีกว่าครึ่งเซลล์ H2
ถ้า E0 เป็นลบแสดงว่าครึ่งเซลล์นั้นชิง e- สู้ครึ่งเซลล์ H2 ไม่ได้
2. ถ้า E0 บวกมากชิง e- ดีกว่าบวกน้อย > 0 > ลบน้อย > ลบมาก
กลับไปที่เนื้อหา
บทเรียนที่ 10 ประโยชน์ของค่า E

1. ใช้เรียงลำดับการชิง e หรือตัวออกซิไดซ์
2. ใช้เรียงลำดับการให้ e หรือตัวรีดิวซ์
3. ใช้บอกให้ทราบถึงขั้วบวก ขั้วลบ แอโนด แคโทด ความต่างศักย์ แผนภาพ ปฏิกิริยา และอื่นๆ เมื่อนำครึ่งเซลล์มาต่อเข้าด้วยกัน
4. ใช้บอกให้ทราบว่าโลหะใดใช้ป้องกันการผุของ Fe ได้ (โดยเสีย e- ง่ายกว่า Fe)
5. ใช้บอกให้ทราบว่าโลหะใดทำให้ Fe ผุเร็วขึ้น (โดยเสีย e- ยากกว่า Fe)
6. ใช้ทำนายการเกิดปฏิกิริยาได้หรือไม่ได้ โดยการหาค่า E0 ของเซลล์ตามโจทย์กำหนด ถ้า E0 ของเซลล์เป็นวกเกิดได้ ถ้า E0 ของเซลล์เป็นลบเกิดไม่ได้ (หมายถึง เกิดตรงกันข้าม) แต่ไม่บอกว่าเกิดเร็วหรือช้า (อัตราเร็ว) หรือเกิดมากหรือน้อย
ตัวอย่าง จากค่า E0 ต่อไปนี้
| Zn2+ + 2e | ---> Zn | E0 = -0.76 |
| Fe2+ + 2e | ---> Fe | E0 = -0.44 |
| Cl2 + 2e | ---> 2Cl- | E0 = +1.36 |
| H2 + 2e | ---> 2H+ | E0 = 0.00 |
| Cu2+ + 2e | ---> Cu | E0 = +0.34 |
1. การเรียงลำดับการชิง e หรือตัวออกซิไดซ์จากมากไปน้อย (ซ้ายมือ) + มาก ชิง e - ดีกว่า + น้อย
Cl2 , Cu2+ , H+ , Fe2+ , Zn2+
2. การเรียงลำดับการให้ e จากง่ายไปยากหรือตัวรีดิวซ์จากมากไปน้อย (ขวามือ)
Zn , Fe , H2 , Cu , Cl-
3. เมื่อนำครึ่งเซลล์ Zn ต่อกับครึ่งเซลล์ Cu การหาขั้วบวก ขั้วลบ แอโนด แคโทด ศักย์ของเซลล์(ความต่างศักย์) หาได้ดังนี้

| ความต่างศักย์ | = ศักย์ที่ขั้วบวก (แคโทด) - ศักย์ที่ขั้วลบ (แอโนด) = ศักย์ของเซลล์ (E0 เซลล์) = Cu - Zn = +0.34 - (-0.76) = +1.10 Volts |
แผนภาพเซลล์กัลวานิก Zn / Zn2+ || Cu2+ / Cu
| ปฏิกิริยา | ครึ่งเซลล์แอโนด Zn ---> Zn2+ + 2e ครึ่งเซลล์แคโทด Cu2+ + 2e ---> Cu ทั้งเซลล์ (Redox) ทำให้ หมดไป (1) + (2) Zn + Cu2+ ---> Cu + Zn2+ |
4. โลหะที่ป้องกันการผุกร่อนของ Fe ได้ (โลหะที่เสีย e ง่ายกว่า Fe) ก็คือ โลหะ Zn
5. โลหะที่ทำให้ Fe ผุเร็วขึ้น (โลหะที่เสีย e ยากกว่า Fe) ก็คือ โลหะ Cu
หลักการใช้ค่า E0 ทำนายการเกิดปฏิกิริยารีดอกซ์
1. เขียนสมการตามโจทย์กำหนด
2. หาขั้วแคโทด (ขั้วที่เกิดปฏิกิริยา Reduction) และขั้วแอโนด (ขั้วที่เกิดปฏิกิริยา Oxidation) ตามโจทย์กำหนดในสารตั้งต้น
3. หาค่า E0 ของเซลล์จากสมการ E0 เซลล์ = E0 แคโทด - E0 แอโนด
ถ้า E0 ของเซลล์ออกมาเป็นบวกแสดงว่าปฏิกิริยานี้เกิดขึ้นได้ เช่น
Zn + 2H+ ----> Zn2+ + H2 E0 เซลล์ = +0.76 volts
Cu + 2H+ ----> Cu2+ + H2 E0 เซลล์ = -0.34 volts
ถ้า E0 ของเซลล์ออกมาเป็นลบแสดงว่าปฏิกิริยาไม่เกิดแต่เกิดตรงกันข้าม เช่น
Cu2+ + H2 ----> Cu + 2H+ E0 เซลล์ = +0.34 volts
กลับไปที่เนื้อหา
บทเรียนที่ 11 เซลล์ปฐมภูมิ

เป็นเซลล์ไฟฟ้าที่เมื่อเกิดปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นอย่างสมบูรณ์แล้วไม่สามารถนำกลับมาใช้ใหม่ได้ เช่น ถ่านไฟฉาย เซลล์แอลคาไลน์ เซลล์ปรอท เซลล์เงิน เป็นต้น เซลล์ไฟฟาประเภทนี้เมื่อสร้างเสร็จสามารถนำมาใช้ได้เลย
| ถ่านไฟฉายหรือเซลล์แห้ง |  |
ปฏิกิริยาที่เกิด
| 1. Anode (Oxidation) | Zn | --> | Zn2+ + 2e- |
| 2. Cathode (Reduction) | 2MnO2 + 2NH4 + + 2e- | ---> | Mn2O3 + H2O + 2NH3 |
ปฏิกิริยารวม (Redox) โดย (1) + (2) ทำให้ e- หมดไป
| Zn + 2MnO2 + 2NH4+ | ---> | Zn2+ + Mn2O3 + H2O + 2NH3 |
Zn2+ รวมกับ NH2 เกิดสารประกอบเชิงซ้อน [Zn(NH3)4]2+ และ [Zn(NH3)2(H2O)]2+] เพื่อรักษาความเข้มข้นของ Zn2+ & NH3 เซลล์ชนิดนี้มีแรงเคลื่อนประมาณ 1.5 Volts
เซลล์อัลคาไลน์ มีส่วนประกอบและหลักการเหมือนกับถ่านไฟฉายแต่ใช้ด่าง KOH เป็นอิเล็กโทรไลต์แทน NH4Cl
ปฏิกิริยาที่เกิด
| 1. Anode (Oxidation) | Zn + 2OH- | --> | ZnO + H2O + 2e- |
| 2. Cathode (Reduction) | 2MnO2 + H2O + + 2e- | ---> | Mn2O3 + 2OH- |
ปฏิกิริยารวม (Redox) โดย (1) + (2) ทำให้ e- หมดไป
| Zn + 2MnO2 | ---> | ZnO + Mn2O3 |
เซลล์อัลคาไลน์มีศักย์ไฟฟ้าเท่ากับเซลล์แห้งแต่ใช้ได้นานกว่า เพราะน้ำและไฮดรอกไวด์ (OH-) ที่เกิดขึ้นในปฏิกิริยาหมุนเวียนกลับไปเป็นสารตั้งต้นของปฏิกิริยาได้อีก จึงทำให้ศักย์คงที่ตลอดการใช้งานและใช้ได้นานกว่า
เซลล์ปรอท มีหลักการเหมือนกับเซลล์อัลคาไลน์ แต่ใช้เมอร์คิวรี (II) ออกไซด์ ( HgO) แทนแมงกานีส (IV) ออกไซด์ (MnO2)
ปฏิกิริยาที่เกิด
| 1. Anode (Oxidation) | Zn + 2OH- | --> | ZnO + H2O + 2e- |
| 2. Cathode (Reduction) | HgO + H2O + + 2e- | ---> | Hg + 2OH- |
ปฏิกิริยารวม (Redox) โดย (1) + (2) ทำให้ e- หมดไป
| Zn + HgO | ---> | ZnO + Hg |
เซลล์ปรอทให้ศักย์ไฟฟ้าประมาณ 1.3 Volts ให้กระแสไฟฟ้าต่ำ แต่มีข้อดีที่สามารถให้ศักย์ไฟฟ้าเกือบคงที่ตลอดอายุการใช้งาน นิยมใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ
เซลล์เงิน มีส่วนประกอบเช่นเดียบกับเซลล์ปรอท แต่ใช้ซิลเวอร์ออกไวด์ ( Ag2O) แทนเมอร์คิวรี (II) ออกไซด์ ( HgO)
ปฏิกิริยาที่เกิด
| 1. Anode (Oxidation) | Zn + 2OH- | --> | ZnO + H2O + 2e- |
| 2. Cathode (Reduction) | Ag2O + H2O + + 2e- | ---> | 2Ag + 2OH- |
ปฏิกิริยารวม (Redox) โดย (1) + (2) ทำให้ e- หมดไป
| Zn + Ag2O | ---> | ZnO + 2Ag |
เซลล์เงินให้ศักย์ไฟฟ้าประมาณ 1.5 Volts มีขนาดเล็กและมีอายุการใช้งานได้นานมากแต่มีราคาแพง จึงใช้กับอุปกรณ์หรือเครื่องใช้ไฟฟ้าบางชนิด เช่น เครื่องคิดเลข นาฬิกา
กลับไปที่เนื้อหา
บทเรียนที่ 12 การผุกร่อนของโลหะและการป้องกัน

การผุกร่อนของโลหะที่พบบ่อยในชีวิตประจำวันได้แก่ เหล็กเป็นสนิม (สนิมเหล็กเป็นออกไซด์ของเหล็ก Fe2O3.xH2O) ซึ่งเกิดจากสาเหตุหลายประการ ตัวอย่างเช่น การที่อะตอมของโลหะที่ถูกออกซิไดส์แล้วรวมตัวกับออกซิเจนในอากาศเกิดเป็นออกไซด์ของโลหะนั้น เช่น สนิมเหล็ก(Fe2O3) สนิมทองแดง (CuO) หรือสนิมอลูมิเนียม (Al2O3) การเกิดสนิมมีกระบวนการที่ซับซ้อนมากและมีลักษณะเฉพาะตัวดังนี้
1. การผุกร่อนของโลหะ คือปฏิกิริยาเคมีที่เกิดระหว่างโลหะกับภาวะแวดล้อม
2. ภาวะแวดล้อมที่ทำให้ผุกร่อน คือ ความชื้น และออกซิเจน(H2O, O2) หรือ H2O กับอากาศ
3. ปฏิกิริยาเคมีที่เกิดในการผุกร่อน เป็นปฏิกิริยารีดอกซ์
3.1 โลหะที่เกิดปฏิกิริยา Oxidation (ให้อิเล็กตรอน)
3.2 ภาวะแวดล้อมเป็นฝ่ายรับอิเล็กตรอน เกิดปฏิกิริยา Reduction
4. สมการแสดงปฏิกิริยาการผุกร่อน (เกิดจากการทดลอง)
โลหะ + ภาวะแวดล้อม -----> Ion ของโลหะ + เบส
Fe (s) + H2O (l) + O2 (g) -----> Fe2+ (aq) + OH- (aq)
Fe2+ ทดสอบโดยใช้สารละลาย K3Fe(CN)6 จะได้สีน้ำเงิน ถ้าสีน้ำเงินเข้ม แสดงว่ามี Fe2+ มาก ถ้าจางมี Fe2+ น้อย
เบส(OH-) ทดสอบโดยสารละลายฟินอล์ฟทาลีน ได้สีชมพู
5. ในการ Balance สมการ
เมื่อเหล็กสัมผัสกับอากาศและความชื้น อะตอมของเหล็กจะเกิดปฏิกิริยาออกซิเดชันดังสมการ
Fe (s) ------> Fe2+ (aq) + 2e ………….(1) (Oxidation)
น้ำและออกซิเจนรับอิเล็กตรอนจากเหล็ก ดังสมการ
2H2O (l) + O2 (g) + 4e ------> 4OH- (aq) ……….(2) (Reduction)
(1) * 2 + (2) ; 2Fe + 2H2O + O2 -------> 2Fe2+ + 4OH- (Redox)
การป้องกันสนิมเหล็ก
1. ทาสี ทาน้ำมัน การรมดำ และการเคลือบพลาสติก เป็นการป้องกันการถูกกับ O2 และความชื้น ซึ่งเป็นการป้องกันการเกิดสนิมของโลหะได้และเป็นวิธีที่สะดวกและให้ผลดีในการป้องกันสนิม
2. โลหะบางชนิดมีสมบัติพิเศษ กล่าวคือเมื่อทำปฏิกิริยากับออกซิเจนจะเกิดเป็นออกไซด์ของโลหะเคลือบอยู่บนผิวของโลหะนั้นและไม่เกิดการผุกร่อนอีกต่อไป โลหะที่มีสมบัติดังกล่าวได้แก่ อลูมิเนียม ดีบุก และสังกะสี การชุบ หรือเคลือบโดยโลหะที่ Oxide ของโลหะนั้นคงตัว สลายตัวยาก จะเป็นผิวบางๆ คลุมผิวโลหะอีกที ได้แก่ Cr (โครเมียม) และอลูมิเนียม(Al) เป็นต้น ดังนั้น Cr2O3.Al2O3 สลายตัวยาก เรียกชื่อว่าวิธี อโนไดซ์ (Anodize)
หมายเหตุ เหล็กกล้าไม่เกิดสนิม (stainless steel) เป็น Fe ผสม Cr
3. การผุกร่อนของโลหะมีปฏิกิริยาเกิดขึ้นเช่นเดียวกับแอโนดในเซลล์อิเล็กโทรไลต์ ดังนั้นถ้าไม่ต้องการให้เกิดการผุกร่อนจึงต้องให้โลหะนั้นมีสภาวะเป็นแคโทดหรือคล้ายกับแคโทด โดยใช้โลหะที่เสีย e- ง่ายกว่าเหล็กไปอยู่กับเหล็ก ได้แก่ Fe ชุบ Zn สำหรับมุงหลังคา การฝังถุง Mg ตามท่อ หรือการผูก Mg ตามโครงเรือ จะทำให้ Fe ผุช้าลง เนื่องจาก Zn & Mg เสีย e ง่ายกว่า Fe จะเสีย e แทน Fe เรียกชื่อวิธี แคโธดิก (Cathodic)
4. การป้องกันการผุกร่อนของโลหะในระบบหล่อเย็นแบบปิด
เครื่องยนต์ที่ใช้ในรถยนต์หรือเครื่องมือผลิตกระแสไฟฟ้าจะใช้ระบบหล่อเย็นแบบปิดเพื่อรักษาอุณหภูมิของเครื่องยนต์ไม่ให้สูงมากเกินไป สารหล่อเย็นที่ใช้คือน้ำซึ่งมีออกซิเจนละลายอยู่ ถ้าเครื่องยนต์มีโลหะผสมของอลูมิเนียม ออกซิเจนที่ละลายอยู่ในน้ำจะถูกใช้ในการสร้างฟิล์มอลูมิเนียมออกไซด์ และฟิล์มนี้จะป้องกันการผุกร่อนเครื่องยนต์ได้ แต่ถ้าเครื่องยนต์มีส่วนประกอบที่เป็นโลหะผสมของเหล็ก ส่วนประกอบของเครื่องยนต์ที่สัมผัสกับน้ำจะเกิดการผุกร่อนได้ เนื่องจากออกไซด์ของเหล็กไม่มีสมบัติในการเป็นสารเคลือบผิว จึงต้องเติมสารยับยั้งการกัดกร่อนซึ่งประกอบด้วยสารประกอบของไนไตรต์โบแรกซ์ สารนี้จะทำให้น้ำในระบบหล่อเย็นมี pH สูงกว่า 8.5 และทำให้โลหที่เป็นส่วนประกอบของเครื่องยนต์เกิดปฏิกิริยาออกซิเดชันได้ยาก การผุกร่อนของโลหะจึงลดลง นอกจากนี้การใช้ระบบปิดมีผลดีอีกประการหนึ่งคือเป็นการจำกัดปริมาณของออกซิเจนที่ละลายลงไปในน้ำจึงทำให้การผุกร่อนของโลหะลดลง
กลับไปที่เนื้อหา



