โปรตีน
บทเรียนที่ 1 กรดอะมิโนและพันธะเปบไทด์
1.1 กรดอะมิโนและพันธะเฟปไทด์
โปรตีนประกอบด้วยธาตุคาร์บอน ไฮโดรเจน ออกซิเจน ไนโตรเจน เป็นองค์ประกอบหลัก นอกจากนี้อาจจะมีธาตุอื่น ๆ เป็นองค์ประกอบอยู่ด้วย เช่น กำมะถัน ฟอสฟอรัส เหล็ก สังกะสี และทองแดง พบในอาหารประเภทเนื้อสัตว์ นม ไข่ ถั่ว และงา
การทดสอบโปรตีน
ปฏิกิริยาไบยูเรต (Biuret reaction)
การทดสอบโปรตีนสามารถทดสอบได้ด้วยปฏิกิริยาไบยูเรต โดยให้โปรตีนทำปฏิกิริยากับสารละลาย CuSO4ในสารละลายเบส NaOH หรือ KOH จะได้สารสีน้ำเงินม่วง โดยปฏิกิริยา CuSO4ในสารละลายเบสจะทำปฏิกิริยากับองค์ประกอบย่อยของโปรตีนคือ กรดอะมิโน ได้สารสีน้ำเงินม่วง ซึ่งเป็นสารประกอบเชิงซ้อนระหว่าง Cu2+กับไนโตรเจนในสารที่มีพันธะเพปไทด์ตั้งแต่ 2 พันธะขึ้นไป
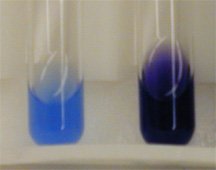
ปฏิกิริยาไบยูเรต
 |
 |
|
นมถั่วเหลือง (โปรตีนจากพืช) |
นมสด (โปรตีนจากสัตว์) |

ไข่ขาวและไข่แดงดิบ (โปรตีนจากสัตว์)
ปฏิกิริยาการทดสอบโปรตีนด้วยไบยูเรต
ต้องการขยายภาพวีดิโอให้เต็มจอ คลิกขวาที่วีดิโอ >> Zoom >> Full scene
ต้องการย่อวีดิโอ กด Esc
วิธีทดสอบ
1. ใส่น้ำกลั่น 5 cm3ลงในหลอดทดลองหลอดที่ 1 และใส่งสารละลายนมผงไร้ไขมันใส่ในหลอดทดลอง หลอดที่ 2 และ 3 หลอดละ 5 cm3
2. หยดสารละลายไบยูเร็ตส่วนที่ 1 (สารละลายเบส KOH เข้มข้น 15 %) จำนวน 10 หยด ลงในหลอดทดลองทั้ง 3 หลอด สังเกตผลการทดลอง
3. หยดสารละลายไบยูเร็ตส่วนที่ 2 (สารละลาย CuSO4เข้มข้น 3%) ลงในหลอดทดลองทั้ง 3 หลอด สังเกตผลการทดลอง
ผลการทดลอง
| การทดลองที่ | สาร | ผลการทดลองเมื่อเติมสารละลาย | ||
| KOH | CuSO4 | HCl | ||
| หลอดที่ 1 | น้ำกลั่น | สารละลายใสไม่มีสี | สารละลายเปลี่ยนเป็นฟ้า | - |
| หลอดที่ 2 | นม | เกิดตะกอนขุ่นขาว | ตะกอนเปลี่ยนสารสีม่วง | - |
| หลอดที่ 3 | นม | เกิดตะกอนขุ่นขาว | ตะกอนเปลี่ยนสารสีม่วง | ตะกอนสีม่วงมีสีจางลง |
หลอดที่ 1 ใส่น้ำกลั่น 5 cm3เมื่อหยดสารละลาย KOH ลงในหลอด สารละลายยังคงเป็นสารละลายใสไม่มีสี และเมื่อหยดสารละลาย CuSO4สารละลายเปลี่ยนเป็นสีฟ้า ซึ่งยังคงเป็นสีเดิมของ CuSO4แสดงว่าไม่เกิดปฏิกิริยา หลอดที่ 1 จึงเป็นหลอดควบคุม
หลอดที่ 2 เมื่อหยดสารละลาย KOH เกิดลักษณะขุ่นขาว แสดงว่านมเกิดการตกตะกอน และเมื่อเติมสารละลาย CuSO4เกิดสารสีม่วง แสดงว่านมซึ่งมีโปรตีนอยู่ ทำปฏิกิริยากับสารละลาย CuSO4ได้สารสีม่วง
หลอดที่ 3 เมื่อหยดสารละลาย KOH เกิดลักษณะขุ่นขาว แสดงว่านมเกิดการตกตะกอน และเมื่อเติมสารละลาย CuSO4เกิดสารสีม่วง แสดงว่านมซึ่งมีโปรตีนอยู่ ทำปฏิกิริยากับสารละลาย CuSO4ได้สารสีม่วงเช่นเดียวกับหลอดที่ 2 และเมื่อเติมสารละลาย HCl สารละลายสีม่วงมีสีจางลง แสดงว่ากรด HCl ได้ทำให้โมเลกุลของโปรตีนในนมแตกตัวมีขนาดโมเลกุลเล็กลง
ผลการทดสอบโปรตีนกับไบยูเร็ต ได้สารสีม่วง
โปรตีนเป็นสารที่มีมวลโมเลกุลสูง ประกอบด้วยกรดอะมิโนจำนวนมากเชื่อมต่อกันด้วยพันธะเพปไทด์ (Peptide bond) โปรตีนจัดเป็นพอลิเมอร์ธรรมชาติ
พันธะเพปไทด์ (Peptide bond)
พันธะเพปไทด์ เป็นพันธะที่เกิดขึ้นระหว่างอะตอมของคาร์บอนในหมู่คาร์บอกซิลของกรดอะมิโนโมเลกุลหนึ่งกับไนโตรเจนในหมู่อะมิโน (–NH2) ของกรดอะมิโนอีกโมเลกุลหนึ่ง
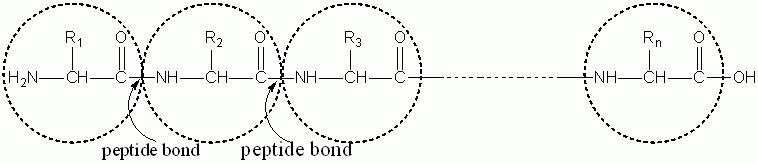
การเกิดพันธะเพปไทด์ (พันธะเอไมด์) ในโมเลกุลของโปรตีน
กลับไปที่เนื้อหา
บทเรียนที่ 2 กรดอะมิโน
กรดอะมิโน (Amino acid)
กรดอะมิโนเป็นกรดคาร์บอกซิลิกที่มีหมู่อะมิโน (–NH2) ที่ตำแหน่งแอลฟา (a) เรียกอีกอย่างหนึ่งว่ากรดแอลฟาอะมิโน กรดอะมิโนเป็นหน่วยที่เล็กที่สุดของโปรตีน มีโครงสร้างทั่วไปดังนี้
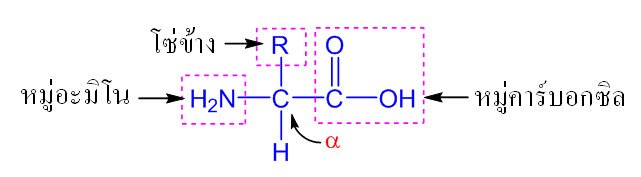
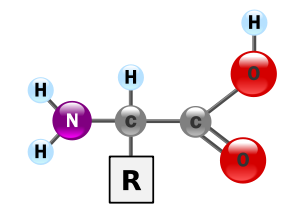
กรดอะมิโนมาตรฐาน (standard amino acid) มี 20 ชนิดโดยมีโครงสร้างดังต่อไปนี้
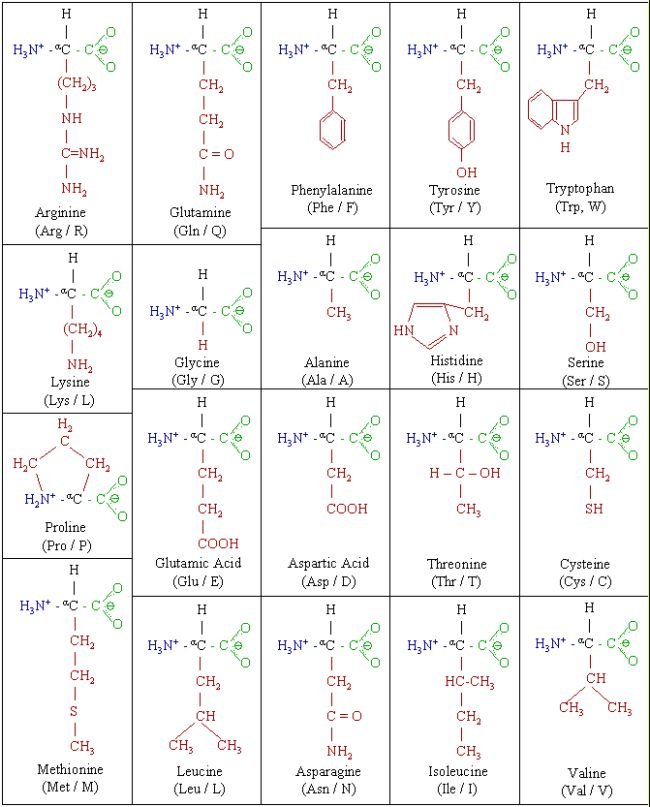
สามารถจำแนกกรดอะมิโนได้เป็นพวกๆ ตามชนิดของหมู่ R ดังนี้
1) หมู่R ที่ไม่มีขั้ว และเป็นอะลิฟาติก (nonpolar, aliphatic R groups)
ได้แก่ glycine, alanine, valine, leucine, methionine และ isoleucineGlycine เป็นกรดอะมิโนที่มีขนาดเล็กที่สุด และมีโครงสร้างง่ายที่สุด (เพราะมีหมู่แทนที่ (R group) เป็นไฮโดรเจนอะตอมเดียว) โดยหมู่แทนที่ของกรดอะมิโนในกลุ่มนี้มีแนวโน้มจะจับกลุ่มกันอยู่ภายในของก้อนโปรตีน ทั้งนี้เป็นเพราะ hydrophobic interaction ส่วนmethionine เป็นกรดอะมิโนที่ไม่ขั้วและมีหมู่แทนที่เป็นหมู่ thioether กรดอะมิโนตัวนี้เป็น 1 ใน 2 ของกรดอะมิโนที่มี sulfur อยู่ในโมเลกุล
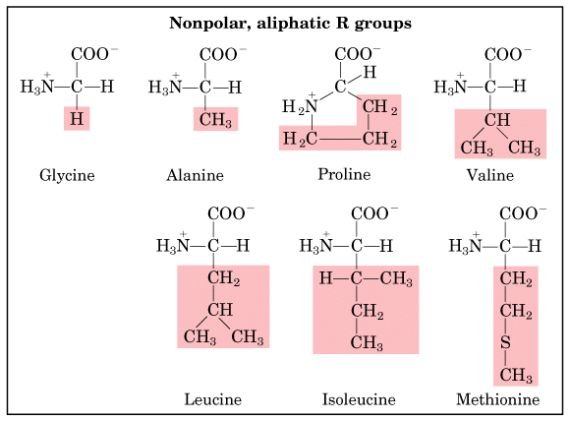
Amino acids with nonpolar, aliphatic R groups
2) หมู่ R ที่เป็น อะโรมาติก ( aromatic R groups) ได้แก่ phenylalanine, tyrosine และ tryptophan
กรดอะมิโนพวกนี้มีหมู่แทนที่ที่เป็นอะโรมาติก จึงมีลักษณะไม่มีขั้วและสามารถทำให้เกิด hydrophobic interaction ได้เช่นกัน หมู่ไฮดรอกซิลของ tyrosine สามารถเกิดพันธะไฮโดรเจนได้ และหมู่ไฮดรอกซิลนี้เป็นหมู่ที่ทำหน้าที่สำคัญในเอนไซม์บางตัวด้วย tyrosine และ tryptophan มีความมีขั้วมากกว่า phenylalanine เพราะ tyrosine มีหมู่ไฮดรอกซิล และ tryptophan มีไนโตรเจนใน indole ring
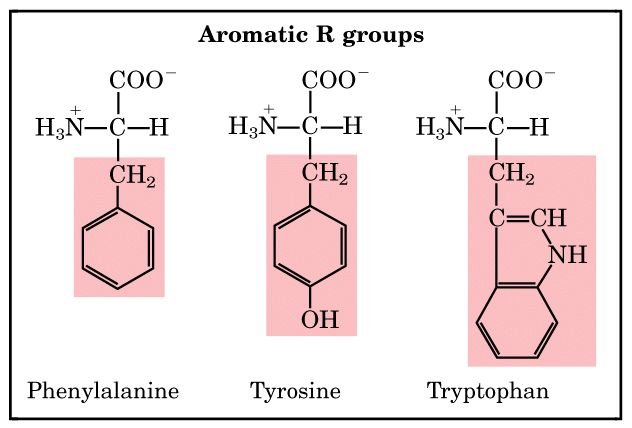
Amino acids with Aromatic R groups
3) หมู่ R ที่มีขั้ว, แต่ไม่มีประจุ ( polar, uncharged R groups) ได้แก่ serine, threonine, cysteine, proline, asparagines และ glutamine
หมู่ R ของกรดอะมิโนในกลุ่มนี้เป็น hydrophilic คือ ชอบน้ำ สามารถละลายน้ำได้ดี เพราะ functional group ของกรดอะมิโนในกลุ่มนี้สามารถเกิดพันธะไฮโดรเจนกับน้ำได้ ความมีขั้วของ serine และ threonine เกิดจากหมู่ไฮดรอกซิล ความมีขั้วของ cysteine เกิดจากหมู่ซัลฟไฮดริล ส่วนความมีขั้วของ asparagines และ glutamine เกิดจากหมู่เอไมด์ proline มีโครงสร้างโมเลกุลเป็นรูปวงและมีขั้วเพียงในระดับกลางๆ หมู่อะมิโนของ proline (ที่จริงเป็น imino group) อยู่ในสภาพที่ แข็งเกร็ง(rigid) ยืดหยุ่นไม่ได้มากนัก ทำให้เปปไทด์ส่วนที่มี proline ขาดความยืดหยุ่น (ก์คือเปลี่ยนแปลงรูปร่างของเปปไทด์ในบริเวณนี้มากนักไม่ได้)
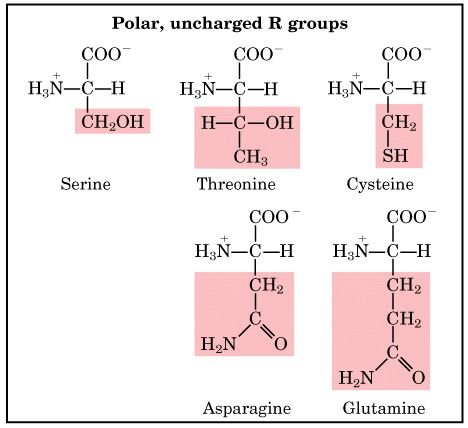
Amino acids with polar, uncharged R groups
Cysteine (กรดอะมิโนที่มี sulfur เป็นส่วนประกอบอีกตัวหนึ่ง, นอกเหนือจาก methionine) สามารถถูกออกซิไดส์ได้เป็น dimeric amino acid ที่เชื่อมต่อกันแบบโควาเลนต์ เรียกว่า cystine ซึ่งเป็น cysteine 2 โมเลกุลมาเชื่อมกันด้วย disulfide bond ในโปรตีนหลายๆตัว disulfide bond จะเป็นตัวเชื่อมสายโปรตีน
(ทั้งภายในสายโปรตีนเดียวกันและคนละสายกัน) ให้เชื่อมติดกัน
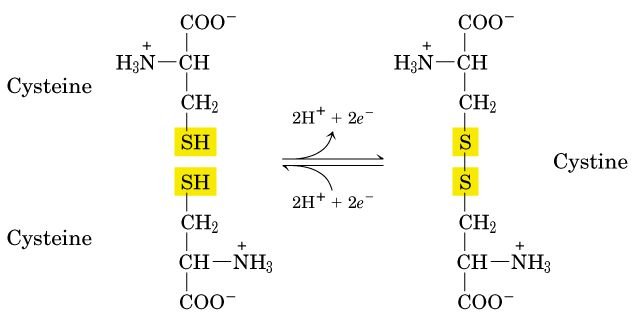
Cysteine 2 โมเลกุลทำปฏิกิริยาออกซิเดชั่น และเกิดdisulfide bondได้เป็น cystine
4) หมู่R ที่มีประจุบวก (positively (basic) R groups) ได้แก่ lysine, arginine และ histidine
หมู่ R ของกรดอะมิโนในกลุ่มนี้จะมีประจุบวกที่ pH 7.0 histidine เป็นกรดอะมิโนเพียงตัวเดียวที่สามารถแตกตัวได้ที่ pH เป็นกลาง (เพราะ pKaใกล้กับ 7.0) ในการเร่งปฏิกิริยาของเอนไซม์หลายชนิด ใช้ histidine ทำหน้าที่เป็นตัวรับ/ให้โปรตอน (proton donor/acceptor)
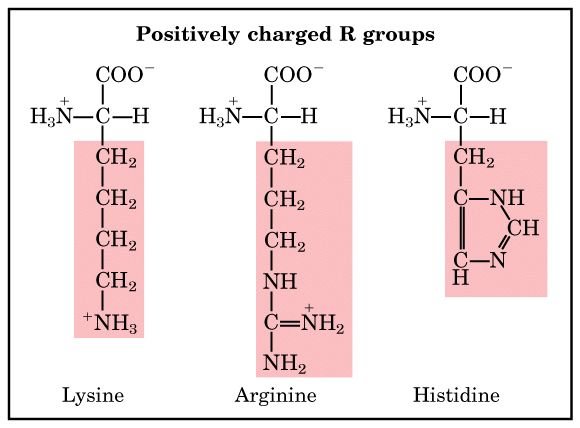
Amino acids with positively charged R groups
5) หมู่ R ที่มีประจุลบ (negatively charged (acid) R groups) ได้แก่ กรดอะมิโนสองชนิด คือ aspartate และ glutamate
กรดอะมิโนในกลุ่มนี้มีหมู่ R ที่มีประจุลบที่ pH 7.0 ทั้งนี้ เพราะมีหมู่คาร์บอกซิลอันที่สองอยู่ในหมู่ R
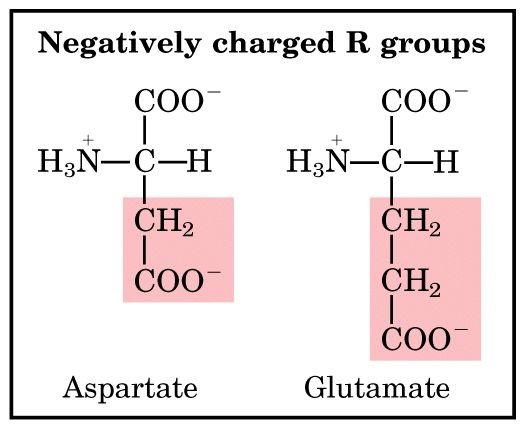
Amino acids with negatively charged R groups
กลับไปที่เนื้อหา
บทเรียนที่ 3 ชนิดและหน้าที่ของโปรตีน
ชนิดและหน้าที่ของโปรตีน
หน้าที่ของโปรตีนแต่ละชนิดขึ้นอยู่กับโครงสร้าง 3 มิติของโปรตีนนั้น ส่วนโครงสร้างของโปรตีนขึ้นอยู่กับกรดอะมิโนที่เป็นองค์ประกอบของสายพอลิเพปไทด์
โปรตีน แบ่งตามลักษณะการจัดตัวในโครงสร้างสามมิติ 2 ชนิด
1) โปรตีนก้อนกลม (globular protein) เกิดจากสายพอลิเพปไทด์รวมตัวม้วนพับพันกันและอัดแน่นเป็นก้อนกลม ละลายน้ำได้ดี ทำหน้าที่เกี่ยวกับกระบวนการเมทาบอลิซึมต่าง ๆ ที่เกิดขึ้นภายในเซลล์ ตัวอย่างเช่น เอนไซม์ ฮอร์โมนอินซูลิน ฮีโมโกลบิน โกลบูลินในพลาสมา
2) โปรตีนเส้นใย (Fibrous protein) เกิดจากสายพอลิเพปไทด์พันกันในลักษณะเหมือนเส้นใยยาว ๆ ละลายน้ำได้น้อย ส่วนใหญ่ทำหน้าที่เป็นโปรตีนโครงสร้าง เพราะมีความแข็งแรงและยืดหยุ่นสูง ตัวอย่างเช่น ไฟโบรอินในเส้นไหม อีลาสตินในเอ็น คอลลาเจนในเนื้อเยื่อเกี่ยวพัน เคราตินในผม ขน เล็บ ครีบ กีบสัตว์ ไมโอซินในกล้ามเนื้อ
โปรตีน สามารถแบ่งตามหน้าที่ได้ 6 ประเภท ซึ่งมีหน้าที่ และตัวอย่างดังนี้
|
ชนิดของโปรตีน |
หน้าที่ |
ตัวอย่างและแหล่งที่พบ |
|
โปรตีนเร่งปฏิกิริยา |
เร่งปฏิกิริยาในเซลล์สิ่งมีชีวิต |
–เอนไซม์ เช่น เอนไซม์อะไมเลส เอนไซม์ฟอสฟาเตส |
|
โปรตีนโครงสร้าง |
ให้ความแข็งแรงและช่วยคงรูปร่างโครงสร้างต่าง ๆ ของร่างกาย |
–คอลลาเจน ซึ่งพบในกระดูก เอ็น และเนื้อเยื่อเกี่ยวพัน – เคราติน พบในกระดูก ขน ผม เล็บ กีบสัตว์ ผิวหนัง |
|
โปรตีนขนส่ง |
ขนส่งสารไปสู่ส่วนต่าง ๆ ของร่างกาย |
– ฮีโมโกลบินในเซลล์เม็ดเลือดแดงพาออกซิเจนไปสู่เนื้อเยื่อต่าง ๆ –ทรานสเฟอริน นำธาตุเหล็กในน้ำเลือดจากบริเวณที่สะสมไปยังม้าม ตับและกระดูก |
|
โปรตีนสะสม |
สะสมธาตุต่าง ๆ |
–เฟอริทิน สะสมธาตุเหล็กในตับ ม้าม และไขกระดูก |
|
โปรตีนป้องกัน |
ป้องกันและกำจัดสิ่งแปลกปลอมที่เข้ามาภายในเซลล์ เช่น แบคทีเรีย |
–แอนติบอดี |
|
โปรตีนฮอร์โมน |
ทำหน้าที่แตกต่างกันตามชนิดของฮอร์โมน เช่น – ควบคุมการเจริญเติบโตของร่างกาย – ควบคุมการเผาผลาญคาร์โบไฮเดรต |
d – โกรทฮอร์โมน (Growth hormone ) – อินซูลิน กลูคากอน สร้างที่ตับอ่อน |
กลับไปที่เนื้อหา
บทเรียนที่ 4 ความสำคัญของกรดอะมิโน
ความสำคัญของกรดอะมิโน
โปรตีนประกอบด้วยกรดอะมิโน 20 ชนิด (standard amino acids) ซึ่งแบ่งได้เป็น 2 ประเภทได้แก่กรดอะมิโนจำเป็น (essential amino acid) และกรดอะมิโนไม่จำเป็น (non-essential amino acid) กรดอะมิโนจำเป็น เป็นกรดอะมิโนที่ร่างกายสร้างเองไม่ได้ ต้องได้รับจากอาหารเท่านั้น มี 10 ชนิด ได้แก่ methionine arginine threonine tryptophan valine isoleucine leucine phenylalanine histidine และ lysine ซึ่งมีสูตรจำง่ายๆ ตามชื่อย่อของกรดอะมิโนว่าเป็น MATT VILPHL ส่วนกรดอะมิโนอีก 10 ชนิดที่เหลือเป็นกรดอะมิโนไม่จำเป็น ซึ่งร่างกายสามารถสังเคราะห์ได้เอง อย่างไรก็ตาม tyrosine สามารถสังเคราะห์ได้จาก phenylalanine
โดยเอนไซม์ phenylalanine hydroxylase แต่ tyrosine ไม่สามารถเปลี่ยนกลับมาเป็น phenylalanine ได้ ดังนั้นถ้าอาหารมี phenylalanine เพียงพอ ถึงแม้ว่าจะไม่มี tyrosine เลย ร่างกายก็จะไม่มีอาการขาด tyrosine แต่ถ้าไม่มีทั้ง phenylalanine และ tyrosine ร่างกายจะเกิดการขาดกรดอะมิโนทั้งคู่ เมื่อให้ tyrosine อาการขาด tyrosine จะหายไป ดังนั้น tyrosine จึงได้ชื่อว่าเป็น semi-essential amino acid นั่นคือ จะแสดงลักษณะของกรดอะมิโนจำเป็นเฉพาะเมื่ออาหารขาด phenylalanine เท่านั้น
กรดอะมิโนบางชนิด เช่น glycine มีความสำคัญหลายอย่าง เช่น เป็นส่วนประกอบของโปรตีน ฮอร์โมน เอนไซม์ นอกจากนี้ยังทำหน้าที่เป็น neurotransmitter และเป็นสารต้นของสารต่างๆ หลายชนิด เช่น porphyrin heme creatine glutathione glycocholic acid ในน้ำดี เป็นต้น
กรดอะมิโนบางตัวสามารถนำไปสังเคราะห์สารที่มีความสำคัญหลายชนิด เช่น
1) s-adenosyl methionine (SAM) ทำหน้าที่เป็น methyl group donor ที่สำคัญจะสังเคราะห์จาก methionine
2) creatine phosphate ทำหน้าที่เป็นสารพลังงานสูงที่เก็บสะสมไว้ในกล้ามเนื้อและสมอง สังเคราะห์จากกรดอะมิโน 3 ชนิด คือ glycine arginine และ methionine
เมตะบอลิสมของกรดอะมิโนก่อให้เกิดสารประกอบมากมายที่มีความสำคัญทางการแพทย์ เช่น decarboxylation ของกรดอะมิโนบางชนิด จะให้ amines ที่มีหน้าที่สำคัญ เช่น เป็นฮอร์โมน และ neurotransmitter ได้แก่ g-butyric acid (GABA) จาก glutamate histamine จาก histidine 5-hydroxytryptamine หรือ serotonin จาก tryptophan ส่วน dopa dopamine norepinephrine epinephrine และ thyroid hormone นั้นสังเคราะห์จาก tyrosine
amine บางตัว เป็นสารต้น (precursor) ของการสังเคราะห์สารอื่นๆ เช่น ethanolamine จาก serine เป็นสารต้นของ cephalin และ lecithins, b- mercaptoethylamine จาก cysteine ใช้สังเคราะห์ coenzyme A ที่ต้องใช้ในปฏิกิริยา citric acid cycle หรือ Krebs cycle หรือ tricarboxylic acid (TCA) cycle, melanin ในเซลล์ผิวหนังจาก tyrosine ทำหน้าที่ป้องกันเซลล์จากแสงแดด, carnitine จาก lysine ทำหน้าที่ขนส่งกรดไขมันเข้าไมโตคอนเดรีย เป็นต้น
กลับไปที่เนื้อหา



