หมู่ฟังก์ชัน (functional groups)
![]()
ความหมายของหมู่ฟังก์ชัน
หมู่ฟังก์ชัน คือ กลุ่มของอะตอมที่เป็นส่วนหนึ่งของโมเลกุลที่มีบทบาทในการกำหนดสมบัติทางเคมีรวมทั้งสมบัติทางกายภาพของสารเคมีนั้น ๆ กลุ่มของสารอินทรีย์ที่สำคัญที่จัดจำแนกตามชนิดของหมู่ฟังก์ชัน ได้แก่
|
ประเภทของสารอินทรีย์ |
หมู่ฟังก์ชั่น |
ตัวอย่าง |
|
อัลเคน(alkanes)/ |
— |
CH3CH2CH2CH3 |
|
อัลคีน(alkenes)/ |
|
CH2= CH2 |
|
อัลไคน์(alkynes)/ |
|
HC?CH |
|
ออร์กาโนฮาโลเจน หรือ เฮไลด์ (organohalogens or halides) |
— X |
CH3CH2Br |
|
อัลกอฮอล์และฟีนอล |
-OH |
CH3CH2OH |
|
อีเทอร์ (ethers) |
-O- |
CH3CH2OCH2CH3 |
|
เอมีน (amines) |
- NH2 |
CH3CH2NH2 |
|
อัลดีไฮด์ (aldehyde) |
|
CH3CH2CH2CHO |
|
คีโตน (ketone) |
|
CH3COCH3 |
|
กรดคาร์บอกซิลิก |
|
CH3CO2H |
|
เอสเทอร์ (esters) |
|
CH3COOCH2CH3 |
กลับไปที่เนื้อหา
ฟังก์ชันพันธะคู่ในแอลคีน
พันธะที่เกิดขึ้นอันเนื่องมาจากอะตอม 2 อะตอมนำอิเล็กตรอนมาใช้ร่วมกัน ถ้ามีการใช้อิเล็กตรอนร่วมกัน 2 คู่ เรียกพันธะที่เกิดว่า พันธะคู่แอลคีน (alkene) คือ สารประกอบไฮโดรคาร์บอนที่มีพันธะคู่อยู่ในโมเลกุล1 พันธะ นอกนั้นเป็นพันธะเดี่ยวจัดเป็นสารประกอบไฮโดรคาร์บอนชนิดไม่อิ่มตัว ในทำนองเดียวกับแอลเคน แต่แอลคีนมีจำนวนไฮโดรเจนน้อยกว่าแอลเคนอยู่ 2 ตัวสูตรโมเลกุลทั่วไปของแอลคีนจึงเป็นCnH2nเมื่อ n คือจำนวนคาร์บอน
แอลคีนมีหมู่ฟังก์ชันเป็นพันธะคู่ (Doublecovalent bond) เกิดจากการใช้อิเล็กตรอนร่วมกันของธาตุทั้งสองเป็นคู่ หรือ 2 อิเล็กตรอน เช่น O2CO2C2H4เป็นต้น

กลับไปที่เนื้อหา
ฟังก์ชันพันธะสามในแอลไคน์ (Alkyne)
พันธะที่เกิดขึ้นอันเนื่องมาจากอะตอม 2 อะตอมนำอิเล็กตรอนมาใช้ร่วมกัน ถ้ามีการใช้อิเล็กตรอนร่วมกัน 3 คู่ เรียกพันธะที่เกิดว่า พันธะสามแอลไคน์ (alkyne)
แอลไคน์ เป็นสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวเหมือนแอลคีน ในโมเลกุลของแอลไคน์จะต้องมีพันธะสามระหว่าง C กับ C (C C)
ถ้ามีพันธะสาม 1 แห่ง จะมีสูตรทั่วไปเป็น
CnH2n - 2เมื่อ n = 2, 3, ….
เช่น
n = 2 คือ C2H2
n = 3 คือ C3H4
n = 4 คือ C4H6เป็นต้น
เมื่อมีคาร์บอนเท่ากันแอลไคน์จะมีไฮโดรเจนน้อยกว่าแอลคีน 2 อะตอมและน้อยกว่าแอลเคน 4 อะตอม เช่น C2H2, C2H4, C2H6ซึ่งเป็นแอลไคน์ แอลคีนและแอลเคน ตามลำดับ
อัตราส่วนระหว่าง C : H ในแอลไคน์มากกว่าในแอลคีนและแอลเคน เมื่อเผาไฟแอลไคน์จึงทำให้เกิดเขม่ามากกว่าแอลคีน (แอลเคนไม่เกิดเขม่า)
กลับไปที่เนื้อหา
หมู่ฟังก์ชันไฮดรอกซิล
หมู่ไฮดรอกซิล (hydroxyl group)ใช้ในการกล่าวถึงหมู่ฟังก์ชัน-OH ในสารประกอบอินทรีย์ (organic compounds) สารประกอบอินทรีย์ที่ประกอบด้วยหมู่ไฮดรอกซิลเราจะเรียกว่าสารประเภทแอลกอฮอล์ (สูตรเคมีอย่างง่ายของแอลกอฮอล์คือ CnH2n+1-OH)
แอลกอฮอล์ (alcohol) คือสารประกอบที่มีหมู่ไฮดรอกซิล (hydroxyl, -OH) เกาะอยู่กับ
แอลิฟาติกคาร์บอน มีสูตรทั่วไปคือ R–OH แอลกอฮอล์มีหลายชนิดแบ่งตามจำนวนหมู่ไฮดรอกซิลที่เป็นองค์ประกอบในโมเลกุลออกเป็น 4 ชนิด คือ
1. มอนอไฮดริกแอลกอฮอล์ (monohydric alcohol) คือ แอลกอฮอล์ที่โมเลกุลมีหมู่ไฮดรอกซิลหนึ่งหมู่ เช่น ethanol CH3CH2OH
2. ไดไฮดริกแอลกอฮอล์ (dihydric alcohol) คือ แอลกอฮอล์ที่โมเลกุลมีหมู่ไฮดรอกซิล สองหมู่ เช่น glycol Ethylene glycol HOCH2CH2OH มีจุดเดือดสูง จุดเยือกแข็งต่ำละลายน้ำได้ดี ใช้เป็นสารป้องกันการแข็งตัวในหม้อน้ำรถยนต์
3. ไตรไฮดริกแอลกอฮอล์ (trihydric alcohol) คือ แอลกอฮอล์ที่โมเลกุลมีหมู่ไฮดรอกซิล สามหมู่ เช่น glycerol หรือ glycerine ใช้ในเครื่องสำอาง และการเตรียมยา
4. พอลิไฮดริกแอลกอฮอล์ (polyhydric alcohol) คือแอลกอฮอล์ที่โมเลกุลมีหมู่ไฮดรอกซิล มากกว่าสามหมู่ เช่น สารประกอบคาร์โบไฮเดรต เป็นต้น
มอนอไฮดริกแอลกอฮอล์แบ่งตามคาร์บอนที่หมู่ไฮดรอกซิลเกาะอยู่ออกเป็น 3 ชนิดคือ
1. แอลกอฮอล์ชนิดปฐมภูมิ (primary alcohol) มีสูตรทั่วไป คือ RCH2OH
2. แอลกอฮอล์ชนิดทุติยภูมิ (secondary alcohol) มีสูตรทั่วไป คือ R2CHOH
3. แอลกอฮอล์ชนิดตติยภูมิ (tertiary alcohol) มีสูตรทั่วไป คือ R3COH
(หมู่ R อาจเหมือนหรือต่างกันก็ได้)
แอลกอฮอล์มีหมู่ไฮดรอกซิล จึงเกิดพันธะไฮโดรเจนระหว่างโมเลกุลได้ ทำให้จุดเดือดของ
แอลกอฮอล์สูงกว่าจุดเดือดของแอลเคนอีเทอร์ ที่มีน้ำหนักโมเลกุลใกล้เคียงกัน พันธะไฮโดรเจนนี้ช่วยให้แอลกอฮอล์ละลายน้ำได้ แอลกอฮอล์ที่โมเลกุลมีคาร์บอนตั้งแต่หนึ่งถึงสี่อะตอมละลายน้ำได้ดี การละลายจะลดลงเมื่อจำนวนคาร์บอนเพิ่มขึ้น แอลกอฮอล์ที่มีจำนวนคาร์บอนเท่ากันแอลกอฮอล์ ที่คาร์บอนเกาะเป็นโซ่กิ่ง จะละลายน้ำได้มากกว่าที่คาร์บอนเกาะเป็นโซ่ตรง การละลายน้ำ จะเพิ่มตาม จำนวนหมู่ไฮดรอกซิลที่มีอยู่ในโมเลกุล
เมื่อต้องการแยกแอลกอฮอล์หรือสารอินทรีย์ที่ละลายน้ำได้ดีออกจากน้ำ ทำได้โดยการเติมเกลือที่แตกตัวได้ดีในน้ำ เช่น NaCl ลงไปจนอิ่มตัว เป็นผลให้การละลายน้ำของแอลกอฮอล์หรือสารอินทรีย์ลดลง เกิดการแยกจากชั้นน้ำ ปรากฎการณ์นี้เรียกว่า salting out
แอลกอฮอล์เป็นสารประกอบ amphoteric คือเป็นได้ทั้งกรดและเบส
กลับไปที่เนื้อหา
หมู่ฟังก์ชันแอลคอกซีในอีเทอร์
หมู่ฟังก์ชันแอลคอกซี (R - O - R') พบในสารอินทรีย์ เรียกสารอินทรีย์ที่มีหมู่แอลคอกซีว่า อีเทอร์
อีเทอร์เป็นสารประกอบอินทรีย์ที่มีหมู่ฟังก์ชันเป็น หมู่แอลคอกซี (alcoxy,R–O–R’) มีสูตรทั่วไปเป็นROR’มีสูตรโมเลกุลเหมือนแอลกอฮอล์และฟีนอลจึงเป็นไอโซเมอร์โครงสร้างกับแอลกอฮอล์และฟีนอล
1.williamson of ether
2.dehydration of alcohol
3.autoxidation
กลับไปที่เนื้อหา
หมู่ฟังก์ชันคาร์บอกซาลดีไฮด์ในแอลดีไฮด์
แอลดีไฮด์ (Aldehyde) เป็นสารประกอบอินทรีย์ที่หมู่ฟังก์ชันเป็นหมู่คาร์บอกซาลดีไฮด์ (Carboxaldehyde: หรือ –CHO) มีสูตรทั่วไปเป็น หรือ RCHO หรือ CnH2nO เมื่อ R , R’ เป็นหมู่แอลคิลหรือหมู่แอริล
ปฏิกิริยาในหมู่ฟังก์ชันคาร์บอกซาลดีไฮด์ในแอลดีไฮด์
1.1 Oxidation of alcohol
ใช้ PCC/pyradine ทำให้1alcohol เปลี่ยนไปเป็นaldehydeเท่านั้น
3ํalcohol ไม่สามารถถูกออกซิไดซ์ได้
1.2 Ozonolysis of alkenes
2. ปฏิกิริยาของแอลดีไฮด์และคีโตน
2.1 Oxidation Reaction
***แอลดีไฮด์สามารถถูกออกซิไดซ์ได้ง่ายกว่าคีโตน จึงสามารถใช้ปฏิกิริยาต่อไปนี้ทดสอบความแตกต่างระกว่างแอลดีไฮด์กับคีโตน โดยคีโตนจะไม่เกิดปฏิกิริยา
2.1.1 ปฏิกิริยากับTollen's reagent(Silver mirror test)
2.1.2 ปฏิกิริยากับ Benedict's reagent
ใช้ Benedict ซึ่งเป็นสารละลายของ CuSO4และกรดซิตริกในเบสได้ตะกอนสีแดงอิฐ
2.1.3 ปฏิกิริยากับFehling's reagent
ใช้Fehling's reagent ซึ่งเป็นสารละลาย CUSO4 และกรดทาทาริกในเบส
2.2 Reduction of Aldehydes and Ketones
2.3 Clemensen Reduction
กลับไปที่เนื้อหา
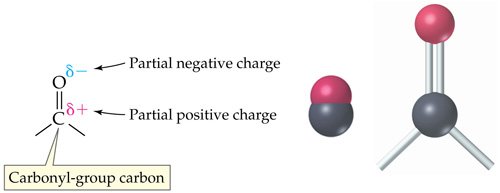
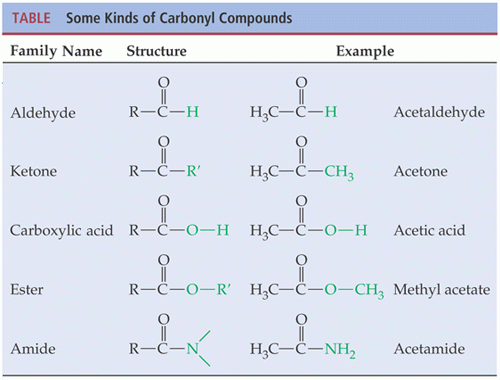
หมู่ฟังก์ชันคาร์บอนิบในคีโดน
หมู่คาร์บอนิลเป็นหมู่ฟังก์ชันที่พบในสารประกอบอินทรีย์โดยมีคาร์บอนอะตอมจับกันด้วยพันธะคู่กับออกซิเจนอะตอม ซึ่งการเปลี่ยนแปลงต่าง ๆ จะขึ้นอยู่กับคาร์บอน สารประกอบของหมู่คาร์บอนิลที่เกิดขึ้นเป็นประจำ ได้แก่ คีโตน คาร์บอกซิลิคแอซิด เอสเทอร์ และเอไมด์ รสมทั้งสารประกออบอื่น ๆ ที่รวมอยู่ในหม่คาร์บอนิลล แอซิดแฮไลด์ แอซิดแอนไฮไดร์ แลคโตนและแลคแทม
กลับไปที่เนื้อหา
หมู่ฟังก์ชันคาร์บอกซิลในกรดอินทรีย์
หมู่ฟังก์ชันคาร์บอกซิล
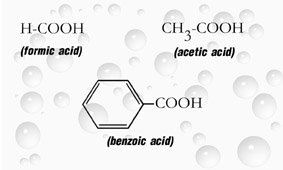
คือกลุ่มที่ประกอบด้วย(-COOH)ที่มีอยู่ในกรดอินทรีย์ทุกชนิดหรือเรียกว่ากรดคาร์บอกซิลิก(Carboxylic Acid)กลุ่มคาร์บอกซิลนี้ประกอบด้วยกลุ่มคาร์บอนิล(Cabonyl Group)และกลุ่มไฮครอกซิล(Hydroxy Group)อย่างละ 1 กลุ่ม
คุณสมบัติ เนื่องจากไฮโดรเจนที่ไอออนไนส์ได้ซึ่งก็อาจถูกแทนที่โดยโลหะเกิดเป็นเกลือขึ้นหรืออยู่แทนที่โดยพวกอนุมูล อัลคิล(Alkyl Radical)หรืออนุมูลอะโรมาติก(Aromatic Radical)เกิดเป็นเอสเทอร์(Ester)กลุ่มไอดรอกซิลสามารถถูกแทนที่โดยอะตอมหรือกลุ่มอะตอมเกิดเป็น เอไมด์(Amindes)หรือAcid HalogenideชนิดR – CO - CL (Rหมายถึงอนุมูลใด ๆ)ตัวอย่างที่สำคัญได้แก่พวกคลอไรด์ (Chloride)และโบร์ไมด์(Bromide)ใช้เป็นสารตัวกลางในกระบวนการที่เกี่ยวข้องกับการสังเคราะห์สารอินทรีย์
กลับไปที่เนื้อหา



