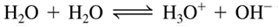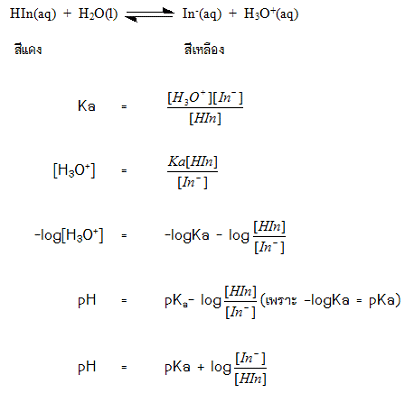สารละลายกรด-เบส
- 1. การแนะนำ
- 2. บทเรียนที่ 2 ไอออนในสารละลายกรด-เบส
- 3. บทเรียนที่ 3 ทฤษฎีกรด-เบส
- 4. บทเรียนที่ 4 คู่กรด-เบส
- 5. บทเรียนที่ 5 ความแรงของกรดและเบส
- 6. บทเรียนที่ 6 การแตกตัวของสารละลายกรด-เบส
- 7. บทเรียนที่ 7 การแตกตัวของน้ำ
- 8. บทเรียนที่ 8 ค่า PH ของสารละลาย
- 9. บทเรียนที่ 9 อินดิเคเตอร์สำหรับกรด-เบส
- 10. บทเรียนที่ 10 ปฏิกิริยาระหว่างสารละลายกรด-เบส
- 11. บทเรียนที่ 11 ปฏิกิริยาไฮโดรไลซิส
- 12. บทเรียนที่ 12 การไทเทรตสารละลายกรด-เบส
- 13. บทเรียนที่ 13 บัฟเฟอร์
- - ทุกหน้า -
![]()
บทเรียนที่ 1 สารละลายอิเล็กโทรไลต์
อิเล็กโทรไลต์ (Electrolyte) หมายถึง สารที่เมื่อละลายในน้ำจะนำไฟฟ้าได้ เนื่องจากมีไอออนซึ่งอาจจะเป็นไอออนบวก หรือไอออนลบเคลื่อนที่อยู่ในสารละลาย สารละลายอิเล็กโทรไลต์นี้อาจเป็นสารละลายกรด เบส หรือเกลือก็ได้ ตัวอย่างเช่น สารละลายกรดเกลือ (HCl) สารละลายโซเดียมไฮดรอกไซด์ (NaOH) และสารละลายของเกลือ KNO3เป็นต้น โดยในสารละลายดังกล่าวประกอบด้วยไอออน H+, Cl-,OH-, K+และ NO3-ตามลำดับ
นอนอิเล็กโทรไลต์ (Non-electrolyte)หมายถึง สารที่ไม่สามารถนำไฟฟ้าได้เมื่อละลายน้ำ ทั้งนี้ เนื่องจาก สารพวกนอนอิเล็กโทรไลต์ จะไม่สามารถแตกตัวเป็นไอออนได้ เช่น น้ำบริสุทธิ์ น้ำตาล แอลกอฮอล์ เป็นต้น
ความแตกต่างของสารอิเล็กโทรไลต์และนอน-อิเล็กโทรไลต์ พิจารณาจากสาร 2 ชนิดที่มีสูตร AB กับ CD เมื่อละลายน้ำจะรวมกันน้ำเกิดการเปลี่ยนแปลงดังนี้

การเป็นอิเล็กโทรไลต์และนอนอิเล็กโทรไลต์ของสาร
จากภาพ AB เป็นสารนอนอิเล็กโทรไลต์ เพราะ AB ไม่ละลายน้ำและไม่แตกตัวเป็นไอออน
CD เป็นสารอิเล็กโทรไลต์ เพราะ CD จะแตกตัวได้ C+และ D-ไอออนซึ่งถูกล้อมรอบด้วยโมเลกุลของน้ำ
อิเล็กโทรไลต์แก่และอิเล็กโทรไลต์อ่อน
สารละลายอิเล็กโทรไลต์ต่างๆ นำไฟฟ้าได้ไม่เท่ากัน เนื่องจากการแตกตัวเป็นไอออนของอิเล็กโทรไลต์ไม่เท่ากัน อิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้มากกว่า ก็จะนำไฟฟ้าได้ดีกว่าอิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้น้อยกว่า อิเล็กโทรไลต์แบ่งออกได้เป็น 2 ประเภท ดังนี้
1. อิเล็กโทรไลต์แก่ (strong electrolyte)หมายถึง สารที่ละลายน้ำแล้วแตกตัวเป็นไอออนได้มาก อาจจะแตกตัวได้ 100% และนำไฟฟ้าได้ดีมาก เช่น กรดแก่ และเบสแก่ และเกลือส่วนใหญ่จะแตกตัวได้ 100% เป็นต้น
2. อิเล็กโทรไลต์อ่อน (weak electrolyte)หมายถึง สารที่ละลายน้ำแล้วแตกตัวได้บางส่วน นำไฟฟ้าได้น้อย
ตัวอย่างของอิเล็กโทรไลต์แก่ และอิเล็กโทรไลต์อ่อนบางชนิด
|
อิเล็กโทรไลต์แก่ (นำไฟฟ้าได้ดี) |
อิเล็กโทรไลต์อ่อน (นำไฟฟ้าได้ไม่ดี) |
|
เกลือที่ละลายน้ำทั้งหมด H2SO4 HNO3 HCl HBr HClO4 NaOH KOH Ca(OH)2 Ba(OH)2 |
CH3COOH H2CO3 HNO2 H2SO3 H2S H2C2O4 H3BO3 HClO NH4OH HF |
การทดสอบการนำไฟฟ้าของสารละลาย
สารละลายที่นำไฟฟ้า ได้แก่ สารละลายของกรด เบส และเกลือ อุปกรณ์ที่ใช้ในการทดลอง ประกอบด้วยขั้วไฟฟ้า 2 ขั้ว ต่อเข้ากับแหล่งให้พลังงานไฟฟ้า (ให้ศักย์ไฟฟ้า) หลอดไฟ และสวิตซ์ให้ครบวงจร
วิธีทดสอบ
เมื่อกดสวิตซ์ลงเพื่อให้ครบวงจร ถ้าสารละลายในภาชนะเป็นสารละลายอิเล็กโทรไลต์ หลอดไฟจะสว่างขึ้น แสดงว่าสารละลายนั้นนำไฟฟ้าได้
ตัวอย่างผลการทดลองการทดสอบการนำไฟฟ้า
|
สารที่ใช้ทดสอบ |
ผลการทดสอบ |
|
น้ำบริสุทธิ์ น้ำที่มีน้ำตาลละลายอยู่ ยูเรีย (CO(NH2)2 สารละลายเกลือ NaCl สารละลายเกลือ K2SO4 สารละลายกรด HCl สารละลายกรดแอซิติก (CH3COOH) สารละลายเบส NaOH สารละลายเบส NH4OH |
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง) ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง) ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้าน้อย (หลอดไฟสว่างน้อย) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้า (หลอดไฟสว่าง) |
ผลที่ได้อธิบายได้ว่า สารละลายที่ไม่มีไอออนอยู่ เช่น น้ำ หรือน้ำตาลทราบที่ละลายอยู่ในน้ำมัน จะมีพันธะแบบโคเวเลนต์ ไม่สามารถแตกตัวเป็นไอออนได้ จึงไม่นำไฟฟ้า แต่ NaCl HCl เมื่ออยู่ในน้ำจะแตกตัวเป็น Na+, Cl-หรือ H+, Cl-ซึ่งเป็นไอออนที่เคลื่อนที่ในสารละลายทำให้เกิดการนำไฟฟ้าขึ้นได้
การทดสอบสมบัติอื่นๆ ของสารละลาย
1. การทดสอบความเป็นกรด-เบสจากการเปลี่ยนสีของกระดาษลิตมัส
- ถ้าสารละลายเป็นกรด จะเปลี่ยนสีกระดาษลิตมัสจากน้ำเงินเป็นแดง
- ถ้าสารละลายเป็นเบส จะเปลี่ยนสีกระดาษลิตมัสจากแดงเป็นน้ำเงิน
- ถ้าสารละลายเป็นเกลือ จะเปลี่ยนหรือ ไม่เปลี่ยนสีกระดาษลิตมัสก็ได้
นอกจากการใช้กระดาษลิตมัส อาจจะใช้อินดิเคเตอร์อื่นๆ เช่น เมทิลเรด ฟีนอล์ฟทาลีน ก็ได้
2. การทดสอบปฏิกิริยาของกรดและปฏิกิริยาของเบส
ปฏิกิริยาของกรด
ก. ทำปฏิกิริยากับโลหะ จะได้ก๊าซไฮโดรเจน เช่น
HCl(aq) + Ca (s) ------------> CaCl2(aq) + H2(g)
H2SO4(aq) + Mg (g) ------------> MgSO4(aq) + H2(g)
ข. ทำปฏิกิริยากับโลหะออกไซด์ ได้เกลือกับน้ำ
2HCl (aq) + Na2O (s) -----------> 2NaCl (aq) + H2O (l)
H2SO4(aq) + MgO (g) ---------> MgSO4(aq) + H2O (l)
ค. ทำปฏิกิริยากับคาร์บอเนตได้ก๊าซ CO2น้ำ และเกลือ
2HCl (aq) + NaCO3(aq) -----------> 2NaCl + H2O + CO2
HCl (aq) + NaHCO3(aq) ------------> NaCl + H2O + CO2
ง. ทำปฏิกิริยากับเบสได้เกลือกับน้ำ
2HCl (aq) + NaOH (aq) ------------> NaCl (aq) + H2O (l)
CH3COOH (aq) + NaOH (aq) ---------> CH3COONa (aq) + H2O (l)
ปฏิกิริยาของเบส
ก. ทำปฏิกิริยากับโลหะบางชนิด ให้ก๊าซไฮโดรเจน
2NaOH (aq) + Zn (s) ------------> Na2ZnO2(aq) + H2(g)
6KOH (aq) + 2Al (s) ----------------> 2K3AlO3(aq) + 3H2(g)
ข. ทำปฏิกิริยากับเกลือ ได้เป็นเกลือไฮดรอกไซด์ของโลหะที่ไม่ละลายน้ำ
2NaOH (aq) + MnCl2(aq) --------------> Mn(OH)2(s) + 2NaCl (aq)
2KOH (aq) + CuSO4(aq) ----------------> Cu(OH)2(s) + K2SO4(aq)
ค. ทำปฏิกิริยากับเกลือแอมโมเนียม เช่น NH4Cl ได้ก๊าซ NH3(g)
NaOH (aq) + NH4Cl (aq) -------------> NaCl (aq) + H2O (l) + NH3(g)
KOH (aq) + NH4Cl (aq) ------------------> KCl (aq) + H2O (l) + NH3(g)
ง. ทำปฏิกิริยากับกรดได้เกลือกับน้ำ
กลับไปที่เนื้อหา
บทเรียนที่ 2 ไอออนในสารละลายกรด-เบส
จากการศึกษาสมบัติของสารละลาย พบว่า สารละลายกรดและสารละลายเบส เป็นสารละลายอิเล็กโทรไลต์ นำไฟฟ้าได้ เปลี่ยนสีกระดาษลิตมัส ทำปฏิกิริยากับโลหะและเกลือ กรดและเบสสามารถแตกตัวเป็นไอออน เมื่อเป็นสารละลาย เราจะศึกษาต่อไปถึงไอออนในสารละลายกรดและเบส ซึ่งทำให้สารละลายแสดงสมบัติเฉพาะตัวดังกล่าว
1. ไอออนในสารละลายกรด
ในสารละลายกรดทุกชนิด จะมีไอออนที่เหมือนกันอยู่ส่วนหนึ่งคือ H+หรือ เมื่อรวมกับน้ำได้เป็น H3O+(ไฮโดรเนียมไอออน) ทำให้กรดมีสมบัติเหมือนกัน ตัวอย่างเช่น สารละลายกรดไฮโดรคลอริก (HCl) ซึ่งเกิดจากกรด HCl ละลายในน้ำ โมเลกุลของ HCl และ น้ำต่างก็เป็นโมเลกุลโคเวเลนต์มีขั้ว ทำให้เกิดแรงดึงดูดระหว่างขั้วของ HCl และน้ำ โดยที่โปรตอน (H) ของ HCl ถูกดึงดูดโดยโมเลกุลของน้ำเกิดเป็นไฮโดรเนียมไอออน
(H++ H2O -----> H3O+) ในบางครั้งเขียนแทน H3O+ด้วย H+โดยเป็นที่เข้าใจว่า H+นั้นจะอยู่รวมกับโมเลกุลของน้ำในรูป H3O+เสมอ

ไฮโดรเนียมไอออนในน้ำไม่ได้อยู่เป็นไอออนเดียว แต่จะมีน้ำหลายโมเลกุลมาล้อมรอบอยู่ด้วย เช่น อาจอยู่ในรูปของH5O2+, H7O3+, H9O4+เป็นต้น
ตัวอย่าง สมการแสดงการแตกตัวเป็นไอออนของกรดในน้ำ
HNO3(l) + H2O (l) -------------> H3O+(aq) + NO3-(aq)
H2SO4(l) + H2O (l) --------------> H3O+(aq) + SO42-(aq)
CH3COOH (l) + H2O (l) ---------------> H3O+(aq) + CH3COO-(aq)
HClO4(l) + H2O (l) --------------------> H3O+(aq) + ClO4-(aq)
2. ไอออนในสารละลายเบส
ในสารละลายเบสทุกชนิดจะมีไอออนที่เหมือนกันอยู่คือ ไฮดรอกไซด์ไอออน (OH-) ซึ่งทำให้เบสมีสมบัติเหมือนกัน และมีสมบัติต่างไปจากกรด ตัวอย่างเช่น เมื่อ NaOH ละลายน้ำจะแตกตัวได้ OH-ดังนี้
NaOH (s) ---------------> Na+(aq) + OH-(aq)
หรือตัวอย่างอื่นๆ ได้แก่
KOH (s) ---------------------> K+(aq) + OH-(aq)
NH3(g) + H2O (l) -----------------> NH4+(aq) + OH-(aq)
สรุปสมบัติทั่วๆ ไปของสารละลายกรด
1. มีรสเปรี้ยว
2. มีสมบัติในการกัดได้
3. เปลี่ยนสีอินดิเคเตอร์ เช่น กระดาษลิตมัสจากน้ำเงินเป็นแดง
4. นำไฟฟ้าได้
5. ทำปฏิกิริยากับแมกนีเซียม หรือโลหะบางชนิดได้ก๊าซ H2
Mg (s) + HCl (aq) ---------------> MgCl2(aq) + H2(g)
6. ทำปฏิกิริยากับเบส ได้เกลือกับน้ำ เรียกว่าปฏิกิริยาสะเทิน(Neutralization reaction)เช่น
NaOH + HCl ----------------------> NaCl + H2O
7. ทำปฏิกิริยากับเกลือคาร์บอเนต (CO32-) หรือเกลือไฮโดรเจนคาร์บอเนต (HCO3-) จะได้
เกลือ + น้ำ + ก๊าซคาร์บอนไดซ์ออกไซด์ เช่น
CaCO3+ 2HCl ----------------> CaCl2+ H2O + CO2
2NaHCO3+ H2SO4-------------> Na2SO4+ 2H2O + 2CO2
8. ทำปฏิกิริยากับโลหะซัลไฟด์จะได้เกลือและก๊าซไฮโดรเจนซัลไฟด์ (ก๊าซไข่เน่า) เช่น
FeS + 2HCl ------------> FeCl2+ H2S
BaS + H2SO4---------------> BaSO4(s) ® H2S
สรุปสมบัติทั่วๆ ไปของสารละลายเบส
1. มีรสฝาด
2. ถูกมือลื่นคล้ายสบู่
3. นำไฟฟ้าได้
4. ผสมกับไขมันได้สบู่
5. เปลี่ยนสีอินดิเคเตอร์ เช่น กระดาษลิตมัสจากสีแดงเป็นสีน้ำเงิน ฟินอล์ฟทาลีนจากไม่มีสีเป็นสีแดง เป็นต้น
กลับไปที่เนื้อหา
บทเรียนที่ 3 ทฤษฎีกรด - เบส
ทฤษฎีกรด-เบส
ในการที่จะให้นิยามของกรด-เบส และในการจำแนกสารต่างๆ ว่าเป็นกรดหรือเบสนั้น ได้มีนักวิทยาศาสตร์ ได้ศึกษาและตั้งทฤษฎีกรด-เบส ขึ้นหลายทฤษฎีด้วยกัน ทฤษฎีกรด-เบสที่สำคัญมีดังนี้
1 ทฤษฎีกรด-เบสของอาร์เรเนียส
อาร์เรเนียส เป็นนักวิทยาศาสตร์ชาวสวีเดน ได้ตั้งทฤษฎีกรด-เบส ในปี ค.ศ. 1887 (พ.ศ. 2430) อาร์เรเนียสศึกษาสารที่ละลายน้ำ (Aqueous solution) และการนำไฟฟ้าของสารละลายนั้น เขาพบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน เมื่อละลายอยู่ในน้ำ และให้นิยามกรดไว้ว่า
“กรด คือสารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน” เช่น
HCl (g) ------------------> H+(aq) + Cl-(aq)
HClO4(l)------------------> H+(aq) + ClO4-(aq)
CH3COOH (l) ------------------>H+(aq) + CH3COO-(aq)
H2SO4(l) ------------------>H+(aq) + SO42-(aq)
H2CO3(l)------------------> H+(aq) + HCO3-(aq)
“เบสคือสารที่ละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน” เช่น
NaOH (s) ------------------>Na+(aq) + OH-(aq)
Ca(OH)2(s) ------------------>Ca2+(aq) + 2OH-(aq)
KOH (s) ------------------>K+(aq) + OH-(aq)
NH4OH (l) ------------------>NH4+(aq) + OH-(aq)
ข้อจำกัดของทฤษฎีกรด-เบส อาร์เรเนียส
- ทฤษฎีกรด-เบส อาร์เรเนียส จะเน้นเฉพาะการแตกตัวในน้ำ ให้เป็น H+และ OH-ไม่รวมถึงตัวทำละลายอื่นๆ ทำให้อธิบายความเป็นกรด-เบสได้จำกัด
- สารที่จะเป็นกรดได้ต้องมี H+อยู่ในโมเลกุล และสารที่จะเป็นเบสได้ก็ต้องมี OH-อยู่ในโมเลกุล
2. ทฤษฎีกรด-เบส ของเบรินสเตต-เลารี
โจฮันส์ นิโคลัส เบรินสเตต นักเคมีชาวเดนมาร์ก และ โทมัส มาร์ติน ลาวรี นักเคมีชาวอังกฤษ ได้ศึกษาการให้และรับโปรตอนของสาร เพื่อใช้ในการอธิบายและจำแนกกรด-เบสได้กว้างขึ้น และได้ตั้งทฤษฎีกรด-เบสขึ้นในปี ค.ศ.1923 (พ.ศ.2466)
กรด คือสารที่สามารถให้โปรตอนกับสารอื่นๆ ได้ (Proton donor)
เบส คือสารที่สามารถรับโปรตอนจากสารอื่นได้ (Proton acceptor)
พิจารณาตัวอย่างต่อไปนี้

HCl เป็นสารที่ให้โปรตอน (H+) ดังนั้น HCl จึงเป็นกรด
H2O เป็นสารที่รับโปรตอน (H+) ดังนั้น H2O จึงเป็นเบส

NH4+เป็นสารที่ให้โปรตอน (H+) ดังนั้น NH4+จึงเป็นกรด
H2O เป็นสารที่รับโปรตอน (H+) ดังนั้น H2O จึงเป็นเบส

H2O เป็นสารที่ให้โปรตอน (H+) ดังนั้น H2O จึงเป็นกรด
NH3เป็นสารที่รับโปรตอน (H+) ดังนั้น NH3จึงเป็นเบส
ข้อจำกัดของทฤษฎีกรด-เบสของเบรินสเตต-ลาวรี
ทฤษฎีกรด-เบสของเบรินสเตต-ลาวรี ใช้อธิบายสมบัติของกรด-เบส ได้กว้างกว่าทฤษฎีของอาร์เรเนียส แต่ยังมีข้อจำกัดคือ สารที่จะทำหน้าที่เป็นกรดจะต้องมีโปรตอนอยู่ในสารนั้น
สารที่เป็นได้ทั้งกรดและเบส
(Amphoteric)
สารบางตัวทำหน้าที่เป็นทั้งกรด เมื่อทำปฏิกิริยากับสารตัวหนึ่ง และทำหน้าที่เป็นเบส เมื่อทำปฏิกิริยากับอีกสารหนึ่ง นั่นคือเป็นได้ทั้งกรดและเบส สารที่มีลักษณะนี้เรียกว่า สารเอมโพเทอริก(Amphoteric) เช่น H2O , HCO3-เป็นต้น
กรณีของ H2O


ในกรณีนี้ H2O เป็นกรดเมื่อทำปฏิกิริยากับ NH3และเป็นเบสเมื่อทำปฏิกิริยากับ NH4+
กรณีของ HCO3-


ในกรณีนี้ HCO3-เป็นเบสเมื่อทำปฏิกิริยากับ HCl และเป็นกรดเมื่อทำปฏิกิริยากับ OH-
ดังนั้นอาจจะสรุปได้ว่า สารที่เป็นเอมโฟเทอริก ถ้าทำปฏิกิริยากับสารที่ให้โปรตอนได้ดีกว่า ตัวมันเองจะรับโปรตอน (ทำหน้าที่เป็นเบส) แต่ถ้าไปทำปฏิกิริยากับสารที่ให้โปรตอนได้ไม่ดี ตัวมันเองจะเป็นตัวให้โปรตอนกับสารนั้น (ทำหน้าเป็นกรด)
ในกรณีนี้ HCO3-เป็นเบสเมื่อทำปฏิกิริยากับ HCl และเป็นกรดเมื่อทำปฏิกิริยากับ OH-
ดังนั้นอาจจะสรุปได้ว่า สารที่เป็นเอมโฟเทอริก ถ้าทำปฏิกิริยากับสารที่ให้โปรตอนได้ดีกว่า ตัวมันเองจะรับโปรตอน (ทำหน้าที่เป็นเบส) แต่ถ้าไปทำปฏิกิริยากับสารที่ให้โปรตอนได้ไม่ดี ตัวมันเองจะเป็นตัวให้โปรตอนกับสารนั้น (ทำหน้าเป็นกรด)

ในกรณีนี้ NH3เป็นเบส มีอิเล็กตรอนคู่ 1 คู่ จะให้อิเล็กตรอนคู่กับกรดในการเกิดพันธะโคเวเลนต์ และ BF3รับอิเล็กตรอนจาก NH3BF3จึงเป็นกรด
ทฤษฎีของลิวอิสนี้มีข้อดีคือ สามารถจำแนกกรด-เบส ที่ไม่มีทั้ง H หรือ OH-ในสารนั้น และแม้ว่าสารนั้นไม่ได้อยู่ในรูปสารละลาย แต่อยู่ในสถานะก๊าซก็สามารถใช้ทฤษฎีลิวอิสอธิบายความเป็นกรดเบสได้
กลับไปที่เนื้อหา
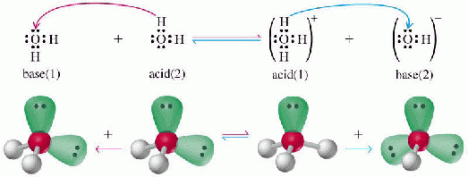
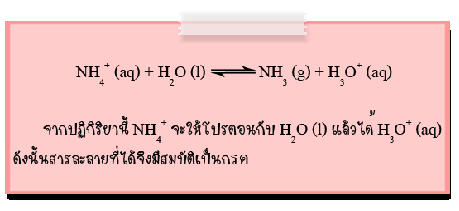
บทเรียนที่ 4 คู่กรด - เบส
คู่กรด-เบส
จากปฏิกิริยาของกรดกับเบสที่กล่าวถึงแล้ว ตามทฤษฎีของเบรินสเตต-ลาวรี จะเห็นว่าในปฏิกิริยาหนึ่งๆ อาจจะจัดคู่กรด-เบสได้ 2 คู่ด้วยกัน ตัวอย่างเช่น

ปฏิกิริยาตัวอย่างนี้ ปฏิกิริยาไปข้างหน้า NH4+ทำหน้าที่เป็นกรด เพราะให้ H+กับ H2O แล้วได้เป็น NH3และ H2O รับ H+ทำหน้าที่เป็นเบส ส่วนปฏิกิริยาย้อนกลับ H3O+เป็นกรด เพราะให้ H+กับ NH3ซึ่งเป็นเบส แล้วได้ H2O และ NH4+ตามลำดับ
เรียก NH4+ว่าคู่กรดของ NH3(เบส)
H2O ว่าคู่เบสของ H3O+(กรด)
NH3ว่าคู่เบสของ NH4+
H3O+ว่าคู่กรดของ H2O
จะเห็นได้ว่า คู่กรด-เบสนั้นจะมีจำนวนโปรตอน (H) ต่างกัน 1 ตัว หรืออาจกล่าวได้ว่า จำนวนโปรตอนของคู่กรด จะมากกว่าโปรตอนคู่เบสอยู่ 1 ตัวเสมอ
ตัวอย่างอื่นๆ ของปฏิกิริยาคู่กรด-เบส

กลับไปที่เนื้อหา
บทเรียนที่ 5 ความแรงของกรดและเบส
ความแรงของกรดและเบส
การเปรียบเทียบความแรงของกรดและเบส อาจจะพิจารณาได้ดังนี้
1. ดูจากการแตกตัวของกรด
กรดที่มีการแตกตัวมาก มีความเป็นกรดมาก กรดและเบสที่แตกตัวได้ 100% จะเรียกว่ากรดแก่ และเบสแก่ ตามลำดับ ซึ่งสามารถนำไฟฟ้าได้ดี แต่ถ้ากรดและเบสนั้นแตกตัวได้เพียงบางส่วนก็จะเรียกว่า กรดอ่อน หรือเบสอ่อน ตามลำดับ ซึ่งการนำไฟฟ้าจะไม่ดี
สำหรับการพิจารณาค่าการแตกตัวของกรดและเบสนั้น นอกจากจะคิดจากเปอร์เซ็นต์การแตกตัว หรืออาจจะดูได้จากค่าคงที่สมดุลของการแตกตัวของกรดหรือเบส (Kaหรือ Kb) เช่น
สารละลายกรด 4 ชนิด มีค่าคงที่ของการแตกตัวของกรดเป็นดังนี้
HClO2Ka= 1.1 x 10-2
HF Ka= 6.8 x 10-4
CH3COOH Ka= 1.8 x 10-5
H2CO3Ka= 4.4 x 10-7
ความแรงของกรดเรียงลำดับจากมากไปหาน้อยตามค่า Kaได้ดังนี้
HClO2> HF > CH3COOH > H2CO3
ในทำนองเดียวกัน ความแรงของเบส ก็พิจารณาจากค่า Kbกล่าวคือ ถ้ามีค่า Kbมาก มีความเป็นเบสมากกว่า Kbน้อย เช่น
NH3Kb= 1.76 x 10-5
N2H4Kb= 9.5 x 10-7
C6H5NH2Kb= 4.3 x 10-10
ความเป็นเบส NH3> N2H4> C6H5NH2
2. ดูจากความสามารถในการให้และรับโปรตอน
กรดแก่ ได้แก่ กรดที่ให้โปรตอนได้มาก
กรดอ่อน ได้แก่ กรดที่ให้โปรตอนได้น้อย
เบสแก่ ได้แก่ เบสที่รับโปรตอนได้มาก
เบสอ่อน ได้แก่ เบสที่รับโปรตอนได้น้อย
โดยมีข้อสังเกตเกี่ยวกับคู่กรด-เบส ดังนี้
- ถ้ากรดเป็นกรดแก่ คู่เบสจะเป็นเบสอ่อน เช่น
HCl (aq) + H2O ------------> H3O+(aq) + Cl-(aq)
กรดแก่ เบสอ่อน
* ถ้ากรดเป็นกรดอ่อน คู่เบสจะเป็นเบสแก่ เช่น
HS-(aq) + H2O------------> H3O++ S2-(aq)
กรดอ่อน เบสแก่
- ถ้าเบสเป็นเบสแก่ คู่กรดจะเป็น กรดอ่อน เช่น
H3O++ S2-(aq)------------> HS-(aq) + H2O
เบสแก่ กรดอ่อน
- ถ้าเบสเป็นเบสอ่อน คู่กรดจะเป็น กรดแก่ เช่น
Cl-(aq) + H3O+------------>HCl + H2O
เบสอ่อน กรดแก่
ตาราง ลำดับความแรงของกรดและเบสตัวอย่างตามทฤษฎีของเบรินสเตต-ลาวรี
|
คู่กรด |
คู่เบส |
||||||
กรดเปอร์คลอริก กรดไฮโดรไอโอดิก กรดไฮโดรโบรมิก กรดไฮโดรคลอริก กรดไนตริก กรดซัลฟิวริก ไฮโดรเนียมไอออน ไฮโดรเจนซัลเฟตไอออน กรดไนตรัส กรดแอซิติก กรดคาร์บอนิก แอมโมเนียมไอออน ไบคาร์บอเนตไอออน น้ำ เมทานอล แอมโมเนีย |
HClO4 HI HBr HCl HNO3 H2SO4 H3O+ HSO4- HNO2 CH3COOH H2CO3 NH4+ HCO3- H2O CH3OH NH3 |
เปอร์คลอเรตไอออน ไอโอไดด์ไอออน โบรไมด์ไอออน คลอไรด์ไอออน ไนเตรตไอออน ไฮโดรเจนซัลเฟตไอออน น้ำ ซัลเฟตไอออน ไนตรัสไอออน แอซิเตตไอออน ไบคาร์บอเนตไอออน แอมโมเนีย คาร์บอเนตไอออน ไฮดรอกไซด์ไอออน เมทออกไซด์ไอออน เอไมด์ไอออน |
ClO4- I- Br- Cl- NO3- HSO4- H2O SO42- NO2- CH3COO- HCO3- NH3 CO32- OH- CH3O- NH2- |
||||
กลับไปที่เนื้อหา
บทเรียนที่ 6 การแตกตัวของสารละลายกรด-เบส
การแตกตัวของกรดแก่และเบสแก่
การแตกตัวของกรดแก่และเบสแก่ จะแตกตัวได้หมด 100% หมายถึง การแตกตัวของกรดแก่และเบสแก่ เป็นไอออนได้หมดในตัวทำละลายซึ่งส่วนใหญ่เป็นน้ำ เช่น การแตกตัวของกรด HCl จะได้ H+หรือ H3O+ และ Cl-ไม่มี HCl เหลืออยู่ หรือการแตกตัวของเบส เช่น NaOH ได้ Na+และ OH-ไม่มี NaOH เหลืออยู่ การแตกตัวของกรดแก่และเบสแก่เขียนแทนด้วยลูกศร ซึ่งแสดงการเปลี่ยนแปลงไปข้างหน้าเพียงอย่างเดียว เช่น

การคำนวณเกี่ยวกับการแตกตัวของกรดแก่และเบสแก่
ตัวอย่างที่ 1จงคำนวณหา [H3O+] , [NO3-] ในสารละลาย 0.015 M HNO3

เพราะฉะนั้น[H3O+] = [NO3-] = 0.015 โมล/ ลิตร
ตัวอย่างที่ 2ถ้า KOH 0.1 โมล ละลายน้ำและสารละลายมีปริมาตร 2 ลิตร ในสารละลายจะมีไอออนใดบ้างอย่างละกี่โมลต่อลิตร

การแตกตัวของกรดอ่อน
สารละลายกรดอ่อน เช่น กรดแอซิติก (CH3COOH) เมื่อละลายน้ำ จะนำไฟฟ้าได้ไม่ดี ทั้งนี้ เพราะกรดแอซิติกแตกตัวเป็นไอออนได้เพียงบางส่วน เขียนแทนโดยสมการจะใช้ลูกศร เพื่อชี้ว่าปฏิกิริยาเกิดขึ้นทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ และอยู่ในภาวะสมดุลกัน เช่น
 ปริมาณการแตกตัวของกรดอ่อน นิยมบอกเป็นร้อยละ เช่น กรด HA แตกตัวได้ร้อยละ 10 ในน้ำ หมายความว่า กรด HA 1 โมล เมื่อละลายน้ำ จะแตกตัวให้ H+เพียง 0.10 โมล
ปริมาณการแตกตัวของกรดอ่อน นิยมบอกเป็นร้อยละ เช่น กรด HA แตกตัวได้ร้อยละ 10 ในน้ำ หมายความว่า กรด HA 1 โมล เมื่อละลายน้ำ จะแตกตัวให้ H+เพียง 0.10 โมล การแตกตัวของกรดของกรดอ่อนชนิดเดียวกัน จะเพิ่มขึ้นเมื่อสารละลายมีความเจือจางมากขึ้น เช่น กรดแอซิติก CH3COOH ความเข้มข้นต่างกันจะมีเปอร์เซ็นต์การแตกตัวต่างกัน ดังนี้
การแตกตัวของกรดของกรดอ่อนชนิดเดียวกัน จะเพิ่มขึ้นเมื่อสารละลายมีความเจือจางมากขึ้น เช่น กรดแอซิติก CH3COOH ความเข้มข้นต่างกันจะมีเปอร์เซ็นต์การแตกตัวต่างกัน ดังนี้
CH3COOH 1.0 M แตกตัวได้ 0.42 %
CH3COOH 0.10 M แตกตัวได้ 1.30 %
CH3COOH 0.010 M แตกตัวได้ 4.20 %
ตัวอย่างที่ 3จงคำนวณเปอร์เซ็นต์การแตกตัวของกรด HA 1 โมล/ ลิตร ซึ่งมี H3O+0.05 โมล/ ลิตร


ตัวอย่างที่ 4สารละลายกรด HA มีค่า Ka เป็น 6.8 x 10-4สารละลายกรดนี้มีความเข้มข้น 1 โมล/ ลิตร สารละลายกรดนี้จะมีความเข้มข้นของ H3O+ เท่าใด


ตัวอย่างที่ 5 ที่ 250Cกรดแอซิติก (CH3COOH) เข้มข้น 0.1 โมล/ ลิตร แตกตัวได้ 1.34 % จงคำนวณหาความเข้มข้นของไฮโดรเนียมไอออน แอซิเตตไอออน และ Ka 0.1 mol/dm3 CH3COOH แตกตัวได้ 1.34 % หมายความว่า CH3COOH 100 mol/dm3แตกตัวได้ = 1.34 mol/dm3


การแตกตัวของเบสอ่อน
เบสอ่อนเมื่อละลายน้ำจะแตกตัวเป็นไอออนเพียงบางส่วน และปฏิกิริยาการแตกตัวของเบสอ่อน เป็นปฏิกิริยาที่ผันกลับได้ เช่น แอมโมเนีย เมื่อละลายน้ำจะมีภาวะสมดุลเกิดขึ้น ดังสมการ


Kb คือ ค่าคงที่สมดุลของเบส ค่า Kb นี้เป็นค่าคงที่และใช้เปรียบเทียบความแรงของเบสได้ เช่นเดียวกับค่า Ka
>>โมโนโปรติกเบส (monoprotic base) จะรับ H+ได้ 1 ตัว และมีค่า Kb เพียงค่าเดียว เช่น NH3
>>โพลิโปรติกเบส (polyprotic base) จะรับ H+ ได้มากกว่า 1 ตัว และมีค่า Kb ได้หลายค่า เช่น ไฮดราซีน H2NNH2

การคำนวณเกี่ยวกับ เบสอ่อน
ตัวอย่างที่ 6จงเขียนค่าคงที่สมดุลของเบสอ่อนต่อไปนี้ C6H5NH2 , N2H2
กลับไปที่เนื้อหา
บทเรียนที่ 7 การแตกตัวของน้ำ
การแตกตัวเป็นไอออนของน้ำ
น้ำเป็นอิเล็กโทรไลต์ที่อ่อนมาก จึงทำให้แตกตัวได้น้อยมาก ดังนั้นการนำไฟฟ้าของน้ำจะน้อย จนไม่สามารถตรวจสอบได้ด้วยการนำไฟฟ้าผ่านหลอดไฟ แต่ตรวจได้ด้วยเครื่องวัดกระแส (แอมมิเตอร์) ด้วยเหตุนี้จึงมีการอนุโลมให้น้ำบริสุทธิ์เป็นสารนอนอิเล็กโทรไลต์ ตามทฤษฎีของเบรินสเตต – ลาวรี กล่าวว่า น้ำ ทำหน้าที่เป็นทั้งกรดและเบส ไอออนที่เกิดขึ้นจากการแตกตัวของน้ำนั้นจะมีการถ่ายเทโปรตอนกันเอง เรียกว่า ออโตไอออนไนเซชัน ดังรูป
โมเลกุลของน้ำที่เสีย H+จะเปลี่ยนเป็น OH-ซึ่งมีประจุลบและโมเลกุลของน้ำที่ได้รับ H+จะเปลี่ยนเป็น H3O+ซึ่งมีประจุบวก เราอาจเขียน
สมการกรด- เบส ได้ง่ายๆ ดังนี้
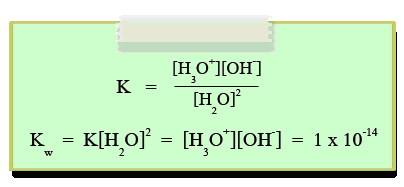
เนื่องจากระบบนี้อยู่ในภาวะสมดุล สามารถเขียนสมการค่าคงที่สมดุลของ H2O ได้ดังนี้
Kwคือค่าคงที่การแตกตัวของน้ำ มีค่าเท่ากับ 1 x 10-14ที่ 250C เนื่องจากน้ำบริสุทธิ์แตกตัวเป็นไอออนจะให้ความเข้มข้นของ H3O+และ
OH-เท่ากัน
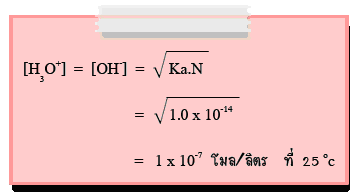
นั่นคือ น้ำบริสุทธิ์ที่อุณหภูมิ 25°C มีความเข้มข้นของไฮโดรเนียมไอออน(H3O+) เท่ากับความเข้มข้นของไฮดรอกไซด์ไอออน(OH-)
= 1.0 x 10-7mol/dm3
ดังนั้น น้ำบริสุทธิ์จึงมีสภาพเป็นกลางเนื่องจากปริมาณ H3O+เท่ากับ OH-ค่าคงที่สมดุลของน้ำมีค่าเปลี่ยนแปลงตามอุณหภูมิ แสดงดังตาราง
ต่อไปนี้
ตารางค่า Kwของน้ำที่อุณหภูมิต่างๆ
|
อุณหภูมิ(0C) |
Kw |
|
0 10 20 25 30 40 50 60 |
0.114 x 10-14 0.296 x 10-14 0.681 x 10-14 1.010 x 10-14 1.470 x 10-14 2.920 x 10-14 5.470 x 10-14 9.610 x 10-14 |
กลับไปที่เนื้อหา
บทเรียนที่ 8 ค่า PH ของสารละลาย
pH ของสารละลาย
ในสารละลายกรดหรือเบสจะมีทั้ง H3O+และ OH-อยู่ในปริมาณที่แตกต่างกัน การบอกความเป็นกรด เป็นเบสของสารละลายโดยใช้ความเข้มข้นของ H3O+หรือ OH-มักเกิดความผิดพลาดได้ง่ายเพราะสารละลายมักมีความเข้มข้นของ H3O+หรือ OH-น้อย
ดังนั้นในปี ค.ศ. 1909 นักเคมีชาวสวีเดนชื่อ ซอเรสซัน (Sorensen)ได้เสนอให้บอกความเป็นกรด-เบสของสารละลายในรูปมาตราส่วน pH ย่อมาจากภาษาฝรั่งเศสว่า puissance d,hydrogine แปลว่า กำลังของไฮโดรเจน (power of hydrogen) โดยกำหนดว่า

เมื่อความเข้มข้นของ H3O+มีหน่วยเป็น mol/dm3หรือ Molar
ในสารละลายที่เป็นกลาง [H3O+] = [OH-] = 1.0 x 10-7mol/dm3
ดังนั้น หา pH ของสารละลายได้ดังนี้ pH = – log[H3O+]
= – log 1.0 x 10-7
= – (log 1.0 – 7log10)
= 0 + 7 = 7
นั่นคือสารละลายที่เป็นกลางมี pH = 7
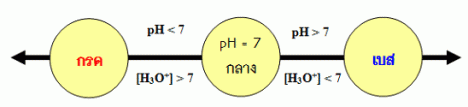
ค่า pH ที่ใช้ระบุความเป็นกรดหรือเบสของสารละลายสรุปได้ดังนี้
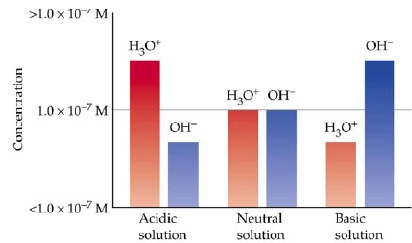
สารละลายกรด มี [H3O+] มากกว่า 1.0 x 10-7mol/dm3ดังนั้น pH<7.00
สารละลายที่เป็นกลาง มี [H3O+] เท่ากับ 1.0 x 10-7mol/dm3ดังนั้น pH = 7.00
สารละลายเบส มี [H3O+] น้อยกว่า1.0 x 10-7mol/dm3ดังนั้น pH>7.00
นอกจากนี้สามารถบอกความเป็นกรด-เบสของสารละลายในรูปความเข้มข้นของ OH-ก็ได้โดยค่า pOHค่าpOH ใช้บอกความความเป็นกรด-เบสของสารละลายเจือจางได้เช่นเดียวกับค่า pH ซึ่งค่า pOH จะขึ้นอยู่กับความเข้มข้นของ OH-โดยกำหนดความสัมพันธ์ดังนี้

ตัวอย่างการคำนวณค่าpOH
สารละลาย NaOH เข้มข้น 0.01 โมลต่อลูกบาศก์เซนติเมตร มี pH เท่าใด
วิธีทำNaOH (aq) ————-> Na+(aq) + OH-(aq)
0.01 mol/dm30.01 mol/dm3= 1 x 10-2mol/dm3
pOH = -log[OH-]
=-log 1×10-2mol/dm3
= 2log10 – log1
pOH = 2

ในสารละลายที่เป็นกลางซึ่งมี [OH-] = 1.0 x 10-7mol/dm3จะมี pOH = 7
ความสัมพันธ์ระหว่าง pH กับ pOH
[H3O+][ OH-] = 1.0 x 10-14
log[H3O+][ OH-] = log1.0 x 10-14
log[H3O+] + log[OH-] = log1.0 – 14 log10
- log[H3O+] – log[OH-] = 14 log10

มาตราส่วนpH (pH scale) ใช้บอกความเป็นกรด-เบสของสารละลาย
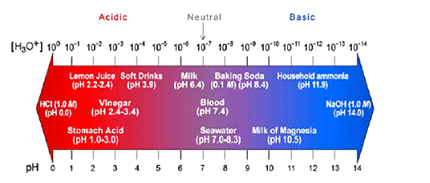
(ที่มา : สุนทร พรจำเริญ เอกสารประกอบการสอนเรื่องกรด-เบส โรงเรียนมหิดลวิทยานุสรณ์)
ตารางแสดง สเกลpH ของสารละลายที่มีความเข้มข้นต่างๆ กัน
 |
วิธีวัดpH ของสารละลายวัดได้ 2 วิธี ดังนี้
1. วิธีเปรียบเทียบสีวิธีนี้เป็นการวัด pH โดยประมาณ (มีความถูกต้อง 0.5 หน่วย pH) ซึ่งทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบกับสารละลาย ทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบสีกับสารละลายบัฟเฟอร์ที่ทราบค่า pH แน่นอน ซึ่งได้เติมอินดิเคเตอร์ชนิดเดียวกันไปแล้ว หรือใช้กระดาษชุบอินดิเคเตอร์ (กระดาษ pH) จุ่มลงไปแล้วเปรียบเทียบกับสีมาตรฐาน
2. วิธีวัดความต่างศักย์วิธีนี้วัด pH ได้อย่างละเอียด (มีความถูกต้อง 0.01 หน่วย pH) โดยการใช้เครื่องมือที่เรียกว่า พีเอชมิเตอร์ ซึ่งวัด pH ของสารละลายได้โดยการวัดความต่างศักย์ระหว่างขั้วไฟฟ้า 2 ขั้ว

ภาพแสดงเครื่องพีเอชมิเตอร์
http://www.ponpe.com/component/option,com_virtuemart/page,shop.browse/category_id,30/Itemid,90/vmcchk,1/

กลับไปที่เนื้อหา
บทเรียนที่ 9 อินดิเคเตอร์สำหรับกรด-เบส
อินดิเคเตอร์สำหรับกรด – เบส
อินดิเคเตอร์เป็นสารที่ใช้บอกความเป็นกรด – เบสของสารละลาย ส่วนใหญ่เป็นสารอินทรีย์ประเภทสีย้อมและมีสีต่างๆ กัน มีสูตรโครงสร้างที่ซับซ้อนและมีสมบัติเป็นกรดอ่อน เพื่อความสะดวกจึงสมมุติให้มีสูตรเป็น HIn อินดิเคเตอร์ชนิดหนึ่ง ๆ จะมีโครงสร้าง 2 แบบ ซึ่งมีสีแตกต่างกันเมื่ออินดิเคเตอร์ละลายน้ำหรืออยู่ในสารละลายจะมีการแตกตัวเป็นไอออนการที่มีสมบัติเป็นกรดอ่อนจึงทำให้มีภาวะสมดุลเกิดขึ้น เขียนแสดงได้ด้วยสมการ
ดังนี้
ในปฏิกิริยาจะพบว่า HIn และ In-เป็นคู่กรด-เบสซึ่งกันและกัน HIn มีโครงสร้างเป็นกรดจึงเรียกว่า รูปกรดในขณะที่คู่เบส คือ In-เป็นโครงสร้างที่แสดงสมบัติเป็นเบสจึงเรียกว่ารูปเบสโครงสร้างของรูปกรดและรูปเบสสำหรับอินดิเคเตอร์ชนิดหนึ่งๆจะมีสีไม่เหมือนกันและมีปริมาณอยู่ในสารละลายต่างกันจึงทำให้สีของสารละลายเปลี่ยนแปลงไปได้ในสารละลายถ้ามีโครงสร้างของรูปใดมากกว่า สารละลายจะมีสีตามรูปนั้นการที่จะมีรูปกรดหรือรูปเบสมากกว่ากันจะขึ้นอยู่กับปริมาณของ H3O+ในสารละลายหรือขึ้นอยู่กับ pHของสารละลายนั่นเองดังนั้นอินดิเคเตอร์จึงมีสีเปลี่ยนแปลงไปตามค่า pH ของสารละลายทำให้สามารถบอกความเป็นกรด-เบส ของสารละลายจากการดูที่สีของอินดิเคเตอร์
(ที่มา :http://www.il.mahidol.ac.th/e-media/acid-base/C8.HTM)
ตัวอย่างการเปลี่ยนสีของเมทิลเรด ซึ่งเป็นอินดิเคเตอร์ที่มีสมบัติเป็นกรดอ่อน เมื่ออยู่ในรูปโมเลกุล (HIn) ซึ่งเป็นรูปกรด (acid form) จะมีสีแดง และเมื่ออยู่ในรูป ไอออน (In-) ซึ่งอยู่ในรูปเบส (base form) หรือเป็นคู่เบสจะมีสีเหลือง เมื่ออยู่ในสารละลาย ที่มีน้ำเป็นตัวทำละลายจึงมีภาวะสมดุล ดังสมการ
เมทิลเรดจะปรากฎสีใดขึ้นอยู่กับปริมาณของ HIn และ In-ดังนี้
1. ในสารละลายที่มี H3O+มาก เนื่องจากการเติมกรดลงในสารละลาย ตามหลักของเลอชาเตอลิเอร์สมดุลจะเลื่อนมาทางซ้าย ทำให้เกิด [HIn] มาก อินดิเคเตอร์ จะปรากฎเป็นสีแดงมากกว่าสีเหลือง ดังสมการ
2. ในสารละลายที่มี OH-มาก เนื่องจากการเติมเบสลงในสารละลาย สมดุลจะเลื่อนไปทางขวามากขึ้น เพราะ OH-ไปทำปฏิกิริยากับ H3O+ทำให้ [H3O+] ลดลง เกิดปฏิกิริยาไปข้างหน้ามากขึ้น [In-] จึงเพิ่มขึ้นอินดิเคเตอร์จะปรากฎสีเหลืองมากกว่าสีแดง
3. ในสารละลายที่มีค่าความเข้มข้นของ HIn และ In-ใกล้เคียงกัน สีของอินดิเคเตอร์จะเป็นสีผสมระหว่างสีของรูปกรดและรูปเบสผสมกัน ในกรณีของเมทิลเรดจะได้สีส้มซึ่งเป็นสีผสมระหว่างสีแดงกับสีเหลืองและเรียก pH ของสารละลายช่วงสีผสมนี้ว่า “ช่วง pH ของการเปลี่ยนสี (pH range) ของอินดิเคเตอร์” ดังสมการต่อไปนี้
จากอัตราส่วนระหว่าง [HIn] ต่อ [In-] มีผลต่อสีของอินดิเคเตอร์ ดังนี้
ถ้าอัตราส่วนของ [HIn] ต่อ [In-] = 1 : 1 ได้สีส้ม
ถ้าอัตราส่วนของ [HIn] ต่อ [In-] = 10 : 1 ได้สีแดง
ถ้าอัตราส่วนของ [HIn] ต่อ [In-] =1 : 10 ได้สีเหลือง
ดังนั้น ช่วงปรับเปลี่ยนสีของอินดิเคเตอร์ที่มีสมบัติเป็นกรดอ่อน คือ ช่วง pH ที่ทำให้อัตราส่วนระหว่าง [HIn] ต่อ [In-] เปลี่ยนจาก 10 ไปเป็น 0.1
ถ้า [HIn] > [In-] ≥ 10 จะพบสีของสารละลายในรูปกรด
หรือเปลี่ยนสีที่
ถ้า
จะพบสีของสารละลายในรูปเบสหรือเปลี่ยนสีที่ช่วง pH = pKa + log10
= pKa + 1
แสดงว่าอินดิเคเตอร์ใดๆ จะเปลี่ยนสีที่ pH=pKa ± 1ดังตัวอย่างต่อไปนี้
ตัวอย่างอินดิเคเตอร์ชนิดหนึ่ง มีค่า Ka = 2×10-5รูปกรดมีสีเหลือง รูปเบสมีสีน้ำเงิน
เติมลงในสารละลาย มีค่า pH = 3จะได้สีอะไรและที่ pH 5.5 และ 9.2สารละลายจะมีสีใด
แสดงว่า pH ต่ำกว่า 3.7 มีสีเหลือง สูงกว่า 5.7 มีสีน้ำเงิน และช่วง pH 3.7 ถึง 5.7
เมื่อเติมอินดิเคเตอร์ในสารละลายpH =3 จะมีสีเหลือง
pH= 5.5 จะมีสีเขียว
pH = 9.2 จะมีสีน้ำเงิน
ส่วนช่วง pH ที่ทำให้อินดิเคเตอร์ที่เป็นเบสอ่อนเปลี่ยนสี คือ ช่วงที่ pH = pKa ± 1
ตารางแสดงช่วง pH ที่เปลี่ยนสีของอินดิเคเตอร์บางชนิด
(ที่มา :http://www.lks.ac.th/student/kroo_su/chem22/indi.htm)
ผลการวิเคราะห์ข้อมูลจากตารางพบว่า อินดิเคเตอร์แต่ละชนิดเปลี่ยนสีที่ค่า pH ต่างกันมีช่วง pH ของการเปลี่ยนสีกว้างต่างกัน อินดิเคเตอร์ที่มีช่วง pH เปลี่ยนสีที่กว้างมาก จะไม่สามารถบอกความเป็นกรด – เบส ได้ถูกต้อง ถ้าใช้อินดิเคเตอร์เพียงชนิดเดียว ถ้าใช้อินดิเคเตอร์หลายชนิดทดสอบค่า pH ของสารละลาย จะสามารถประมาณค่า pH ได้ใกล้เคียงที่สุด โดยการวิเคราะห์ค่าpH แล้วหาช่วงที่มีค่า pH ซ้ำกัน จะเป็นค่า pH ของสารละลาย ดังตัวอย่าง
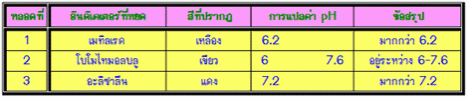
ตัวอย่างที่ 1การทดลองหาค่า pH ของสารละลายชนิดหนึ่ง โดยใช้อินดิเคเตอร์ 5 ชนิดด้วยกัน
ผลการทดลองเป็นดังนี้
|
ชนิดของอินดิเคเตอร์ |
ช่วง pH |
สีที่เปลี่ยน |
สีสารละลายที่ได้จากการทดลอง |
| 1. methyl yellow 2. Bromeresol green 3. Methyl red 4. Bromothymol blue 5. Phenophtalein |
2.9-4.0 |
สีแดง-เหลือง |
เหลือง |
ให้หาค่า pH ของสารละลายจากข้อมูลการทดลองข้างต้น
แนวคิด จากอินดิเคเตอร์ชนิดที่ 1 แสดงว่า pH ของสารละลาย > 4 จากอินดิเคเตอร์ ชนิดที่ 2แสดงว่า pH ของสารละลายอยู่ระหว่าง 4.4-6.2 จากอินดิเคเตอร์ชนิดที่ 3 แสดงว่า pH ของสารละลาย > 5.4 จากอินดิเคเตอร์ชนิดที่ 4 แสดงว่า pH ของสารละลาย < 6 จากอินดิเคเตอร์ชนิดที่ 5 แสดงว่า pH ของสารละลาย < 8.0 สรุปได้ว่า สารละลายมี pH อยู่ระหว่าง 5.4 – 6
ตัวอย่างที่ 2 กำหนดชนิดของอินดิเคเตอร์ช่วง pH ที่เปลี่ยนสีและสีที่เปลี่ยนให้ ดังนี้
นำสารละลาย X ซึ่งใสไม่มีสีมา 3 หลอด หยดอินดิเคเตอร์ ได้ผลดังนี้
pH ของสารละลาย X เท่ากับ 7.2 – 7.6 เนื่องจากเป็นช่วง pH ที่ซ้ำกันของอินดิเคเตอร์ ทั้ง 3 ชนิดและสามารถสรุปได้ว่าสารละลายมีสมบัติเป็นเบสเนื่องจาก pH มากกว่า 7 ดังนั้น ถ้านำอินดิเคเตอร์หลายชนิด ซึ่งเปลี่ยนสีของสารละลายได้ในช่วง pH แตกต่างกันมากผสมกันในอัตราส่วนที่เหมาะสม จะได้อินดิเคเตอร์ที่ค่า pH ของสารละลายได้ชัดเจนมากขึ้น เรียกว่า“ยูนิเวอร์ซัลอินดิเคตอร์ (universal indicatior)” ทำให้สามารถระบุค่า pHของสารละลายตั้งแต่ pH1-14
(ที่มา :http://www.camlab.co.uk/item.asp?itemid=21331&categoryid=204&browsecategoryid=307)
(ที่มา:http://ujutchemical.exteen.com/20060911/entry-3)
ยูนิเวอร์ซัลอินดิเคเตอร์ที่ใช้โดยทั่วไป ได้จากการผสมอินดิเคเตอร์ 4 ชนิด คือ เมทิลเรด เมทิลออเรนจ์ฟีนอล์ฟทาลีน และโบรโมไทมอลบลู ในอัตราส่วนที่เหมาะสม ทำให้เปลี่ยนสีได้เกือบทุกช่วงของ pH เช่นที่ pH=3 เมทิลออเรนจ์และเมทิลเรดจะมีสีแดง ฟีนอล์ฟทาลีนไม่มีสี โบรโมไทมอลบูลมีสีเหลืองเมื่อรวมกันยูนิเวอร์ซัลอินดิเคเตอร์จะให้สีที่ปรากฏเป็นสีแดงส้มที่ pH เท่ากับ 3 กระดาษ pH เป็นกระดาษที่ชุบด้วยยูนิเวอร์ซัลอินดิเคเตอร์ใช้ทดสอบความเป็นกรด-เบสของสารละลายได้สะดวก โดยการตัดเป็นชิ้นเล็กๆและนำสารละลายมาแตะบนกระดาษแล้วนำผลที่ได้ไปเทียบสีของค่า pHที่แผ่นเทียบสีบนกล่องบรรจุกระดาษ pH ทำให้สามารถระบุค่า pHของสารละลายได้ สีที่สกัดได้จากส่วนต่างๆ ของพืชจะเปลี่ยนสีในช่วง pH ต่างๆ ได้ดังนั้น จึงสามารถนำมาใช้เป็นอินดิเคเตอร์ ดังตัวอย่างต่อไปนี้
ตารางแสดงอินดิเคเตอร์จากพืชที่สกัดด้วยน้ำ
|
ชนิดของพืช |
ช่วงpH ที่เปลียนสี |
สีที่เปลี่ยน |
| ดอกอัญชัน |
1-3 |
แดง-ม่วง |
| ดอกกระเจี๊ยบ |
6-7 |
แดง-เขียว |
| ขมิ้นชัน |
6-7 |
เหลืองส้ม |
| ขมิ้นชัน | 11-12 | ส้ม-น้ำตาล |
| ชบาซ้อน | 7-8 | แดง-เขียว |
| ดาวเรืองเหลือง | 9-10 | ไม่มีสี-เขียว |
| กล้วยไม้ | 10-11 | ไม่มีสี-เหลือง |
| ทองกวาว | 11-12 | เหลืองเขียว-แดง |
จากตารางพบว่า สีจากพืชสามารถเปลี่ยนสีในช่วง pH ต่างๆ กัน ดังนั้น อาจเตรียมอินดิเคเตอร์จากสารสกัดจากส่วนต่างๆ ที่มีสีของพืชได้ นอกจากนี้การวัดค่า pH ของสารละลายอาจใช้เครื่องมือที่เรียกว่า “พีเอชมิเตอร์ (pH meter)” เป็นเครื่องมือที่ใช้วัดค่า pH ของสารละลายที่ปรากฎเป็นตัวเลขที่มีค่าถูกต้องและละเอียดยิ่งขึ้น
กลับไปที่เนื้อหา
บทเรียนที่ 10 ปฏิกิริยาระหว่างสารละลายกรด-เบส
ปฏิกิริยาระหว่างสารละลายกรด-เบส
เมื่อเติมสารละลายกรดซัลฟิวริก (H2SO4) ลงในสารละลายโพแทสเซียมไฮดรอกไซด์ (KOH) ความเป็นเบสของสารละลายจะลดลง ความเป็นกรดจะเพิ่มขึ้น ซึ่งสังเกตจากสารละลาย ฟีนอลฟ์ทาลีนจะค่อย ๆ เปลี่ยนจากสีชมพูเข้มแล้วจางลง จนกระทั่งไม่มีสี ณ ภาวะนี้ถือว่าสารละลายเบสรวมพอดีกับสารละลายกรด
เขียนสมการแสดงปฏิกิริยาได้ดังนี้
| H2SO4(aq) + 2KOH(aq) ————-> K2SO4(aq) + 2H2O(l) |
โพแทสเซียมซัลเฟตที่เกิดขึ้น จะละลายน้ำได้เป็นสารละลายไม่มีสี เมื่อนำสารละลายไประเหยแห้งจะได้ของแข็งสีขาว ซึ่งเป็นสารประกอบประเภทเกลือ ดังนั้นเมื่อกรดและเบสทำปฏิกิริยากัน จะได้เกลือกับน้ำ ถ้ากรดและเบสทำปฏิกิริยากัน แล้วเกิดตะกอน แสดงว่าเกลือที่เกิดขึ้นไม่ละลายน้ำแต่ถ้ากรดและเบสทำปฏิกิริยากันแล้วไม่เกิดตะกอนแสดงว่าเกลือที่เกิดขึ้นละลายน้ำได้
1.ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสแก่ KOH ได้เกลือ KCl และน้ำ ดังนี้
2.ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสอ่อน NH4OH ได้เกลือ NH4Cl และน้ำ
3.ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
เช่น ปฏิกิริยาระหว่างกรด CH3COOH และเบส NaOH ได้เกลือโซเดียมแอซิเตต (CH3COONa) และน้ำ
4.ปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรด HCN กับเบส NH4OH ได้เกลือ NH4CN และน้ำ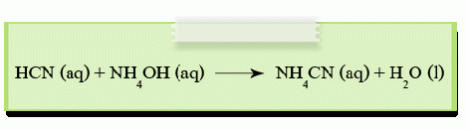
กลับไปที่เนื้อหา
บทเรียนที่ 11 ปฎิกิริยาไฮโดรไลซิส
ปฏิกิริยาไฮโดรไลซิส คือ ปฏิกิริยาของสารใดๆ ที่ทำปฏิกิริยาแล้วได้ผลิตภัณฑ์เป็นน้ำกับสารใดๆ ไฮโดรไลซีสของเกลือหมายถึง ปฏิกิริยาระหว่างเกลือกับน้ำ ซึ่งเกลือเป็นอิเล็กโทรไลต์แก่ เมื่อละลายน้ำแล้วจะแตกตัวออกเป็นไอออนบวกและลบทั้งหมด ดังนั้นสมบัติของสารละลายเกลือ จึงขึ้นอยู่กับไอออนบวกและลบในสารละลายนั้น ไอออนบางตัวสามารถทำปฏิกิริยากับน้ำ และให้ H+หรือ OH-ได้ จึงเรียกว่า ปฏิกิริยาไฮโดรไลซีส เช่น
สรุปได้ว่า ถ้าไอออนลบของเกลือเกิดปฏิกิริยาไฮโดรไลซีสจะทำให้สารละลายแสดงความเป็นเบส แต่ถ้าไอออนบวกของเกลือเกิดปฏิกิริยาไฮโดรไลซีส จะทำให้ สารละลายแสดงความเป็นกรด
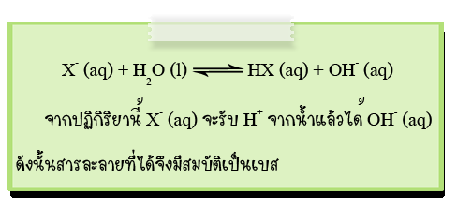
หลักในการพิจารณาว่าไอออนลบใดสามารถเกิดปฏิกิริยา ไฮโดรไลซีสได้ มีหลักพิจารณา ดังนี้
1. ไอออนลบของกรดแก่ เช่น Cl-, Br-, I-, NO3-และ ClO4-จะไม่ทำปฏิกิริยากับน้ำจึงทำให้ไม่มีผลต่อความเป็นกรด – เบสของสารละลาย
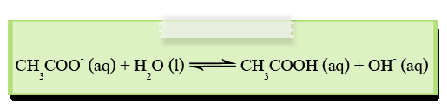
2. ไอออนลบของกรดอ่อน เช่น CH3COO-, ClO-, CN-และ CO32-จะรับโปรตอนจากน้ำทำให้เกิดปฏิกิริยาไฮโดรไลซีสได้สารละลายที่มีความเป็นเบส เช่น
หลักในการพิจารณาว่าไอออนบวกใดสามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ มีหลักพิจารณาดังนี้
1. ไอออนบวกของโลหะหมู่ IA หรือ IIA (ยกเว้น Be) ได้แก่ Li+, Na+, K+, Mg2+, Ca2+ และ Ba2+จะไม่เกิดปฏิกิริยาไฮโดรไลซีส รวมถึงไอออนบวกของเบสแก่ทั้งหมดด้วย
2. NH3+ของเกลือแอมโมเนียม จะเกิดปฏิกิริยาไฮโดรไลซีสจึงทำให้สารละลายเป็นกรด
การไฮโดรไลซีสของเกลือ แบ่งออกเป็น 5 ประเภท ดังนี้
1. การไฮโดรไลซีสที่เกิดจากกรดแก่และเบสแก่
เกลือประเภทนี้เมื่อละลายน้ำจะไม่เกิดปฏิกิริยาไฮโดรไลซีส เพราะไอออนบวกจากเบสแก่ และไอออนลบจากกรดแก่ต่างก็ไม่ทำปฏิกิริยากับน้ำ จึงทำให้ค่า pH ของสารละลายไม่เปลี่ยนแปลง (เป็นกลาง) คือ มีปริมาณ[H3O+] และ [OH-] เท่ากัน ดังนั้น pH ของสารละลาย จึงเท่ากับ 7
2. การไฮโดรไลซีสที่เกิดจากกรดอ่อนกับเบสแก่
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนลบจากกรดอ่อนซึ่งมีสมบัติเป็นคู่เบสโดยเกิดปฏิกิริยาไฮโดรไลซีสกับน้ำได้ OH-ไอออน ดังนั้นสารละลายจึงมีสมบัติเป็นเบส (pH > 7) เช่น CH3COONa , KCN , NaClO
3. การไฮโดรไลซีสที่เกิดจากกรดแก่กับเบสอ่อน
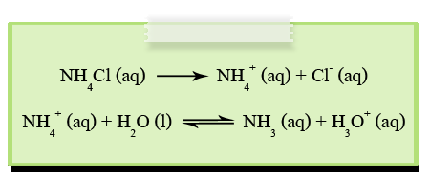
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนบวกจากเบสที่เป็นคู่กรด โดยเกิดปฏิกิริยาไฮโดรไลซีสกับน้ำให้ H3O+ดังนั้นสารละลายจึงแสดงสมบัติเป็นกรด (pH < 7) ส่วนไอออนลบจากกรดแก่ จะไม่เกิดปฏิกิริยาไฮโดรไลซีส เช่นNH4Cl , (NH4)2SO4
4. การไฮโดรไลซีสที่เกิดจากกรดอ่อนและเบสอ่อน
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนบวกและลบ ไอออนบวกจะเกิดปฏิกิริยาไฮโดรไลซีสได้ H3O+ส่วนไอออนลบจะได้ OH-ดังนั้นความเป็นกรด – เบสจึงขึ้นอยู่กับว่าไอออนบวกหรือลบใดเกิดปฏิกิริยาการไฮโดรไลซีสได้ดีกว่ากัน โดยพิจารณาจากค่าคงที่ ของการแตกตัวของคู่เบส (Kb) หรือของคู่กรด (Ka) เช่นNH4CN
เนื่องจาก ค่า Kb> Kaแสดงว่า CN-เกิดปฏิกิริยาไฮโดรไลซีสได้ดีกว่า NH4+ จึงแสดงสมบัติเป็นเบสที่มีค่า pH > 7
5. การไฮโดรไลซีสไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก
ไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก เช่น CO32-, PO43-จะเกิดปฏิกิริยาการไฮโดรไลซีสได้หลายขั้น เนื่องจากสามารถรับ H+จาก H2O ได้มากกว่า 1 โปรตอน เช่น
Na+ไม่เกิดปฏิกิริยาไฮโดรไลซีส เพราะมาจาก เบสแก่ NaOH ส่วน CO32-(aq) เกิดปฏิกิริยาการไฮโดรไลซีสได้ 2 ขั้นตอนดังนี้
กลับไปที่เนื้อหา
บทเรียนที่ 12 การไทเทรตสารละลายกรด-เบส
การไทเทรต (Titration) เป็นวิธีการหาปริมาณของสารละลายมาตรฐาน (Standard Solution) สารที่ทราบค่าความเข้มข้นที่แน่นอน โดยให้ทำปฏิกิริยาพอดีกับสารละลายที่ไม่ทราบความเข้มข้นแต่ทราบปริมาตร (Unknown sample) และใช้การเปลี่ยนสีของอินดิเคเตอร์เป็นเกณฑ์
ในการบอกจุดยุติ (End Point) เมื่อกรดและเบสทำปฏิกิริยากันพอดีกันตามจุดสมมูล (Equivalent Point) ก็จะทราบปริมาตรของสารละลายมาตรฐานแล้วนำค่าที่ได้ไปคำนวณหาความเข้มข้นของสารละลายอื่นได้
จุดยุติ (End Point) คือจุดที่กรดกับเบสทำปฏิกิริยาพอดีกันโดยสังเกตจากการเปลี่ยนสีของอินดิเคเตอร์
จุดสมมูล (Equivalent Point) หรือจุดสะเทิน คือจุดที่กรดกับเบสทำปฏิกิริยาพอดีกันตามสมการที่ดุลแล้วโดยกรด-เบสหมด เหลือเกลือกับน้ำ
pH ของปฏิกิริยาสะเทินปฏิกิริยาสะเทินจุด pH ไม่จำเป็นต้องเท่ากับ 7 แต่จะขึ้นอยู่กับชนิดของกรดเบสดังนี้
ในการไทเทรตกรดเบส ใช้อินดิเคเตอร์บอกจุดยุติระหว่างกรด-เบส โดยอินดิเคเตอร์ที่เหมาะสมจะเปลี่ยนสีที่จุดสมมูล ดังนั้นควรเลือกอินดิเคเตอร์ที่เปลี่ยนสีตรงช่วงจุดสมมูล หรือใกล้เคียงมากที่สุด
วิธีการไทเทรตกรด – เบส
คือ นำสารละลายกรด – เบสตัวอย่างที่ต้องการหาปริมาณ มาทำการไทเทรตกับสารละลาย เบส – กรดมาตรฐานที่ทราบค่าความเข้มข้น หมายความว่า ถ้าสารละลายตัวอย่างเป็นสารละลายกรด จะต้องใช้สารละลายมาตรฐานที่เป็นเบสมาทำการไทเทรต แล้วบันทึกปริมาตรของสารละลายมาตรฐานที่ใช้ จากนั้นจึงนำไปคำนวณหาปริมาณของสารตัวอย่าง ในทางตรงกันข้าม ถ้าใช้สารละลายตัวอย่างเป็นเบส ก็จะต้องใช้สารละลายมาตรฐานเป็นกรดสารละลายมาตรฐานที่ทราบความเข้มข้นแน่นอนแล้ว จะถูกบรรจุอยู่ในเครื่องแก้วที่เรียกว่า บิวเรตต์ ซึ่งจะมีก๊อกไขเปิด – ปิดเพื่อหยดสารละลายมาตรฐานลงมายังขวดรูปกรวยที่บรรจุสารละลายตัวอย่างที่ต้องการวิเคราะห์ไว้แล้ว
ในการไทเทรตจะค่อยๆ หยดสารละลายมาตรฐานลงมาทำปฏิกิริยากับสารละลายตัวอย่าง
ในขวดรูปกรวย เขย่าหรือหมุนขวดรูปกรวยเพื่อให้สารผสมกันไทเทรตจนกระทั่งอินดิเคเตอร์เปลี่ยนสีจึงหยุดการไทเทรต จากนั้นให้บันทึกปริมาตรสารละลายมาตรฐานที่ใช้เพื่อนำไปคำนวณหา pH ของสารละลาย
http://www.lakelandschools.us/lh/lburris/pages/acid-base.htm
รูปแสดงการอ่านค่าปริมาตรของเหลว
(ที่มา : สุนทร พรจำเริญ เอกสารประกอบการสอนเรื่องกรด-เบส โรงเรียนมหิดลวิทยานุสรณ์)
กลับไปที่เนื้อหา
บทเรียนที่ 13 บัฟเฟอร์
สารละลายบัฟเฟอร์ คือ สารละลายที่เมื่อเติมกรดแก่หรือเบสแก่ลงไปเพียงเล็กน้อย
ทำให้ pHของสารละลายเปลี่ยนไปน้อยมาก จนถือได้ว่าไม่เปลี่ยนแปลง
ชนิดของบัฟเฟอร์แบ่งออกเป็น 2 ชนิด
บัฟเฟอร์กรดคือ บัฟเฟอร์ที่เกิดจากกรดอ่อนกับเกลือของกรดอ่อน pH < 7
บัฟเฟอร์เบสคือ บัฟเฟอร์ที่เกิดจากเบสอ่อนกับเกลือของเบสอ่อน pH> 7
กรดแก่ เบสแก่ เป็นบัฟเฟอร์ไม่ได้ เพราะสารพวกนี้แตกตัว 100%ไม่มีโอกาสเกิดคู่กรดคู่เบส
ตัวอย่างสารละลายบัฟเฟอร์
การควบคุมของสารละลายบัฟเฟอร์

ลองทำดูสารละลายต่อไปนี้สารละลายใดเป็นบัฟเฟอร์กรด บัฟเฟอร์เบส หรือไม่เป็นบัฟเฟอร์
HCNและ KCN …………………………. H2S และ NaHS …………………………..
NH4Cl และ NH3………………………. NaF และ HF ………………………………
CH3NH2และCH3NH2Cl …………….. KNO2และHNO2…………………………….
HCl และ NaCl ………………………. KOH และ KCl ……………………………..
สารละลายบัฟเฟอร์ในธรรมชาติ
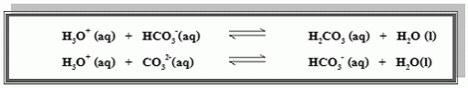
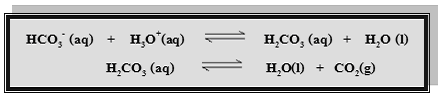
น้ำทะเลเป็นบัฟเฟอร์ที่มีองค์ประกอบซับซ้อนมาก สารและไอออนที่มีบทบาทสำคัญ
ในการควบคุม pH ของน้ำทะเลได้แก่กรดคาร์บอนิก (H2CO3)ไฮโดรเจนคาร์บอเนต ไอออน (HCO3-) และคาร์บอเนตไอออน (CO32-)
ถ้าเติมกรดลงในน้ำทะเล pH จะเปลี่ยนแปลงน้อยมาก เพราะ H3O+ในกรดที่เพิ่มลง
ไปจะทำปฏิกิริยา กับ HCO3-, CO32-ดังสมการ
นอกจากนี้น้ำทะเลอาจจะมีแคลเซียมอยู่ด้วยจะเข้าทำปฏิกิริยากับ H3O+ในกรด
ดังนี้
ถ้าเติมเบสลงในน้ำทะเล pH จะเปลี่ยนแปลงน้อยมาก เพราะ OH-ในเบสที่เติมลงไป
จะเข้าทำปฏิกิริยากับ HCO3-, H2CO3และของผสมระหว่าง Ca2+, HCO3-ดังสมการ
นอกจากนี้ในน้ำทะเลยังมีระบบบัฟเฟอร์อื่นๆ อีก เช่น กรดโบริก (H3BO3-) และ ได
ไฮโดรเจนโบเรตไอออน ( H2BO3-) ถ้าเติมกรดหรือเบส ลงในน้ำทะเลH3O+และ OH-
จะเข้าทำปฏิกิริยากับ H2BO3-และH2BO3-ดังสมการ
จะเห็นได้ว่า H3O+และ OH-ที่เติมลงไปถูกกำจัดโดยสารละลายบัฟเฟอร์ในน้ำ
ทะเลจึงไม่ทำให้ pH ของน้ำทะเลเปลี่ยนแปลง
สารละลายบัฟเฟอร์ในสิ่งมีชีวิต
1. ฟอสเฟตบัฟเฟอร์ H2PO4-/ HPO42-จะเกี่ยวข้องกับการทำงานของไต เมื่อเรา
ออกกำลังกายนาน ๆจะมีกรดเกิดขึ้นทำให้ pH ของ เลือดเปลี่ยนไป ระบบบัฟเฟอร์
H2PO4-/ HPO42-ในเลือดจะเข้าทำปฏิกิริยาเพื่อลดความเข้มข้นของกรดได้
H2PO4-จะถูกกำกัดออกมาทางปัสสาวะ
2. ระบบH2CO3/HCO3-จะควบคุม pH ของพลาสมาในเลือดให้มีค่าอยู่ระหว่าง
7.35-7.45ซึ่งเกิดปฏิกิริยาดังนี้
เนื่องจากความเป็นกรด-เบสในร่างกายของสิ่งมีชีวิตเป็นเรื่องที่สำคัญมาก ถ้า pH เปลี่ยนแปลงไปเพียง 0.2 หน่วย จากช่วง 7.35-7.45 อาจทำให้เจ็บป่วยได้
กลับไปที่เนื้อหา