สารชีวโมเลกุล:โปรตีน
![]()
บทเรียนที่ 1 กรดอะมิโน
ในธรรมชาติกรดอะมิโนที่พบเป็นองค์ประกอบในโปรตีนนั้นมี 20 ชนิด และเป็นกรดอะมิโนชนิดแอลฟา(a-amino acid) ซึ่งมีโครงสร้างและคุณสมบัติที่แตกต่างกันไป โดยสูตรโครงสร้างทั่วไปในโมเลกุลของกรดอะมิโนประกอบด้วย 3 หมู่ต่อกับอะตอมของคาร์บอนคือ หมู่อะมิโน (-NH2) และหมู่คาร์บอกซิล (-COOH) อย่างละ 1 หมู่ และหมู่โซ่ข้างหรือหมู่ R 1 หมู่
กรดอะมิโนทุกชนิดจะมีหมู่อะมิโนและหมู่คาร์บอกซิลเป็นองค์ประกอบเหมือนกัน แต่หมู่ R จะแตกต่างกันไปตามชนิดของกรดอะมิโน และสามารถเรียกชื่อกรดอะมิโนแต่ละชนิดโดยใช้คำย่อได้ 2 รูปแบบคือ แบบ 3 ตัวอักษร และแบบ 1 ตัวอักษร
| กรดอะมิโน |
คำย่อแบบ 3 ตัวอักษร |
คำย่อแบบ 1 ตัวอักษร |
|
อะลานีน (Alanine) |
Ala |
A |
|
อาร์จินีน (Arginine) |
Arg |
R |
|
แอสพาราจีน (Asparagine) |
Asn |
N |
|
กรดแอสพาร์ติค (Aspartic acid) |
Asp |
D |
|
ซิสเตอีน (Cysteine) |
Cys |
C |
|
กรดกลูตามิค (Glutamic acid) |
Glu |
E |
|
กลูตามีน (Glutamine) |
Gln |
Q |
|
กลัยซีน (Glycine) |
Gly |
G |
|
ฮิสติดีน (Histidine) |
His |
H |
|
ไอโซลูซีน (Isoleucine) |
Ile |
I |
|
ลูซีน (Leucine) |
Leu |
L |
|
ไลซีน (Lysine) |
Lys |
K |
|
เมไธโอนีน (Methionine) |
Met |
M |
|
ฟีนิลอะลานีน (Phenylalanine) |
Phe |
F |
|
โพรลีน (Proline) |
Pro |
P |
|
เซรีน (Serine) |
Ser |
S |
|
ธรีโอนีน (Threonine) |
Thr |
T |
|
ทริพโตเฟน (Tryptophan) |
Trp |
W |
|
Tyr |
Y |
|
|
วาลีน (Valine) |
Val |
V |
อะตอมของแอลฟาคาร์บอนในกรดอะมิโนทั้ง 20 ชนิด ยกเว้นในกลัยซีน เป็นอะตอมคาร์บอนที่ไม่สมมาตรหรือไครัลคาร์บอนอะตอม คือมีหมู่ที่แตกต่างกัน 4 หมู่ เกาะอยู่กับอะตอมคาร์บอนนี้ ซึ่งกรดอะมิโนที่มีอะตอมคาร์บอนที่ไม่สมมาตรจะแสดงสมบัติ optical activity คือสามารถหมุนระนาบแสงโพลาไรซ์ได้
กรดอะมิโนทุกชนิดที่พบในโปรตีนตามธรรมชาติจะมี configuration แบบ L- เมื่อเทียบกับสารมาตรฐานกลีเซอราลดีไฮด์ โดยที่ configuration แบบ D- และ L- เป็นไอโซเมอร์ซึ่งเป็นภาพเงากระจกซึ่งกันและกัน หรือเรียกว่าเป็น อีแนนทิโอเมอร์
กลับไปที่เนื้อหา
บทเรียนที่ 2 การสังเคราะห์เปบไทด์
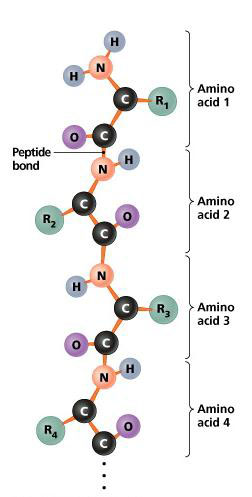
เมื่อหมู่คาร์บอกซิลของกรดอะมิโนโมเลกุลหนึ่งทำปฏิกิริยากับหมู่อะมิโนอีกโมเลกุลหนึ่งจะมีการสร้างพันธะเอไมด์ขึ้นซึ่งเรียกกันว่า “พันธะเพปไทด์” (peptide bond) กรดอะมิโนทั้งหลายของโปรตีนจะจับกันด้วยพันธะเพปไทด์ทั้งสิ้น
เพปไทด์และพอลิเพปไทด์
เพปไทด์ คือเอไมด์ที่ประกอบด้วยหน่วยของกรดอะมิโนตั้งแต่ 2 หน่วยขึ้นไป จับต่อกันด้วยพันธะเพปไทด์
เพปไทด์ที่ประกอบด้วยกรดอะมิโน 2 หน่วยเรียกว่า ไดเพปไทด์ (dipeptide) ถ้าประกอบด้วย 3 หน่วย เรียกว่า ไตรเพปไทด์ (tripeptide) ในกรณีที่มีหลาย ๆ หน่วยก็จัดเป็นสารที่เรียกว่า พอลิเพปไทด์ (polypeptide)
กลับไปที่เนื้อหา
บทเรียนที่ 3 ลำดับของกรดอะมิโน
การเขียนลำดับของกรดอะมิโน
การเขียนลำดับของกรดอะมิโนของพอลิเพปไทด์และโปรตีน กำหนดให้เขียนเป็นชื่อย่อโดยใช้พยัญชนะ 3 ตัวแรกของกรดอะมิโน และเรียกชื่อกนดอะมิโนในลำดับแรกด้วยการลงท้ายเสียง –yl (–อิล) แล้วต่อด้วยชื่อของกรดอะมิโนตัวสุดท้าย
การจัดลำดับของกรดกรดอะมิโน
ไตรเพปไทด์ จะมีจำนวนโครงสร้างปฐมภูมิที่เกิดขึ้นทั้งหมดได้เท่ากับ 3 x 2 x 1 = 6 หรือ 3! ( 3 แฟคทอเรียล) สรุปได้ว่าจำนวนโครงสร้างปฐมภูมิของพอลิเพปไทด์จะมีค่าเท่ากับ n! เมื่อ n คือจำนวนกรดอะมิโนที่เป็นองค์ประกอบ
กลับไปที่เนื้อหา
บทเรียนที่ 4 พันธะเพบไทด์และโปรตีน
พันธะเพปไทด์ (Peptide bond) คือ พันธะโคเวเลนต์ที่เกิดขึ้นระหว่าง C อะตอมในหมู่คาร์บอกซิล
() ของกรดอะมิโนโมเลกุลหนึ่งยึดกับ N อะตอม ในหมู่อะมิโน (-NH2) ของกรดอะมิโนอีกโมเลกุลหนึ่ง ดังภาพสมการ
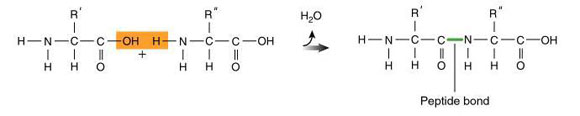
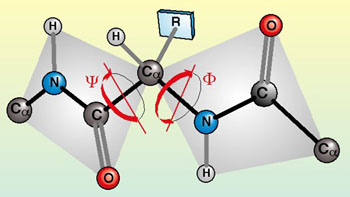
บริเวณที่เป็นพันธะเพปไทด์จะหมุนไม่ได้ ส่วนที่หมุนได้ คือ พันธะระหว่าง C - N หมุนด้วยมุม Ø และพันธะระหว่าง C - C หมุนด้วยมุม Ÿ ดังภาพ
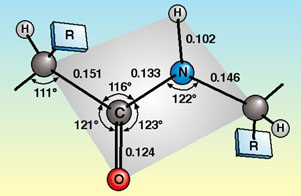
บริเวณที่เป็นพันธะเพปไทด์ อะตอมของธาตุจะทำมุมกัน ดังภาพ
![]() สารที่ประกอบด้วยกรดอะมิโน 2 โมเลกุล เรียกว่า ไดเพปไทด์
สารที่ประกอบด้วยกรดอะมิโน 2 โมเลกุล เรียกว่า ไดเพปไทด์![]() สารที่ประกอบด้วยกรดอะมิโน 3 โมเลกุล เรียกว่า ไตรเพปไทด์
สารที่ประกอบด้วยกรดอะมิโน 3 โมเลกุล เรียกว่า ไตรเพปไทด์![]() สารที่ประกอบด้วยกรดอะมิโนตั้งแต่ 100 โมเลกุลขึ้นไป เราเรียกพอลิเพปไทด์นี้ว่า โปรตีน
สารที่ประกอบด้วยกรดอะมิโนตั้งแต่ 100 โมเลกุลขึ้นไป เราเรียกพอลิเพปไทด์นี้ว่า โปรตีน
![]() โปรตีนเป็นพอลิเพบไทด์ ซึ่งมีมวลโมเลกุลมากกว่า 5,000
โปรตีนเป็นพอลิเพบไทด์ ซึ่งมีมวลโมเลกุลมากกว่า 5,000 ![]() สารสังเคราะห์บางชนิดก็เกิดพันธะเพปไทด์เหมือนกัน
สารสังเคราะห์บางชนิดก็เกิดพันธะเพปไทด์เหมือนกัน![]() พวกเพปไทด์ที่เป็นโมเลกุลเปิดไม่ดูดเป็นวงจะหาจำนวนพันธะเพปไทด์ได้ดังนี้
พวกเพปไทด์ที่เป็นโมเลกุลเปิดไม่ดูดเป็นวงจะหาจำนวนพันธะเพปไทด์ได้ดังนี้
![]() ถ้ากรดอะมิโน n ชนิด ชนิดละ 1 โมเลกุล มาทำปฏิกิริยาเกิดเป็นพอลิเพปไทด์แบบต่างๆ โดยที่พอลิเพปไทด์แต่ละแบบต่างประกอบด้วยกรดอะมิโนแต่ละชนิดเท่าๆ กัน จะพบว่า
ถ้ากรดอะมิโน n ชนิด ชนิดละ 1 โมเลกุล มาทำปฏิกิริยาเกิดเป็นพอลิเพปไทด์แบบต่างๆ โดยที่พอลิเพปไทด์แต่ละแบบต่างประกอบด้วยกรดอะมิโนแต่ละชนิดเท่าๆ กัน จะพบว่า
โปรตีนแบ่งตามลักษณะโครงสร้างออกเป็น 2 แบบ คือ
1. โปรตีนเส้นใย (Fibrous Proteins) มีลักษณะเป็นเส้นใยที่เกิดเป็นพอลิเพปไทด์สายยาวๆ เป็นโครงรูปที่มีลักษณะเฉพาะตัวและคงที่ ได้แก่ เกลียวแอลฟา (â-Helix) และแผ่นพลีตบีตา (ß -pleated sheet) โดยอาศัยแรงยึดระหว่างสาย เช่น ไฟโบรอินในเส้นไหม อีลาสตินในเอ็น คอลลาเจนในเนื้อเยื่อยึดต่อ เคอราตินในผม ขน คลีบ กีบ และเล็บ ไมโอซินในกล้ามเนื้อ เป็นต้น
2. โปรตีนก้อนกลม (Globular Proteine) มีลักษณะกลมมนหรือวงรี เพราะสายพอลิเพปไทด์ขดมวนกันอย่างหนาแน่น เช่น อินซูลิน แอลบูมิน โกบูลินในพลาสมา ฮีโมโกบิล และเอนไซม์ชนิดต่างๆ เป็นต้น
กลับไปที่เนื้อหา
บทเรียนที่ 5 อนุพันธ์ของกรดอะมิโน
กรดอะมิโนในสายพอลิเพปไทด์ที่เซลล์สังเคราะห์ขึ้นมาอาจจะถูกดัดแปลงหมู่ต่างๆ ไปบ้าง ตัวอย่างเช่น 4- ไฮดรอกซีโพรลีน (4-hydroxyproline) และ 5- ไฮดรอกซีไลซีน (5-hydroxylysine) ที่พบใน คอลลาเจน (collagen) ซึ่งเป็นโปรตีนที่พบมากที่สุดในร่างกายของสัตว์เลี้ยงลูกด้วยนม
กรดอะมิโนที่เป็นองค์ประกอบของโปรตีน ฮิสโตน (histones) ที่อยู่รวมกับสายดีเอ็นเอ (DNA) ในเซลล์ อาจเติมหมู่เมทิล แอซิติล หรือหมู่ฟอสเฟตเข้าไปเพิ่มเติม
ส่วน กรดแกมมาคาร์บอกซีกลูตามิก (gamma-carboxyglutamic acid) ที่เป็นส่วนประกอบของโปรตีนหลายตัวที่เกี่ยวข้องกับกระบวนการแข็งตัวของเลือดก็ถูกดัดแปลงมาจากกรดอะมิโนพื้นฐานเช่นกัน
|
|
|
ภาพที่ 1 แขนงข้างของอนุพันธ์กรดอะมิโนพื้นฐานที่เป็นองค์ประกอบของโปรตีน |
นอกเหนือจากการเป็นหน่วยย่อยของโปรตีนแล้ว กรดอะมิโนอิสระและอนุพันธ์ของกรดอะมิโนหลายตัวก็ยังทำหน้าที่ที่สำคัญอย่างอื่นได้อีกด้วย เช่น เป็นสารสื่อสัญญาณประสาท ได้แก่ ไกลซีนกรดแกมมาอะมิโนบิวทิริก (γ-aminobutyric acid หรือ GABA: a glutamate decarboxylation product) และ โดปามีน (dopamine) อนุพันธ์กรดอะมิโนตัวที่ชื่อ ฮิสตามีน (histamine) เป็นสารน้ำที่เซลล์ในระบบภูมิคุ้มกันหลั่งออกมา และ ไธรอกซิน (thyroxin) จากต่อมไธรอยด์ (thyroid gland) ทำหน้าที่เป็นฮอร์โมนกระตุ้นกระบวนการเมแทบอลิซึมของร่างกาย
|
|
|
ภาพที่ 2 กรดอะมิโนและอนุพันธ์ที่ไม่ได้เป็นองค์ประกอบของโปรตีน |
เกลือของกรดอะมิโนพื้นฐานตัวที่ชื่อกรดกลูตามิก เราสามารถนำมาใช้ประโยชน์ในการปรุงแต่งรสอาหารในรูปของผงชูรสซึ่งมีชื่อเรียกทางเคมีว่า โมโนโซเดียมกลูตาเมต (monosodium glutamate) รสชาติที่เกิดจากโมโนโซเดียมกลูตาเมต เป็นจัดเป็นรสชาติใหม่ที่นอกเหนือไปจากรสหวาน เปรี้ยว ขม เค็มที่เรารู้จักกันดี เราเรียกรสชาติที่ 5 นี้ว่า รสอูมามิ (umami)
|
|
|
|
นอกเหนือจากเกลือของกรดอะมิโนซึ่งให้รสชาติอูมามิแล้ว ไดเพปไทด์ตัวที่ชื่อ L- แอสปาติล L- ฟีนิลอะลานีน เมทิล เอสเทอร์ (L-aspartyl-L-phenylalanine methyl ester) หรือแอสพาร์เทม (aspartame) ยังให้รสหวานที่เราสามารถนำมาใช้เป็นสารความหวานทดแทนการใช้น้ำตาลได้ด้วย
|
|
|
ภาพที่ 4 แอสพาร์เทม |
กลับไปที่เนื้อหา
บทเรียนที่ 6 โครงสร้างโปรตีน
พันธะเพปไทด์ระหว่างกรดอะมิโน ทำให้กรดอะมิโนเรียงตัวต่อกันเป็นสายยาว แต่สายพอลิเพปไทด์ในโปรตีนไม่ได้เป็นสายที่ยืดออกเป็นเส้นตรง แต่จะม้วนหรือพับเข้าหากันทำให้โปรตีนมีโครงสร้างสามมิติที่เป็นเอกลักษณ์และมีคุณสมบัติทำงานได้จำเพาะอย่าง
โครงสร้างที่เป็นเอกลักษณ์ของโปรตีนเป็นตัวกำหนดหน้าที่ของโปรตีน การทำงานของโปรตีนทุกตัวขึ้นกับความสามารถในการจดจำและความสามารถในการจับกับโมเลกุลบางชนิด เช่น การที่โปรตีนในระบบภูมิคุ้มกันจับกับสิ่งแปลกปลอม หรือเอนไซม์จับกับตัวเข้าทำปฏิกิริยาที่จำเพาะ เป็นต้น
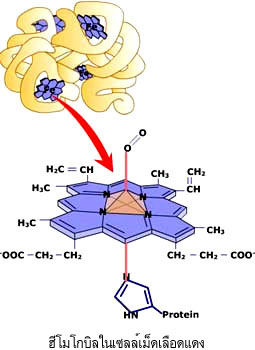
ไมโอโกลบิน (myoglobin) และฮีโมโกลบิน (hemoglobin) เป็นโปรตีนที่ได้มีการศึกษาโครงสร้างอย่างละเอียดเป็นอันดับแรกๆ ไมโอโกลบินเป็นโมเลกุลที่มีลักษณะกลมภายในตัน ประกอบไปด้วยกรดอะมิโน 153 ตัว สายพอลิเพปไทด์ของมันมีการขดตัวโดยมีทั้งส่วนที่เป็นแท่งและส่วนที่ขดงอ ส่วนที่เป็นแท่งมีลักษณะเป็นเกลียว ซึ่งบางเกลียวก็เป็นเกลียวสั้น บางเกลียวก็ยาว เนื้อที่ภายในก้อนกลมเพียงพอให้โมเลกุลของน้ำอยู่ได้เพียงสี่โมเลกุล แขนงข้างของกรดอะมิโนที่มีความเป็นขั้วจะอยู่ตามผิวภายนอก ส่วนแขนงข้างของกรดอะมิโนที่โมเลกุลแสดงความไม่มีขั้วจะฝังตัวเองอยู่ภายในโปรตีน กรดอะมิโนโพรลีนจะอยู่ตามส่วนที่ขดงอของโมเลกุล การศึกษาโครงสร้างของฮีโมโกลบินพบว่าเป็นโปรตีนที่ประกอบด้วยสายพอลิเพปไทด์หลายสาย แต่ละสายมีการขดตัวเป็นก้อนกลมและเกาะกันเป็นโมเลกุลเดียวที่สามารถทำงานได้อย่างมีประสิทธิภาพ ลักษณะการขดตัวของฮีโมโกลบินมีความคล้ายคลึงกับไมโอโกลบินมาก คือมีปริมาณของเกลียว หรือลักษณะการขดงอใกล้เคียงกัน จึงอาจกล่าวได้ว่าโครงสร้างที่คล้ายคลึงกันทำหน้าที่ได้เหมือนกัน

ดังนั้นในการศึกษาโครงสร้างของโปรตีนชนิดอื่นๆ เพื่อให้เข้าใจถึงหน้าที่การทำงาน จึงจำเป็นต้องศึกษาโครงรูปในส่วนต่างๆ ของโปรตีน ว่าการขดตัวในแต่ละช่วงของสายพอลิเพปไทด์นั้นมีลักษณะอย่างไรบ้าง เช่น ขดเป็นเกลียวหรือเรียงตัวขนานกันเป็นแผ่นอย่างมีระเบียบแบบแผน หรือขดงออย่างไม่เป็นระเบียบ และโครงรูปในแต่ละส่วนนั้นมีการยึดเหนี่ยวกันไว้ในลักษณะใด เพื่อให้เข้าใจโครงสร้างสามมิติของโปรตีน แต่อย่างไรก็ตามการศึกษาเพื่อให้เข้าใจโครงสร้างสามมิติแต่เพียงอย่างเดียวไม่เพียงพอที่จะใช้อธิบายกลไกการทำงานของโปรตีนนั้นๆ การศึกษาการเรียงตัวของกรดอะมิโนในสายพอลิเพปไทด์จะช่วยให้เราเข้าใจกลไกการเข้าจับของโปรตีนกับชีวโมเลกุลอื่น โดยอาศัยคุณสมบัติทางเคมีของแขนงข้างของกรดอะมิโนในบริเวณที่ทำงานได้ (active site) ของโปรตีน นอกจากนี้ลำดับการเรียงตัวของกรดอะมิโนยังมีความสำคัญในแง่ที่มันเป็นตัวกำหนดลักษณะการขดงอของส่วนต่างๆ ในสายพอลิเพปไทด์อีกด้วย
ดังนั้นขั้นตอนในการดูลักษณะโครงสร้างของโปรตีนจึงแบ่งออกเป็นหลายระดับตามความซับซ้อน หากเป็นการดูลำดับการเรียงตัวของกรดอะมิโนในสายพอลิเพปไทด์โดยยังไม่สนใจรูปร่างของโปรตีน เราเรียกว่าเป็นการศึกษาโครงสร้างในระดับพื้นฐาน (primary structure) หากเราสนใจลักษณะการขดงอที่มีระเบียบในแต่ละส่วนของสายพอลิเพปไทด์ เราเรียกว่าเป็นการศึกษาโครงสร้างในระดับที่สอง (secondary structure) ส่วนการดูลักษณะโครงสร้างโปรตีนว่าแต่ละส่วนในสายพอลิเพปไทด์มีการยึดเหนี่ยวเข้าด้วยกันอย่างไรจึงทำให้เกิดเป็นโครงสร้างสามมิติที่เป็นเอกลักษณ์ของโปรตีนในสภาพธรรมชาติหรือใกล้เคียงสภาพธรรมชาติ เป็นการดูลักษณะโครงสร้างระดับที่สาม (tertiary structure) แต่ถ้าหากโปรตีนนั้นประกอบไปด้วยสายพอลิเพปไทด์มากกว่าหนึ่งสายมารวมกันเป็นโครงสร้างเดียว เราจำเป็นต้องดูลักษณะของกลุ่มก้อนที่มีการยึดเหนี่ยวหน่วยโครงสร้างระดับที่สามหลายหน่วยเข้าไว้ด้วยกัน ซึ่งเราเรียกว่าเป็นโครงสร้างระดับที่สี่ (quaternary structure) ของโปรตีน
โครงสร้างระดับพื้นฐานของโปรตีนแต่ละชนิดมีความจำเพาะไม่เหมือนกับโปรตีนชนิดอื่นๆ การดูลักษณะโครงสร้างระดับนี้ของโปรตีนมีความสำคัญอย่างยิ่ง เพราะมันเป็นตัวกำหนดว่าโครงสร้างในระดับสูงขึ้นไปควรจะเป็นอย่างไร แต่ความรู้เกี่ยวกับโครงสร้างระดับนี้ก็ยังไม่เพียงพอที่จะอธิบายการทำงานของโปรตีนได้

โครงสร้างระดับที่สองของโปรตีนชี้ให้เห็นการม้วน การขด หรือการทบไปทบมาเป็นแผ่นพลีท หรือเป็นแผ่นบิดที่มีความเป็นระเบียบแบบแผน ซึ่งปรากฏอยู่ในแต่ละช่วงของสายพอลิเพปไทด์ โครงสร้างระดับนี้อยู่ตัวได้ดีเนื่องจากมีพันธะไฮโดรเจนเป็นตัวจัดระเบียบ
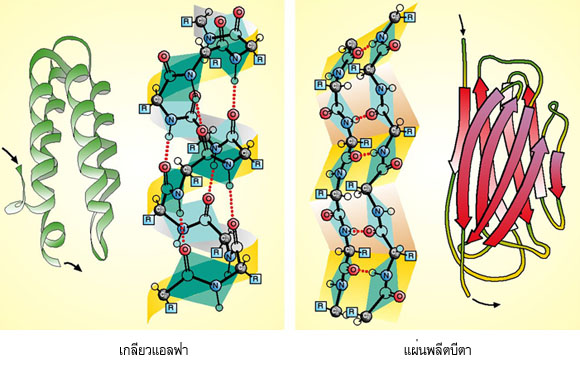
โครงสร้างระดับที่สองที่พบมากได้แก่ เกลียวแอลฟา( α-helix) และ แผ่นพลีทบีตา( ß-pleated sheet)
ในเกลียวแอลฟา สายพอลิเพปไทด์จะม้วนตัวเป็นเกลียวแบบเวียนขวา โดยที่หนึ่งรอบเกลียวจะมีกรดอะมิโน 3.6 ตัว และมีระยะระหว่างเกลียวเท่ากับ 5.4 อังสตรอม เกลียวแอลฟาอยู่ตัวได้ดีเพราะมีพันธะไฮโดรเจนระหว่างกลุ่ม CO ในพันธะเพปไทด์ของกรดอะมิโนตัวหนึ่งกับกลุ่ม NH ในพันธะเพปไทด์ของกรดอะมิโนที่อยู่ถัดไปอีก 4 ตัว ส่วนแขนงข้างของกรดอะมิโนจะชี้ออกสู่ด้านนอกรอบตัวเกลียว

โปรตีนบางตัวมีปริมาณเกลียวแอลฟามาก แต่บางชนิดมีน้อยหรือไม่มีเลย ส่วนใหญ่โปรตีนที่ทำหน้าที่เกี่ยวกับโครงสร้าง เช่น โปรตีนเส้นใยมักจะมีปริมาณเกลียวแอลฟามาก (เช่น คอลลาเจน) ส่วนโปรตีนทั่วไปที่ไม่เป็นเส้นใย เกลียวของโปรตีนอาจเป็นเกลียวเวียนขวาในลักษณะอื่น หรืออาจเป็นเกลียวแอลฟาที่บิดเบี้ยวไปบ้าง

เกลียวหลายๆ อันในโปรตีนอาจหมุนรอบตัวเองร่วมกันเป็นเกลียวซ้อนเกลียว ( α-helical coiled coil) คล้ายการควั่นเชือก ซึ่งจะช่วยเพิ่มความแข็งแรงและความเหนียวให้กับโครงสร้างมากขึ้น เช่น โปรตีนเคราติน (keratin) ในเส้นผม โปรตีนโทรโปไมโอซิน (tropomyosin) ในเส้นใยกล้ามเนื้อ
ในแผ่นพลีทบีตา สายพอลิเพปไทด์จะขดตัวอยู่ในลักษณะขนานกัน ซึ่งอาจมีทิศทางการเรียงตัวของกรดอะมิโนที่มีหมู่อะมิโนอิสระและกรดอะมิโนที่มีหมู่คาร์บอกซิลอิสระไปในทางเดียวกัน (parallel) หรือมีทิศสวนทางกัน (antiparallel) ก็ได้ โดยมีพันธะไฮโดรเจนระหว่างกลุ่ม CO และกลุ่ม NH ของสายพอลิเพปไทด์ที่วิ่งเคียงคู่กันนั้น กรดอะมิโนแต่ละตัวบนสายพอลิเพปไทด์เรียงตัวกันด้วยระยะ 3.5 อังสตรอม แขนงข้างของกรดอะมิโนจะชี้ออกสู่ด้านล่างและด้านบนของสายพอลิเพปไทด์
ในโปรตีนชนิดเส้นใยจะพบว่าสายพอลิเพปไทด์ที่อยู่เคียงคู่กันจะวิ่งสวนทางกัน แต่ในโปรตีนชนิดก้อนกลม สายพอลิเพปไทด์ที่อยู่เคียงคู่กันอาจวิ่งไปในทางเดียวกันหรือสวนทางกันก็ได้ และแผ่นพลีทบีตาในโปรตีนที่ไม่เป็นเส้นใยมักจะไม่อยู่ในระนาบเดียวกันดังแผ่นพลีทที่ค่อนข้างสมบูรณ์อย่างที่ปรากฏในใยไหมหรือใยแมงมุม แต่จะบิดเล็กน้อยไปในทิศทางตามเข็มนาฬิกา
ในโปรตีนก้อนกลมมักจะพบว่าโครงสร้างระดับที่สอง เช่น เกลียวอัลฟา หรือแผ่นพลีทบีตาที่อยู่ใกล้กันรวมตัวกันเป็นโครงสร้างระดับที่สาม โดยมีส่วนอื่นๆ ของพอลิเพปไทด์เป็นสายต่อเชื่อมโยงระหว่างโครงสร้างที่ต่างๆ กันนั้น และพบว่าแขนงข้างในโครงสร้างระดับสองที่ใกล้เคียงกันจะอัดตัวกันแน่น
โครงสร้างระดับที่สามของโปรตีนประกอบด้วยโครงสร้างระดับที่สองหลายๆ ส่วนมารวมกัน โดยที่คุณสมบัติทางเคมีของกรดอะมิโนแต่ละตัวในโปรตีนจะเป็นตัวกำหนดว่าโครงสร้างระดับที่สองหลายๆ ส่วนนั้นจะยึดเหนี่ยวกันไว้ในลักษณะใด
โครงสร้างระดับที่สามของโปรตีนอาจมีลักษณะเป็นก้อนกลม (globular structure) หรือเป็นเส้นใย (fibrous structure) ก็ได้
แรงยึดเหนี่ยวในโมเลกุลที่ช่วยยึดสายพอลิเพปไทด์ให้มีโครงสร้างระดับที่สามที่เหมาะสมต่อหน้าที่ทางชีวภาพของโปรตีนนั้น ล้วนไม่ใช่พันธะโควาเลนต์ แต่เป็นแรงยึดเหนี่ยวที่มีพลังงานระดับต่ำ เช่น พันธะไฮโดรเจน แรงไฮโดรโฟบิก แรงแวนเดอร์วาลส์ และพันธะระหว่างประจุ

ถึงแม้ว่าพันธะที่ไม่ใช่โควาเลนต์เหล่านี้จะเป็นแรงดึงดูดอย่างอ่อนแต่ก็สามารถยึดโครงสร้างสามมิติของโปรตีนให้อยู่ตัวได้ ทั้งนี้เพราะแรงดึงดูดชนิดอ่อนเหล่านี้มีเป็นจำนวนมาก
โครงสร้างระดับที่สี่ของโปรตีนเป็นโครงสร้างที่ยึดเหนี่ยวหน่วยโครงสร้างระดับที่สามหลายหน่วยเข้าไว้ด้วยกันกลายเป็นโมเลกุลเดียว
หน่วยโครงสร้างระดับที่สามแต่ละหน่วยในโครงสร้างระดับที่สี่อาจเป็นหน่วยที่มีโครงสร้างแบบเดียวกันหรือต่างกันก็ได้ และจำนวนหน่วยโครงสร้างระดับที่สามอาจมีน้อยหรือมากก็ได้

โปรตีนจะมีโครงสร้างสามมิติเป็นแบบใดนั้นขึ้นอยู่กับชนิดของกรดอะมิโนที่มาประกอบกันเป็นสายพอลิเพปไทด์และสภาวะความเป็นกรดด่างในเซลล์ที่มีผลต่อแรงยึดเหนี่ยวในโมเลกุล
การที่โครงสร้างสามมิติของโปรตีนขึ้นอยู่กับแรงดึงดูดชนิดอ่อน ทำให้โครงรูปของโปรตีนเปลี่ยนแปลงไปได้ง่ายเมื่อสภาพแวดล้อมเปลี่ยนแปลงไป ซึ่งอาจมีผลต่อการทำงานของโปรตีน
สภาพแวดล้อมที่รุนแรง เช่น อุณหภูมิสูง pH สูงหรือต่ำมากๆ หรือมีสารบางชนิด เช่น ยูเรีย และ กวานิดีนไฮโดรคลอไรด์ อาจทำลายแรงดึงดูดชนิดอ่อนเหล่านี้ ทำให้โครงสร้างของโปรตีนเปลี่ยนไปจนกระทั่งโปรตีนไม่สามารถทำหน้าที่ทางชีวภาพ ปรากฏการณ์เช่นนี้เรียกว่า การเสียสภาพของโปรตีน (denaturation)
ในบางกรณีโครงสร้างของโปรตีนที่เสียสภาพธรรมชาติไปแล้ว อาจกลับคืนสู่โครงร่างเดิมภายหลังการปรับสภาพแวดล้อมกลับให้เหมือนเดิม แต่ในบางกรณีโปรตีนที่เสียสภาพไม่อาจกลับมาเป็นโปรตีนที่สามารถทำหน้าที่เหมือนเดิมได้
กลับไปที่เนื้อหา









