อินดิเคเตอร์
![]()
อินดิเคเตอร์คืออะไร
อินดิเคเตอร์ (Indicator) คือ สารที่ใช้ทดสอบความเป็นกรด – เบส ของสารละลาย โดยส่วนใหญ่จะเป็นอินทรีย์ที่มีโครงสร้างสลับซับซ้อนมีสมบัติเป็นกรดอ่อนหรือเบสอ่อนแต่ส่วนใหญ่จะเป็นกรดอ่อน
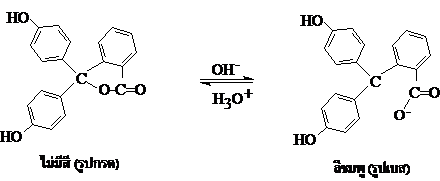
สมบัติของอินดิเคเตอร์
1.อินดิเคเตอร์แต่ละชนิดมีช่วง pH ของการเปลี่ยนสีจำกัด
2. อินดิเคเตอร์โดยทั่วไปจะมีสารที่ใหสีแตกต่างกัน
3. สีของอินดิเคเตอร์จะเปลี่ยนไปเมื่อค่า pH เปลี่ยนแปลง
อินดิเคเตอร์ส่วนใหญ่เป็นสารละลายที่มีน้ำหรือแอลกอฮอล์เป็นตัวทำละลาย โดยปกติใช้ความเข้มข้นร้อยละ 0.1 และใช้เพียง 2-3 หยด ก็จะเห็นสีได้ชัดเจน สีของอินดิเคเตอร์เปลี่ยนไปตามค่า pH ของสารละลาย
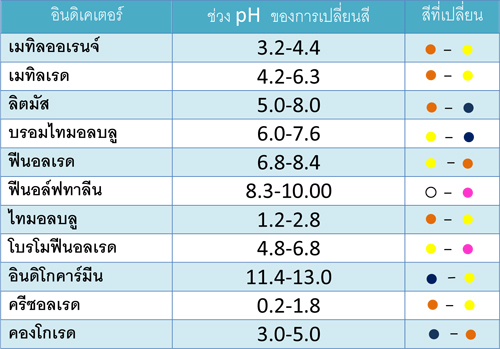
ตารางแสดงช่วงการเปลี่ยนสีของอินเคเตอร์บางชนิด
กลับไปที่เนื้อหา
ประเภทของอินดิเคเตอร์
อินดิเคเตอร์แต่ละชนิดจะมีการตรวจสอบความเป็นกรด-เบสของสารละลายแตกต่าง กัน อินดิเคเตอร์ที่นิยมใช้กันมากมี 2ประเภท คือ กระดาษลิตมัสและยูนิเวอร์ซัลอินดิเคเตอร์
1. กระดาษลิตมัสเป็นอินดิเคเตอร์ที่เรารู้จักกันดี กระดาษลิตมัสมี 2 สี ได้แก่ กระดาษลิตมัสสีแดงและกระดาษลิตมัสสีน้ำเงิน
เมื่อใช้กระดาษลิตมัสตรวจสอบสารละลายจะสามารถจำแนกสารได้เป็น 3 ประเภท ดังนี้
+ สารละลายที่มีสมบัติเป็นกรด จะเปลี่ยนสีกระดาษลิตมัสจากสีน้ำเงินไปเป็นสีแดง
+ สารละลายที่มีสมบัติเป็นเบส จะเปลี่ยนสีกระดาษลิตมัสจากสีแดงไปเป็นสีน้ำเงิน
+ สารละลายที่มีสมบัติเป็นกลาง จะไม่ทำปฏิกิริยากับกระดาษลิตมัสทั้งสีน้ำเงินและสีแดง กระดาษลิตมัสจึงไม่เปลี่ยนสี
2. ยูนิเวอร์ซัลอินดิเคเตอร์เป็นอินดิเคเตอร์ที่มีการ เปลี่ยนสีเกือบทุกค่า pH จึงใช้ทดสอบหาค่า pH ได้ดี อินดิเคเตอร์ชนิดนี้มีทั้งแบบที่เป็นกระดาษและแบบสารละลาย
รูปแสดงกระดาษยูนิเวอร์ซัลอินดิเคเตอร์
รูปแสดงการเปลี่ยนสีของกระดาษยูนิเวอร์ซัลอินดิเคเตอร์
ยูนิเวอร์ซัลอินดิเคเตอร์แบบสารละลายจะเปลี่ยนสีเมื่อใช้ทดสอบสารละลายที่มีค่า pH อยู่ในช่วงที่แตกต่างกัน ดังตัวอย่างต่อไปนี้
+ ฟีนอล์ฟทาลีน เป็นสารละลายใสไม่มีสีซึ่งจะเปลี่ยนเป็นสีชมพู เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 8.3-10.0
+ เมทิลเรด เป็นสารละลายสีแดงซึ่งจะเปลี่ยนเป็นสีเหลือง เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 4.2-6.2
+ บรอมไทมอลบลู เป็นสารละลายสีเหลืองซึ่งจะเปลี่ยนเป็นสีน้ำเงิน เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 6.0-7.6
+ ฟีนอลเรด เป็นสารละลายสีเหลืองซึ่งจะเปลี่ยนเป็นสีแดง เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 6.8-8.4
ตารางแสดงช่วงการเปลี่ยนสีของอินดิเตอร์เตอร์บางชนิด
|
อินดิเคเตอร์
|
ช่วง pH ที่เปลี่ยนสี
|
สีที่เปลี่ยน
|
|
เมทิลออเรนจ์ เมทิลเรด ลิตมัส บรอมไทมอลบลู ฟีนอลเรด ฟีนอล์ฟทาลีน |
3.1-4.4 4.2-6.3 5.0-8.0 6.0-7.6 6.8-8.4 8.3-10.0 |
แดง-เหลือง แดง-เหลือง แดง-น้ำเงิน เหลือง-น้ำเงิน เหลือง-แดง ไม่มีสี-ชมพูเข้ม |
การแปรความหมายเช่น
1) เมทิลเรด
ช่วง pH ที่เปลี่ยนสี คือ 4.2-6.3
สีที่เปลี่ยน คือ แดง-เหลือง
หมายถึง ถ้าสารละลายมี pH ต่ำกว่า 4.2 จะมีสีแดง
ถ้าสารละลายมี pH ช่วง 4.2-6.3 จะมีสีส้ม
(สีผสมของสีแดงกับสีเหลือง)
ถ้าสารละลายมี pH มากกว่า 6.3 จะมีสีเหลือง
สรุป
2) ฟีนอล์ฟทาลีน
ช่วง pH ที่เปลี่ยนสี คือ 8.3- 10.0
สีที่เปลี่ยน คือ ไม่มีสี-ชมพู
หมายถึง ถ้าสารละลายมี pH ต่ำกว่า 8.3 จะไม่มีสี
ถ้าสารละลายมี pH อยู่ในช่วง 8.3-10.0 จะมีสีชมพูอ่อน (ไม่มีสีผสมกับสีชมพู)
ถ้าสารละลายมี pH มากกว่า 10.0 จะมี
สีชมพูเข้ม
สรุป
ตัวอย่างถ้าต้องการทดสอบสารละลาย X โดยการเติมฟีนอล์ฟทาลีน พบว่ามีสีชมพู สารละลาย X มี pH เท่าใด
การใช้อินดิเคเตอร์ จะบอกได้เป็นช่วง pH ที่เปลี่ยนสี ดังนั้นสารละลาย X เปลี่ยนเป็นสีชมพูในฟีนอล์ฟทาลีน เพราะฉะนั้นสารละลาย X จึงมีค่า pH มากกว่า 10
อินดิเคเตอร์จากธรรมชาติ คือ สารธรรมชาติที่สกัดได้จากส่วนต่างๆ ของพืช สามารถใช้เพื่อตรวจสอบความเป็นกรด-เบสของสารละลายได้
ตารางแสดงช่วงการเปลี่ยนสีของอินดิเคเตอร์จากธรรมชาติบางชนิด
|
ชนิดของพืช
|
ช่วง pH ที่เปลี่ยนสี
|
สีที่มีการเปลี่ยนแปลง
|
|
อัญชัน กุหลาบ กระเจี๊ยบ ชงโค บานไม่รู้โรย ดาวเรือง ผกากรอง
|
1-3 3-4 6-7 6-7 8-9 9-10 10-11
|
แดง-ม่วง ชมพู-ไม่มีสี แดง- เขียว ชมพู-เขียว แดง-ม่วง ไม่มีสี-เหลือง ไม่มีสี-เหลือง
|
การใช้อินดิเคเตอร์ในการทดสอบหาค่า pH ของสารละลายนั้นจะทราบค่า pH โดยประมาณเท่านั้น ถ้าต้องการทราบค่า pH ที่แท้จริงจะต้องใช้เครื่องมือวัด pH ที่เรียกว่า"พีเอชมิเตอร์ (pH meter)"ซึ่งเป็นเครื่องมือที่สามารถตรวจวัดค่า pH ของสารละลายได้เป็นเวลานานติดต่อกัน ทำให้ตรวจสอบการเปลี่ยนแปลงความเป็นกรด-เบสของสารละลายได้ และค่า pH ที่อ่านได้จะมีความละเอียดมากกว่าการใช้อินดิเคเตอร์
รูปแสดงพีเอชมิเตอร์
กลับไปที่เนื้อหา
อินดิเคเตอร์กับการไทเทรต
อินดิเคเตอร์กับการไทเทรตกรด-เบส
อินดิเคเตอร์กรด-เบส ที่เหมาะสมกับปฏิกิริยาการไทเทรตจะต้องมีค่า pH ที่จุดกึ่งกลางช่วงการเปลี่ยนสีใกล้เคียงหรือเท่ากับ pH ที่จุดสมมูลของปฏิกิริยา นอกจากนี้ การเลือกใช้อินดิเคเตอร์กรด-เบส ต้องพิจารณาสีที่ปรากฎ จะต้องมีความเข้มมากพอที่จะมองเห็นได้ง่าย หรือเห็นการเปลี่ยนสีได้ชัดเจน ช่วงการเปลี่ยนสีของอินดิเคเตอร์ จะเกิดขึ้นในช่วง 2 หน่วย pH
ตัวอย่างเช่น การไทเทรตกรดแก่กับเบสแก่ pH ของสารละลายผลิตภัณฑ์ที่เกิดจากปฏิกิริยาการไทเทรต เมื่อถึงจุดสมมูลมีค่าใกล้เคียง 7 ก็ควรเลือกใช้อินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนสีใกล้เคียงกับ 7 เช่น อาจใช้โบรโมไทมอลบลูหรือ ฟีนอล์ฟทาลีน ซึ่งจะเปลี่ยนจากไม่มีสีเป็นสีชมพู ในช่วง pH 8.20-10.00 เป็นต้น ดังนั้น ถ้าทราบ pH ของสารละลายที่จุดสมมูลของปฏิกิริยาการไทเทรตก็สามารถเลือกอินดิเคเตอร์ที่เหมาะสมได้
การเลือกอินดิเคเตอร์ ก็ขึ้นอยู่กับชนิดของปฏิกิริยาระหว่างกรดกับเบส เพราะที่จุดสมมูลของแต่ละปฏิกิริยานั้น มีค่า pH ที่ต่างกัน
วิธีการไทเทรตกรด – เบส
คือ นำสารละลายกรด – เบสตัวอย่างที่ต้องการหาปริมาณ มาทำการไทเทรตกับสารละลายเบส – กรดมาตรฐานที่ทราบค่าความเข้มข้น หมายความว่า ถ้าสารละลายตัวอย่างเป็นสารละลายกรดจะต้องใช้สารละลายมาตรฐานที่เป็นเบสมาทำการไทเทรต แล้วบันทึกปริมาตรของสารละลายมาตรฐานที่ใช้ จากนั้นจึงนำไปคำนวณหาปริมาณของสารตัวอย่าง ในทางตรงกันข้ามถ้าใช้สารละลายตัวอย่างเป็นเบส ก็จะต้องใช้สารละลายมาตรฐานเป็นกรดสารละลายมาตรฐานที่ทราบความเข้มข้นแน่นอนแล้ว จะถูกบรรจุอยู่ในเครื่องแก้วที่เรียกว่าซึ่งจะมีก๊อกไขเปิด – ปิดเพื่อหยดสารละลายมาตรฐานลงมายังขวดรูปกรวยที่บรรจุสารละลายตัวอย่างที่ต้องการวิเคราะห์ไว้แล้วในการไทเทรตจะค่อยๆ หยดสารละลายมาตรฐานลงมาทำปฏิกิริยากับสารละลายตัวอย่างในขวดรูปกรวย เขย่าหรือหมุนขวดรูปกรวยเพื่อให้สารผสมกันไทเทรตจนกระทั่งอินดิเคเตอร์เปลี่ยนสีจึงหยุดการไทเทรต จากนั้นให้บันทึกปริมาตรสารละลายมาตรฐานที่ใช้เพื่อนำไปคำนวณหา pH ของสารละลาย
http://www.lakelandschools.us/lh/lburris/pages/acid-base.htm
รูปแสดงการอ่านค่าปริมาตรของเหลว
(ที่มา : สุนทร พรจำเริญ เอกสารประกอบการสอนเรื่องกรด-เบส โรงเรียนมหิดลวิทยานุสรณ์)
กราฟของการไทเทรตจะช่วยในการเลือกอินดิเคเตอร์ที่เหมาะสมได้ดี เพราะกราฟจะแสดงค่า pH ของสารละลายขณะไทเทรต ตั้งแต่ก่อนจุดสมมูล ที่จุดสมมูล และหลังจุดสมมูล จุดที่ pH ของสารละลายเปลี่ยนแปลงมาก ซึ่งเป็นจุดสมมูลนั้น จะบอกช่วง pH ของอินดิเคเตอร์ที่จะเลือกใช้ ในการพิจารณาเลือกอินดิเคเตอร์ จากกราฟของการไทเทรต จะแบ่งออกตามชนิดของปฏิกิริยาดังนี้
1.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสแก่
รูปกราฟของการไทเทรตระหว่างกรดแก่และเบสแก่ จะแสดง pH ที่จุดสมมูลอยู่ที่ pH ใกล้เคียง 7
จากกราฟ จะเห็นว่าค่า pH เปลี่ยนแปลงรวดเร็วที่จุดใกล้ๆ จุดยุติ (ตั้งแต่ pH 4-10) ดังนั้น อินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนแปลงสีระหว่าง 4 ถึง 10 ก็สามารถนำมาใช้ได้ ซึ่ง อินดิเคเตอร์ที่เหมาะสมที่อาจใช้ได้ ได้แก่ เมทิลเรด (4.4-6.2) โบรโมไทมอลบลู (6.0-7.5) และ ฟีนอล์ฟทาลีน(8.2-10.0) ดังแสดงในภาพ แต่เรามักจะนิยมใช้ฟีนอล์ฟทาลีน เพราะสังเกตการเปลี่ยนแปลงสีได้ชัดเจน สำหรับ โบรโมคลีซอล กรีน (3.8-5.4) ไม่เหมาะสมที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแก่และเบสแก่ เพราะช่วงเปลี่ยนสีที่เป็นรูปเบสของอินดิเคเตอร์ จะเกิดก่อนจุดสมมูล ทำให้เกิดความคลาดเคลื่อนในการบอกจุดยุติ
2.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
การเลือกอินดิเคเตอร์สำหรับการไทเทรตกรดอ่อน เช่น กรดแอซิติก กับเบสแก่ เช่น NaOH จะมีข้อจำกัดมากกว่าที่จุดสมมูลของการไทเทรต สารละลายจะมีโซเดียมแอซิเตต ทำให้สารละลายเป็นเบส มี pH มากกว่า 7

รูปกราฟแสดงการไทเทรตระหว่างกรดอ่อนกับเบสแก่และอินดิเคเตอร์ที่เหมาะสม
จากกราฟจะเห็นได้ว่า เมทิลเรด จะเปลี่ยนสีก่อนจุดสมมูลจึงไม่เหมาะที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแอซิติกกับ NaOH (เข้มข้น 0.100 M) ฟีนอล์ฟทาลีนเปลี่ยนสีที่ช่วงจุดสมมูลพอดี โบรโมไทมอลบลู อาจจะใช้เป็นอินดิเคเตอร์ได้ดี เมื่อใช้สีมาตรฐานเทียบ
3. อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
การเปลี่ยนแปลง pH ของสารละลายขณะไทเทรตเบสอ่อน เช่น NH3กับกรดแก่ เช่น HCl จะค่อยๆ ลดลง เมื่อใช้ HCl เป็นสารมาตรฐาน ที่จุดยุติจะได้เกลือ NH4Cl และ pH < 7 ในการไทเทรต 0.100 M NH3กับ 0.100 M HCl จะได้กราฟของการไทเทรต (ดังภาพ)

รูปกราฟของการไทเทรตระหว่าง 0.1000 M NH3กับ 0.1000 M HCl
จากกราฟ เราสามารถพิจารณาชาวง pH 3-7.5 ในการเลือกอินดิเคเตอร์ ซึ่งเราอาจใช้โบรโมไทมอลบลูหรือเมทิลเรดได้ แต่ไม่ควรใช้ฟีนอล์ฟทาลีนเพราะช่วง pH ของฟีนอล์ฟทาลีนมากกว่า 7 ทำให้เกิดความคลาดเคลื่อนในการบอกจุดสมมูล
ตัวอย่างที่ 1กำหนดช่วง pH ของอินดิเคเตอร์ให้ดังนี้

จงเลือกอินดิเคเตอร์ที่เหมาะสมที่สุดในการไทเทรตระหว่างสารละลาย 0.1 โมล/ลิตร HCN จำนวน 50 cm3กับ 0.1 โมล/ลิตร จำนวน 50 cm3กำหนดค่า Kaของกรด HCN = 7.2 x 10-10 ที่ 250C และ log 8.4 = 0.92
วิธีทำ
HCN (aq) + NaOH(aq) ---->NaCN (aq) + H2O (l)
| เพราะฉะนั้นจำนวนโมลของ HCN = | = 5 x 10-3โมล | |
| เพราะฉะนั้นจำนวนโมลของ NaOH = | = 5 x 10-3โมล | |
ดังนั้นสารละลายทั้งสองทำปฏิกิริยากันพอดีด้วยจำนวนโมลเท่ากันได้ผลิตภัณฑ์เป็น NaCN = 5 x 10-3โมล ในปริมาตร 50 + 50 = 100 cm3
เพราะฉะนั้น [NaCN] =1000/100 = x 5 x 10-3= 0.05 โมล/ลิตร
NaCN แตกตัวได้ 100 % ดังนี้
NaCN (aq)Na+(aq) + CN-(aq)
0.05 0.05 0.05 โมล/ลิตร
CN-(aq) + H2OHCN (aq) + OH-(aq)
ความเข้มข้นเริ่มต้น 0.05 0 0
ความเข้มข้นที่เปลี่ยนไป -x +x +x
ความเข้มข้นที่ภาวะสมดุล 0.05-x x x

1.4 x 10-5=![]()
1.4 x 10-5=![]()
(![]() x มีค่าน้อยมาก 0.05-x
x มีค่าน้อยมาก 0.05-x![]() 0.05)
0.05)
x = 8.4 x 10-4= [OH-]
pOH = -log[OH-] = -log[8.4 x 10-4] = -0.92 + 4 = 3.08
pH = 14 - pOH = 14 - 3.08 = 10.92
เนื่องจาก pH ของสารละลายหลังไทเทรตเท่ากับ 10.92 ดังนั้นจะต้องเลือกใช้อินดิเคเตอร์ไทมอลทาลีน ซึ่งมีช่วงการเปลี่ยนแปลง pH อยู่ระหว่าง 10.2-11.7 จึงจะเหมาะสมที่สุด
ตัวอย่างที่ 2นำสารละลาย HA ซึ่งเป็นกรดอ่อนชนิดหนึ่งปริมาตร 50.00 cm3ไปไทเทรตกับสารละลายมาตรฐาน NaOH เข้มข้น 0.15 โมล/ลิตร พบว่าเมื่อเติม NaOH ลงไป 12.00 cm3จะทำให้สารละลายที่ได้มี pH 7 และเมื่อเติม NaOH ลงไป 16.00 cm3จะถึงจุดยุติพอดี สารละลายกรด HA มีความเข้มข้นเริ่มต้นเท่าใด และการไทเทรตกรด-เบสคู่นี้ควรใช้อินดิเคเตอร์ชนิดใด (กำหนด Kaของกรดอ่อน HA = 1.7 x 10-6) กำหนดให้

วิธีทำ
ที่จุดยุติจำนวนโมล NaOH = 0.1500 x![]() mol
mol
สมมติความเข้มข้นเริ่มต้นของ HA = X โมล/ลิตร
HA + NaOHNaA + H2O
จำนวนโมล HA : NaOH = 1 : 1
เพราะฉะนั้นจำนวนโมล HA = 0.1500 x![]() ด้วย
ด้วย
= X(![]() )
)
X(![]() ) = 0.1500 x
) = 0.1500 x![]()
X = 0.048
ความเข้มข้นเริ่มต้น = 0.048 โมล/ลิตร
เพราะฉะนั้นความเข้มข้นของ NaA = 0.048 โมล/ลิตร
การไทเทรตกรดอ่อนกับเบสแก่ที่จุดยุติ มี NaA ซึ่งแตกตัวให้ A-
A-(aq) + H2O (l)HA (aq) + OH-(aq)
ความเข้มข้นเริ่มต้น 0.048 0 0
ความเข้มข้นที่เปลี่ยนไป -x +x +x
ความเข้มข้นที่ภาวะสมดุล 0.048-x x x

5.88 x 10-9=![]()
1.4 x 10-5=![]() (
(![]() x มีค่าน้อยมาก 0.048-x
x มีค่าน้อยมาก 0.048-x![]() 0.048)
0.048)
x = 1.68 x 10-5= [OH-]
pOH = -log[OH-] = -log[1.68 x 10-5] = 4.77
pH = 14 - pOH = 14 - 4.77 = 9.22
ดังนั้น ควรใช้ฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์
กลับไปที่เนื้อหา
อินดิเคเตอร์ที่พบในธรรมชาติ
นอกจากอินดิเคเตอร์กรด-เบส ที่เป็นสารอินทรีย์ที่กล่าวมาแล้ว ในธรรมชาติยังมีสารหลายชนิดที่มีสมบัติเหมาะสมที่จะใช้เป็นอินดิเคเตอร์ได้ กล่าวคือ มีสีต่างกันที่ pH ต่างกัน สารเหล่านี้พบในดอกไม้ ผลไม้ ผัก หรือรากไม้บางชนิด เช่น ในกะหล่ำปลีสีแดง (Red cabage) มีสารที่เป็นอินดิเคเตอร์ จากการทดลองสกัดสารจากกะหล่ำปลีสีแดง ซึ่งเมื่อละลายเป็นกรดจะได้สีแดง (a) แต่เมื่อเติมเบสลงไปจะมีสีหลายสี ได้แก่ เขียว น้ำเงิน เหลือง (b) และเมื่อสารละลายเบส สารละลายจะเปลี่ยนเป็นสีน้ำเงิน แสดงว่าอินดิเคเตอร์ที่สกัดได้จากกะหล่ำปลีสีแดง จะเปลี่ยนสีแดงเป็นน้ำเงินในช่วงกรดเป็นเบส
ดอกกุหลาบสีแดง เมื่อนำมาละลายในแอลกอฮอล์และอีเทอร์ 1 : 1 จะให้สารละลายซึ่งเป็นอินดิเคเตอร์ตามธรรมชาติ เช่นกัน เมื่อนำสารละลายนี้มาหยดในสารละลายที่มี pH 1, 3, 7, 9 และ 11 ปริมาณเล็กน้อย พบว่าให้สารละลายสี แดง ส้ม น้ำตาล และเขียว ตามลำดับ โดยที่อินดิเคเตอร์นี้จะเปลี่ยนสีในช่วง pH 2 ช่วง คือ 5-7 (แดง-น้ำตาล) และ 8-10(น้ำตาล-เขียว)
น้ำสีน้ำเงินของดอกอัญชัน สามารถเป็นอินดิเคเตอร์ วัดความเป็นกรด-ด่างได้ โดยสารที่เป็น กรดจะทำให้น้ำเปลี่ยนเป็นสีม่วงแดงสารที่เป็นด่างจะทำให้น้ำเปลี่ยนเป็นสีเขียว
ตารางที่ 14.9 อินดิเคเตอร์ที่พบในธรรมชาติ
|
ชนิดพืช |
สารที่ใช้สกัด |
ช่วง pH ที่เปลี่ยนสี |
สีที่เปลี่ยน |
|
อัญชัน ดาวเรือง ดาวเรือง หางนกยูง หางนกยูง แคแดง ชงโค เข็มแดง เข็มแดง กระเจี๊ยบ คริสต์มาส คริสต์มาส บานไม่รู้โรย บานไม่รู้โรย แวนด้า แวนด้า ส้มเกลี้ยง(ผิว) สารภี สารภี ทองกวาว |
น้ำ แอลกอฮอล์ น้ำ น้ำ แอลกอฮอล์ น้ำ น้ำ น้ำ แอลกอฮอล์ น้ำ+แอลกอฮอล์+อีเทอร์ น้ำ แอลกอฮอล์+อีเทอร์ น้ำ แอลกอฮอล์ แอลกอฮอล์ น้ำ น้ำ แอลกอฮอล์ น้ำ น้ำ |
1-3 2-3 11-12 9-10 3-4 7-8 10-11 2-3 10-11 4-5 6-7 6-7 6-7 7-8 5-6 6-7 6-7 5-6 8-9 6-7 8-9 10-12 10-11 3-4 9-10 12-13 6-7 10-11 11-13 11-13 11-12 11-12 12-13 11-12 |
แดง - ม่วง ไม่มีสี - เหลืองอ่อน เหลือง - เหลืองน้ำตาล ไม่มีสี - เหลือง ส้ม - เหลือง เหลือง - เขียว เขียว - เหลือง ชมพู - ส้ม ส้ม - เหลือง บานเย็น - แดง แดง - เขียว ชมพู - เขียว แดง - เหลือง เหลือง - เขียว ชมพู - เหลือง เหลือง - เขียว แดง - เขียว ชมพู - เขียวอ่อน เขียว - เขียวน้ำตาล แดง - ชมพู แดง - ม่วง ม่วง - น้ำเงิน ไม่มีสี - เหลือง ชมพู - ม่วง ม่วง - เขียว เขียว - เหลือง แดง - เขียว ชมพู - เขียว เขียว - เหลือง เขียวอ่อน - เหลือง เหลืองอ่อน - เหลืองเข้ม เหลือง - น้ำตาลเหลือง น้ำตาลเหลือง - น้ำตาลแดง เหลืองเขียว - แดง |
กลับไปที่เนื้อหา
การเปลี่ยนสีของอินดิเคเตอร์
HIn เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปกรด (Acid form)
In-เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปเบส (Basic form)
รูปกรดและรูปเบสมีภาวะสมดุล เขียนแสดงได้ด้วยสมการ ดังนี้
HIn (aq) + H2O (l) H3O+(aq) + In-(aq)
ไม่มีสี * (รูปกรด) สีชมพู* (รูปเบส) ; (* = กรณีเป็นฟีนอล์ฟทาลีน)
Kind=
HIn และ In-มีสีต่างกันและปริมาณต่างกัน จึงทำให้สีของสารละลายเปลี่ยนแปลงได้ ถ้าปริมาณ HIn มากก็จะมีสีของรูปกรด ถ้ามีปริมาณ In-มากก็จะมีสีของรูปเบส การที่จะมีปริมาณ HIn หรือ In มากกว่าหรือน้อยกว่านั้นขึ้นอยู่กับปริมาณ H3O+ในสารละลาย ถ้ามี H3O+มากก็จะรวมกับ In-ได้เป็น HIn ได้มาก แต่ถ้าอยู่ในสารละลายที่มี OH-มาก OH-จะทำปฏิกิริยากับ H3O+ทำให้ H3O+ลดลง ซึ่งจะมีผลทำให้เกิดปฏิกิริยาไปข้างหน้าได้ In-มากขึ้น ซึ่งสามารถเขียนอธิบายด้วยสมการ ดังนี้
- เมื่อเติมกรด (H3O+) ทำให้ปริมาณ [H3O+] ทางขวาของสมการมีมากขึ้น ปฏิกิริยาจะเกิดย้อนกลับ ทำให้มี HIn มากขึ้นจึงเห็นเป็สีของกรด HIn
- เมื่อเติมเบส (OH-) OH-จะทำปฏิกิริยากับ H3O+ทำให้ H3O+น้อยลง ปฏิกิริยาจะไปข้างหน้ามากขึ้น (®) ทำให้มี In-มากขึ้น จึงเห็นเป็นสีเบสของ In-
* ถ้า [HIn] มากกว่า [In-] 10 เท่าขึ้นไป จะเห็นเป็นสีของรูปกรด (HIn)
* ถ้า [In-] มากกว่า [HIn] 10 เท่าขึ้นไป จะเห็นเป็นสีของรูปเบส (In-)
[HIn] จะมากหรือน้อยกว่า [In-] ขึ้นอยู่กับ pH ของสารละลาย (หรือปริมาณของ H3O+ดังที่ได้กล่าวมาแล้ว
ช่วง pH ที่อินดิเคเตอร์เปลี่ยนสีจากรูปหนึ่งไปเป็นอีกรูปหนึ่ง สารละลายจะมีสีผสมระหว่างรูปกรดและรูปเบส เรียกว่า ช่วง pH ของอินดิเคเตอร์ (pH range หรือ pH interval)
ช่วง pH ของอินดิเคเตอร์หาได้จากค่า Kindของอินดิเคเตอร์ดังนี้
HIn (aq) + H2O (l) H3O+(aq) + In-(aq)
Kind=
[H3O+] = Kind
-log [H3O+] = -log Kind-log
pH = pKind- log
¨ จะเริ่มเห็นสีของรูปกรดเมื่อ 10
pH = pKind- log10
pH = pKind- 1
¨ จะเริ่มเห็นสีของรูปเบสเมื่อ
pH = pKind- log
pH = pKind+ 1
นั่นคือ ช่วง pH ของอินดิเคเตอร์ = pKind1
หมายความว่า สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind1 ซึ่งเป็นค่าโดยประมาณ แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In-] 10 เท่าขึ้นไป อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง
ตัวอย่างเช่น เมทิลเรด มีช่วง pH 4.4 - 6.2 หมายความว่า สารละลายที่หยดเมทิลเรดลงไป จะเปลี่ยนสีจากรูปกรด (แดง) ไปเป็นรูปเบส (เหลือง) ในช่วง pH ตั้งแต่ 4.4 - 6.2 นั่นคือ
- ถ้า pH < 4.4 จะให้สีแดง (รูปกรด
- pH อยู่ระหว่าง 4.4 - 6.2 จะให้สีผสมระหว่างสีแดงกับเหลือง คือ สีส้ม
- pH > 6.2 จะให้สีเหลือง (รูปเบส)
สีของอินดิเคเตอร์แต่ละชนิด จะเปลี่ยนในช่วง pH ที่ต่างกัน ซึ่งแสดงได้ดังภาพที่ 14.8
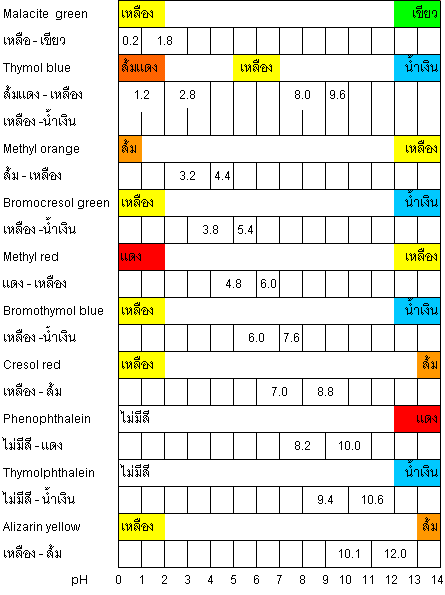
ภาพที่ 14.8 สีของอินดิเคเตอร์แต่ละชนิด
อย่างไรก็ตาม อินดิเคเตอร์ชนิดหนึ่งๆ จะใช้หาค่า pH ของสารละลายได้อย่างคร่าวๆ เท่านั้น เช่น เมื่อนำสารละลายมาเติม เมทิลออเรนจ์ลงไป (ช่วง pH ของเมทิลออเรนจ์เท่ากับ 3.0 - 4.4 และสีที่เปลี่ยนอยู่ในช่วง สีแดง ® เหลือง) ถ้าสารละลายมีสีเหลืองหลังจากหยดเมทิลออเรนจ์ แสดงว่าสารละลายนี้มี pH ตั้งแต่ 4.4 ขึ้นไป ซึ่งอาจมีฤทธิ์เป็นกรด กลางหรือ เบส ก็ได้ ดังนั้น การหาค่า pH ของสารละลายหนึ่งๆ อาจจะต้องใช้อินดิเคเตอร์หลายๆ ตัว แล้วนำข้อมูลมาวิเคราะห์ pH ของสารละลายร่วมกัน
กลับไปที่เนื้อหา






