อุณหพลศาสตร์ (Thermodynamics)
![]()
อุณหพลศาสตร์เคมี (Chemical Thermodynamics)
อุณหพลศาสตร์ดั้งเดิม (Classical Thermodynamics) คือทฤษฏีแรกๆ ในช่วงต้นคริสต์ศตวรรษ 1800 ที่ให้ความสนใจกับสถานะทางอุณหพลศาสตร์ และคุณสมบัติของพลังงานรูปแบบต่างๆ เช่น พลังงาน งาน และความร้อน ทว่าตามกฎของอุณหพลศาสตร์แล้ว ทฤษฏีทั้งหมดยังไม่สามารถอธิบายในระดับอะตอมได้ อุณหพลศาสตร์ดั้งเดิมพัฒนาขึ้นจากทฤษฏีของโรเบิร์ตบอยล์นักเคมีที่ว่าความดันP ของก๊าซปริมาณหนึ่งจะแปรผกผันกับปริมาตรV ของก๊าซนั้นๆ เมื่ออุณหภูมิคงที่ กล่าวอีกนัยหนึ่งคือสมการ PV = k (ค่าคงที่) นั่นเอง จากจุดนี้ทำให้วิทยาศาสตร์ด้านอุณหภูมิเริ่มพัฒนาขึ้นโดยสามารถสร้างเครื่องจักรไอน้ำขึ้นได้เป็นครั้งแรกในอังกฤษโดยโทมัส ซาเวอรีในปี ค.ศ. 1697 และโทมัส นิวโคเมนในปี ค.ศ. 1712 กฎข้อที่หนึ่งและสองของอุณหพลศาสตร์ตั้งขึ้นในเวลาต่อมาตามลำดับราวคริสต์ทศวรรษ 1850 โดยอาศัยข้อมูลจากการศึกษาของวิลเลียม แรนคิน,รูดอล์ฟ เคลาซิอุสและวิลเลียม ทอมป์สัน(ลอร์ดเคลวิน)
อุณหพลศาสตร์เคมี (Chemical Thermodynamics)เป็นการศึกษาความเกี่ยวพันของความร้อนที่เกิดจากปฏิกิริยาทางเคมีหรือจากการเปลี่ยนแปลงสถานะทางฟิสิกส์ภายในขอบเขตของกฎอุณหพลศาสตร์ ในช่วงปี 1873-76 นักคณิตศาสตร์และนักฟิสิกส์ชาวอเมริกันชื่อโจซิอาห์ วิลลาร์ด กิ๊บส์ได้เผยแพร่งานวิจัยสามฉบับ ฉบับที่โด่งดังที่สุดคือOn the Equilibrium of Heterogeneous Substancesซึ่งเขาได้แสดงให้เห็นว่ากระบวนการทางอุณหพลศาสตร์สามารถนำมาวิเคราะห์ให้เห็นเป็นภาพได้ จากการศึกษาพลังงานเอนโทรปีปริมาตรอุณหภูมิและความดันของระบบอุณหพลศาสตร์นั้น ทำให้สามารถอธิบายลำดับการเกิดของกระบวนการได้ตลอดช่วงต้นคริสต์ศตวรรษที่ 20 นักเคมีหลายคนเช่น กิลเบิร์ต เอ็น. ลิวอิส, เมิร์ล รันดัล และ อี. เอ. กุกเกินเฮม เริ่มนำสมการคณิตศาสตร์ของกิ๊บส์ไปใช้ในการวิเคราะห์กระบวนการทางเคมีในงานของพวกเขา

วิลเลียมทอมป์สันหรือลอร์ดเคลวินผู้นิยามคำว่าเทอร์โมไดนามิกส์ และนิยามกฎข้อที่สองอย่างเป็นทางการ
กลับไปที่เนื้อหา
กฎของอุณหพลศาสตร์มีทั้งหมด 4 ข้อ ดังนี้
1. กฎข้อที่ศูนย์
กล่าวถึงภาวะสมดุลทางอุณหพลศาสตร์ดังนี้
ถ้าระบบ A และ B อยู่ในภาวะสมดุลทางอุณหพลศาสตร์ และระบบ B และ C อยู่ในสภาวะสมดุลทางอุณหพลศาสตร์แล้ว ระบบ A และ C จะอยู่ในภาวะสมดุลทางอุณหพลศาสตร์ด้วยเช่นกัน
นั่นคือภาวะสมดุลทางอุณหพลศาสตร์มีคุณสมบัติถ่ายทอด(transitive) นั่นเอง
2. กฎข้อที่หนึ่ง
กล่าวถึงกฎทรงพลังงานดังนี้
พลังงานของระบบที่เปลี่ยนแปลงในกระบวนการอะเดียแบติก(กระบวนการที่ไม่มีการถ่ายเทความร้อน) จะไม่ขึ้นกับวิถีทางหรือทิศทางของงานที่กระทำต่อระบบในกระบวนการนั้น ๆ การเปลี่ยนแปลงจะขึ้นอยู่กับสถานะเริ่มต้นและสถานะสุดท้ายเท่านั้น
นั่นคือการเปลี่ยนแปลงพลังงานของระบบมีคุณสมบัติความไม่แปรผัน(invariance) ต่อทิศทางของกระบวนการในกระบวนการอะเดียแบติก. กฎข้อนี้สามารถแสดงด้วยสัญลักษณ์ทางคณิตศาสตร์ได้ว่า
โดยEหมายถึงพลังงานของระบบ,Qหมายถึงพลังงานความร้อนที่เข้าสู่ระบบ, และWหมายถึงงานที่กระทำต่อระบบ
กำเนิดกฎข้อที่หนึ่งของอุณหพลศาสตร์
จูเลียส ฟอน เมเยอร์และเจมส์ จูลเป็นนักวิทยาศาสตร์สองท่าน ที่นำแนวคิดของรัมฟอร์ดไปศึกษาต่ออย่างจริงจัง โดยในปีค.ศ. 1840ฟอน เมเยอร์ ที่เป็นแพทย์และนักวิทยาศาสตร์สมัครเล่น ได้สังเกตถึงความสัมพันธ์ระหว่างความร้อนและงานทางกลศาสตร์ ระหว่างตรวจคนไข้ในเรือ ทำให้ ฟอน เมเยอร์ ได้พยายามตีพิมพ์ผลงานเรื่องกฎการอนุรักษ์พลังงาน. อย่างไรก็ตามเนื่องจากความที่ว่าพื้นฐานทางวิทยาศาสตร์ของ ฟอน เมเยอร์ มีน้อย ทำให้ผลงานของเขามีข้อผิดพลาด และถูกปฏิเสธการตีพิมพ์ ในปีถัดมา ฟอน เมเยอร์ พยายามส่งผลงานเข้าตีพิมพ์อีกครั้ง โดยถึงแม้จะสำเร็จ แต่ผลงานของเขาถูกมองข้าม เนื่องจากเขาไม่มีชื่อเสียงในฐานะนักฟิสิกส์ ฟอน เมเยอร์ ต้องรออีกราว ๆ 20 ปี กว่าจะได้ชื่อเสียงที่เขาสมควรจะได้รับ เมื่อเคลาซิอุสได้พยายามยกย่องเขาแก่สาธารณชนในฐานะผู้คิดค้นกฎข้อที่ 1
กฎการอนุรักษ์พลังงานได้ถูกค้นพบเช่นกันที่อังกฤษโดยจูลในปีค.ศ. 1843จูลเป็นลูกศิษย์ของจอห์น ดอลตันจึงมีพื้นฐานทางด้านวิทยาศาสตร์อย่างดีเยี่ยม แตกต่างจากฟอน เมเยอร์ จูลได้ทดลองเพื่อพิสูจน์ถึงความสัมพันธ์ระหว่างความร้อนและงานทางกลศาสตร์อย่างรัดกุมมาก ทำให้ผลงานของเขาได้รับการยอมรับไปทั่วยุโรปในปีค.ศ. 1847เฮอร์มันน์ ฟอน เฮล์มโฮลทซ์ได้ตีพิมพ์ผลงานที่นิยามกฎข้อที่ 1 อย่างเป็นทางการในÜber die Erhaltung der Kraft (On the Conservation of Force)
3. กฎข้อที่สอง
กล่าวถึงการเพิ่มขึ้นของเอนโทรปีหรือพลังงานเสียในระบบอิสระ โดยอธิบายได้หลายแบบดังนี้
ไม่มีเครื่องจักรความร้อนใด ๆ ที่จะให้ประสิทธิภาพ 100%(เคลวิน-พลังค์)
ความร้อนจากแหล่งที่มีอุณหภูมิต่ำ ไม่สามารถถ่ายเทไปยังแหล่งที่มีอุณภูมิสูงกว่าได้ โดยธรรมชาติ(เคลาซิอุส)
เอนโทรปีของระบบอิสระไม่มีทางที่จะลดลงในกระบวนการใด ๆ(ทั่วไป)
นั่นคือการเปลี่ยนแปลงเอนโทรปีของระบบมีคุณสมบัติเป็นฟังก์ชันเพิ่มทางเดียว(monotonically increasing) โดยเราพิจารณาเอนโทรปีเป็นฟังก์ชันของเวลา. จากคุณสมบัตินี้ทำให้นักวิทยาศาสตร์เชื่อว่าเราสามารถพิจารณาเอนโทรปีในการระบุทิศทางของเวลาได้ กฎข้อนี้สามารถแสดงด้วยสัญลักษณ์ทางคณิตศาสตร์ได้ว่า
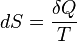
กำเนิดกฎข้อที่สองของอุณหพลศาสตร์
ชื่อเทอร์โมไดนามิกส์ ถือกำเนิดขึ้นเป็นครั้งแรกในปี 1849 โดยวิลเลียม ทอมป์สันหรือ ลอร์ด เคลวิน นั่นเอง เคลวินประทับใจในงานของจูลเป็นอย่างมาก เคลวินจึงได้คุยและถกกับจูลหลายต่อหลายครั้ง ความสัมพันธ์ของทั้งคู่ดำเนินไปดังนี้จูลถามปัญหาทอมป์สัน ทอมป์สันวิเคราะห์คำตอบทางทฤษฎี จูลนำบทวิเคราะห์ของทอมป์สันมาทดลองกลับไปกลับมาเป็นเวลา 4 ปี ในช่วง ปีค.ศ. 1852ถึงค.ศ. 1856ทำให้ทั้งสองมีผลงานค้นพบร่วมกัน เช่นการแพร่กระจายแบบจูล-ทอมป์สัน(Joule-Thompson expansion) นอกจากนี้จากการศึกษางานของการ์โนต์อย่างจริงจัง ทำให้เคลวินเริ่มมีแนวคิดเกี่ยวกับกฎข้อที่ 2
ในช่วงเวลาเดียวกันที่ประเทศเยอรมนี(ค.ศ. 1850-ค.ศ. 1860)รูดอล์ฟ เคลาซิอุสก็ได้ตีพิมพ์ผลงานที่เกี่ยวข้องกับกฎข้อที่ 2 และทฤษฎีจลน์ของก๊าซมากมาย เช่นระยะทางอิสระเฉลี่ย(mean free path) หรือ ระยะทางเฉลี่ยที่โมเลกุลจะเคลื่อนที่ได้โดยไม่ชนกับโมเลกุลอื่น ๆ ในปีค.ศ. 1865เคลาซิอุสก็ได้นิยามการเปลี่ยนแปลงของเอนโทรปี(ในมุมมองมหภาค) อย่างเป็นทางการ
ในช่วงเดียวกันนั้น ปีค.ศ. 1854ฟอน เฮล์มโฮลทซ์ ที่ได้รับแรงบันดาลใจจากงานของจูล เคลวิน และ เคลาซิอุสได้เริ่มตั้งข้อสันนิษฐานเกี่ยวกับจุดดับของจักรวาลว่าจะมีแต่พลังงานเสียในรูปของความร้อนเท่านั้น ไม่มีพลังงานอย่างอื่นอีก เรียกปรากฏการณ์นี้ว่าheat deathเนื่องจากข้อสรุปนี้ขัดแย้งกับคำสอนของศาสนาคริสต์และตรงกับความเห็นของเคลวินเป็นอย่างยิ่ง ด้วยความที่เคลวินเป็นผู้เคร่งครัดในคำสอนของศาสนาทำให้เคลวินรู้สึกกลัดกลุ้มใจในข้อสรุปนี้เป็นอย่างยิ่ง
หลังจากนั้น เคลวินได้นิยามกฎข้อที่ 2 อย่างเป็นทางการในปีค.ศ. 1874
4. กฎข้อที่สาม
กล่าวถึงอุณหภูมิศูนย์องศาสัมบูรณ์ โดยอธิบายได้ดังนี้
เมื่ออุณหภูมิสัมบูรณ์ลู่เข้าศูนย์ เอนโทรปีของระบบจะลู่เข้าค่าคงที่
ซึ่งอาจสรุปได้ง่ายๆ ว่า 'ถ้า T=0 K, แล้ว S=0' เมื่อ T คือ อุณหภูมิของระบบปิด และ S คือค่าเอนโทรปีของระบบ
กฎข้อที่สามนี้พัฒนาขึ้นโดยวอลเตอร์ แนรนสต์ (Walther Nernst) นักฟิสิกส์ชาวเยอรมัน ในช่วงปี ค.ศ. 1906-1912
บางครั้งจึงเรียกกฎข้อนี้ว่า ทฤษฎีของเนิร์นสต์ เขากล่าวว่าค่าเอนโทรปีของระบบที่ศูนย์องศาสัมบูรณ์จะเป็นค่าคงที่ เนื่องจากระบบที่ศูนย์องศาสัมบูรณ์เป็นระบบที่ ground state ค่าเอนโทรปีของระบบจึงมาจาก ground state เท่านั้น นัยหนึ่งคือ "ไม่มีกระบวนการใดที่สามารถลดพลังงานของระบบลงจนถึงศูนย์องศาสัมบูรณ์ได้"
กลับไปที่เนื้อหา
ทฤษฎีจลน์ของแก๊สกับอุณหพลศาสตร์
อะตอม ทฤษฎีจลน์ของก๊าซและกลศาสตร์สถิติ
ในขณะที่สมมุติฐานเรื่องอะตอมยังไม่เป็นที่ยอมรับกันในสมัยนั้น ด้วยความประทับใจในงานของเคลาซิอุสเจมส์ เคลิร์ก แมกซ์เวลล์ได้พยายามนำสมมุติฐานดังกล่าวมาใช้ และได้สร้างสาขาใหม่ของอุณหพลศาสตร์ขึ้น เรียกว่าทฤษฎีจลน์ของก๊าซโดยแมกซ์เวลล์ได้อาศัยความรู้เรื่องกลศาสตร์ดั้งเดิมมาคิดกับทุก ๆ อะตอมในระบบ และอาศัยความรู้เรื่องทฤษฎีความน่าจะเป็นทำให้สามารถสร้างฟังก์ชันความน่าจะเป็นสำหรับความเร็วของแต่ละอะตอมได้สำเร็จ ฟังก์ชันนี้ปัจจุบันเรียกว่าการกระจายตัวแบบแมกซ์เวลล์ผลการทดลองหลาย ๆ อย่างสนับสนุนทฤษฎีของแมกซ์เวลล์
ที่ออสเตรียลุดวิก โบลทซ์มันน์ประทับใจงานของแมกซ์เวลล์เป็นอย่างมาก และได้นำแนวคิดเรื่องอะตอมและทฤษฎีความน่าจะเป็นไปพัฒนาต่อจนสามารถสร้างนิยามใหม่ของเอนโทรปีในระดับจุลภาคได้ ดังนี้

โดย S แทนเอนโทรปีและ [W] เป็นจำนวนสถานะที่เป็นไปได้ทั้งหมดของอะตอมในระบบ และ k คือค่าคงที่ของโบลทซ์มันน์ความหมายของสมการของโบลทซ์มันน์ก็คือเอนโทรปีคือค่าที่วัดการกระจายตัวของพลังงานในระบบยิ่งพลังงานกระจายตัวกันมาก ทำให้พลังงานไม่มีระเบียบ ไม่เป็นกลุ่มก้อน เราอาจเรียกพลังงานชนิดนี้ว่าพลังงานเสียโดยพลังงานเสียนี้ไม่สามารถสร้างงานได้ด้วยตนเอง และจะเพิ่มขึ้นเรื่อย ๆ ตามกฎข้อที่ 2เช่นเดียวกับแมกซ์เวลล์ โบลทซ์มันน์สร้างฟังก์ชันการกระจายตัวแบบโบลทซ์มันน์เพื่ออธิบายถึงความน่าจะเป็นของแต่ละสถานะในระบบ อย่างไรก็ตามการค้นพบของโบลทซ์มันน์ไม่ได้รับการยอมรับเท่าที่ควร ด้วยความเสียใจ ทำให้โบลทซ์มันน์ตัดสินใจจบชีวิตของเขาด้วยมือตัวเองในที่สุด ผลงานของโบลทซ์มันน์ในเวลาต่อมาสร้างสาขาใหม่ให้กับฟิสิกส์ นั่นคือกลศาสตร์สถิติและฟิสิกส์สถิติ
ในปีค.ศ. 1876ถึงค.ศ. 1878ที่สหรัฐอเมริกาโจซิอาห์ วิลลาร์ด กิ๊บส์ก็ได้ศึกษาเรื่องกลศาสตร์สถิติอย่างจริงจัง และได้ตีพิมพ์ผลงานออกมามากมาย และรวมไว้ในชื่อOn the Equilibrium of Heterogeneous Substances(ว่าด้วยเรื่องดุลยภาพของสสารต่างชนิด) ในผลงานชิ้นนั้นกิ๊บส์ได้นิยามพลังงานเสรีของกิ๊บส์ซึ่งเป็นฟังก์ชันที่มีประโยชน์มหาศาลและเป็นที่มาของสาขาใหม่ในเคมีและฟิสิกส์นั่นคือเคมีฟิสิกส์(Physical chemistry) และเคมีความร้อน(Thermochemistry) เคยมีเรื่องเล่าว่า ที่อเมริกาไม่มีผู้ใดตระหนักถึงความสามารถของกิ๊บส์ และเมื่ออเมริกาต้องการทำงานวิจัยเรื่องนี้อย่างจริงจัง ทางอเมริกาต้องส่งตัวแทนไปเชิญแมกซ์เวลล์ถึงที่สหราชอาณาจักรโดยแมกซ์เวลล์ได้กล่าวว่าประเทศคุณนั้นมีเพชรอย่าง วิลลาร์ด กิ๊บส์อยู่แล้ว ไยต้องลำบากมาหาคนอื่นถึงดินแดนห่างไกลอย่างที่นี่อีกเล่า
ทฤษฎีจลน์ของแก๊ส(Kinetic Theory of Gases) เป็นทฤษฎีที่พยายามอธิบายสมบัติต่างๆ ของแก๊สโดยศึกษาจากทิศทางเคลื่อนที่ของโมเลกุลแก๊สและลักษณะของโมเลกุลแก๊ส
ในช่วงแรก การเริ่มศึกษาทฤษฎีนี้โดยเจมส์ คลาร์ก แมกซ์เวลล์นับเป็นจุดเริ่มต้นของการศึกษาอุณหพลศาสตร์ในมุมมองจุลภาคคือศึกษาความสัมพันธ์ระหว่างพลังงานอุณหภูมิและการเคลื่อนที่ของอะตอมโดยใช้กฎการเคลื่อนที่ของนิวตันโดยตรง. แทนที่จะเป็นการศึกษาอุณหพลศาสตร์แบบดั้งเดิมที่ทำกันในมุมมองของระดับมหภาคคือการศึกษาความสัมพันธ์ของค่าเฉลี่ยของคุณสมบัติต่าง ๆ ในระบบที่สามารถวัดได้ เช่นความดันหรือปริมาตร. ความสำเร็จของทฤษฎีนี้ ทำให้นักวิทยาศาสตร์ในสมัยนั้นเริ่มเชื่อว่า อะตอม มีอยู่จริง (ในสมัยนั้นยังมีการถกเถียงเรื่องนี้กันอยู่กว้างขวาง).
กลับไปที่เนื้อหา
เอนโทรปีกับอุณหพลศาสตร์
เอนโทรปี (Entropy, มาจากภาษากรีกว่า εν (en) แปลว่าภายใน รวมกับ τρέπω (trepo) แปลว่า ไล่ หนี หรือ หมุน) ถือเป็นหัวใจของกฎข้อที่สองของอุณหพลศาสตร์ซึ่งเกี่ยวข้องกับกระบวนการทางกายภาพที่เกิดขึ้นเองทางธรรมชาติ การเปลี่ยนแปลงดังกล่าวมีแนวโน้มที่จะทำให้ความแตกต่าง ไม่ว่าจะเป็น อุณหภูมิ แรงดัน ความหนาแน่น หรือค่าอื่น ๆ ในระบบค่อย ๆ น้อยลงจนกลืนเป็นเนื้อเดียวกัน ซึ่งต่างจากกฎข้อที่หนึ่งของอุณหพลศาสตร์ซึ่งกล่าวถึงการอนุรักษ์พลังงาน
เอนโทรปี (entropy)คือ ปริมาณที่บอกถึงความไม่เป็นระเบียบของระบบ ยิ่งระบบมีความไม่เป็นระเบียบสูง เอนโทรปีก็จะยิ่งมีค่าสูง แต่ถ้าระบบมีความไม่เป็นระเบียบน้อย เอนโทรปีก็จะยิ่งมีค่าต่ำ ซึ่งเราไม่มีวิธีที่จะหาเอนโทรปีสัมบูรณ์ (absolute entropy, So) ของสารใดๆ ได้ แต่เราจะใช้เอนโทรปีมาตรฐาน (standard entropy) เข้ามาช่วยโดยค่าของเอนโทรปีจะมีค่าขึ้นอยู่กับทั้งเอนทัลปี (H) และอุณหภูมิ ดังความสัมพันธ์ในสมการ
| DS = -DH/ T |
Soหมายถึงเอนโทรปีที่ 1 atm และ 25oC ซึ่งเอนโทรปีของทั้งธาตุและสารประกอบล้วนมีค่าเป็นบวก (So> 0)
เอนโทรปีเป็นจำนวนซึ่งใช้อธิบายระบบอุณหพลศาสตร์ เมื่อมองในระดับโมเลกุล กระบวนการทางกายที่เกิดขึ้นเองทำให้โมเลกุลมีการเรียงตัวที่ไม่เป็นระเบียบมากขึ้น สามารถแทนได้ด้วยค่าเอนโทรปีที่เพิ่มขึ้น ในการคำนวณ นิยมใช้สัญลักษณ์Sซึ่งนิยามจากสมการดิฟเฟอเรนเซียล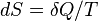 โดยที่
โดยที่ แทนพลังงานความร้อนที่ถูกดูดเข้าสู่ระบบที่ย้อนกลับได้ส่วนTคืออุณหภูมิสัมบูรณ์
แทนพลังงานความร้อนที่ถูกดูดเข้าสู่ระบบที่ย้อนกลับได้ส่วนTคืออุณหภูมิสัมบูรณ์
หนึ่งในสมการสำคัญของโลกที่เกี่ยวข้องกับเอนโทรปีคือ สมการของลุดวิก โบลทซ์มันน์
มาเป็นโมเลกุลเคลื่อนที่ไปมาภายในแก้ว
เอนโทรปีและสถานะของสาร
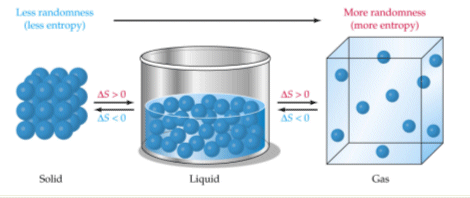
เมื่อพิจารณาอนุภาคของของแข็งของเหลวและแก๊สพบว่า ของแข็งมีความไม่เป็นระเบียบต่ำและแก๊สมีความไม่เป็นระเบียบมากที่สุดดังนั้นหากจะเรียงเอนโทรปีจากมากไปน้อยสามารถเรียงได้โดย แก๊สจะมีเอนโทรปีมากที่สุด รองลงมาคือของเหลว และเอนโทรปีน้อยที่สุดได้แก่ของแข็งนั้นเอง
โดยทั่วไปกระบวนการละลาย เช่นผลึกของน้ำตาลละลายน้ำจะทำให้เอนโทรปีมีค่ามากขึ้น แต่เมื่อนำ NaCl มาละลายน้ำปรากฏว่าเอนโทรปีน้อยลง เพราะมีกระบวนการไฮเดรชันซึ่งจะทำให้เอนโทรปีลดลงดังนั้นในการพิจารณาสารประกอบไอออนิกไม่เพียงแต่คิดการละลายจะต้องคิดการเกิดไฮเดรชันอีกด้วย
กลับไปที่เนื้อหา
ระบบอุณหพลศาสตร์ (Thermodynamics system) คือส่วนหนึ่งของจักรวาลที่เรากำลังพิจารณาอยู่ โดยเราจะต้องกำหนดขอบเขตของระบบ (ไม่ว่าจะเป็นขอบเขตจริงหรือขอบเขตในจินตนาการ) ให้ชัดเจน ส่วนอื่น ๆ ของจักรวาลที่ไม่อยู่ในระบบเรียกว่าสิ่งแวดล้อมระบบอุณหพลศาสตร์ที่สำคัญมี 3 ประเภท คือ
- ระบบอิสระ(isolated systems) คือ ระบบที่ปิดกั้นตัวเองจากสิ่งแวดล้อมโดยสมบูรณ์มวลหรือพลังงานภายนอกไม่สามารถเข้ามาในระบบได้
- ระบบปิด(closed systems) คือ ระบบที่อนุญาตให้พลังงานถ่ายเทผ่านเข้าหรือออกระบบได้ แต่ไม่อนุญาตให้มวลเข้ามาในระบบ (มวลโดยรวมของระบบคงที่ตลอดเวลา) ในการวิเคราะห์กระบวนการทางอุณหพลศาสตร์ เรานิยามพลังงานที่เข้าออกจากระบบให้มีสองประเภทคือพลังงานความร้อน(พลังงานที่เกิดจากความแตกต่างระหว่างอุณหภูมิของระบบกับอุณหภูมิของสิ่งแวดล้อม) และพลังงานอื่น(เช่น พลังงานที่เกิดจากงานทางกลศาสตร์)
- ระบบเปิด(open systems) คือ ระบบที่อนุญาตให้ทั้งมวลและพลังงานเข้าออกจากระบบได้ หนังสือบางเล่มกำหนดว่าระบบเปิดจะต้องนิยามให้ปริมาตรคงที่ (fixed volume)
อนึ่ง กฎต่าง ๆ ในอุณหพลศาสตร์จะมีความหมายก็ต่อเมื่อผู้ใช้นิยามระบบอุณหพลศาสตร์อย่างชัดเจนแล้วเท่านั้น เมื่อระบบอยู่ในสภาวะสมดุลในทุก ๆ ด้าน (สมดุลทางกลศาสตร์,สมดุลทางอุณหภูมิ,สมดุลทางเคมี,ฯลฯ) เราจะกล่าวว่าระบบอยู่ในสถานะที่แน่นอนการวิเคราะห์กระบวนการทางอุณหพลศาสตร์จะวิเคราะห์ได้ก็ต่อเมื่อทุก ๆ ขั้นตอนในกระบวนการสามารถประมาณได้ว่าอยู่ในสภาวะสมดุลเท่านั้น โดยเรียกสภาวะที่พอจะอนุโลมว่าสมดุลได้ว่าสภาวะกึ่งสมดุล(quasi-equilibrium) คุณสมบัติต่าง ๆ ของระบบสามารถอธิบายได้ด้วยสมการของระบบซึ่งระบุถึงความสัมพันธ์ของตัวแปรในระบบ ตัวแปรในระบบอุณหพลศาสตร์ที่สำคัญ คือ ความดัน ปริมาตร อุณหภูมิพลังงานภายในเอนโทรปีเอนธาลปีพลังงานเสรีของกิ๊บส์และพลังงานเสรีของเฮมโฮลทซ์เป็นต้น
ระบบ ขอบเขต และสิ่งแวดล้อม ของอุณหพลศาสตร์
ระบบทางอุณหพลศาสตร์ ( Thermodynamic System )
ระบบของอุณหพลศาสตร์จะแยกออกจากสิ่งแวดล้อมโดยผิวขอบเขต พิจารณาระบบทางอุณหพลศาสตร์ จะกำหนดโดยมวลของระบบ ซึ่งมีผลต่อการวิเคราะห์ทางอุณหพลศาสตร์ ดังนั้นระบบที่มีมวลสารที่อยู่กับที่ ซึ่งวาสำคัญในการวิเคราะห์ทางอุณหพลศาสตร์ก็คือ การพิจารณาเลือกขอบเขตของระบบ ในการดำเนินกระบวนการสามารถเลือกขอบเขตของระบบให้เหมาะสม โดยการกำหนดขอบเขตของระบบต้องให้เข้ากับมวลและมีขนาดใหญ่เพียงพอกับการวิเคราะห์เชิงมหาภาค ในหลายกรณี ที่มีการกำหนดขอบเขตของระบบที่สามารถเห็นปรากฏการณ์ที่ชัดเจน รูปร่างของขอบเขตของระบบสามารถแสดงได้ดังรูป2.1
ความเป็นขั้นตอนมีความสำคัญมากในการวิเคราะห์ การไหลของของไหลผ่านระบบใดๆ จะมีมวลไหลเกิดขึ้นในระบบทางเทอร์โมไดนามิกส์ ซึ่งจะทำให้การวิเคราะห์และการประยุกต์ยากยิ่งขึ้น การวิเคราะห์จะต้องกำหนดขอบเขตในที่ว่าง ขอบเขตนี้สามารถแสดงในรูป2.2ซึ่งเรียกว่าปริมาตรควบคุม (Control Volume)
กลับไปที่เนื้อหา






