บทเรียนที่ 1 สารละลายอิเล็กโทรไลต์
สารละลายอิเล็กโทรไลต์
อิเล็กโทรไลต์ (Electrolyte)หมายถึง สารที่เมื่อละลายในน้ำจะนำไฟฟ้าได้ เนื่องจากมีไอออนซึ่งอาจจะเป็นไอออนบวก หรือไอออนลบเคลื่อนที่อยู่ในสารละลาย สารละลายอิเล็กโทรไลต์นี้อาจเป็นสารละลายกรด เบส หรือเกลือก็ได้ ตัวอย่างเช่น สารละลายกรดเกลือ (HCl) สารละลายโซเดียมไฮดรอกไซด์ (NaOH) และสารละลายของเกลือ KNO3เป็นต้น โดยในสารละลายดังกล่าวประกอบด้วยไอออน H+, Cl-,OH-, K+และ NO3-ตามลำดับ
นอนอิเล็กโทรไลต์ (Non-electrolyte) หมายถึง สารที่ไม่สามารถนำไฟฟ้าได้เมื่อละลายน้ำ ทั้งนี้ เนื่องจาก สารพวกนอนอิเล็กโทรไลต์ จะไม่สามารถแตกตัวเป็นไอออนได้ เช่น น้ำบริสุทธิ์ น้ำตาล แอลกอฮอล์ เป็นต้น
ความแตกต่างของสารอิเล็กโทรไลต์และนอน-อิเล็กโทรไลต์ พิจารณาจากสาร 2 ชนิดที่มีสูตร AB กับ CD เมื่อละลายน้ำจะรวมกันน้ำเกิดการเปลี่ยนแปลงดังนี้
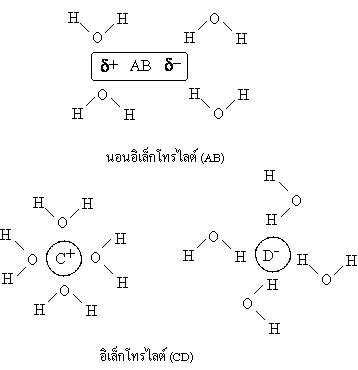
เมื่ออยู่ในน้ำจะแตกตัวเป็นNa+, Cl-หรือH+, Cl-ซึ่งเป็นไอออนที่เคลื่อนที่ในสารละลายทำให้เกิดการนำไฟฟ้าขึ้นได้
อิเล็กโทรไลต์แก่และอิเล็กโทรไลต์อ่อน
สารละลายอิเล็กโทรไลต์ต่างๆ นำไฟฟ้าได้ไม่เท่ากัน เนื่องจากการแตกตัวเป็นไอออนของอิเล็กโทรไลต์ไม่เท่ากัน อิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้มากกว่า ก็จะนำไฟฟ้าได้ดีกว่าอิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้น้อยกว่า อิเล็กโทรไลต์แบ่งออกได้เป็น 2 ประเภท ดังนี้
1. อิเล็กโทรไลต์แก่ (strong electrolyte)หมายถึง สารที่ละลายน้ำแล้วแตกตัวเป็นไอออนได้มาก อาจจะแตกตัวได้ 100% และนำไฟฟ้าได้ดีมาก เช่น กรดแก่ และเบสแก่ และเกลือส่วนใหญ่จะแตกตัวได้ 100% เป็นต้น
2. อิเล็กโทรไลต์อ่อน (weak electrolyte)หมายถึง สารที่ละลายน้ำแล้วแตกตัวได้บางส่วน นำไฟฟ้าได้น้อย
ตัวอย่างของอิเล็กโทรไลต์แก่ และอิเล็กโทรไลต์อ่อนบางชนิด
|
อิเล็กโทรไลต์แก่
(นำไฟฟ้าได้ดี)
|
อิเล็กโทรไลต์อ่อน
(นำไฟฟ้าได้ไม่ดี)
|
|
เกลือที่ละลายน้ำทั้งหมด
H2SO4
HNO3
HCl
HBr
HClO4
NaOH
KOH
Ca(OH)2
Ba(OH)2
|
CH3COOH
H2CO3
HNO2
H2SO3
H2S
H2C2O4
H3BO3
HClO
NH4OH
HF
|
การทดสอบว่าสารละลายเป็นสารละลายอิเล็กโทรไลต์ หรือไม่ก็ต้องดูการนำไฟฟ้าของสารละลาย เราอาจทดสอบโดยใช้เครื่องมือง่ายๆ ดังนี้
การทดสอบการนำไฟฟ้าของสารละลาย
สารละลายที่นำไฟฟ้า ได้แก่ สารละลายของกรด เบส และเกลือ อุปกรณ์ที่ใช้ในการทดลอง ประกอบด้วยขั้วไฟฟ้า 2 ขั้ว ต่อเข้ากับแหล่งให้พลังงานไฟฟ้า (ให้ศักย์ไฟฟ้า) หลอดไฟ และสวิตซ์ให้ครบวงจรดังภาพ
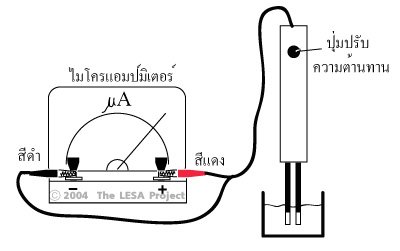
ภาพอุปกรณ์การวัดการนำไฟฟ้าของสารละลายอิเล็กโทรไลต์
วิธีทดสอบ
เมื่อกดสวิตซ์ลงเพื่อให้ครบวงจร ถ้าสารละลายในภาชนะเป็นสารละลายอิเล็กโทรไลต์ หลอดไฟจะสว่างขึ้น แสดงว่าสารละลายนั้นนำไฟฟ้าได้
ตัวอย่างผลการทดลองการทดสอบการนำไฟฟ้า
|
สารที่ใช้ทดสอบ
|
ผลการทดสอบ
|
|
น้ำบริสุทธิ์
น้ำที่มีน้ำตาลละลายอยู่
ยูเรีย (CO(NH2)2
สารละลายเกลือ NaCl
สารละลายเกลือ K2SO4
สารละลายกรด HCl
สารละลายกรดแอซิติก (CH3COOH)
สารละลายเบส NaOH
สารละลายเบส NH4OH
|
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง)
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง)
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้าน้อย (หลอดไฟสว่างน้อย)
นำไฟฟ้า (หลอดไฟสว่าง)
นำไฟฟ้า (หลอดไฟสว่าง)
|
ผลที่ได้อธิบายได้ว่า สารละลายที่ไม่มีไอออนอยู่ เช่น น้ำ หรือน้ำตาลทราบที่ละลายอยู่ในน้ำมัน จะมีพันธะแบบโคเวเลนต์ ไม่สามารถแตกตัวเป็นไอออนได้ จึงไม่นำไฟฟ้า แต่ NaCl HCl เมื่ออยู่ในน้ำจะแตกตัวเป็น Na+, Cl-หรือ H+, Cl-ซึ่งเป็นไอออนที่เคลื่อนที่ในสารละลายทำให้เกิดการนำไฟฟ้าขึ้นได้
การทดสอบสมบัติอื่นๆ ของสารละลาย
1. การทดสอบความเป็นกรด-เบสจากการเปลี่ยนสีของกระดาษลิตมัส
- ถ้าสารละลายเป็นกรด จะเปลี่ยนสีกระดาษลิตมัสจากน้ำเงินเป็นแดง
- ถ้าสารละลายเป็นเบส จะเปลี่ยนสีกระดาษลิตมัสจากแดงเป็นน้ำเงิน
- ถ้าสารละลายเป็นเกลือ จะเปลี่ยนหรือ ไม่เปลี่ยนสีกระดาษลิตมัสก็ได้
นอกจากการใช้กระดาษลิตมัส อาจจะใช้อินดิเคเตอร์อื่นๆ เช่น เมทิลเรด ฟีนอล์ฟทาลีน ก็ได้
2. การทดสอบปฏิกิริยาของกรดและปฏิกิริยาของเบส
ปฏิกิริยาของกรด
ก. ทำปฏิกิริยากับโลหะ จะได้ก๊าซไฮโดรเจน เช่น
HCl(aq) + Ca (s) ----------> CaCl2(aq) + H2(g)
H2SO4(aq) + Mg (g)---------->MgSO4(aq) + H2(g)
ข. ทำปฏิกิริยากับโลหะออกไซด์ ได้เกลือกับน้ำ
2HCl (aq) + Na2O (s)---------->2NaCl (aq) + H2O (l)
H2SO4(aq) + MgO (g) ---------->MgSO4(aq) + H2O (l)
ค. ทำปฏิกิริยากับคาร์บอเนตได้ก๊าซ CO2น้ำ และเกลือ
2HCl (aq) + NaCO3(aq)---------->2NaCl + H2O + CO2
HCl (aq) + NaHCO3(aq)---------->NaCl + H2O + CO2
ง. ทำปฏิกิริยากับเบสได้เกลือกับน้ำ
2HCl (aq) + NaOH (aq)---------->NaCl (aq) + H2O (l)
CH3COOH (aq) + NaOH (aq)---------->CH3COONa (aq) + H2O (l)
ปฏิกิริยาของเบส
ก. ทำปฏิกิริยากับโลหะบางชนิด ให้ก๊าซไฮโดรเจน
2NaOH (aq) + Zn (s)---------->Na2ZnO2(aq) + H2(g)
6KOH (aq) + 2Al (s) ---------->2K3AlO3(aq) + 3H2(g)
ข. ทำปฏิกิริยากับเกลือ ได้เป็นเกลือไฮดรอกไซด์ของโลหะที่ไม่ละลายน้ำ
2NaOH (aq) + MnCl2(aq)---------->Mn(OH)2(s) + 2NaCl (aq)
2KOH (aq) + CuSO4(aq)---------->Cu(OH)2(s) + K2SO4(aq)
ค. ทำปฏิกิริยากับเกลือแอมโมเนียม เช่น NH4Cl ได้ก๊าซ NH3(g)
NaOH (aq) + NH4Cl (aq)---------->NaCl (aq) + H2O (l) + NH3(g)
KOH (aq) + NH4Cl (aq) ---------->KCl (aq) + H2O (l) + NH3(g)
ง. ทำปฏิกิริยากับกรดได้เกลือกับน้ำ
กลับไปที่เนื้อหา
บทเรียนที่ 2 ไอออนในสารละลายกรด-เบส
จากการศึกษาสมบัติของสารละลาย พบว่า สารละลายกรดและสารละลายเบส เป็นสารละลายอิเล็กโทรไลต์ นำไฟฟ้าได้ เปลี่ยนสีกระดาษลิตมัส ทำปฏิกิริยากับโลหะและเกลือ กรดและเบสสามารถแตกตัวเป็นไอออน เมื่อเป็นสารละลาย เราจะศึกษาต่อไปถึงไอออนในสารละลายกรดและเบส ซึ่งทำให้สารละลายแสดงสมบัติเฉพาะตัวดังกล่าว
ไอออนในสารละลายกรด
ในสารละลายกรดทุกชนิด จะมีไอออนที่เหมือนกันอยู่ส่วนหนึ่งคือ H+หรือ เมื่อรวมกับน้ำได้เป็น H3O+( ไฮโดรเนียมไอออน) ทำให้กรดมีสมบัติเหมือนกัน ตัวอย่างเช่น สารละลายกรดไฮโดรคลอริก (HCl) ซึ่งเกิดจากกรด HCl ละลายในน้ำ โมเลกุลของ HCl และ น้ำต่างก็เป็นโมเลกุลโคเวเลนต์มีขั้ว ทำให้เกิดแรงดึงดูดระหว่างขั้วของ HCl และน้ำ โดยที่โปรตอน ( H+) ของ HCl ถูกดึงดูดโดยโมเลกุลของน้ำเกิดเป็นไฮโดรเนียมไอออน (H++ H2O -----> H3O+) ในบางครั้งเขียนแทน H3O+ด้วย H+โดยเป็นที่เข้าใจว่า H+นั้นจะอยู่รวมกับโมเลกุลของน้ำในรูป H3O+เสมอ
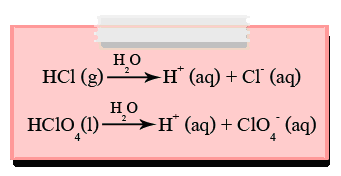
ref :http://www.thaigoodview.com/node/43857
ไฮโดรเนียมไอออนในน้ำไม่ได้อยู่เป็นไอออนเดียว แต่จะมีน้ำหลายโมเลกุลมาล้อมรอบอยู่ด้วย เช่น อาจอยู่ในรูปของ H5O2+, H7O3+, H9O4+เป็นต้น
ไอออนในสารละลายเบส
ในสารละลายเบสทุกชนิดจะมีไอออนที่เหมือนกันอยู่คือ ไฮดรอกไซด์ไอออน ( OH–) ซึ่งทำให้เบสมีสมบัติเหมือนกัน และมีสมบัติต่างไปจากกรด ตัวอย่างเช่น เมื่อ NaOH ละลายน้ำจะแตกตัวได้ OH–ดังนี้

ref:http://www.thaigoodview.com/node/43857
กลับไปที่เนื้อหา
บทเรียนที่ 3 ทฤษฎีกรด-เบส (อังกฤษ:Acid-Base Theory)
ทฤษฎีกรด-เบส (อังกฤษ:Acid-Base Theory) เป็นทฤษฎีที่ว่าด้วยนิยามหรือคำจำกัดความ (definition) ของสารเคมีที่มีสมบัติเป็นกรดและเบสโดยทั่วไปแล้ว ทฤษฎีกรด-เบสที่สำคัญ ได้อิงตามคำจำกัดความของนักเคมีที่สำคัญได้แก่ อาร์รีเนียส (Arrhenius) เบรินสเตด-ลาวรี (Brønsted-Lowry acid) และลิวอิส (Lewis) อย่างไรก็ตาม ยังมีนิยามที่เกี่ยวข้องกับการพิจารณาสมบัติในการโพลาไลซ์ของโมเลกุล คือ กรด-เบสแบบฮาร์ด-ซอฟต์ (Hard-Soft Acids-Bases: HSAB) และกฎของฟาจาน (Fahjan's Rules) โดยการคำนวณที่เกี่ยวข้องกับปฏิกิริยากรดเบสมักจะเกี่ยวข้องกับหลักการของสมดุลเคมี
สเวนเต อาร์รีเนียส (Svante Arrhenius) นักเคมีชาวสวีเดนได้ให้คำจำกัดความของกรดและเบสขึ้น ในปีพ.ศ. 2427โดยเกี่ยวข้องกับความเข้มข้นของไฮโดรเจนไอออน (H+) หรือ ไฮโดรเนียมไอออน (H3O+) และไฮดรอกไซด์ไอออน (OH−) เมื่อสารนั้นๆละลายน้ำโดยระบุว่า "กรด หมายถึง สารที่ละลายน้ำแล้วแตกตัวทำให้ความเข้มข้นของไฮโดรเจนไอออนหรือไฮโดรเนียมไอออนเพิ่มขึ้น" และ "เบส หมายถึง สารที่ละลายน้ำแล้วแตกตัวทำให้ความเข้มข้นของไฮดรอกไซด์ไอออนเพิ่มขึ้น"

สเวนเต อาร์รีเนียส (Svante Arrhenius)
HCl (aq) → H+(aq) + Cl−(aq)
NaOH (aq) → Na+(aq) + OH−(aq)
อย่างไรก็ตาม น้ำบริสุทธิ์ จะมีสมบัติเป็นกลาง เนื่องจากการแตกตัวด้วยตัวเอง(Auto-dissociation) ของน้ำจะอยู่ในสภาวะสมดุลระหว่างความเข้มข้นของ (H3O+) และ (OH−) ซึ่งมีค่าเท่ากัน ดังนั้น
การละลายน้ำของสารที่เป็นกรดตามนิยามของอาร์รีเนียสจึงไปทำให้ความเข้มข้นของไฮโดรเจนไอออนเพิ่มขึ้น อนึ่ง เนื่องจากไฮโดรเจนไอออน (H+) เป็น1ไอออนที่มีอนุภาคมูลฐานเป็นโปรตอนเพียงตัวเดียว นักเคมีจึงนิยมเรียกว่าโปรตอนทั้งนี้ หากโปรตอนละลายอยู่ในน้ำก็อาจจะเขียนแทนได้เป็น (H3O+) ที่เกิดจากการรวมตัวของโปรตอนกับโมเลกุลของน้ำ
- สมการการแตกตัวด้วยตัวเองของน้ำ:
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH−(aq)
ปัญหาที่สำคัญของทฤษฎีกรด-เบสของอาร์รีเนียส คือ ไม่สามารถระบุความเป็นกรด-เบสของสารที่ไม่ละลายน้ำได้ และไม่สามารถระบุความเป็นกรดที่ไม่มีไฮโดรเจนได้ เช่น AlCl3หรือเบสที่ไม่มีไฮดรอกไซด์ไอออน เช่น NH3หรือ N(CH3)3ได้ จึงมีการนิยามขึ้นใหม่โดยนักเคมีรุ่นหลัง
ปฏิกิริยาสะเทินกรดเบสของอาร์รีเนียส
ปฏิกิริยาสะเทิน(Neutralization)กรด-เบสของอาร์รีเนียสเป็นปฏิกิริยาระหว่างไฮโดรเจนไอออน (H+) และไฮดรอกไซด์ไอออน (OH−) เกิดเป็นน้ำ ดังสมการ:
- H+(aq) + OH−(aq) → H2O (l)
โยฮันเนส นิโคลัส เบรินสเตด(Johannes Nicolaus Brønsted)และทอมัส มาร์ติน ลาวรี(Thomas Martin Lowry) นักเคมีสองคนได้ให้คำจำกัดความของกรด-เบสใหม่ ในปีพ.ศ. 2466โดยเกี่ยวข้องกับการถ่ายโอนโปรตอน(Proton Transferring) โดยเป็นทฤษฎีที่ครอบคลุมและอธิบายสมบัติของกรด-เบสได้ดีกว่าทฤษฎีของอาร์รีเนียส โดยกล่าวว่า "กรด (AH) หมายถึง สารที่ให้โปรตอน (Proton Donor) แก่เบส " และ "เบส (B) หมายถึงสารที่รับโปรตอน (Proton Acceptor) จากกรด" ดังสมการ:

โยฮันเนส นิโคลัส เบรินสเตด (Johannes Nicolaus Brønsted)

โทมัส มาร์ติน ลาวรี (Thomas Martin Lowry)
AH + B ⇌ A−+ BH+
พิจารณาการแตกตัวในน้ำของกรดอะซิติก(CH3COOH) ดังสมการ:
CH3COOH (aq)) + H2O (l) ⇌ CH3COO−(aq)) + H3O+(aq)

ในสมการทิศทางไปข้างหน้า น้ำทำหน้าที่เป็นเบสเบรินสเตด(Brønsted Base) เนื่องจากรับโปรตอน (H+) มาจากกรดอะซิติก และกรดอะซิติกทำหน้าที่เป็นกรดเบรินสเตด(Brønsted Acid) และเมื่อพิจารณาสมการย้อนกลับ อะซิเตตไอออน (CH3COO−) ทำหน้าที่เป็นเบสเบรินสเตด เนื่องจากรับโปรตอน (H+) มาจากไฮโดรเนียมไอออน (H3O+) ที่เป็นกรดเบรินเสตด(เนื่องจากให้โปรตอนแก่อะซิเตดไอออน)
จากตัวอย่างข้างต้น ทำให้เกิดคู่กรด-เบสสังยุค (conjugate acid–base pair) ขึ้น โดยกรดอะซิติก(CH3COOH) เป็นคู่กรด (conjugate acid) ของอะซิเตตไอออน (CH3COO−) และอะซิเตตไอออน (CH3COO−) เป็นคู่เบส (conjugate base) ของกรดอะซิติก และในทำนองเดียวกัน น้ำ (H2O ) เป็นคู่เบสของไฮโดรเนียมไอออน (H3O+)
ดังที่กล่าวข้างต้น นิยามกรด-เบสตามทฤษฎีของเบรินสเตด ยังสามารถอธิบายปฏิกิริยากรด-เบสที่ไม่สามารถอธิบายได้ด้วยทฤษฎีของอาร์รีเนียส เช่น:
- H3O+(aq) + Cl−aq) + NH3(g) → Cl−(aq) + NH+4(aq)
สารประกอบที่ทำหน้าที่ได้ทั้งกรดเบรินสเตดและเบสเบรินสเตด เรียกว่าเป็นแอมโฟเทอริก(Amphoteric) โดยน้ำเป็นตัวอย่างของสารแอมโฟเทอริก ดังสมการ:
(น้ำทำหน้าที่เป็นเบส)
- H2O + NH=C(NH2)2⇌ OH−+ H2N=C(NH2)2+
(น้ำทำหน้าที่เป็นกรด)
ปฏิกิริยาสะเทินกรดเบสของเบรินสเตด
ปฏิกิริยาสะเทินกรดเบสของเบรินสเตดหมายถึงปฏิกิริยาระหว่างคู่กรดและคู่เบสของโมเลกุลหนึ่งๆ เช่น:
- H++ OH−⇌ H2O
- NH4++ NH2−⇌ 2NH3
กระบวนการแตกตัวเป็นไอออนด้วยตัวเอง
กระบวนการแตกตัวเป็นไอออนด้วยตัวเอง(Autoionization Process) ที่พบเป็นปกติในตัวทำละลายโปรติก(protic solvent) คือ ปฏิกิริยาย้อนกลับของปฏิกิริยาสะเทินนั่นเอง
อนึ่งค่าคงที่สมดุลของการแตกตัวเป็นไอออนด้วยตัวเอง เรียกว่าค่าคงที่การแตกตัวให้โปรตอนด้วยตัวเอง(Autoprotolysis Constant:KAP) หรือผลคูณไอออน(Ionic Product) ในกรณีของน้ำค่าKAPใช้สัญลักษณ์เฉพาะเป็นKWซึ่งมีค่าเท่ากับ 1.0 × 10−14ที่อุณหภูมิ 25℃:KAP=KW= [H+][OH−] = 1.0 × 10−14ที่อุณหภูมิ 25℃
ค่า pKAPของ H2SO4เท่ากับ 2.9 ที่อุณหภูมิ 25℃ และ pKAPของ NH3เท่ากับ 27.7 ที่อุณหภูมิ −50℃ และโดยทั่วไปแล้ว ค่า pKAPจะมีค่าเปลี่ยนแปลงตามอุณหภูมิ
ค่า pKwของน้ำที่เปลี่ยนแปลงตามอุณหภูมิ
| อุณหภูมิ (℃) |
0 |
5
|
10
|
15
|
20
|
25
|
30
|
35
|
40
|
45
|
50
|
|---|
| pKw |
14.943 |
14.734 |
14.535 |
14.346 |
14.167 |
13.997 |
13.830 |
13.680 |
13.535 |
13.396 |
13.262 |
|---|
[หมายเหตุ:ค่า pKAP= −logKAPกรณี pKW= −log (1.0 × 10−14) = 14.0 ที่อุณหภูมิ 25℃]
ความแรงสัมพัทธ์ของกรดเบรินสเตด
ความแรงของกรดเบรินสเตดสามารถเปรียบเทียบโดยใช้ค่าคงที่การแตกตัวของกรด(Acid Dissociation Constant:Ka) โดยที่:
HA ⇌ A−+ H+
![K_{mathrm a} = mathrm{frac{[A^-] [H^+]}{[HA]}}](http://upload.wikimedia.org/math/9/2/5/92593d3f8ab692bf55d05e13fee7de98.png)

อย่างไรก็ตาม ค่าคงที่การแตกตัวของกรดเป็นค่าคงที่ที่เป็นค่าเฉพาะ ณ อุณหภูมิหนึ่งๆ และมีค่าเปลี่ยนแปลงไปตามอุณหภูมิ รวมถึงขึ้นอยู่กับชนิดองตัวทำละลายด้วย ดังตารางเป็นตัวอย่างของค่า pKaของกรดบางชนิดในตัวทำละลายชนิดต่างๆ ที่อุณหภูมิ 25℃
pKaของกรด (HA) และคู่กรด (conjugate acid, HB) ของเบส (B)
|
HA ⇌ A−+ H+
|
อะซิโตไนไตล์ (MeCN)
|
ไดเมทิลซัลฟอกไซด์ (DMSO)
|
น้ำ
|
|---|
|
กรด พารา-โทลูอีนซัลโฟนิก
|
8.5
|
0.9
|
เป็นกรดแก่มาก
|
|
2,4-ไดไนโตรฟีนอล
|
16.66
|
5.1
|
3.9
|
|
กรดเบนโซอิก
|
21.51
|
11.1
|
4.2
|
|
กรดอะซิติก
|
23.51
|
12.6
|
4.756
|
|
ฟีนอล
|
29.14
|
18.0
|
9.99
|
|
BH+⇌ B + H+
|
|---|
|
พีโรลิดีน
|
19.56
|
10.8
|
11.4
|
|
ไตรเอทิลามีน
|
18.82
|
9.0
|
10.72
|
|
พีริดีน
|
12.53
|
3.4
|
5.2
|
|
อะนิลีน
|
10.62
|
3.6
|
4.6
|
อย่างไรก็ตาม ในปฏิกิริยาที่สารไม่มีโปรตอนหรือไม่มีการถ่ายโอนโปรตอน ทฤษฎีกรด-เบสของเบรินสเตด-ลาวรีไม่สามารถอธิบายได้ เช่น ปฏิกิริยาระหว่าง BF3กับ Me3N: เป็นต้น จึงมีการนิยามกรด-เบสขึ้นมาใหม่ในปีเดียวกันโดย ลิวอิส
กิลเบิร์ต นิวตัน ลิวอิส(Gilbert Newton Lewis) นักเคมีชาวอเมริกันได้เสนอนิยามของกรด-เบสในปีพ.ศ. 2466โดยพิจารณาการให้และการรับคู่อิเล็กตรอน(Electron Pair) ซึ่งกล่าวว่า "กรด หมายถึง สารที่รับคู่อิเล็กตรอน (Electron Pair Acceptor)" และ "เบส หมายถึง สารที่ให้คู่อิเล็กตรอน (Electron Pair Donor)" เช่น:
Me3N: + BF3→ Me3N: + BF3
โดย Me3N: เป็นเบสลิวอิส(Lewis Base) เนื่องจากให้คู่อิเล็กตรอนแก่ BF3และ BF3เป็นกรดลิวอิส(Lewis Acid) เนื่องจากรับคู่อิเล็กตรอนมาจาก Me3N:ผลิตภัณฑ์จากปฏิกิริยากรด-เบสของลิวอิส เรียกว่าแอดดักต์(Adduct) หรือสารเชิงซ้อน(Complex)
ตัวอย่างปฏิกิริยากรด-เบสของลิวอิส
BF3+ F−→ BF4−
BF3+ OMe2→ BF3OMe2
I2+ I−→ I3−
SiF4+ 2 F−→ SiF62−
สหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ(IUPAC) ได้นิยามความหมายของกรด-เบสโดยรวมนิยามของเบรินสเตดและนิยามของลิวอิสเข้าด้วยกัน ดังนี้
"กรด หมายถึง หน่วยในระดับโมเลกุลหรือสปีชีส์ใดๆทางเคมีที่มีความสามารถให้ไฮดรอน(Hydron) (โปรตอน) (ตามนิยามกรดเบรินสเตด) หรือมีความสามารถที่จะสร้างพันธะโคเวเลนต์โดยรับคู่อิเล็กตรอน(ตามนิยามกรดลิวอิส)"
เบส หมายถึง หน่วยในระดับโมเลกุลหรือสปีชีส์ใดๆทางเคมีที่มีความสามารถสร้างพันธะโคเวเลนต์กับไฮดรอน (Hydron) (โปรตอน) (ตามนิยามเบสเบรินสเตด) หรือกับออร์บิทัลที่ว่างอยู่ของสปีชีส์อื่นๆ(ตามนิยามเบสลิวอิส)"
กลับไปที่เนื้อหา
บทเรียนที่ 4 การแตกตัวของกรดแก่และเบสแก่
กรดแก่และเบสแก่เป็นอิเล็กโทรไลต์แก่เมื่อละลายน้ำแตกตัวเป็นไอออนได้ดี แตกตัวได้เกือบหมด
100% ซึ่งถือว่าแตกตัวได้หมดจึงเกิดปฏิกิริยาไปข้างหน้าอย่างเดียว ดังนั้นถ้าทราบความเข้มข้นของกรดแก่หรือ
เบสแก่ ก็สามารถคำนวณหาความเข้มข้นของ H3O+ และ OH- ในสารละลายได้ เช่น
1. สารละลาย HNO3 เข้มข้น 1 mol/dm3 จะแตกตัวให้ H3O+ และ NO3- อย่างละ 1 mol/dm3

2. สารละลายเบสแก่ NaOH เข้มข้น 0.1 mol/dm3 จะแตกตัวให้ Na+ และ OH- เข้มข้น
อย่างละ 0.1 mol/dm3

3. สารละลายเบสแก่ Ca(OH)2 เข้มข้น 1 mol/dm3 จะแตกตัวให้ Ca2+ 1 mol/dm3 แต่ให้
OH- 2 mol/dm3


H2SO4 แตกตัวได้ 2 ขั้น ดังนี้

การแตกตัวของกรดอ่อน - เบสอ่อน
กรดอ่อนและเบสอ่อนจัดเป็นอิเล็กโทรไลต์อ่อน เมื่อละลายน้ำจึงแตกตัวได้ไม่หมด แตกตัวได้เพียงบางส่วนและเป็นส่วนที่น้อยมากเมื่อเทียบกับความเข้มข้นเริ่มต้นของกรดอ่อนหรือเบสอ่อน การแตกตัวของกรดอ่อน และเบสอ่อน จึงเป็นการเปลี่ยนแปลงที่ผันกลับได้ ณ ภาวะสมดุลจึงมีทั้งโมเลกุลของกรดอ่อนหรือเบสอ่อนและไอออน ที่เกิดจากการแตกตัวของกรดอ่อนและเบสอ่อน การบอกความเข้มข้นของ H3O+ และ OH- ที่เกิดจากการแตกตัวของกรดอ่อนและเบสอ่อน นิยมบอกเป็นร้อยละเรียกว่าร้อยละการแตกตัว(percent ionization : α)เช่น กรดอ่อน HA เข้มข้น 1 mol/dm3 แตกตัวได้ร้อยละ 5 หมายความว่าในสารละลายปริมาตร 1 dm3 มีกรด HA ละลายอยู่ 1 mol และเมื่อถึงสมดุลกรด HA แตกตัวไปเพียง 0.05 mol และเหลืออยู่ 0.95 mol

**ปริมาณการแตกตัวของกรดอ่อนนอกจากจะบอกเป็นร้อยละแล้ว ยังสามารถบอกโดยใช้ค่าคงที่สมดุลของปฏิกิริยาก็ได้ เรียกว่า ค่าคงที่สมดุลของกรด หรือ ค่าคงที่การแตกตัวของกรด (acid ionization constant : Ka)

**ส่วนเบสอ่อนเรียกว่า ค่าคงที่สมดุลของเบส หรือ ค่าคงที่การแตกตัวของเบส (base ionization constant : Kb) เช่น ถ้า MOH เป็นเบสอ่อน

ค่าคงที่การแตกตัวของกรด (Ka) และค่าคงที่การแตกตัวของเบส (Kb)เป็นค่าที่บอกให้ทราบว่ากรดอ่อนหรือเบสอ่อนนั้นแตกตัวเป็นไอออนได้มากน้อยเพียงใด
กรดที่มีค่า Ka สูงจะแตกตัวเป็นไอออนได้มากกว่ากรดที่มีค่าKa ต่ำ และเบสที่มีค่า Kb สูงจะแตกตัวเป็นไอออนได้มากกว่าเบสที่มีค่า Kb ต่ำกรดอ่อนที่มี H 1 อะตอม
ใน 1 โมเลกุล เช่น HA เรียกกรดประเภทนี้ว่า กรดโมโนโปรติก (monoprotic)ได้แก่ CH3COOH, HCOOH, HF, HCN เป็นต้น
แสดงค่าคงที่การแตกตัวของกรดบางชนิดในน้ำที่ 25 oC

(ที่มา : สุนทร พรจำเริญ เอกสารประกอบการสอนวิชาเคมี โรงเรียนมหิดลวิทยานุสรณ์)
กลับไปที่เนื้อหา
บทเรียนที่ 5 ค่า PH
ค่า pH และ pOH
|
ค่า pH
ในสารละลายกรดหรือเบส จะมีทั้งและอยู่ในปริมาณที่แตกต่างกัน จึงใช้ความเข้มข้นของหรือในสารละลายเป็นเกณฑ์บอกความเป็นกรด-เบสของสารละลายได้ เพื่อความสะดวกจึงกำหนดให้ใช้ความเข้มข้นของเป็นเกณฑ์ โดยสารละลายกรดจะมีมากกว่า1.0 xส่วนสารละลายเบสมีน้อยกว่า 1.0 xเนื่องจากความเข้มข้นของมีค่าน้อยเช่นนี้ไม่สะดวกต่อการนำมาใช้ในปี พ.ศ.2411-2482 (ค.ศ. 1868-1939) นักชีวเคมีชาวสวีเดนชื่อ ซอเรสซัน ได้เสนอเปลี่ยนค่าความเข้มข้นของให้อยู่ในรูปที่ใช้งานได้สะดวก โดยการหาค่า log ของความเข้มข้นแล้วคูณด้วย -1 ทำให้เกิดเป็นค่าใหม่เรียกว่า pH กำหนดให้ pH มีค่าเท่ากับ -log สารละลายในน้ำไม่ว่าจะเป็นกรด เบส หรือกลางย่อมประกอบด้วยH3O+และOH-เสมอโดยมีผลคูณของไอออนทั้งสองเท่ากับ10-14ดังนั้นถ้าทราบ [H3O+]หรือ [H+]เพียงอย่างเดียวก็สามารถบอกได้ว่าสารละลายเป็นกรด เบส หรือเป็นกลาง เนื่องจาก [H3O+]ในสารละลายมีค่าน้อยและเปลี่ยนแปลงในช่วงกว้าง จาก1 mol dm-3(1 M HCl )ถึง10-14mol dm-3(1 M NaOH)การเขียนความเข้มข้นด้วยเลขยกกำลังที่ติดลบย่อยไม่สะดวกและผิดพลาดได้ง่ายซอเรนเสน(Sorensen)จึงเสนอแนะให้ใช้มาตราส่วนใหม่ที่สะดวกกว่าซึ่งเรียกว่า มาตราส่วนpH (pH scale)
โดยนิยามว่าpH = - log [ H+]
หรือ [H+] = 10-pHโดยสรุปแล้ว สารละลายกรดมีpH < 7และ สารละลายเบสมีpH > 7
ส่วนสารละลายที่เป็นกลางจะมีpHเท่ากับ7
เมื่อคำนวณ pH ของสารละลายที่เป็นกลางจะได้ดังนี้สารละลายที่เป็นกลางมี= 1.0 x
log = log(1.0 x)
= log 1.0-7 log 10ดังนั้น -log = 7 log 10 - log 1.0
= 7-0
ค่า pOH
โดยนิยามว่าpOH = - log [OH-]
ในน้ำบริสุทธิ์[H3O+] = [OH-] = 10-7M.
นั่นคือpH = pOH = 7และpH + pOH = 14
วิธีวัด pH ของสารละลาย
1.วิธีเปรียบเทียบสีเป็นการวัดpHโดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายหรือใช้กระดาษชุบอินดิเคเตอร์(กระดาษpH)2.วัดความต่างศักย์เป็นการวัดpHโดยใช้เครื่องpHมิเตอร์ (pH meter) ซึ่งวัดความต่างศักย์ระหว่างขั้วไฟฟ้าแก้วและขั้วไฟฟ้ามาตรฐานการคำนวณค่า pH , pOH , [H+] , [OH-] , H+, OH-
| สูตรที่ |
ใช้เมื่อไหร่ |
สูตรว่าอย่างไร |
| 1. |
หาค่าของ[H+][OH-] |
[H+][OH-] = 1.0 x 10–14 |
| 2. |
หาค่า pH |
pH = -log[H+] |
| 3. |
หาค่า pOH |
pOH = -log[OH-] |
| 4. |
หาค่า pH + pOH |
pH + pOH = 14 |
| 5. |
หาค่า H+, OH- |
H+=[H+] x Vหรือ OH-=[OH-] x V
1,000 1,000
ในกรณีนี้ H+, OH-มีค่าออกมาเป็น mol
V ปริมาตรของสาร |
|
กลับไปที่เนื้อหา
บทเรียนที่ 6 อินดิเคเตอร์
อินดิเคเตอร์คือ สารที่ใช้ทดสอบความเป็นกรด เบสของสารต่าง ๆ และสีของสารนี้จะเปลี่ยนไปเมื่อค่าความเป็นกรด - เบสเปลี่ยนไป
การทดสอบความเป็นกรด - เบสของสารละลาย
ความเป็นกรด - เบส หรือค่า pH ของสารละลายสามารถทดสอบได้โดยใช้อินดิเคเตอร์อินดิเคเตอร์ที่ใช้ในการทดสอบความเป็นกรด - เบส หรือค่า pH ของสารละลายได้แก่
1. กระดาษลิตมัสมีสีแดงกับสีน้ำเงิน มีการเกิดขึ้น ดังนี้
- สารละลายกรด หรือสารละลายที่มีค่า pH ต่ำกว่า 7 จะเปลี่ยนสีของกระดาษลิตมัสจากสีน้ำเงินเป็นสีแดง แต่ไม่เปลี่ยนสีของกระดาษลิตมัสสีแดง
- สารละลายเบสหรือสารละลายที่มีค่า pH สูงกว่า 7 จะ เปลี่ยนสีของกระดาษลิตมัสจากสีแดงเป็นสีน้ำเงินแต่ไม่เปลี่ยนสีของกระดาษ ลิตมัสสีน้ำเงิน
- สารละลายเป็นกลางหรือสารละลายที่มีค่า pH เท่ากับ 7 จะไม่เปลี่ยนสีของกระดาษลิตมัสทั้งสีแดงและสีน้ำเงิน
2. สารละลายฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์ที่ไม่มีสี เมื่อหยดสารละลายกรด สีของสารละลายจะคงเดิม เมื่อหยดสารละลายเบส สีของสารละลายฟีนอล์ฟทา ลีนจะเปลี่ยนเป็นสีชมพูม่วง แต่ถ้าเป็นเบสแก่จะเปลี่ยนเป็นสีแดง
3. สารละลายยูนิเวอร์แซลอินดิเคเตอร์เป็นการนำอินดิเคเตอร์หลาย ๆชนิดที่มีการเปลี่ยนสีในช่วง pH ต่างกันมาผสมกันในสัดส่วนที่เหมาะสม จึงสามารถบอกค่าความเป็นกรด - เบส ของสารละลายโดยบอกค่า pH ที่ละเอียด และถูกต้องยิ่งขึ้น
อินดิเคเตอร์ที่ใช้ในการทดสอบความเป็นกรด เบสของดิน
ยูนิเวอร์แซลอินดิเคเตอร์เป็นตลับ ภายในมีกระดาษยูนิเวอร์แซลอินดิเคเตอร์ และบนตลับจะมีแผ่นเทียบสีค่า pH ตั้งแต่ 1 ถึง 14
ดินเป็นกรดจะเปลี่ยนสีกระดาษยูนิเวอร์แซลอินดิเคเตอร์จากสีน้ำตาลเป็นสีแดง
ดินเป็นเบสจะเปลี่ยนสีกระดาษยูนิเวอร์แซลอินดิเคเตอร์ จากสีน้ำตาลเป็นสีเขียวน้ำเงิน
ดินเป็นกลางจะไม่เปลี่ยนสีกระดาษยูนิเวอร์แซลดิเคเตอร์
ภาพฟีนอล์ฟทาลีน
อินดิเคเตอร์สำหรับกรด-เบส เป็นสารอินทรีย์ อาจเป็นกรดหรือเบสอ่อนๆ ซึ่งสามารถเปลี่ยนจากรูปหนึ่งไปเป็นอีกรูปหนึ่งได้ เมื่อpHของสารละลายเปลี่ยน
การเปลี่ยนสีของ
HInเป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปกรด (Acid form)
In-เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปเบส (Basic form)รูปกรดและรูปเบสมีภาวะสมดุล เขียนแสดงได้ด้วยสมการ ดังนี้
HIn (aq) + H2O (l) -----------> H3O+(aq) + In-(aq)
ไม่มีสี *สีชมพู*; (* =กรณีเป็นฟีนอล์ฟทาลีน)(รูปกรด)(รูปเบส)
HIn และ In- มีสีต่างกันและปริมาณต่างกัน จึงทำให้สีของสารละลายเปลี่ยนแปลงได้ ถ้าปริมาณHInมากก็จะมีสีของรูปกรด ถ้ามีปริมาณIn-มากก็จะมีสีของรูปเบส การที่จะมีปริมาณHInหรือInมากกว่าหรือน้อยกว่านั้นขึ้นอยู่กับปริมาณH3O+ในสารละลาย ถ้ามีH3O+มากก็จะรวมกับIn-ได้เป็นHInได้มากจะเห็นสารละลายใสไม่มีสีของHInแต่ถ้าอยู่ในสารละลายที่มีOH-มากOH-จะทำปฏิกิริยากับH3O+ทำให้H3O+ลดลง ซึ่งจะมีผลทำให้เกิดปฏิกิริยาไปข้างหน้าได้In-มากขึ้น จะเห็นสารละลายในรูปของIn-คือเห็นเป็นสีชมพู
ช่วง pH ที่อินดิเคเตอร์เปลี่ยนสีจากรูปหนึ่งไปเป็นอีกรูปหนึ่ง สารละลายจะมีสีผสมระหว่างรูปกรดและรูปเบส เรียกว่า ช่วง pH ของอินดิเคเตอร์ (pH range หรือ pH interval)
ช่วง pH ของอินดิเคเตอร์หาได้จากค่า Kind ของอินดิเคเตอร์ดังนี้
HIn (aq) + H2O (l)H3O+(aq) + In-(aq)
ไม่มีสี * (รูปกรด) สีชมพู* (รูปเบส); (* =กรณีเป็นฟีนอล์ฟทาลีน)
นั่นคือ ช่วง pH ของอินดิเคเตอร์ =pKind1 หมายความว่า สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind1 ซึ่งเป็นค่าโดยประมาณ แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In-] 10 เท่าขึ้นไป อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง
ตัวอย่างเช่น เมทิลเรด มีช่วงpH 4.4 - 6.2หมายความว่า สารละลายที่หยดเมทิลเรดลงไป จะเปลี่ยนสีจากรูปกรด (แดง) ไปเป็นรูปเบส (เหลือง) ในช่วงpHตั้งแต่4.4 - 6.2นั่นคือ
-ถ้า pH < 4.4จะให้สีแดง (รูปกรด)
- pH อยู่ระหว่าง4.4 - 6.2 จะให้สีผสมระหว่างสีแดงกับเหลือง คือ สีส้ม
- pH > 6.2 จะให้สีเหลือง (รูปเบส)
ตัวอย่างอินดิเคเตอร์
กลับไปที่เนื้อหา
บทเรียนที่ 7 ปฏิกิริยาระหว่างกรดและเบส
1.ปฏิกิริยาระหว่างกรดกับเบส
จากทฤษฎีกรด-เบสของเบรินสเตตและลาวรี กรดคือสารที่ให้โปรตอน และเบสคือ สารที่รับโปรตอน เมื่อกรดทำปฏิกิริยากับเบส จึงมีการถ่ายโอนโปรตอนระหว่างกรดและเบสนั่นเอง ตัวอย่างเช่น ปฏิกิริยาระหว่าง HClและ NaOHสามารถเขียนปฏิกิริยาได้ดังนี้
HCl (aq) + NaOH (aq) -------------> NaCl (aq) + H2O
HCl เป็นกรดจะให้โปรตอน (H+) กับเบส NaOH ได้เกลือ NaCl กับน้ำ โปรตอนถ่ายโอนจากกรด HCl ไปให้กับเบส NaOH เมื่อเขียนสมการไอออนิกสุทธิระหว่างกรดและเบสจะได้ดังนี้
H+(aq) + OH-(aq) -----------> H2O (l)
ปฏิกิริยาระหว่าง H+จากสารละลายกรดกับ OH-จากสารละลายเบสได้ H2O เรียกว่า ปฏิกิริยาสะเทิน (Neutralization reaction) ปฏิกิริยาระหว่างกรดกับเบส จะได้เกลือกับน้ำเป็นส่วนใหญ่ แต่จะมีบางปฏิกิริยาที่ได้เกลือเพียงอย่างเดียว เช่น ปฏิกิริยาระหว่าง HCl กับ NH3ได้เกลือ NH4Cl ซึ่งเกลือ NH4Cl จะแตกตัวให้ NH4+และ Cl-ทำให้สารละลายนำไฟฟ้าได้
HCl (aq) + NH3-----------> NH4Cl (aq)
NH4Cl (aq) -------------> NH4+(aq) + Cl-(aq)
ตัวอย่างปฏิกิริยาระหว่างกรดซัลฟิวริกกับแบเรียมไฮดรอกไซด์จะได้ตะกอน BaSO4กับน้ำ
H2SO4(aq) + Ba(OH)2(aq)------------> BaSO4(s) + 2H2O (l)
สารละลาย H2SO4และสารละลาย BaSO4นำไฟฟ้าได้ แต่เมื่อนำมาผสมเข้าด้วยกันแล้วสารละลายที่ได้ไม่สามารถนำไฟฟ้าได้เพราะ BaSO4เป็นของแข็งที่ละลายน้ำได้น้อยมาก จึงมีไอออนที่จะนำไฟฟ้าได้อยู่น้อยมาก ซึ่งไอออนที่เกิดขึ้นอาจเกิดขึ้นเนื่องจากการแตกตัวของน้ำ ทำให้สารละลายผสมสามารถนำไฟฟ้าได้เล็กน้อย
ปฏิกิริยาระหว่างกรดกับเบส สามารถแบ่งได้ดังนี้
1.ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสแก่ KOH ได้เกลือ KCl และน้ำ ดังนี้
HCl (aq) + KOH (aq) ------------> KCl (aq) + H2O (l)
2.ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสอ่อน NH4OH ได้เกลือ NH4Cl และน้ำ
HCl (aq) + NH4OH (aq) ---------> NH4Cl (aq) + H2O (l)
3.ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
เช่น ปฏิกิริยาระหว่างกรด CH3COOH และเบส NaOH ได้เกลือโซเดียมแอซิเตต (CH3COONa) และน้ำ
CH3COOH (aq) + NaOH (aq) ----------> CH3COONa (aq) + H2O (l)
4.ปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรด HCN กับเบส NH4OH ได้เกลือ NH4CN และน้ำ
HCN (aq) + NH4OH (aq)------------> NH4CN (aq) + H2O (l)
ปฏิกิริยาระหว่างกรดและเบสในน้ำนี้จะทำให้สารละลายที่ได้แสดงสมบัติเป็นกรด เบส หรือกลางได้ ซึ่งพิจารณาได้เป็น 2 กรณี
1.ในกรณีกรดและเบสทำปฏิกิริยากันแล้วมีกรดหรือเบสเหลืออยู่ ถ้ามีกรดเหลืออยู่สารละลายแสดงสมบัติเป็นกรด ถ้ามีเบสเหลืออยู่สารละลายก็จะแสดงสมบัติเป็นเบส
2.ถ้ากรดกับเบสทำปฏิกิริยากันหมดพอดี ได้เกลือกับน้ำ สารละลายของเกลือที่ได้จากปฏิกิริยา จะแสดงสมบัติเป็นกรด เบส หรือกลาง ขึ้นอยู่กับชนิดของเกลือนั้นว่ามาจากกรดและเบสประเภทใด ทั้งนี้เพราะเกลือแต่ละชนิดจะเกิดการแตกตัวและทำปฏิกิริยากับน้ำ เรียกว่า ไฮโดรไลซีส ซึ่งจะทำให้สารละลายแสดงสมบัติกรด-เบสต่างกัน รายละเอียดอยู่ในหัวข้อต่อไป
2.ปฏิกิริยาของกรดหรือเบสกับสารบางชนิด
กรดนอกจากจะสามารถทำปฏิกิริยาสะเทินกับเบสได้เกลือกับน้ำ แล้วยังสามารถทำปฏิกิริยากับโลหะบางชนิด เช่น Zn, Fe, ได้แก๊ส H2และเกลือของโลหะนั้น หรือทำปฏิกิริยากับเกลือคาร์บอนเนต เช่น CaCO3, Na2CO3หรือเกลือ NaHCO3ได้แก๊ส CO2
ตัวอย่างปฏิกิริยาระหว่าง HCl กับ CaCO3จะได้เกลือและแก๊ส CO2
HCl(aq) + CaCO3(s) --------> CaCl2(aq) + CO2(g)
เบสก็เช่นเดียวกันนอกจากจะทำปฏิกิริยาสะเทินกับกรดได้เกลือกับน้ำแล้ว ยังสามารถทำปฏิกิริยากับเกลือแอมโมเนียมเช่น NH4Cl, (NH4)2SO4, จะได้แก๊ส NH3หรือทำปฏิกิริยากับเกลือ เช่นปฏิกิริยาระหว่าง NaOH กับ FeCl3ได้สารผลิตภัณฑ์ดังนี้
3NaOH (aq) + FeCl3(aq) --------> Fe(OH)2(s) + 3NaCl (aq)
ดังนั้น จะเห็นได้ว่ากรดและเบสทำปฏิกิริยากันเองได้ และทั้งกรดและเบสก็สามารถทำปฏิกิริยากับสารอื่นได้ด้วย
กลับไปที่เนื้อหา
บทเรียนที่ 8 เกลือ (Salt)
เกลือเป็นสารประกอบไอออนิก ประกอบด้วยไอออนบวก (แคตไอออน) และไอออนลบ (แอนไอออน) ยกเว้น OH-ตัวอย่างเช่น NaCl ประกอบด้วยโซเดียมไอออน (Na+) และคลอไรด์ไอออน (Cl-) แบเรียมซัลเฟต (BaSO4) ประกอบด้วยแบเรียมไอออน (Ba2+) และซัลเฟตไอออน (SO42-) เกลือ NaCl ละลายในน้ำได้ดีและให้ Na+และ Cl-แต่เกลือ BaSO4เป็นเกลือที่ไม่ละลายน้ำ ทำให้สารละลายของเกลือ NaCl นำไฟฟ้าได้ดี แต่สารละลายของเกลือ BaSO4ไม่นำไฟฟ้า
เราอาจจำแนกเกลือออกได้เป็นประเภทต่างๆ ดังนี้
1.เกลือปกติ (Normal salt)
เกลือปกติเป็นเกลือที่ไม่มีไฮโดรเจนหรือไฮดรอกไซด์ไอออนที่อาจถูกแทนที่ ดังนั้น จึงประกอบด้วยไอออนบวกคือโลหะ หรือกลุ่มธาตุที่เทียบเท่าโลหะ เช่น NH4+(แอมโมเนียมไอออน) กับไอออนลบซึ่งเป็นอนุมูลกรด (Acid radical) ตัวอย่างของเกลือปกติ เช่น NaCl, K2SO4, Ca3(PO4)2, NH4NO3, (NH4)2SO4, ZnSO4เป็นต้น
2.เกลือกรด (Acid salt)
เกลือประเภทนี้มี H อะตอมอยู่ในโมเลกุลของเกลือ ซึ่งสามารถไอออไนซ์ได้ (แตกตัวเป็นไอออนได้) เช่น NaHSO4, NaHCO3, Na2HPO4, NaH2PO4เป็นต้น
3.เกลือเบสิก (Base salt)
เกลือประเภทนี้มีไอออนลบ OH-และไอออนบวก เช่น Pb(OH)Cl, Bi(OH)2Cl เป็นต้น
4.เกลือสองเชิง (Double salt)
เกิดจากเกลือปกติสองชนิดรวมกันเป็นโมเลกุลใหญ่ เช่น K2SO4, Al(SO4)3.24H2O เป็นต้น
5.เกลือเชิงซ้อน (Complex salt)
ประกอบด้วยไอออนลบที่ไอออนเชิงซ้อน เช่น K3Fe(CN)6เป็นต้น
การเรียกชื่อเกลือ
1.ให้อ่านโลหะแล้วตามด้วยอนุมูลกรด เช่น
NaCl = โซเดียมคลอไรด์
KI = โพแทสเซียมไอโอไดด์
MgS = แมกนีเซียมซัลไฟด์
ถ้าอนุมูลกรดมาจากกรดที่ลงท้ายด้วย ous ต้องเปลี่ยนเป็น ite แต่ถ้าลงท้ายด้วย ic ต้องเปลี่ยนเป็น ate เช่น
Na2CO3= โซเดียมคาร์บอเนต
Ca3(PO4)2= แคลเซียมฟอสเฟต
K2SO4= โพแทสเซียมซัลเฟต
Na2SO4= โซเดียมซัลเฟต
2.ถ้าโลหะมีเลขออกซิเดชัน (ประจุไฟฟ้า) มากกว่า 1 ค่าให้บอกไว้ในวงเล็บหลังโลหะนั้น แล้วอ่านตามด้วยอนุมูลกรด เช่น
Fe(NO3)2= ไอร์ออน (II) ไนเตรต
Fe(NO3)3= ไอร์ออน (III) ไนเตรต
SnCl2= ทิน (II) คลอไรด์
SnCl4= ทิน (IV) คลอไรด์
วิธีการเตรียมเกลือ
1.เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
กรด + เบสเกลือ + น้ำ
เช่น HCl (aq) + NaOH (aq)NaCl (aq) + H2O (l)
H2SO4(aq) + Ba(OH)2(aq)BaSO4(s) + 2H2O (l)
“เกลือที่เกิดจากกรดและเบสทำปฏิกิริยากัน ไอออนบวกของเกลือจะมาจากเบส ส่วนไอออนลบของเกลือมาจากกรด”
เกลือที่เกิดจากปฏิกิริยาระหว่างกรดกับเบส แบ่งออกได้เป็น
1.1 เกลือที่เกิดจากกรดแก่และเบสแก่ ตัวอย่างเช่น
- NaCl เกิดจากกรด HCl กับเบส NaOH,
HCl (aq) + NaOH (aq) ----------> NaCl (aq) + H2O (l)
- Ca(NO3)2เกิดจาก HNO3และ Ca(OH)2
HNO3(aq) + Ca(OH)2(aq) --------> Ca(NO3)2(aq) + H2O (l)
1.2 เกลือที่เกิดจากกรดอ่อนกับเบสแก่ เช่น
- NaClO เกิดจาก HClO และ NaOH
HClO (aq) + NaOH (aq)-----------> NaClO (aq) + H2O (l)
- Ba(C2H3O2)2เกิดจาก C2H3O2H และ Ba(OH)2
C2H3O2H(aq) + Ba(OH)2(aq) ----------->. Ba(C2H3O2)2(aq) + H2O (l)
1.3 เกลือที่เกิดจากกรดแก่กับเบสอ่อน เช่น
- NH4Cl เกิดจาก HCl กับ NH3
HCl (aq) + NH3(g)NH4Cl (aq) + H2O (l)
- Al(NO3)3เกิดจาก HNO3(aq) และ Al(OH)3(aq)
HNO3(aq) + Al(OH)3(aq) ------------> Al(NO3)3(aq) + H2O (l)
1.4 เกลือที่เกิดจากกรดอ่อนและเบสอ่อน เช่น
- NH4CN เกิดจากกรด HCN กับเบส NH3
HCN(aq) + NH3(g)NH4CN (aq) + H2O (l)
- FeCO3เกิดจากกรด H2CO3(aq) กับเบส Fe(OH)2(aq)
H2CO3(aq) + Fe(OH)2(aq) -------------> FeCO3(aq) + H2O (l)
2.เตรียมจากปฏิกิริยาของโลหะกับกรด
โลหะ + กรดเกลือ + แก๊ส
โลหะ + กรดเกลือ + น้ำ + แก๊ส
เช่น
Mg (s) + 2HCl (aq) -----------> MgCl2(aq) + H2(g)
Zn(s) + H2SO4(aq) -----------> ZnSO4(aq) + H2(g)
3Cu(s) + 8HNO3(aq) ------------> 3Cu(NO3)2(aq) + H2O (l) + 2NO (g)
3.เตรียมจากปฏิกิริยาของโลหะออกไซด์กับกรด
โลหะออกไซด์ + กรดเกลือ + น้ำ
เช่น CaO (s) + H2SO4(aq) --------> CaSO4(s) + H2O (l)
CuO (s) + H2SO4(aq) -------------> CuSO4(s) + H2O (l)
MgO (s) + 2HCl (aq) ---------------> MgCl2(aq) + H2O (l)
4.เตรียมจากปฏิกิริยาของเกลือกับกรด เช่น
FeS(s) + 2HCl (aq)---------> FeCl2(aq) + H2S (g)
Na2CO3(s) + H2SO4(aq) ----------> Na2SO4(aq) + H2CO3(aq)
NaHCO3(s) + HCl(aq) ----------->NaCl(aq) + H2O (l) + CO2(g)
BaCO3(s) + 2HCl (aq) ------------> BaCl2(aq) + H2O (l) + CO2(g)
5.เตรียมจากปฏิกิริยาของเกลือกับเกลือ
NaCl (aq) + AgNO3(aq) -------------> AgCl(s) + NaNO3(aq)
BaCl2(aq) + Na2SO4(aq) -------------> BaSO4(s) + 2NaCl (aq)
ZnCl2(aq) + Na2S (aq)--------------> ZnS (s) + 2NaCl (aq)
6.โดยการรวมตัวกันโดยตรงของโลหะกับอโลหะ
2Na(s) + Cl2(g)2NaCl (aq)
Fe (s) + S (s)FeS
กลับไปที่เนื้อหา
บทเรียนที่ 9 การไทเทรด
การไทเทรตกรด-เบส หมายถึง กระบวนการหาปริมาณสาร โดยวิธีใช้สารละลายมาตรฐานที่ทราบค่าความเข้มข้นที่แน่นอน ให้ทำปฏิกิริยากับสารตัวอย่าง โดยอาศัยหลักการเกิดปฏิกิริยาระหว่างสารละลายกรดและเบสที่เข้าทำปฏิกิริยากันพอดี ทำให้คำนวณหาความเข้มข้นหรือปริมาณของสารตัวอย่างดังกล่าวได้
วิธีการไทเทรตกรด-เบส คือ นำสารละลายกรดหรือเบสตัวอย่างที่ต้องการวิเคราะห์หาปริมาณ มาทำการไทเทรตกับสารละลายเบสหรือกรดมาตรฐานที่ทราบค่าความเข้มข้นที่แน่นอน กล่าวคือ ถ้าสารละลายตัวอย่างเป็นสารละลายกรด ก็ต้องใช้สารละลายมาตรฐานเป็นเบส นำมาทำการไทเทรต แล้วบันทึกปริมาตรของสารละลายมาตรฐานที่ใช้ในการทำปฏิกิริยาพอดีกัน จากนั้นนำไปคำนวณหาปริมาณของสารตัวอย่างต่อไป หรือทางตรงกันข้าม ถ้าใช้สารละลายตัวอย่างเป็นเบส ก็ต้องใช้สารละลายมาตรฐานเป็นกรด
ตัวอย่างเช่น การหาค่าสารละลายกรด HCl ว่ามีความเข้มข้นเท่าใดเราอาจใช้สารละลายมาตรฐาน NaOH เข้มข้น 0.100 โมล/ลิตร มาทำการไทเทรตกับสารละลาย HCl ตัวอย่าง จำนวนหนึ่ง (อาจจะเป็น 50 cm3) เมื่อทราบปริมาตรของ NaOH ที่ใช้ในการทำปฏิกิริยาพอดีกับ HCl จำนวน 50 cm3นี้โดยอินดิเคเตอร์เป็นตัวบอกจุดยุติ แล้วเราก็สามารถคำนวณหาความเข้มข้นของกรด HCl ได้
สารละลายมาตรฐาน ที่ทราบความเข้มข้นแน่นอน บรรจุอยู่ในเครื่องแก้วที่เรียกว่า บิวเรตต์ ซึ่งจะมีก๊อกไขปิด-เปิดเพื่อหยดสารละลายมาตรฐานมายังขวดรูปกรวยที่บรรจุสารละลายตัวอย่างที่ต้องการวิเคราะห์ ในการไทเทรต ค่อยๆ หยดสารละลายมาตรฐานลงมาทำปฏิกิริยากับสารตัวอย่างในขวดรูปกรวย เขย่าหรือหมุนขวดรูปกรวยเพื่อให้สารผสมกันพอดี ไทเรตจนกระทั่งอินดิเคเตอร์เปลี่ยนสีก็หยุดไทเทรต แล้วบันทึกปริมาตรสารละลายมาตรฐานที่ใช้ เพื่อนำไปคำนวณหา pH สารละลายต่อไป
เครื่องแก้วเชิงปริมาตร ที่ใช้ในการถ่ายเทของเหลวตัวอย่าง ลงในขวดรูปกรวยจะใช้เครื่องแก้วที่สามารถ อ่านปริมาตรได้ค่าที่ละเอียด และมีค่าถูกต้องมากที่สุด นั่นคือจะใช้ ปิเปตต์ (จะไม่ใช้กระบอกตวงเพราะให้ค่าที่ไม่ละเอียด และความถูกต้องน้อย) ซึ่งมีขนาดต่างๆ ให้เลือกใช้ เช่น ขนาด 1 cm3, 5, 10, 25, 50 cm3เป็นต้น วิธีใช้ปิเปตต์จะใช้ลูกยางช่วยในการดูดสารละลาย โดยในตอนแรก บีบอากาศออกจากลูกยาง ที่อยู่ปลายบนของปิเปตต์ แล้วจุ่มปลายปิเปตต์ ลงในสารละลายที่ต้องการปิเปตต์ แล้วค่อยๆ ปล่อยลูกยาง สารละลายจะถูกดูดขึ้นมาในปิเปตต์ เมื่อสารละลายอยู่เหนือขีดบอกปริมาตร ดึงลูกยางออก รีบใช้นิ้วชี้กดที่ปลายปิเปตต์ค่อยๆ ปล่อยสารละลายออกจนถึงขีดบอกปริมาตรบน จากนั้นก็ปล่อยสารละลาย ออกจากปิเปตต์สู่ขวดรูปกรวยจนหมด



อินดิเคเตอร์กับการไทเทรตกรด-เบส
อินดิเคเตอร์กรด-เบส ที่เหมาะสมกับปฏิกิริยาการไทเทรตจะต้องมีค่า pH ที่จุดกึ่งกลางช่วงการเปลี่ยนสีใกล้เคียงหรือเท่ากับ pH ที่จุดสมมูลของปฏิกิริยา นอกจากนี้ การเลือกใช้อินดิเคเตอร์กรด-เบส ต้องพิจารณาสีที่ปรากฎ จะต้องมีความเข้มมากพอที่จะมองเห็นได้ง่าย หรือเห็นการเปลี่ยนสีได้ชัดเจน ช่วงการเปลี่ยนสีของอินดิเคเตอร์ จะเกิดขึ้นในช่วง 2 หน่วย pH
ตัวอย่างเช่น การไทเทรตกรดแก่กับเบสแก่ pH ของสารละลายผลิตภัณฑ์ที่เกิดจากปฏิกิริยาการไทเทรต เมื่อถึงจุดสมมูลมีค่าใกล้เคียง 7 ก็ควรเลือกใช้อินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนสีใกล้เคียงกับ 7 เช่น อาจใช้โบรโมไทมอลบลูหรือ ฟีนอล์ฟทาลีน ซึ่งจะเปลี่ยนจากไม่มีสีเป็นสีชมพู ในช่วง pH 8.20-10.00 เป็นต้น ดังนั้น ถ้าทราบ pH ของสารละลายที่จุดสมมูลของปฏิกิริยาการไทเทรตก็สามารถเลือกอินดิเคเตอร์ที่เหมาะสมได้
การเลือกอินดิเคเตอร์ ก็ขึ้นอยู่กับชนิดของปฏิกิริยาระหว่างกรดกับเบส เพราะที่จุดสมมูลของแต่ละปฏิกิริยานั้น มีค่า pH ที่ต่างกัน
การฟของการไทเทรตจะช่วยในการเลือกอินดิเคเตอร์ที่เหมาะสมได้ดี เพราะกราฟจะแสดงค่า pH ของสารละลายขณะไทเทรต ตั้งแต่ก่อนจุดสมมูล ที่จุดสมมูล และหลังจุดสมมูล จุดที่ pH ของสารละลายเปลี่ยนแปลงมาก ซึ่งเป็นจุดสมมูลนั้น จะบอกช่วง pH ของอินดิเคเตอร์ที่จะเลือกใช้ ในการพิจารณาเลือกอินดิเคเตอร์ จากกราฟของการไทเทรต จะแบ่งออกตามชนิดของปฏิกิริยาดังนี้
1.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสแก

จากกราฟ จะเห็นว่าค่า pH เปลี่ยนแปลงรวดเร็วที่จุดใกล้ๆ จุดยุติ (ตั้งแต่ pH 4-10) ดังนั้นอินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนแปลงสีระหว่าง 4 ถึง 10 ก็สามารถนำมาใช้ได้ ซึ่งอินดิเคเตอร์ที่เหมาะสมที่อาจใช้ได้ ได้แก่ เมทิลเรด (4.4-6.2) โบรโมไทมอลบลู (6.0-7.5) และฟีนอล์ฟทาลีน(8.2-10.0) ดังแสดงในภาพ แต่เรามักจะนิยมใช้ฟีนอล์ฟทาลีน เพราะสังเกตการเปลี่ยนแปลงสีได้ชัดเจน สำหรับ โบรโมคลีซอล กรีน (3.8-5.4) ไม่เหมาะสมที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแก่และเบสแก่ เพราะช่วงเปลี่ยนสีที่เป็นรูปเบสของอินดิเคเตอร์ จะเกิดก่อนจุดสมมูล ทำให้เกิดความคลาดเคลื่อนในการบอกจุดยุติ
2.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
การเลือกอินดิเคเตอร์สำหรับการไทเทรตกรดอ่อน เช่น กรดแอซิติก กับเบสแก่ เช่น NaOH จะมีข้อจำกัดมากกว่าที่จุดสมมูลของการไทเทรต สารละลายจะมีโซเดียมแอซิเตต ทำให้สารละลายเป็นเบส มี pH มากกว่า 7

จากกราฟจะเห็นได้ว่า เมทิลเรด จะเปลี่ยนสีก่อนจุดสมมูลจึงไม่เหมาะที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแอซิติกกับ NaOH (เข้มข้น 0.100 M) ฟีนอล์ฟทาลีนเปลี่ยนสีที่ช่วงจุดสมมูลพอดี โบรโมไทมอลบลู อาจจะใช้เป็นอินดิเคเตอร์ได้ดี เมื่อใช้สีมาตรฐานเทียบ
3.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
การเปลี่ยนแปลง pH ของสารละลายขณะไทเทรตเบสอ่อน เช่น NH3กับกรดแก่ เช่น HCl จะค่อยๆ ลดลง เมื่อใช้ HCl เป็นสารมาตรฐาน ที่จุดยุติจะได้เกลือ NH4Cl และ pH < 7 ในการไทเทรต 0.100 M NH3กับ 0.100 M HCl จะได้กราฟของการไทเทรต (ดังภาพ)

กลับไปที่เนื้อหา
สารละลายบัฟเฟอร์คือ สารละลายที่เมื่อเติมกรดแก่หรือเบสแก่ลงไปเพียงเล็กน้อย
ทำให้ pHของสารละลายเปลี่ยนไปน้อยมาก จนถือได้ว่าไม่เปลี่ยนแปลง
ชนิดของบัฟเฟอร์แบ่งออกเป็น 2 ชนิด
บัฟเฟอร์กรดคือ บัฟเฟอร์ที่เกิดจากกรดอ่อนกับเกลือของกรดอ่อน pH < 7

บัฟเฟอร์เบสคือ บัฟเฟอร์ที่เกิดจากเบสอ่อนกับเกลือของเบสอ่อน pH> 7


กรดแก่ เบสแก่ เป็นบัฟเฟอร์ไม่ได้ เพราะสารพวกนี้แตกตัว 100%ไม่มีโอกาสเกิดคู่กรดคู่เบส
ตัวอย่างสารละลายบัฟเฟอร์

การควบคุมของสารละลายบัฟเฟอร์


ลองทำดูสารละลายต่อไปนี้สารละลายใดเป็นบัฟเฟอร์กรด บัฟเฟอร์เบส หรือไม่เป็นบัฟเฟอร์
HCNและ KCN …………………………. H2S และ NaHS …………………………..
NH4Cl และ NH3………………………. NaF และ HF ………………………………
CH3NH2และCH3NH2Cl …………….. KNO2และHNO2…………………………….
HCl และ NaCl ………………………. KOH และ KCl ……………………………..
สารละลายบัฟเฟอร์ในธรรมชาติ
น้ำทะเลเป็นบัฟเฟอร์ที่มีองค์ประกอบซับซ้อนมาก สารและไอออนที่มีบทบาทสำคัญ
ในการควบคุม pH ของน้ำทะเลได้แก่กรดคาร์บอนิก (H2CO3)ไฮโดรเจนคาร์บอเนต ไอออน (HCO3–) และคาร์บอเนตไอออน (CO32-)
ถ้าเติมกรดลงในน้ำทะเล pH จะเปลี่ยนแปลงน้อยมาก เพราะ H3O+ในกรดที่เพิ่มลง
ไปจะทำปฏิกิริยา กับ HCO3–, CO32-ดังสมการ
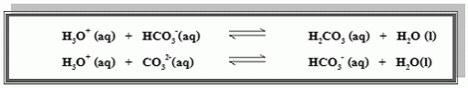
นอกจากนี้น้ำทะเลอาจจะมีแคลเซียมอยู่ด้วยจะเข้าทำปฏิกิริยากับ H3O+ในกรด
ดังนี้

ถ้าเติมเบสลงในน้ำทะเล pH จะเปลี่ยนแปลงน้อยมาก เพราะ OH–ในเบสที่เติมลงไป
จะเข้าทำปฏิกิริยากับ HCO3–, H2CO3และของผสมระหว่าง Ca2+, HCO3-ดังสมการ

นอกจากนี้ในน้ำทะเลยังมีระบบบัฟเฟอร์อื่นๆ อีก เช่น กรดโบริก (H3BO3–) และ ได
ไฮโดรเจนโบเรตไอออน ( H2BO3–) ถ้าเติมกรดหรือเบส ลงในน้ำทะเลH3O+และ OH–
จะเข้าทำปฏิกิริยากับ H2BO3–และH2BO3–ดังสมการ

จะเห็นได้ว่า H3O+และ OH–ที่เติมลงไปถูกกำจัดโดยสารละลายบัฟเฟอร์ในน้ำ
ทะเลจึงไม่ทำให้ pH ของน้ำทะเลเปลี่ยนแปลง
สารละลายบัฟเฟอร์ในสิ่งมีชีวิต
1. ฟอสเฟตบัฟเฟอร์ H2PO4–/ HPO42-จะเกี่ยวข้องกับการทำงานของไต เมื่อเราออกกำลังกายนาน ๆ จะมีกรดเกิดขึ้นทำให้ pH ของ เลือดเปลี่ยนไป ระบบบัฟเฟอร์
H2PO4–/ HPO42-ในเลือดจะเข้าทำปฏิกิริยาเพื่อลดความเข้มข้นของกรดได้

H2PO4–จะถูกกำกัดออกมาทางปัสสาวะ
2. ระบบ H2CO3/HCO3–จะควบคุม pH ของพลาสมาในเลือดให้มีค่าอยู่ระหว่าง 7.35-7.45 ซึ่งเกิดปฏิกิริยาดังนี้
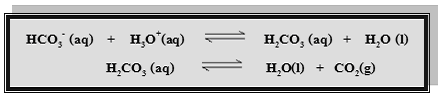
เนื่องจากความเป็นกรด-เบสในร่างกายของสิ่งมีชีวิตเป็นเรื่องที่สำคัญมาก ถ้า pH
เปลี่ยนแปลงไปเพียง 0.2 หน่วย จากช่วง 7.35-7.45 อาจทำให้เจ็บป่วยได้
กลับไปที่เนื้อหา
บทเรียนที่ 11 การทดลองการไทเทรด
การไทเทรตหาจุดสมมูลของปฏิกิริยาระหว่างกรดกับเบสแก่
การทดลองที่ 4 การไทเทรตหาจุดสมมูลของปฏิกิริยาระหว่างกรดกับเบสแก่
1. ปิเปตตสารละลายไฮโดรคลอริกเข้มข้น 0.1 mol/dm3 จำนวน 25cm3ใส่ในขวดรูปกรวยขนาด 100cm3 2. หยดยูนิเวอร์ซัลอินดิเคเตอร์ 5 หยด เขย่าแล้วนำไปเปรียบเทียบสีของยูนิเวอร์ซัลอินดิเคเตอร์ในสารละลายที่มี pH ต่างๆ บันทึกค่า pH ของสารละลาย
3. ไขสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3 จากบิวเรตต์ลงในสารละลายข้อ 2 ครั้งละ 5cm34 ครั้ง บันทึกค่า pH ของสารละลายผสมทุกครั้งที่เติมสารละลายโซเดียมไฮดรอกไซด์ลงไป
4. เติมสารละลายโซเดียมไฮดรอกไซด์ต่อไปอีก ครั้งละ 1cm3บันทึกค่า pH ทุกครั้งที่เติม และไทเทรตต่อไปจนกระทั่งสารละลายเปลี่ยนเป็นสีม่วงน้ำเงิน วัด pH ของสารละลาย
5. หลังจากจุดยุติแล้วเติมสารละลายโซเดียมไฮดรอกไซด์ครั้งละ 1cm3ต่อไปอีก 3 ครั้ง บันทึกค่า pH
6. เขียนกราฟแสดงความสัมพันธ์ระหว่างค่า pH ของสารละลายกับปริมาตรของโซเดียมไฮดรอกไซด์ที่เติมลงไป
ผลการทดลอง
เมื่อนำข้อมูลที่ได้จากการไทเทรตระหว่างกรด HCl กับ NaOH มาเขียนกราฟแสดงความสัมพันธ์ระหว่าง pH ของสารละลายผสม กับปริมาตรของสารละลายโซเดียมไฮดรอกไซด์ที่เติมลงไปได้กราฟดังนี้

กราฟแสดงการเปลี่ยนแปลง pH ที่ได้จากการไทเทรตนี้เรียกว่า กราฟของการไทเทรต ก่อนการไทเทรตสารละลายกรดไฮโดรคลอริกเข้มข้น 0.1 mol/dm3จำนวน 25cm3ซึ่งมี
pH = 1 เมื่อไทเทรตด้วยสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3 จะทำให้ปริมาตรของ H3O+ในสารละลายลดลง pH ของสารละลายจะเพิ่มขึ้นเรื่อยๆ อย่างช้าๆ จนถึงจุดยุติซึ่งเป็นภาวะที่อินดิเคเตอร์เปลี่ยนสี pH ของสารละลายจะเพิ่มขึ้นอย่างรวดเร็ว กราฟช่วงนี้จะมีความชันมากที่สุด และมีช่วง pH 3-11 ณ ภาวะนี้เมื่อเติมสารละลายโวเดียมไฮดรอกไซด์ลงไปเพียงหนึ่งหยดหรือเศษส่วนของหยดเท่านั้น ก็จะทำให้อินดิเคเตอร์เปลี่ยนเป็นสีม่วงน้ำเงิน

ถ้าแบ่งครึ่งเส้นกราฟส่วนที่ชันที่สุดแล้วลากเส้นจากจุดแบ่งครึ่งตั้งฉากกับแกนนอน จะตัดแกนนอนที่ 25cm3ดังรูป แสดงว่าสารละลายกรดไฮโดรคลอริกเข้มข้น 0.1 mol/dm3จำนวน 25cm3ทำปฏิกิริยาพอดีกับสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3จำนวน 25cm3ซึ่งสอดคล้องกับผลการคำนวณ จุดแบ่งครึ่งเส้นกราฟ ส่วนที่ชันที่สุดนี้คือ
จุดสมมูล ซึ่งเป็นจุดที่สารละลายโซเดียมไฮดรอกไซด์ทำปฏิกิริยาพอดีกับกรดไฮโดรคลอริก
จากจุดสมมูล ถ้าลากเส้นขนานไปกับแกนนอนไปตัดแกนตั้งจะได้ pH เท่ากับ 7 แสดงว่า pH ที่จุดสมมูลของการไทเทรตระหว่างกรดไฮโดรคลอริกกับสารละลายโซเดียมไฮดรอกไซด์มรค่าเท่ากับ 7 สารละลายผสมจึงควรมีสมบัติเป็นกลาง แต่จากการทดลองที่ 3 วัด pH จุดยุติได้ประมาณ 7-8 เพราะว่าใช้ฟีนอล์ทาลีนเป็นอินดิเคเตอร์ซึ่งเปลี่ยนสีในช่วง pH 8.3- 10.0 และจากการทดลองที่ 4 วัด pH ของสารละลาย ณ จุดยุติได้ประมาณ 7 ดังนั้น pH ของสารละลายที่จุดสมมูลจึงมีค่าใกล้เคียงกับ pH ของสารละลายที่จุดยุติ
ในกรณีของการไทเทรตระหว่างกรดอ่อนกับเบสแก่ เช่น สารละลายกรดแอซีติกกับสารละลายโซเดียมไฮดรอกไซด์ เป็นดังกราฟ

เมื่อพิจารณากราฟของการไทเทรตสารละลายกรดกับเบส ดังรูป พบว่ามีรูปร่างคล้ายกันคือ pH จะเปลี่ยนอย่างช้าๆ ในตอนแรก และจะเปลี่ยนอย่างรวดเร็วเมื่อใกล้จุดสมมูล แต่ส่วนที่แตกต่างกันคือ กราฟการไทเทรตกรดแอซิติกด้วยโซเดียมไฮดรอกไซด์มี pH ที่จุดเริ่มต้นสูงกว่า เนื่องจากกรดแอซีติกเป็นกรดอ่อน และช่วงที่กราฟมีความชันมากที่สุดสั้นกว่าคือช่วง pH 6-11 เมื่อหา pH ที่จุดสมมูลจะได้สูงกว่า 7 คือประมาณ 8.7 ทั้งนี้อธิบายได้ว่า ปฏิกิริยาระหว่างกรดแอซิติกกับโซเดียมไฮดรอกไซด์ จะได้เกลือโซเดียมแอซีเตตเกิดขึ้น
CH3COOH (aq) + NaOH(aq) CH3COOHNa(aq) +H2O (l)
CH3COOHNa(aq) +H2O (l)
CH3COOHNa เมื่อละลายน้ำจะแตกตัวเป็นไอออนได้หมด และCH3COO-ก็จะเกิดปฏิกิริยาไฮโดรไลซิสกับน้ำต่อไปได้ OH-ดังสมการ
CH3COOHNa(aq) Na+(aq) +CH3COO-(aq)
Na+(aq) +CH3COO-(aq)
CH3COO-(aq) +H2O(l) CH3COOH(aq) + OH-(aq)
CH3COOH(aq) + OH-(aq)
ดังนั้นการไทเทรตกรดแอซีติกด้วยโซเดียมไฮดรอไซด์ จึงได้สารละลายผสมมีสมบัติเป็นเบส pH ของสารละลายที่จุดสมมูลจึงมีค่ามากกว่า 7
การไทเทรตกรดอ่อนด้วยเบสอ่อน เช่น สารละลายกรดแอซีติกกับแอมโมเนีย จะได้กราฟของการไทเทรตเป็นดังนี้

จากกราฟ จะพบว่าช่วงของการเปลี่ยนแปลง pH ตรงจุดสมมูลสั้นมาก การหาจุดสมมูลจากการไทเทรตระหว่างกรดกับเบสคู่นี้ จึงค่อนข้างยากและไม่เที่ยงตรง ดังนั้นในทางปฏิบัติจึงไม่นิยมการไทเทรตระหว่างกรดอ่อนกับเบสอ่อน
ในการไทเทรตระหว่างกรดกับเบส สิ่งที่สำคัญที่ต้องการทราบก็คือ จุดที่กรดกับเบสทำปฏิกิริยาพอดีกันหรือจุดสมมูล ซึ่งจะหาได้โดยใช้อินดิเคเตอร์ช่วยบอกจุดยุติของการไทเทรต ดังนั้นจึงต้องเลือกใช้อินดิเคเตอร์ให้เหมาะสม เพื่อให้ pH ที่จุดยุติใกล้เคียงกับ pH ของจุดสมมูลมากที่สุด
กลับไปที่เนื้อหา
บทเรียนที่ 12 การเลือกอินดิเคเตอร์ในการไทเทรตกรด-เบส
การทดลองที่ 5 การเลือกอินดิเคเตอร์ในการไทเทรตกรด-เบส
1. ปิเปตต์สารละลายCH3COOH0.1 mol/dm3 จำนวน 10cm3ลงในขวดรูปกรวยขนาด 100cm3หยดฟีนอล์ฟทาลีนลงไป 3 หยด
2. บรรจุสารละลาย NaOH 0.1 mol/dm3 ในบิวเรตต์ บันทึกปริมาตรก่อนการไทเทรต
3. หยดสารละลาย NaOH จากบิวเรตต์ลงในสารละลายCH3COOHที่เตรียมไว้ทีละหยด เขย่าขวดทุกครั้งทีหยดลงไป ทำเช่นนี้ต่อไปจนอินดิเคเตอร์เปลี่ยนสี บันทึกปริมาตรของสารละลายในบิวเรตต์
4. ทำการทดลองเช่นเดียวกับข้อ 1-3 แต่ใช้เมทิลออเรนจ์แทนฟีนอล์ฟทาลีน
ผลการทดลอง
จากความรู้ที่ได้ศึกษามาแล้วควรบอกได้ว่า ณ จุดสมมูล ถ้าใช้สารละลายกรดแอซีติกเข้มข้น 0.1 mol/dm3 จำนวน 10cm3จะทำปฏิกิริยาพอดีกับสารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3 จำนวน 10cm3ได้สารละลายที่มีสมบัติเป็นเบส และ pH ที่จุดสมมูลมีค่าประมาณ 8.7
ในการไทเทรตกรดกับเบสคู่นี้ใช้ฟีนอล์ฟทาลีนซึ่งเปลี่ยนสีในช่วง pH 8.3 10.0 และเมทิลออเรนจ์ซึ่งเปลี่ยนสีในช่วง pH 3.2 4.4 เป็นอินดิเคเตอร์ ใช้สารละลายโซเดียมไฮดรอกไซด์มากกว่าเมื่อใช้เมทิลออเรนจ์เป็นอินดิเคเตอร์ แสดงว่าอินดิเคเตอร์ทั้งสองชนิดนี้บอกจุดยุติได้ไม่ตรงกัน ฟีนอล์ฟทาลีนจะบอกจุกยุติได้ใกล้เคียงจุดสมมูลมากกว่า และสามารถเปลี่ยนสีในช่วง pH ที่ตรงกัน pH ของสารละลายเกลือโซเดียมแอซีเตตที่ได้จากปฏิกิริยา ดังนั้นจึงควรใช้ฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์สำหรับการไทเทรตกรด-เบสคู่นี้ กราฟแสดงการไทเทรตระหว่างสารละลาย CH3COOHกับ NaOH

การเลือกใช้อินดิเคเตอร์ที่เหมาะสมสำหรับการไทเทรตกรด-เบส ต้องเลือกใช้อินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนสีใกล้เคียงกับ pH ของสารละลายผลิตภัณฑ์ หรือพิจารณาจากช่วงของการเปลี่ยน pH นั้น ดังตัวอย่างการไทเทรตกรดแก่ดัวยเบสแก่ เช่น HCl กับ NaOH ดังรูป
ซึ่งพบว่าช่วงที่ชันที่สุด มีค่า pH 3-11 เราจึงควรเลือกอินดิเคเตอร์ที่เปลี่ยนสีในช่วง pH 3-11 ได้หลายชนิด ได้แก่
เมทิลออเรนจ์ เปลี่ยนสีที่ช่วง pH 3.2 4.4
เมทิลเรด เปลี่ยนสีที่ช่วง pH 4.2 6.3
โบรโมไทมอลบลู เปลี่ยนสีที่ช่วง pH 6.0 7.6
ฟีนอล์ฟทาลีน เปลี่ยนสีที่ช่วง pH 8.3 10.0

การไทเทรตกรดกับเบสแต่ละคู่ที่ได้กล่าวมาแล้ว ถ้าพิจารณาตามความแรงของกรดและเบสที่เข้าทำปฏิกิริยากัน แบ่งได้เป็น 4 ประภท และต้องเลือกใช้อินดิเคเตอร์ให้เหมาะสมสำหรับกรดกับเบสคู่นั้นๆดังนี้
1. การไทเทรตระหว่างกรดแก่และเบสแก่ ให้เลือกใช้อินดิเคเตอร์ที่แสดงจุดยุติที่pH ประมาณ 7
2. การไทเทรตระหว่างกรดแก่และเบสอ่อน ให้เลือกใช้อินดิเคเตอร์ที่แสดงจุดยุติที่ pH ต่ำกว่า 7
3. การไทเทรตระหว่างกรดอ่อนและเบสแก่ ให้เลือกใช้อินดิเคเตอร์ที่แสดงจุดยุติที่pH สูงกว่า 7
4. การไทเทตรระหว่างกรดอ่อนกับเบสอ่อน ให้เลือกใช้อินดิเคเตอร์ที่แสดงจุกยุติที่pH ประมาณ 7
ในกรณีที่ 4 จะมีการเปล่ยนแปลงค่า pH น้อยมาก เนื่องจากความอ่อนของทั้งกรดและเบส ทำให้ปฏิกิริยาเกิดขึ้นน้อย ดังนั้นการใช้อินดิเคเตอร์ที่มีการเปล่ยนแปลงสีที่จุดยุติ อาจทำให้สังเกตจุดยุติคลาดเคลื่อนได้ หรือบางกรณีไม่สามารถสังเกตจุดยุติได้ จึงต้องใช้ความระมัดระวังเป็นพิเศษในการไทเทรต
กลับไปที่เนื้อหา
บทเรียนที่ 13 การเตรียมสารละลายบัฟเฟอร์
วิธีเตรียมสารละลายบัฟเฟอร์
1.เตรียมโดยตรงโดยการผสมกรดอ่อนกับคู่เบสของกรดนั้นหรือผสมเบสอ่อนกับคู่กรดของเบสนั้นก็จะได้เกลือของกรดอ่อนและเกลือของเบสอ่อน
2.เตรียมจากปฏิกิริยาระหว่างกรดกับเบส ดังนี้
1) บัฟเฟอร์กรดเตรียมโดยใช้กรดอ่อน( แตกตัวบางส่วน )ทำปฏิกิริยากับเบส(แก่หรืออ่อน)
เช่น HF(aq) + NaOH(aq) -----------------> NaF(aq) + H2O(l)
ถ้าใช้HFมากเกินพอ เมื่อเกิดปฏิกิริยาจนสมบูรณ์แล้วNaOHจะหมดไปจากระบบดังนั้นในระบบจะเป็นสารละลายผสมระหว่างHFกับNaFซึ่งเป็นบัฟเฟอร์กรด (กรดอ่อน+เกลือของมัน)ฃ
2) บัฟเฟอร์เบสเตรียมโดยใช้เบสอ่อน( แตกตัวบางส่วน ) ทำปฎิกิริยากับกรด (แก่หรืออ่อน)เช่น
HCl(aq) + NH4OH(aq)--------> NH4Cl(aq) + H2O(l)
ถ้าใช้ NH4OHมากเกินพอ เมื่อเกิดปฏิกิริยาสมบูรณ์แล้วHClจะหมดไปจากระบบดังนั้นในระบบจะเป็นสารละลายผสมระหว่างNH4OHกับ NH4Clซึ่งเป็นบัฟเฟอร์เบส (เบสอ่อน + เกลือของมัน)
การควบคุมค่าpHของสารละลายบัฟเฟอร์
ถ้าบัฟเฟอร์มีสารCH3COO-กับCH3COOHอยู่ในระบบถ้าเติมกรด เช่นHClลงไป H+ในกรดจะถูกสะเทินด้วยคู่เบสดังนี้
CH3COO-+ H+↔ CH3COOH
ถ้าเติมเบส เช่น KOHลงไป OH-ในเบสจะถูกสะเทินด้วยคู่กรณีดังนี้
CH3COOH + OH-↔ CH3COO-+ H2O
สรุปได้ว่า
-ถ้าเติมกรดลงไป H+ในกรดจะถูกสะเทินด้วยเบส
-ถ้าเติมเบสลงไป OH-ในเบสจะถูกสะเทินด้วยกรด
-กรดแก่เบสแก่เป็นบัฟเฟอร์ไม่ได้เพราะสารพวกนี้แตกตัวได้ 100%ไม่มีโอกาสเกิดคู่กรดคู่เบสชนิดของ Buffer
1.คู่เหมือนไม่ทำปฏิกิริยากัน เช่น CH3COOH กับ CH3COONa
2.บัฟเฟอร์คู่กรด คู่เบส ของกรดอ่อนกับเกลือของกรดอ่อน
3.บัฟเฟอร์คู่กรด คู่เบส ของเบสอ่อนกับเกลือของเบสอ่อนหลักการการดูสารว่าเป็นBufferหรือไม่1.ถ้าไม่ทำปฏิกิริยากัน(คู่เหมือน)ตัดแก่ออกจะต้องมีH+ต่างกัน1ตัว
2.ถ้าทำปฏิกิริยากันอ่อนต้องเหลือการดูค่าpHของ สารละลายBuffer1.บัฟเฟอร์ที่เกิดจากกรดอ่อนคู่กับเกลือของกรดอ่อน มีpH <7เป็นกรด
2.บัฟเฟอร์ที่เกิดจากเบสอ่อนคู่กับเกลือของเบสอ่อน มีpH >7เป็นเบสสูตรที่ใช้ในการหาค่าPHและPOH
pHของBufferใช้สูตร
เมื่อ A- =ความเข้มข้นของเกลือ
HA =ความเข้มข้นเริ่มต้นของกรด
pOHของBufferใช้สูตรpOH = -logKb + log [เกลือ]/[เบส]
****สารละลายบัฟเฟอร์จะมีประสิทธิภาพดีที่สุดเมื่อ [HA] = [A-]ซึ่งจะทำให้ [H+] = Kaด้วยเหตุนี้จึงเลือกใช้บัฟเฟอร์ที่มีค่าpKaใกล้เคียงกับpHที่ต้องการเตรียม****
กลับไปที่เนื้อหา
บทเรียนที่ 14 กรด เบส ในชีวิตประจำวัน
สารละลายกรด-เบส ในชีวิตประจำวัน
สารละลายกรด – เบสในชีวิตประจำวันมีอยู่มากมาย ซึ่งสามารถจำแนกได้ดังนี้
1. สารประเภททำความสะอาด
– บางชนิดก็มีสมบัติเป็นเบส เช่น สบู่ ผงซักฟอก น้ำยาล้างจาน
– บางชนิดมีสมบัติเป็นกรด เช่น น้ำยาล้าง ห้องน้ำ และเครื่องสุขภัณฑ์

รูปที่ 15 :สารประเภททำความสะอาด
ที่มา :http://story.yenta4.com/AcidBaseLearning/2008/06/01/public-16
2. สารที่ใช้ทางการเกษตรได้แก่ ปุ๋ย
– บางชนิดก็มีสมบัติเป็นเบส เช่น ยูเรีย
– บางชนิดมีสมบัติเป็นกรด เช่น แอมโมเนียมคลอไรค์
– บางชนิดมีสมบัติเป็นกลาง เช่น โพแทสเซียมไนเตรต
3. สารปรุงแต่งอาหาร
– บางชนิดก็มีสมบัติเป็นเบส เช่น น้ำปูนใส น้ำขี้เถ้า
– บางชนิดมีสมบัติเป็นกรด เช่น น้ำส้มสายชู น้ำมะนาว น้ำมะขาม
– บางชนิดมีสมบัติเป็นกลาง เช่น ผงชูรส เกลือแกง น้ำตาลทราย ฯลฯ

รูปที่ 17 :สารปรุงแต่งอาหาร
ที่มา :http://story.yenta4.com/AcidBaseLearning/2008/06/01/public-16
4. ยารักษาโรค
– บางชนิดก็มีสมบัติเป็นเบส เช่น ยาแอสไพริน วิตามินซี
– บางชนิดมีสมบัติเป็นกรด เช่น ยาลดกรด ยาธาตุ

รูปที่ 18 :ยารักษาโรค
ที่มา :http://story.yenta4.com/AcidBaseLearning/2008/06/01/public-16
5. เครื่องสำอาง
– บางชนิดมีสมบัติเป็นกลาง เช่น น้ำหอม สเปรย์ฉีดผม ยารักษาสิวฝ้า
รูปที่ 19 :เครื่องสำอาง
ที่มา :http://story.yenta4.com/AcidBaseLearning/2008/06/01/public-16
สารละลายกรด-เบสในชีวิตประจำวันและในสิ่งมีชีวิต
*ตัวอย่างสารละลายกรดในชีวิตประจำวันและในสิ่งแวดล้อมมีดังต่อไป
-กรดtartaric [C4H6O6] พบในมะขามป้อม ฝรั่ง
-กรดแอซิติก (acetic acid) [CH3COOH]ใช้ในการผลิตน้ำส้มสายชู
– กรดซิตริก (citric acid) [C6H8O7]เป็นกรดที่อยู่ในผลไม้ที่มีรสเปรี้ยวเช่น ส้ม มะนาว
– กรดแอสคอร์บิก (ascorbic acid) [C6H8O6] มีอยู่ในผลไม้ที่มีรสเปรี้ยว วิตามินC
– กรดอะมิโน (amino acid) เป็นกรดที่ใช้สร้างโปรตีน มักพบในเนื้อสัตว์ ผลไม้
-กรดซัลฟิวริก [H2SO4] ทำปุ๋ยเคมี
-กรดboric [H3BO3] ยาฆ่าเชื้อโรค , น้ำยาล้างตา
-กรดไฮโดรคลอริก [HCl] น้ำยาล้างสุขภัณฑ์
-กรดออกซาลิก [H2C2O2] กำจัดรอยเปื้อนสนิม
-กรดคาร์บอนิก [H2CO3] เป็นส่วนประกอบของน้ำอัดลม
*ตัวอย่างสารละลายเบสในชีวิตประจำวันและสิ่งแวดล้อมมีดังต่อไปนี้
1. สารประเภททำความสะอาด
– NaOH ใช้ทำสบู่
– แอมโมเนีย (NH3) น้ำยาล้างกระจก,น้ำยาปรับผ้านุ่ม
– Na2CO3อุตสาหกรรมผงซักฟอก
2. สารปรุงแต่งอาหาร
-NaOH ทำผงชูรส
-NaHCO3ทำขนม
3. สารที่ใช้ทางการเกษตร ได้แก่ ปุ๋ย
– ยูเรีย
– Ca(OH)2 แก้ดินเปรี้ยว
4. ยารักษาโรค
-NH3-(NH4)2CO3แก้เป็นลม
-Ca(OH)2ลดกรดในกระเพาะอาหาร
-Mg(OH)2ลดกรดในกระเพาะอาหาร , ยาถ่าย
สารเคมีที่ใช้ในบ้าน
ในแต่ละวันเราต้องใช้สารละลายกรด – เบส หลายชนิด บางชนิดอยู่ในอาหารที่เรารับประทาน เราใช้สารละลายกรด – เบส ในการทำความสะอาด เครื่องใช้ ของใช้
พื้นห้องน้ำ สุขภัณฑ์ สารที่ทำความสะอาดร่างกายบางชนิดมีสมบัติเป็นเบส
สารละลายหลายชนิดในร่างกายของเราก็มีคุณสมบัติเป็นกรด – เบส เช่น
น้ำย่อยในกระเพาะอาหารของคนเรามี pH อยู่ใน ช่วง 1.6 – 2.5 ซึ่งมีคุณสมบัติเป็นกรด เพื่อทำหน้าที่ย่อยโปรตีน
ในแต่ละวันเราต้องใช้สารทำความสะอาดเพื่อกำจัดฝุ่นละออง เหงื่อไคล และสิ่งสกปรกออกจากผิวหนังๆแต่ละส่วนของร่างกายจึงใช้ สารทำความสะอาดแตกต่างกัน เช่น ใช้แชมพูทำความสะอาดเส้นผม ใช้สบู่ทำความสะอาดผิวหนัง
บางคนใช้สารทำความสะอาดที่กับใบหน้าโดยเฉพาะ นอกจากประสิทธิในกำจัดสิ่งสกปรกแล้ว สมบัติอื่นๆ ของสารทำความสะอาดที่ใช้กับร่างกาย เช่น กลิ่น สี รวมทั้งความเป็น กรด – เบส ก็เป็นปัจจัยหนึ่งที่เราต้องคำนึงถึงด้วยเมื่อจะเลือกซื้อสารทำความสะอาดกับร่างกาย
ในสมัยก่อน สารทำความสะอาดที่ผสมอยู่ในแชมพูส่วนใหญ่เป็นสารประเภทเดียวกับสบู่ เมื่อสระผมด้วยน้ำกระด้างจึงเกิดไคลสบู่จับอยู่ตามเส้นผม คนในสมัยก่อนจึงนิยมชโลมผมด้วยน้ำมะกรูดหรือน้ำมะนาวเพื่อกำจัดไคลสบู่ออกจากเส้นผมนั่นเอง
ปัจจุบันนี้ใช้สารสังเคราะห์ซึ้งมีสมบัติเป็นสารลดแรงตึงผิวที่สามารถกำจัดสิ่งสกปรกออกจากเส้นผมได้ดีกว่าสบู่มาก นอกจากนี้ยังอาจเติมสารปรับ pH กลิ่น สี ให้น่าใช้และเติมสารที่ทำให้เนื้อแชมพูข้น บางคนนิยมใช้ครีมนวดผมหลังจากที่สระผมแล้ว เพื่อปรับสภาพเส้นผม
การใช้สารรอบตัวโดยเฉพาะสารที่มีสมบัติกัดกร่อน เช่น กรด – เบส นอกจากจะคำนึงถึงสมบัติของสารที่สอดคล้องกับวัตถุประสงค์ของการใช้แล้ว ยังจะต้องคำนึงถึงผลของการใช้สารที่อาจมีต่อสิ่งมีชีวิตอื่นและสิ่งแวดล้อมด้วย จึงควรศึกษาสมบัติของสาร วิธีใช้ และวิธีป้องกันอันตรายอย่างถูกต้อง
เราอาจจะสรุป pH ของสารละลายในชีวิตประจำวันได้ดังนี้
1. ของเหลวบางชนิดอาจจะมีช่วง pH กว้าง และบางชนิดมีช่วง pH แคบตามข้อมูลในตาราง
2. ถ้ารับประทานอาหารประเภทผัก ปัสสาวะจะมี pH สูง แต่ถ้ารับประทานเนื้อสัตว์มาก ปัสสาวะจะมี pH ต่ำ
3. ในร่างกายของคนเราของเหลวบางชนิดมี pH แปรไปได้ในช่วงค่อนข้างกว้าง โดยที่ร่างกายยังคงอยู่ในสภาพปกติไม่เจ็บป่วย แต่ของเหลวบางชนิดในคนปกติมี pH ค่อนข้างคงที่ เช่น เลือดมีค่า pH แปรไปได้เพียง 0.10 เท่านั้น สำหรับคนที่เป็นโรคเบาหวานรุนแรง ค่า pH ของเลือดอาจลดต่ำลงกว่า 7.35 ทำให้เกิดอาการคลื่นไส้ ถ้าลดลงต่ำมากๆ อาจหมดสติถึงตายได้
อย่างไรก็ตาม ปกติในร่างกายของคนจะมีระบบที่ควบคุมค่า pH ของเลือดไว้ให้คงที่
4. ในน้ำฝนซึ่งน่าจะมีสมบัติเป็นกลาง แต่พบว่ามี pH ประมาณ 5.6-6.0 เท่านั้น และปัจจุบันในประเทศอุตสาหกรรม pH ของน้ำฝนมีค่าต่ำถึง 2.8 จากการตรวจสอบพบว่านอกจากมี CO2ละลายอยู่แล้วยังมี H2SO4 และ HNO3 ละลายปนอยู่ด้วย
กลับไปที่เนื้อหา
บทเรียนที่ 15 การไทเทรดแบบตกตะกอน
การไทเทรตสำหรับปฏิกิริยาการเกิดสารเชิงซ้อน (Complexometric titration)*
หลักการของ complexometric titration เป็นการไตเตรทเพื่อหาปริมาณ metal ion โดยการเกิดเป็นสารประกอบเชิงซ้อนระหว่างไอออนของโลหะ ซึ่งเป็นตัวรับอิเลคตรอนกับสารที่สามารถให้คู่อิเลคตรอนกับโลหะได้ ในสารละลายที่ถูก buffered ให้มี pH อยู่ในช่วงที่เหมาะสม อินดิเคเตอร์ที่ใช้จะถูกเติมลงไปในสารละลายนี้ แล้วไอออนของโลหะจะถูกไตเตรทด้วยสารละลายมาตรฐานของ complexing agent และเมื่อถึงจุดยุติควรสังเกตเห็นการเปลี่ยนแปลงสีได้ชัดเจน การตรวจวัดจุดยุติอาจทำได้ทั้ง physical method และ chemical method การไตเตรทโดยวิธีนี้จะทำได้ง่าย สะดวกและมีความถูกต้อง ดังนั้นจึงได้มีการพัฒนามาใช้แทนการวิเคราะห์โดย gravimetric method ซึ่งวิเคราะห์ไอออนโลหะได้หลายชนิด
* หลักการนี้ ไม่สามารถใช้วิเคราะห์โลหะ alkali metal ได้
* Analyte: metal ion ที่มี valency > 1 เช่น Al3+, Cu2+
* Titrant: Chelating agent หรือ complexing agent หรือ Ligand เช่น EDTA
* Complex : Chelate
* การวัดจุดยุติ : Indicator หรือ potentiometric method
A technique of volumetric analysis in which the formation of a colored complex is used to indicate the end point of a titration. Also known as chelatometry. Also spelled compleximetric titration.
Complexometric titration(sometimes chelatometry) is a form of volumetric analysis in which the formation of a colored complex is used to indicate the end point of a titration. Complexometric titrations are particularly useful for the determination of a mixture of different metal ions in solution. An indicator capable of producing an unambiguous color change is usually used to detect the end-point of the titration.
การจะเลือกใช้ complexometric titration method ในการวิเคราะห์หาปริมาณโลหะชนิดต่าง ๆ ได้นั้นต้องพิจารณาถึงหลักเกณฑ์ดังนี้
1. Complex reaction ต้องเป็น stoichiometrically กล่าวคือ metal ion ต้องทำปฏิกิริยากับ chelating agent ในอัตราส่วนที่แน่นอน
2. อัตราการเกิดปฏิกิริยาต้องเร็ว
3. สารประกอบเชิงซ้อนที่เกิดขึ้นต้องมีความคงตัวดี ค่าคงที่ของการเกิดสารประกอบเชิงซ้อนต้องสูง
4. มี sharp end point กับอินดิเคเตอร์ คือสังเกตจุดยุติได้ชัดเจน เมื่อเติม titrant excess ปริมาณเล็กน้อย titrant นั้น ก็สามารถทำปฏิกิริยากับอินดิเคเตอร์แล้วเกิดการเปลี่ยนแปลงสีที่ชัดเจน
5. ไม่เกิดตะกอนระหว่างการไทเทรต เพราะจะทำใ%E
กลับไปที่เนื้อหา
บทเรียนที่ 16 การไทเทรดทางไฟฟ้า
1.หลักการในการวิเคราะห์
คูลอมเมทรีเป็นเทคนิคการวิเคราะห์ทางเคมีเชิงไฟฟ้าวิธีหนึ่ง โดยมีการจัดเซลล์แบบอิเล็กโทรไลต์ ก็คือจะต้องมีการให้พลังงานจากภายนอกให้กับเซลล์ และจะต้องเป็นกระแสตรง (D.C.) เทคนิคนี้จะเกี่ยวข้องกับการวัดปริมาณประจุไฟฟ้า (อิเล็กตรอน) ที่ทำให้เกิดการเปลี่ยนแปลงเลขออกซิเดชันของสารตัวอย่าง ดังนั้นปริมาณของสารตัวอย่างจึงสัมพันธ์กับปริมาณประจุไฟฟ้าทั้งหมดที่ให้กับเซลล์ ในการวิเคราะห์ด้วยเทคนิคนี้จำเป็นที่จะต้องมีการกวนสารละลายตลอดเวลา เพื่อช่วยนำพาไอออนไปเกิดปฏิกิริยาที่ขั้วใช้งาน (working electrode) การวิเคราะห์ด้วยเทคนิคนี้ จะอาศัยความสัมพันธ์ระหว่างปริมาณของประจุไฟฟ้าที่ใช้ กับจำนวนกรัมสมมูลของสารตัวอย่าง ตามกฎของฟาราเดย์
เพราะฉะนั้นการวิเคราะห์หาปริมาณสารตัวอย่างด้วยเทคนิคคูลอมเมทรีจะแตกต่างจากการวิเคราะห์ด้วยเทคนิคอิเล็กโทรแกรวิเมทรี โดยเทคนิคคูลอมเมทรีเป็นการวัดประจุไฟฟ้า (อิเล็กตรอน) แต่อิเล็กโทรแกรวิเมทรีเป็นการชั่งน้ำหนักที่เพิ่มขึ้นบนขั้วไฟฟ้า ซึ่งทั้งสองวิธีสามารถหาปริมาณสารตัวอย่างได้โดยตรง โดยไม่จำเป็นต้องสร้ากราฟมาตรฐาน หรือไปเทียบกับสารมาตรฐานแต่อย่างใด
กฎของฟาราเดย์
กฎการแยกสารด้วยไฟฟ้าของฟาราเดย์ กล่าวไว้ว่า "ปริมาณไฟฟ้าที่ผ่านเข้าในเซลล์ เป็นสัดส่วนโดยตรงกับปริมาณการเปลี่ยนแปลงสมมูลของสารที่เกิดขึ้นที่ขั้วไฟฟ้าของเซลล์นั้น"ซึ่งสามารถเขียนอยู่ในรูปสมการได้ดังนี้
Q = F x No.equivalents ............ (1)
Q = ปริมาณประจุไฟฟ้าที่ถูกพาเข้าสู่เซลล์ มีหน่วยเป็น C
F = เป็นค่าคงที่ของฟาราเดย์ มีค่าเท่ากับ 96,485 คูลอมบ์ (C) หรือ 6.022 x 1023อิเล็กตรอน
เมื่อการไหลของกระแส (i) คงที่ที่ 1 แอมแปร์ (A) ในเวลา (t) 1 วินาที (s) จะได้ว่า
Q = i x t............ (2)
จาก (1) และ (2) จะได้ความสัมพันธ์ ดังนี้

เมื่อ n คือ จำนวนโมลของอิเล็กตรอน เช่น

n = 2 โมลของอิเล็กตรอน
2. เทคนิควิธีวิเคราะห์ด้วยคูลอมเมทรี
การวิเคราะห์เชิงไฟฟ้าด้วยเทคนิคคูลอมเมทรีสารมารถแบ่งออกได้เป็น 2 วิธี ดังนี้
2.1 คูลอมเมทรีแบบควบคุมกระแสคงที่
การวิเคราะห์ด้วยเทคนิคคูลอมเมทรีแบบควบคุมกระแสคงที่ อุปกรณ์ที่ทำหน้าที่เป็นแหล่งควบคุมให้กระแสคงที่คือ แอมเพอโรสแตท (amperostat) วิธีที่สามารถทำได้โดยการไทเทรชัน (titration) จึงเรียกอีกชื่อหนึ่งว่า “ คูลอมเมตริกไทเทรชัน (coulometric titration) ” โดยสารตัวอย่างที่ต้องการวิเคราะห์จะถูกไทเทรตด้วยไทเทรนต์ (อิเล็กตรอน) ในการวิเคราะห์จะมีการให้กระแสคงที่กับวงจรตลอดเวลา จนกว่าจะถึงจุดยุติของการไทเทรต วิธีนี้สามารถสามารถวิเคราะห์สารตัวอย่างได้ถึงระดับไมโครกรัม ( 10-6) ทำให้มีความถูกต้องและความแม่นยำสูง

2.2 คูลอมเมทรีแบบควบคุมศักย์ขั้วไฟฟ้า
เทคนิคการวิเคราะห์คูลอมเมทรีแบบควบคุมศักย์ไฟฟ้านี้ จะมีหลักการของการหาปริมาณสารตัวอย่างเช่นเดียวกับเทคนิคอิเล็กโทรแกรวิเมทรีแบบควบคุมศักย์ขั้วไฟฟ้า กล่าวคือ จะต้องมีอุปกรณ์สำคัญคือ โพเทนชิออสเตท (potentiostate) ที่ทำหน้าที่ในการควบคุมศักย์ไฟฟ้าของขั้วใช้งาน (working electrode) เพื่อให้ค่าศักย์ไฟฟ้ามีค่าคงที่ตลอดการวิเคราะห์ แต่ในเทคนิคคูลอมเมทรีจะมีการบันทึกกระแสที่ใช้ ณ เวลาต่าง ๆ ของการวิเคราะห์ จนกระทั่งปฏิกิริยาการแยกสารตัวอย่างให้ผลเสร็จสมบูรณ์ และการคำนวณหาปริมาณสารตัวอย่างที่เกิดขึ้นในการวิเคราะห์ สามารถทำได้โดยการอินทิเกรตข้อมูลจากกราฟของกระแสกับเวลา ซึ่งก็คือปริมาณประจุไฟฟ้าที่ใช้ทั้งหมด


3. การประยุกต์ใช้ในการวิเคราะห์
การวิเคราะห์ด้วยเทคนิคคูลอมเมตริกไทเทรชัน ใช้ในการวิเคราะห์หาชนิดและปริมาณของไอออนโลหะในสารละลายตัวอย่าง และยังสามารถใช้ได้กับการวิเคราะห์ด้วยวิธีไทเทรตทางเคมีทุกรูปแบบ เช่น ปฏิกิริยาสะเทินของกรดและด่าง ปฏิกิริยาการตกตะกอน ปฏิกิริยาการเกิดสารประกอบเชิงซ้อน และปฏิกิริยารีดอกซ์ ปัจจุบันได้มีการประยุกต์และปรับปรุงเครื่องมืออิเล็กทรอนิกส์ทันสมัย สามารถวิเคราะห์ได้อย่างอัตโนมัติ เช่น การใช้คอมพิวเตอร์มาควบคุมการทำงานของเครื่องมือ ทำให้การวิเคราะห์ในห้องปฏิบัติการที่มีการวิเคราะห์เป็นประจำ มีความสะดวก รวดเร็ว ถูกต้อง และแม่นยำสูง
กลับไปที่เนื้อหา












![K_{mathrm a} = mathrm{frac{[A^-] [H^+]}{[HA]}}](http://upload.wikimedia.org/math/9/2/5/92593d3f8ab692bf55d05e13fee7de98.png)









































