สารประกอบโคเวเลนต์ (Covalent Compound)
![]()
ประเภทของสารประกอบโคเวเลนต์
การเกิดสารประกอบโคเวเลนต์
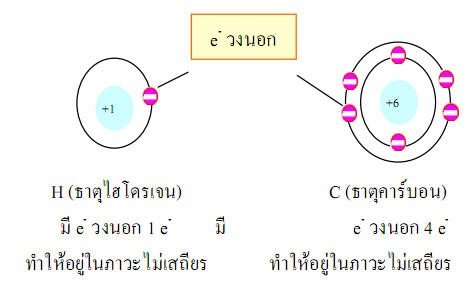
เกิดจากอะตอมของอโลหะทำปฏิกิริยากับอะตอมของอโลหะโดยอะตอมของอโลหะจะนำอิเล็กตรอนวงนอกมาใช้ร่วมกันเป็นคู่ ๆเพื่อให้อยู่สภาวะที่เสถียร และจะอยู่เป็นโมเลกุลชัดเจนว่า1โมเลกุลมีกี่อะตอม

|
ตารางที่4แสดงความต้องการใช้อิเล็กตรอนร่วมกับอะตอมของธาตุอโลหะ เพื่อให้อยู่ในภาวะเสถียร |
||||||||||||||||||||||||||||||||||||||||||||
|
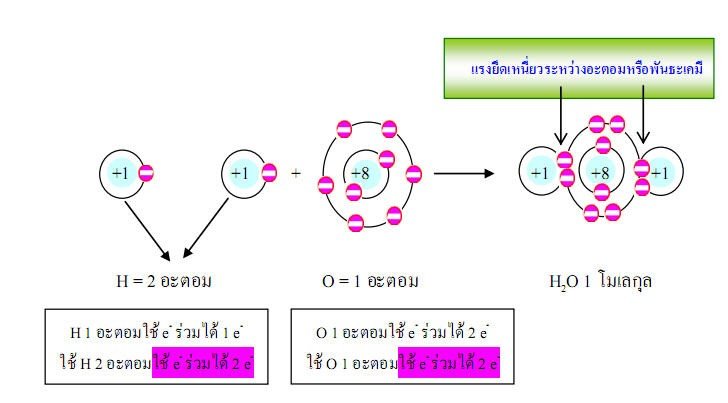
ตัวอย่างที่1อะตอมของธาตุไฮโดรเจน 2 อะตอม รวมกับอะตอมของธาตุออกซิเจน1อะตอมได้น้ำ1โมเลกุล
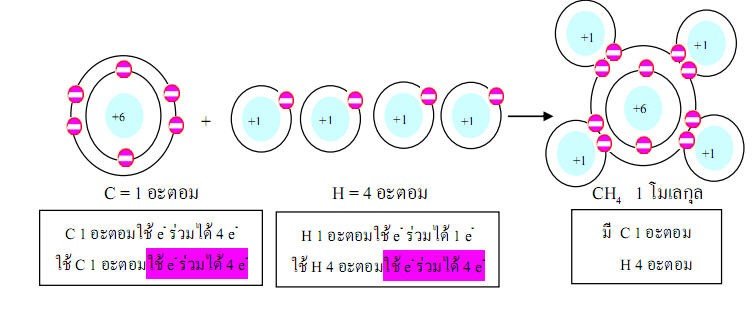
ตัวอย่างที่2อะตอมของธาตุคาร์บอน 1 อะตอม รวมกับอะตอมของธาตุไฮโดรเจน4อะตอมได้แก๊สมีเทน (CH4)1โมเลกุล
สารประกอบโคเวเลนต์ แบ่งเป็น 2 ประเภท
1. Homonuclear molecule (โมเลกุลของธาตุ) หมายถึงสารประกอบโคเวเลนต์ที่ในหนึ่งโมเลกุลประกอบด้วยอะตอมของธาตุชนิดเดียวกันมายึดกันด้วยพันธะโคเวเลนต์ เช่น H2, O2,Br2 ,N2 ,F2 ,Cl2เป็นต้น
2. Heteronuclear molecule (โมเลกุลของสารประกอบ) หมายถึง สารประกอบโคเวเลนต์ที่ในหนึ่งโมเลกุลประกอบด้วยธาตุตั้งแต่ 2 ชนิดขึ้นไป มายึดกันด้วยพันธะโคเวเลนต์ เช่น HCl , CH4, H2O , H2SO4 ,HClO4เป็นต้น
สมบัติของสารประกอบโคเวเลนต์
|
สารประกอบโคเวเลนต์ มีสมบัติดังนี้ |
|
1. มีสถานะเป็นของแข็ง ของเหลว หรือแก๊ส เช่น |
|
- สถานะของเหลว เช่น น้ำเอทานอลเฮกเซน |
|
- สถานะของแข็ง เช่น น้ำตาลทราย (C12H22O11),แนพทาลีนหรือลูกเหม็น (C10H8) |
|
- สถานะแก๊ส เช่น แก๊สคาร์บอนไดออกไซด์ (CO2),แก๊สมีเทน (CH4),แก๊สโพรเพน (C3H8) |
|
2. มีจุดหลอมเหลวต่ำ หลอมเหลวง่ายเนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่ไม่แข็งแรงสามารถถูกทำลายได้ง่าย |
|
3. มีทั้งละลายน้ำและไม่ละลายน้ำ เช่น เอทานอลละลายน้ำ แต่เฮกเซนไม่ละลายน้ำ |
|
4.สารประกอบโคเวเลนต์ไม่นำไฟฟ้าเนื่องจากมีประจุไฟฟ้าเป็นกลาง และอิเล็กตรอนทั้งหมดถูกใช้เป็นอิเล็กตรอน คู่ร่วมพันธะระหว่างอะตอม ทำให้ไม่มีอิเล็กตรอนอิสระช่วยนำไฟฟ้า แต่ยกเว้นในสารประกอบโคเวเลนส์ที่มีสภาพขั้วแรงมาก เช่น HCI, HBr, H2SO4 **แกรไฟต์เป็นรูปหนึ่งของคาร์บอนเกิดจากอะตอมของคาร์บอนสร้างพันธะโคเวเลนต์กับอะตอมที่อยู่ข้างเคียง อีก 3 อะตอม ทำให้เกิดการยึดเหนี่ยวเป็นโครงตาข่ายเป็นชั้น ๆ มีความแข็งแรงภายในชั้นสูง ส่งผลให้แกรไฟต์ มีจุดหลอมเหลวและจุดเดือดสูง ส่วนแรงยึดเหนี่ยวระหว่างชั้นระหว่างชั้นเป็นแรงแวนเดอวาลส์ซึ่งเป็น แรงยึดเหนี่ยวที่ไม่แข็งแรงนัก ดังนั้นแกรไฟต์จึงสามารถแตกหักและเลื่อนไหลออกเป็นชั้น ๆ ได้ง่าย |
กลับไปที่เนื้อหา
การเขียนสูตรโมเลกุล และการเรียกชื่อสารประกอบโคเวเลนต์
ก. การเขียนสูตรสารประกอบโคเวเลนต์
1. ให้เรียงลำดับธาตุให้ถูกต้องตามหลักสากล ดังนี้คือ Si , C , Sb , As , P , N , H , Te , Se , S , At , I , Br , Cl , O , F ตามลำดับ
2. ในสารประกอบโคเวเลนต์ ถ้าอะตอมของธาตุมีจำนวนอะตอมมากกว่าหนึ่งให้เขียนจำนวนอะตอมด้วยตัวเลขแสดงไว้มุมล่างทางขวา ในกรณีที่ธาตุในสารประกอบนั้นมีเพียงอะตอมเดียวไม่ต้องเขียนตัวเลขแสดงจำนวนอะตอม
3. หลักการเขียนสูตรสารประกอบโคเวเลนต์ที่มีอะตอมของธาตุจัดเวเลนต์อิเล็กตรอน เป็นไปตามกฎออกเตต ใช้จำนวนอิเล็กตรอนคู่ร่วมพันธะของแต่ละอะตอมของธาตุคูณไขว้ เช่น
- สูตรของสารประกอบของธาตุ H กับ S ; H และ S มีเวเลนต์อิเล็กตรอน 1 และ 6 ตามลำดับ ดังนั้น H และ S ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 1 และ 2 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
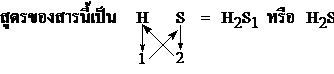
- สูตรของสารประกอบของธาตุ S กับ C ; S และ C มีเวเลนต์อิเล็กตรอน 6 และ 4 ตามลำดับ ดังนั้น S และ C ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 2 และ 4 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
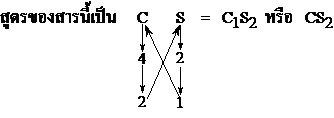
- สูตรของสารประกอบของธาตุ N กับ Cl ; N และ Cl มีเวเลนต์อิเล็กตรอน 5 และ 7 ตามลำดับ ดังนั้น N และ Cl ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 3 และ 1 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
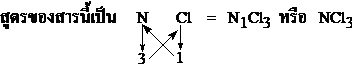
ข. การเรียกชื่อสารประกอบโคเวเลนต์
1.สารประกอบของธาตุคู่ ให้อ่านชื่อธาตุที่อยู่ข้างหน้าก่อนแล้ว ตามด้วยชื่อธาตุที่อยู่หลังโดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ ( ide)
2. ให้ระบุจำนวนอะตอมของแต่ละธาตุด้วยเลขจำนวนในภาษากรีกดังนี้
1 = mono- (มอนอ) 2 = di- (ได)
3 = tri- (ไตร) 4 = tetra- (เตตระ)
5 = penta- (เพนตะ) 6 = hexa- (เฮกซะ)
7 = hepta- (เฮปตะ) 8 = octa- (ออกตะ)
9 = mona- (โมนะ) 10 = deca- (เดคะ)
3. ถ้าสารประกอบนั้น อะตอมของธาตุแรกมีเพียงอะตอมเดียวไม่ต้องระบุจำนวนอะตอมของธาตุนั้น แต่ถ้าเป็นธาตุข้างหลังในสารประกอบ ถึงแม้มีเพียงหนึ่งอะตอมก็ต้องระบุจำนวนอะตอมด้วยคำว่า “มอนอ” เสมอ เช่น
N2O3อ่านว่า ไดไนโตรเจนไตรออกไซด์
PCl5อ่านว่า ฟอสฟอรัสเพนตะคลอไรด์
CO อ่านว่า คาร์บอนมอนอกไซด์
P2O5อ่านว่า ไดฟอสฟอรัสเพนตะออกไซด์
การเขียนสูตรเคมี
สูตรเคมี หมายถึงสัญลักษณ์ที่ใช้เพื่อแสดงว่าสารประกอบนั้นมีธาตุอะไรบ้างเป็นองค์ประกอบอย่างละกี่อะตอม สูตรเคมีแบ่งออกเป็น 3 ประเภทคือ
1. สูตรโมเลกุลเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้างอย่างละกี่อะตอม เช่น สูตรโมเลกุลของน้ำตาลกลูโคส คือ C6H12O6แสดงว่ากลูโคสประกอบด้วยธาตุ C , H และ O จำนวน 6 , 12 และ 6 อะตอมตามลำดับ
สำหรับสูตรโมเลกุล ของสารโคเวเลนต์โดยทั่วไป จะเขียนสัญลักษณ์ของธาตุในโมเลกุล เรียงลำดับคือ B , Si, C , P , H , S , I , Sr , Cl , O และ F เช่น ClF OF2, CO2เป็นต้น
2. สูตรอย่างง่ายเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง มีอัตราส่วนของจำนวนอะตอมเป็นเท่าใด เช่น สูตรอย่างง่ายของกลูโคสคือ CH2O ซึ่งแสดงว่ากลูโคสประกอบด้วยธาตุ C, H และ O โดยมีอัตราส่วนอะตอมของ C : H : O = 1: 2 : 1
3. สูตรโครงสร้างเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง อย่างละกี่อะตอมและแต่ละอะตอมยึดเหนี่ยวกันด้วยพันธะเคมีอย่างไร สูตรโครงสร้างของสารให้รายละเอียดเกี่ยวกับองค์ประกอบของธาตุต่าง ๆ ในโมเลกุลมากกว่าสูตรอย่างง่ายและสูตรโมเลกุล
สูตรโครงสร้างสามารถเขียนได้ 2 แบบคือ สูตรโครงสร้างแบบจุด (electron dot formula) หรือสูตรโครงสร้างแบบลิวอิส (Lewis formula) และสูตรโครงสร้างแบบเส้น (graphic formula) สูตรโครงสร้างทั้ง 2 แบบจะแสดงเฉพาะเวเลนต์อิเล็กตรอนของอะตอมคู่ร่วมพันธะ
ก. สูตรโครงสร้าง
ใช้สัญลักษณ์เป็นจุด ( . ) แทนเวเลนต์อิเล็กตรอนโดยเขียนไว้รอบ ๆ สัญลักษณ์ของธาตุ หรืออาจจะใช้สัญลักษณ์เป็น x แทนเวเลนต์อิเล็กตรอนก็ได้เพื่อให้เห็นความแตกต่างระหว่างอิเล็กตรอนของธาตุคู่ร่วมพันธะต่างชนิดกัน
โดยทั่ว ๆ ไปการเขียนสูตรแบบจุดจะมีข้อกำหนดดังนี้
1. อะตอมของธาตุก่อนเขียน ให้เขียนแยกกัน และเขียนจุด ( . ) แสดงเวเลนต์อิเล็กตรอนล้อมรอบสัญลักษณ์ของธาตุ โดยมีจำนวนจุดเท่ากับจำนวนเวเลนต์อิเล็กตรอน เช่น
1H มี 1 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น![]()
8O มี 6 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น![]()
15P มี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น ![]()
2. เมื่ออะตอม 2 อะตอมสร้างพันธะโคเวเลนต์ ให้เขียนสูตรแบบจุดของอะตอมทั้งสองไว้ด้วยกัน สำหรับอิเล็กตรอนที่ใช้ร่วมกัน ให้เขียนจุด ( . ) ไว้ในระหว่างสัญลักษณ์ของอะตอมคู่ร่วมพันธะ ส่วนอิเล็กตรอนที่ไม่ได้ร่วมกัน หรืออิเล็กตรอนที่ไม่ได้ใช้ในการสร้างพันธะ ให้เขียนด้วยจุดไว้บนอะตอมเดิม
ตัวอย่างเช่น
1. สูตรแบบจุดของไฮโดรเจน (H2)
1H มี 1 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น เมื่อ 2 อะตอมรวมกันเป็นโมเลกุล จะมีการใช้เวเลนต์อิเล็กตรอนร่วมกัน 1 คู่ จึงเขียนสูตรแบบจุดได้ดังนี้
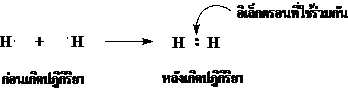
2. สูตรแบบจุดของก๊าซไฮโดรเจนฟลูออไรด์ (HF)
9F มีการจัดเรียงอิเล็กตรอนเป็น 2 , 7ดังนั้นมี 7 เวเลนต์อิเล็กตรอน สูตรแบบจุดคือ
เมื่อ H รวมกับ F เป็น HF เขียนเป็นสูตรแบบจุดได้ดังนี้
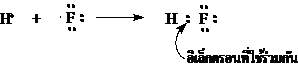
H และ F ใช้อิเล็กตรอนร่วมกันเพียง 1 คู่ในโมเลกุลของ HF จึงมีพันธะโคเวเลนต์เพียง 1 พันธะ โดยเขียนอิเล็กตรอนที่ใช้ร่วมกันไว้ระหว่างธาตุ H กับ F สำหรับอิเล็กตรอนที่เหลือของ F 6 อิเล็กตรอนก็เขียนไว้บนอะตอมของ F
3. สูตรแบบจุดของก๊าซไฮโดรเจนซัลไฟด์ (H2S)
กำมะถันมีเลขอะตอมเท่ากับ 16
เพราะฉะนั้นมีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 6
16S จึงมี 6 เวเลนต์อิเล็กตรอน สูตรแบบจุดคือ ![]()
เมื่อ H รวมกับ S เป็น H2S เขียนสูตรแบบจุดได้เป็นดังนี้
![]()
ในโมเลกุลของ H2S มีการใช้อิเล็กตรอนร่วมกันระหว่าง H กับ S 2 คู่ ดังนั้นในโมเลกุลของ H2S จึงมีพันธะโคเวเลนต์ 2 พันธะ อิเล็กตรอนที่ใช้ร่วมกันทั้ง 2 คู่เขียนไว้ระหว่างอะตอมของ H กับ S ส่วนอิเล็กตรอนที่เหลือของ S 4 อิเล็กตรอนให้เขียนไว้บนอะตอมของ S
4. สูตรแบบจุดของก๊าซแอมโมเนีย (NH3)
ไนโตรเจนเป็นธาตุหมู่ที่ 5 มีเลขอะตอมเท่ากับ 7
เพราะฉะนั้นมีการจัดเรียงอิเล็กตรอนเป็น 2 , 5
7N จึงมี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้ดังนี้ ![]()
เมื่อ N รวมกับ H เป็น NH3เขียนสูตรแบบจุดได้ดังนี้
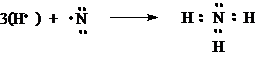
จะเห็นได้ว่าในโมเลกุลของ NH3มีการใช้อิเล็กตรอนร่วมกันระหว่าง H กับ N 3 คู่จึงพันธะโคเวเลนต์ 3 พันธะ
5. สูตรแบบจุดของฟอสฟอรัสไตรคลอไรด์ (PCl3)
P มีเลขอะตอมเท่ากับ 15
เพราะฉะนั้น P มีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 5
15P จึงมี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น![]()
Cl มีเลขอะตอมเท่ากับ 17
เพราะฉะนั้น Cl มีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 7
17Cl จึงมี 7 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น ![]()
เมื่อ Cl 3 อะตอม รวมตัวกับ P 1 อะตอม เกิดเป็นสารประกอบโคเวเลนต์ PCl3จะเขียนสูตรแบบจุดได้ดังนี้
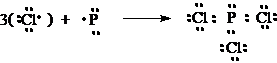
ในโมเลกุลของ PCl3 มีการใช้อิเล็กตรอนร่วมกันระหว่างธาตุ P กับ Cl รวม 3 คู่เกิดเป็นพันธะโคเวเลนต์ 3 พันธะ
ข. สูตรโครงสร้างแบบเส้น
เป็นการเขียนสูตรโครงสร้างของโมเลกุลโคเวเลนต์อีกแบบหนึ่งซึ่งแตกต่างจากสูตรแบบจุดเล็กน้อย โดยกำหนดให้ใช้เส้นตรง ( - ) แทนอิเล็กตรอนคู่ร่วมพันธะ 1 คู่ หรือแทนพันธะโคเวเลนต์ 1 พันธะ ทั้งนี้ให้เขียนไว้ในระหว่างสัญลักษณ์ของธาตุคู่ร่วมพันธะ สำหรับอิเล็กตรอนที่ไม่ใช่อิเล็กตรอนคู่ร่วมพันธะจะเขียนไว้หรือไม่เขียนก็ได้ (ปกติจะไม่เขียน) สูตรแบบเส้นจึงเป็นการกำหนดขึ้นมาเพื่อให้เขียนสูตรโครงสร้างได้สะดวก และง่ายขึ้น ทั้งนี้เพราะไม่จำเป็นต้องแสดงเวเลนต์อิเล็กตรอนทั้งหมดของธาตุคู่ร่วมพันธะ
- ให้ใช้เส้นตรง 1 เส้น ( - ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 1 คู่
- ให้ใช้เส้นตรง 2 เส้น ( = ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 2 คู่
- ให้ใช้เส้นตรง 3 เส้น ( ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 3 คู่
ตัวอย่างสูตรแบบเส้น
1. สูตรแบบเส้นของก๊าซไฮโดรเจน (H2)
สูตรแบบจุดของ H2คือ H : H
จะเห็นได้ว่า H ทั้งสองอะตอมใช้อิเล็กตรอนร่วมกัน 1 คู่จึงใช้เส้นตรง 1 เส้นเขียนแทนอิเล็กตรอนคู่ร่วมพันธะ โดยเขียนไว้ระหว่าง H ทั้งสองอะตอม
เพราะฉะนั้นสูตรโครงสร้างแบบเส้นของ H2จึงเป็น H - H
2. สูตรโครงสร้างแบบเส้นของก๊าซไฮโดรเจนฟลูออไรด์ (HF)
สูตรแบบจุดของ HF คือ ![]()
จะเห็นได้ว่าอะตอม H กับ F มีการใช้อิเล็กตรอนร่วมกันเพียง 1 คู่ จึงใช้เส้นตรง 1 เส้นแทนอิเล็กตรอนคู่ร่วมพันธะ
เพราะฉะนั้นสูตรแบบเส้นของ HF จึงเป็น H - F
3. สูตรแบบเส้นของก๊าซไฮโดรเจนซัลไฟด์ (H2S)
สูตรแบบจุดของ H2S คือ ![]()
จะเห็นได้ว่า H และ S ใช้อิเล็กตรอนร่วมกัน 1 คู่จึงใช้เส้นตรง 1 เส้นแทนอิเล็กตรอนคู่ร่วมพันธะ 1 คู่
ในโมเลกุลของ H2S จึงมี 2 พันธะโคเวเลนต์
เพราะฉะนั้น สูตรแบบเส้นของ H2S คือ H - S – H
4.สูตรแบบเส้นของก๊าซแอมโมเนีย (NH3)
สูตรแบบจุดของ NH3คือ 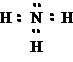
เพราะฉะนั้นสูตรแบบเส้น ของ NH3จึงเป็น 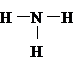
5. สูตรแบบเส้นของฟอสฟอรัสไตรคลอไรด์ (PCl3)
สูตรแบบจุดคือ 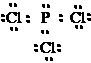
เพราะฉะนั้นเขียนสูตรแบบเส้นได้เป็น 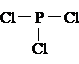
หมายเหตุ
ก. การเขียนสูตรโครงสร้างแสดงพันธะโคเวเลนต์ทั้ง 2 แบบไม่ได้แสดงตำแหน่งที่แน่นอนของอิเล็กตรอน
ข. การเขียนสูตรโครงสร้างทั้งสองแบบนี้ ไม่ได้แสดงตำแหน่งของพันธะหรือตำแหน่งที่แน่นอนของอิเล็กตรอน รวมทั้งไม่ได้แสดงโครงสร้างของโมเลกุล
กลับไปที่เนื้อหา
การเกิดพันธะโคเวเลนต์
1. กฏทั่วไปเกี่ยวกับการเกิดพันธะโคเวเลนต์
ก่อนที่จะกล่าวถึงทฤษฎีต่างๆ ที่ว่าด้วยพันธะโคเวเลนต์ จะกล่าวถึงหลักเบื้องต้น ดังนี้
1. ในการเกิดพันธะโคเวเลนต์จะต้องไม่มีโอกาสเกิดพันธะแบบไอออนิก ถ้าอะตอม A และ อะตอม B จะเกิดพันธะโคเวเลนต์ต่อกัน พลังงานของ B ต่ำกว่าระดับพลังงานของ A มาก อิเล็กตรอนจะย้ายจาก Aมาสู่ B ผลที่ได้รับจะเป็น A+B-พันธะที่เกิดนั้นจะเป็นพันธะไอออนิกไม่ใช่พันธะโคเวเลนต์
2. โดยทั่วๆ ไปพันธะเคมีแต่ละพันธะเกิดจากเวเลนซ์อิเล็กตรอน 2 อิเล็กตรอนเหนือ 1 คู่ อยู่ร่วมกัน ตามหลักการจองเพาลี (Pauli Exclusion Pribciple) ซึ่งมีสาระสำคัญดังนี้ คือ อิเล็กตรอนคู่ใดที่จะอยู่ร่วมกันในที่ว่างระหว่างนิวเคลียสทั้งสอง อิเล็กตรอนคู่นั้นจะมีสปิน (spin) ตรงข้าม และเมื่ออยู่ใกล้นิวเคลียสใดก็จะส่งแรงดึงดูดต่อกันและกันระหว่างอิเล็กตรอนกับนิวเคลียส
3. อะตอมคู่ใดที่เกิดพันธะกัน ออร์บิทัลเชิงอะตอม (atomic orbital) ของทั้งสองจะซ้อนเหลื่อมกัน
4. เมื่อเกิดพันธะเคมีขึ้นแล้วโมเลกุลส่วนใหญ่จะมีเวเลนซ์อิเล็กตรอนในระดับพลังงานสูงสุดครบแปด นั่นคือ จำนวนคู่ของอิเล็กตรอนที่ใช้ในการเกิดพันธะร่วมกัน เมื่อรวมกับจำนวนคู่ของอิเล็กตรอนที่ไม่ได้ใช้ในการเกิดพันธะ แล้วจะเท่ากับ 4 คู่ ซึ่งเท่ากับจำนวนออร์บิทัล เวเลนซ์อิเล็กตรอนที่มีจำนวนแปดอิเล็กตรอน หรือ สี่คู่นี้ถือว่าเป็นจำนวนที่มากที่สุด สำหรับธาตุที่มีเวเลนซ์อิเล็กตรอนน้อยกว่าสี่ แต่โมเลกุลของสารบางชนิดมีเวเลนซ์อิเล็กตรอนรวมแล้วน้อยกว่ามี่ก็ได้ ตัวอย่าง เช่น PH3, H2O, BCl3, BH2และ LiCH3เป็นต้น
5. สำหรับธาตุที่มีออร์บิทัล-ดี (d-orbital) จะมีจำนวนอิเล็กตรอนในระดับพลังงานสูงสุดนับรวมกันแล้วมากกว่าแปดก็ได้ ตัวอย่างเช่น PF5, SF6หรือ IF8 เป็นต้น โดยธาตุพวกนี้เป็นธาตุที่อยู่ในคาบ ที่สามขึ้นไป ธาตุที่เป็นอโลหะจะเป็นธาตุหมู่ที่ V, VI,VII และ VIII ส่วนพวกที่เป็นโลหะจะอยู่ในสภาพของสารประกอบเชิงซ้อนหรือไอออนเชิงซ้อน
6. แรงผลักระหว่างอิเล็กตรอนกับอิเล็กตรอนมีค่าน้อย นั่นคืออิเล็กตรอนทั้งที่ใช้และไม่ใช้ในการเกิดพันธะ จะพยายามปรับตัวหรืออยู่ให้ห่างกันมากที่สุดเท่าที่จะมากได้เพื่อให้แรงผลักที่มีต่อกันมีค่าน้อยที่สุด
7. โมเลกุลจุพยายามอยู่ในสภาพที่ทำให้พลังงานต่ำที่สุด ทำให้เกิดพันธะได้มากที่สุดและพันธะเหล่านี้จะต้องเป็นพันธะที่แข็งแรงที่สุดเท่าที่จะเป็นไปได้ นอกจากนี้การจัดเรียงตัวของอะตอมจเป็นไปในลักษณะที่ทำให้เกิดแรงผลักน้อยที่สกุดด้วย
2. การเกิดพันธะโคเวเลนต์
พันธะโคเวเลนต์มักจะเกิดจากอะตอมที่มีเวเลนซ์อิเล็กตรอนไม่น้อยกว่าสี่และอิเล็กตรอนเหล่านี้มีพลังงานอยู่ในระดับที่ใกล้เคียงกัน ในการเกิดพันธะโคเวเลนต์ อะตอมแต่ละคู่จะใช้อิเล็กตรอนร่วมกันเพื่อให้เวเลนซ์อิเล็กตรอนครบแปด หรือเท่ากับเวเลนซ์อิเล็กตรอนของแก๊สเฉื่อย อิเล็กตรอนที่ใช้ร่วมกันอาจมีหนึ่งคู่ สองคู่ และสามคู่ ซึ่งเรียกว่าพันธะเดี่ยว (single bond) พันธะคู่ (double bond) และพันธะสาม (triple bond) ตามลำดับ
2.1 การเขียนสูตรโครงสร้างแบบจุด (Lewis Electron-Dot formula) และแบบเส้น (Graphic formula)เป็นการแสดงพันธะโดยใช้จุดหรือเส้นแทนอิเล็กตรอนที่ใช้ร่วมกันตัวอย่าง เช่น H2, O2, N2เขียนสูตรโครงสร้างและแบบจุดและแบบเส้นได้ดังนี้
H2H:H H-H
O2:O::O: O=O
N2:N:××:N: NºN
3.2 โมเลกุลอะตอมคู่ (diatomic molecule)เป็นโมเลกุลที่ประกอบด้วยสองอะตอมมีพันธะเคมียึดเหนี่ยวกันไว้ แบ่งได้สองประเภท ประเภทแรกถ้าอะตอมทั้งสองอะตอมเป็นอะตอมของธาตุชนิดเดียวก้น เรียกว่า ฮอโมนิวเคลียร์ โมเลกุล (homonuclear molecule) เช่น Cl2,Br2, O2และ H2เป็นต้น แต่ถ้าอะตอมทั้งสองในโมเลกุลขอธาตุต่างชนิดกัน เรียกว่า เฮเทอโรนิวเคลียร์โมเลกุล (heteronuclear molecule) เช่น HCl, CO, HF และ ClF เป็นต้นสำหรับโมเลกุลที่มีอะตอมมากกว่าสองอะตอมขึ้นไป เรียกว่า พอลีอะตอมิกโมเลกุล (pilyatomic molecule) ซึ่งแบ่งเป็นสองประเภทเช่นกัน คือ ฮอโมนิวเคลียร์โมเลกุล เช่น P4,S8และเฮเทอโรนิวเคลียร์โมเลกุล เช่น H2O, CH4และ H2SO4เป็นต้น
3.3 กฎคู่แปด (Octet rule)เป็นกฎที่ใช้อธิบายโครงสร้างอิเล็กโทรนิกของโมเลกุลและการสร้างพันธะของอะตอมได้ ซึ่งกล่าวว่าอะตอมต่างๆ มีแนวโน้มที่จะสร้างพันธะกับอะตอมอื่นเพื่อให้เวเลนซ์อิเล็กตรอนครบแปดตัวอย่างเช่น PH3, HF เป็นต้น
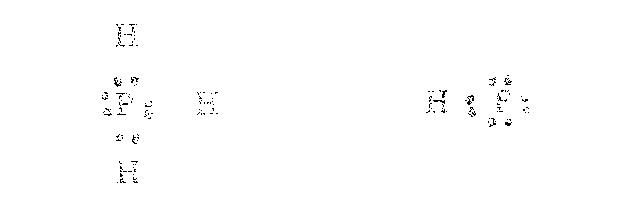
จากการสร้างพันธะกับอะตอมของไฮโดรเจน ทำให้อะตอมของ P และ F ต่างก็มีเวเลนซ์อิเล็กตรอนเท่ากับแปด
โครงแบบอิเล็กตรอน ของเวเลนซ์อิเล็กตรอนของ P เป็น 3S23P1x3p1y3p1zออร์บิทัลเชิงอะตอมที่มีอิเล็กตรอนเพียงครึ่งเดียวมี 3 ออร์บิทัลซึ่งเท่ากับจำนวนพันธะระหว่าง P กับ H ในทำนองเดียวกัน F มีออร์บิทัลเชิงอะตอมที่มีอิเล็กตรอนเพียงครึ่งเดียวอยู่ 1 ออร์บิทัล จำนวนพันธะระหว่าง F กับ H ก็มีอยู่ 1 พันธะ
อย่างไรก็ตาม มีบางอะตอมที่สร้างพันธะขึ้นแล้วมีเวเลนซ์อิเล็กตรอนน้อยกว่าหรือมากกว่าแปด เช่น H ในสารประกอบมีเวเลนซซ์อิเล็กตรอนเท่ากับสอง F ใน PCl3มีเวเลนซ์อิเล็กตรอนเท่ากับ 10 หรือ S ใน SF6มีเวเลนซ์อิเล็กตรอนเท่ากับ 12 เป็นต้น จึงนับว่ากฎคู่แปดใช้ไม่ได้ในบางกรณี จึงต้องมีข้อยกเว้น
สำหรับ PCl3อธิบายได้ว่าอิเล็กตรอนจากกออร์บิทัล 3S ได้รับพลังงานอีกเล็กน้อยก็จะย้ายไปอยูในออร์บิทัล 3d จำนวน 1 อิเล็กตรอน ซึ่งจะได้เป็น 3S13P1x3P1y3P1z3d1ดังนั้น P จึงสามารถสร้างพันธะกับ Cl ได้ทั้งห้าอะตอม
ในทำนองเดียวกันการเกิด SF4และ SF6อธิบายได้ว่า S ซึ่งมีโครงแบบอิเล็กตรอน เป็น 3S13P1x3P1y3P1zเมื่ออิเล็กตรอนจากออร์บิทัล 3Pxย้ายไปอยู่ในออร์บิทัล 3d จำนวนหนึ่งอิเล็กตรอนจะได้เป็น 3S13P1x3P1y3P1z3d1ก็จะมีออร์บิทัลเชิงอะตอมที่มีอิเล็กตรอนเพียงครึ่งเดียวอยู่ใออร์บิทัล จึงสามารถใช้อิเล็กตรอนร่วมกับ F สี่อะตอม เกิดเป็นโมเลกุล SF4ถ้าอิเล็ตรอนจากออร์บิทัล 3S ย้ายไปอยู่ในออร์บิทัล 3d อีกหนึ่งอิเล็กตรอนก็จะกลายเป็น3S13P1x3P1y3P1z3d1ซึ่งสามารถสร้างพันธะกับ F ได้หกอะตอมเกิดเป็นโมเลกุล SF6
กลับไปที่เนื้อหา
4. รัศมีโคเวเลนต์
ขนาดที่แท้จริงของอะตอมเป็นสิ่งที่ทราบได้ยากมาก นอกจากจะไม่ทราบว่าอิเล็กตรอนนอกสุดอยู่ที่ใดแล้ว อะตอมยังอยู่ใกล้ๆ กันในสภาพของการเป็นส่วนหนึ่งของโมเลกุลหรือส่วนหนึ่งของสารประกอบอีกด้วย การวัดขนาดของอะตอมในทางปฏิบัติสามารถใช้รังสีหรือคลื่นต่างๆ เช่น รังสีเอกซ์, รังสีแม่เหล็กไฟฟ้า, คลื่นไมโครเวฟ และรังสีนิวตรอน เป็นต้น
เพื่อความสะดวกจะถือว่าอะตอมมีลักษณะเป็นทรงกลม สำหรับธาตุที่เป็นของแข็งเป็นผลึก เช่น โลหะ ถ้าสามาระวัดระยะระหว่างนิวเคลียสของสองอะตอมที่อยู่ติดกันได้ เมื่อเอาค่านี้หารด้วยสองก็จะเป็นค่ารัศมีหรือขนาดของอะตอม เรียกค่านี้ว่า รัศมีอะตอม (atomic radius)
แต่ถ้าธาตุเป็นโลหะและโมเลกุลอยู่ได้ด้วยพันธะโคเวเลนต์ อะตอมจะไม่เพียงแต่อยู่ชิดกันแต่จะซ้อนเหลื่อมกันส่วนหนึ่ง ถ้าสามารถวัดระยะระหว่างนิวเคลียสของสองอะตอมที่รวมกันเป็นโมเลกุลนั้นได้แล้วหารด้วยสอง ค่าที่ได้นี้เรียกว่ารัศมีโคเวเลนต์
ถ้าโมเลกุลของธาตุที่เป็นอโลหะสองโมเลกุลทั้งสองจะไม่ซ้อนเหลื่อมกันเพราะไม่ได้สร้างพันธะโคเวเลนต์ต่อกัน แต่ดึงดูดกันด้วยแรงแวนเดอร์วาลส์ ถ้าวัดระยะระหว่างนิวเคลียสของสองอะตอมในแต่ละโมเลกุลแล้วหารด้วยสองค่าที่ได้นี้เรียกว่า รัศมีแวนเดอร์วาลส์ซึ่งค่านี้จะมีค่ามากกว่ารัศมีโคเวเลนต์ ดังรูปที่ 3.1

รูปที่ 3.1 แสดงรัศมีโคเวเลนต์และรัศมีแวนเดอร์วาลส์
ธาตุพวกแก๊สเฉื่อยซึ่งโมเลกุลมีเพียงอะตอมเดียวจะไม่มีรัศมีโคเวเลนต์ มีแต่รัศมีแวนเดอร์วาลส์
ตารางที่ 3.2 รัศมีโคเวเลนต์และรัศมีแวนเดอร์วาลส์ของธาตุบางชนิด
|
ธาตุ |
รัศมีโคเวเลนต์(A0) |
รัศมีแวนเดอร์วาลส์(A0) |
|
H O N C P Si |
0.37 0.73 0.75 0.77 1.10 1.18 |
1.10 1.50 1.55 1.56-1.70 1.85 2.10 |
5. เรโซแนนซ์
ในการอธิบายว่าโมเลกุลมีธาตุอะไรเป็นองค์ประกอบและอย่างละกี่อะตอมนั้น ในทางเคมีจะใช้สูตรโมเลกุลแทนคำอธิบายได้อย่างกะทัดรัด เช่น ถ้าเขียนสูตร H2O ก็หมายถึงว่า น้ำหนึ่งโมเลกุลประกอบด้วยไฮโดรเจนสองอะตอมและออกซิเจน 1 อะตอมหรืออัตราส่วนโดยจำนวนโมลอะตอมของ H:O เท่ากับ 2:1 แต่สูตรนี้ใช้อธิบายไม่ได้ว่าอะตอมของธาตุเหล่านี้จัดเรียงตัวกันอยู่อย่างไร อะตอมไหนอยู่ที่ใด ซึ่งสูตรที่แสดงได้คือสูตรโครงสร้าง โดยแสดงได้ดังนี้
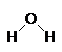
จากสูตรนี้จะทราบได้ว่าอะตอมไหนอยู่ที่ใด โดยใช้เส้นตรงหนึ่งเส้นหรือขีดหนึ่งขีดแทนที่พันธะโคเวเลนต์ที่ใช้อิเล็ตรอนร่วมกันหนึ่งคู่ มีโมเลกุลของสารบางชนิดไม่อาจจะแสดงโดยการเขียนสูตรโครงสร้างแบบใดแบบหนึ่งได้โดยให้มีสมบัติตามที่เป็นจริง ตัวอย่าง เช่น BF3, NO-3และ SO2เป็นต้น ถ้าจะลองเขียนสูตรโครงสร้างแบบเส้น โดยให้มีอิเล็กตรอนเป็นไปตามกฎแปดจะได้ดังนี้
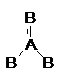
เส้นตรงหนึ่งเส้นแทนพันธะเดี่ยวระหว่าง A กับ B และเส้นตรงสองเส้นหรือเส้นคู่แทนพันธะคู่ระหว่าง A กับ B แต่จากากรทดลองพบว่าความยาวพันธะระหว่าง A กับ B เท่ากันทุกพันธะ และมุมพันธะระหว่าง B-A-B ดังนั้นสูตรโครงสร้างที่แท้จริงจึงไม่ใช่สูตรหนึ่งแต่จะเป็นโครงสร้างผสมระหว่างทั้งสามแบบ ดังนี้
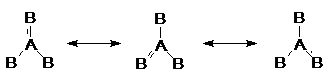
แบบ 1 แบบ 2 แบบ 3
เรียกปรากฏการนี้ว่า เรโซแนนซ์ สูตรโครงสร้างที่แท้จริงจะเป็นแบบผสมระหว่างสามแบบนี้เรียกว่า เรโซแนนซ์ไฮบริด (resonance hybrid) แต่ไม่สามารถจะรวมเขียนสูตรโครงสร้างเพียงสูตรเดียวได้ แต่ละแบบเรียกว่า เรโซแนนซ์ฟอร์ม (resonance form)
ดังในโมเลกุลของ SO2S มีเวเลนซ์อิเล็กตรอนเท่ากับ 6 O ก็มีเวเลนซ์อิเล็กตรอนเท่ากับ 6 ดังนั้นจำนวนเวเลนซ์อิเล็กตรอนรวมทั้งหมดเป็น 18 ถ้าเป็นไปตามกฎคู่แปด โครงสร้างของ ก็จะเขียนได้ตามแบบ 1 หรือ แบบ 2 คือมีพันธะเดี่ยว (พันธะยาว) 1 พันธะและพันธะคู่ (พันธะสั้น) 1 พันธะ แต่จากการทดลองพบว่าพันธะระหว่างอะตอมของ S และ O เป็นพันธะที่มีความยาวเท่ากัน
การเขียนโครงสร้างตามแบบ 1 และ แบบ 2 จึงไม่สอดคล้องกับผลจากการทอลอง ถ้าจะเขียนตามแบบ 3 ก็ไม่ได้อีกเพราะเป็นแบบที่มีอิเล็กตรอนเดี่ยว โมเลกุลที่มีอิเล็กตรอนเดี่ยวมีคุณสมบัติแม่เหล็กดูดได้ (paramagnetic) แต่ผลจากการทดลองพบว่าสารนี้แม่เหล็กดูดไม่ได้ ดังนั้น โมเลกุลของ SO2น่าจะมีโครงสร้างตามแบบ 1 และ แบบ 2 ผสมกัน คือ พันธะระหว่าง S จะเป็นพันธะเดี่ยวรวมกับพันธะคู่ หรือเป็นพันธะที่มีสมบัติเป็นได้ทั้งพันธะเดี่ยวและพันธะคู่ ดังนี้
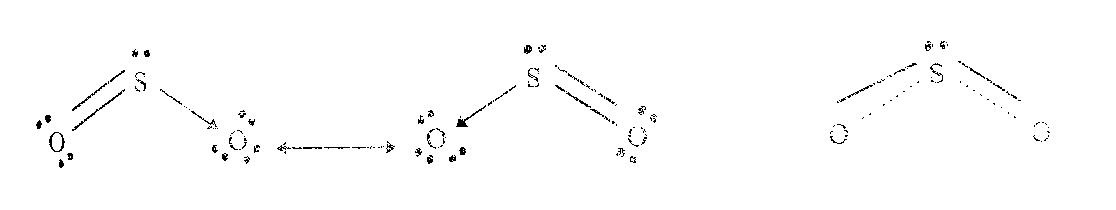
เรโซแนนซ์ฟอร์ม เรโซแนนซ์ไฮบริด
3.5.1 วิธีเขียนโซแนนซ์ฟอร์ม
ในการเขียนเรโซแนนซ์ฟอร์ม มีสิ่งที่ต้องคำนึงถึงดังนี้
1. ตำแหน่งของอะตอมทุกอะตอมไม่มีการเปลี่ยนแปลง ส่วนที่มีการเปลี่ยนแปลงคือตำแหน่งของอิเล็กตรอน เช่น เรโซแนนซ์ฟอร์มของ SO2จะเขียนเป็นแบบ 3 ดังต่อไปนี้ไม่ได้
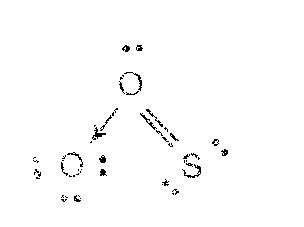
แบบ 3
2. จำนวนคู่ของอิเล็กตรอนของทุกเรโซแนนซ์ฟอร์มจะต้องเท่าเดิม ดังนั้นจะเขียนเรโซแนนซ์ฟอร์มของ SO2เป็นดังต่อไปนี้ไม่ได้
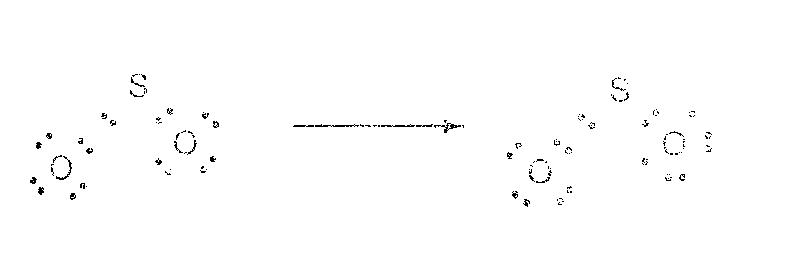
ตัวอย่างที่3.1จงเขียนเรโซแนนซ์ฟอร์มของ CO3=
วิธีทำ
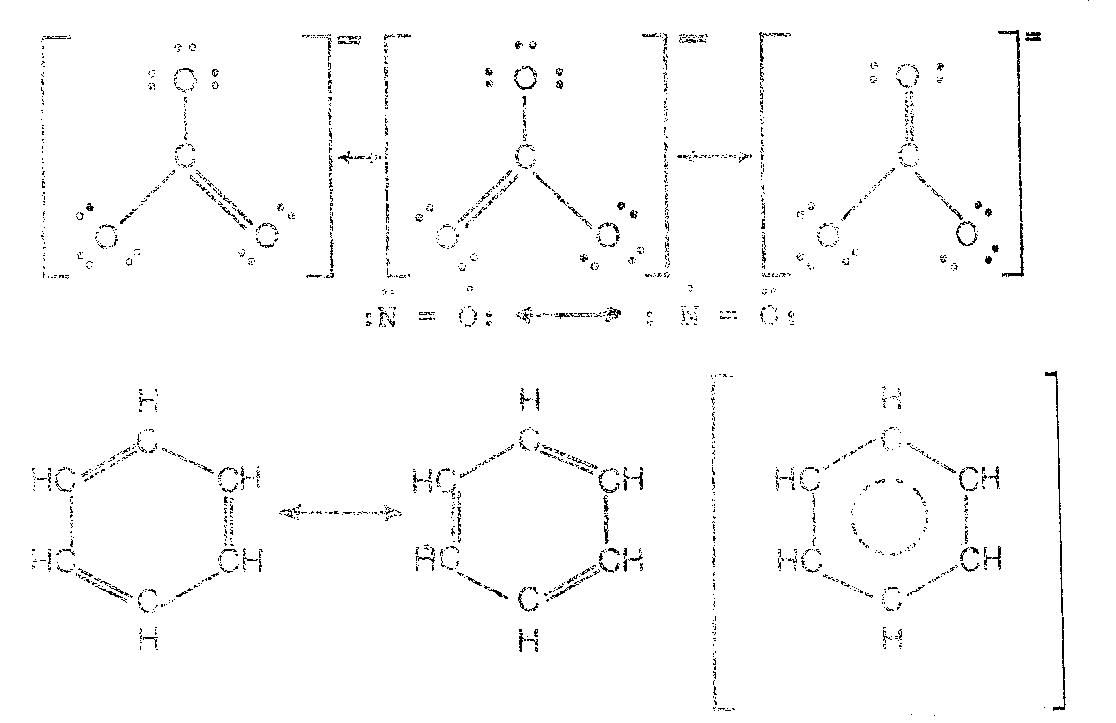
กลับไปที่เนื้อหา



