สารละลายกรด – เบส
สารละลายกรด – เบส
สมบัติของสารละลายกรด – เบส
สารละลายต่าง ๆ ที่ใช้ในชีวิตประจำวันแต่ละชนิดจะมีสมบัติแตกต่างกัน มีทั้งชนิดที่มีฤทธิ์กัดกร่อนหรือที่เรียกว่า มีสมบัติเป็นกรด และชนิดที่มีสมบัติเป็นเบส สารบางชนิดเป็นอันตราย แต่บางชนิดสามารถนำมาใช้ประโยชน์ได้ สมบัติของสารละลายกรด-เบส จึงเป็นเกณฑ์อีกประเภทหนึ่งที่นักวิทยาศาสตร์นำมาใช้ในการจำแนกประเภทของสาร

ภาพ กรดแบตเตอรี่
ที่มา https://pixabay.com
สารละลายกรด
กรด หมายถึง สารประกอบที่มีธาตุไฮโดรเจนเป็นองค์ประกอบ เมื่อละลายน้ำแล้วสามารถแตกตัวให้ไฮโดรเจนไอออน ( H+ )
สมบัติของสารละลายกรด
- กรดทุกชนิดมีรสเปรี้ยว
- เปลี่ยนสีกระดาษลิตมัสจากสีน้ำเงินเป็นสีแดง (มีค่าpH น้อยกว่า 7)
- ทำปฏิกิริยากับโลหะ เช่น สังกะสี ทองแดง แมกนีเซียม อะลูมิเนียม จะได้ฟองแก๊สไฮโดรเจนออกมา
- กรดมีสมบัติกัดกร่อนโลหะ หินปูน เนื้อเยื่อของร่างกาย ถ้ากรดถูกผิวหนังจะทำให้ผิวหนังไหม้ ปวดแสบปวดร้อน ถ้ากรดถูกเส้นใยของเสื้อผ้า เส้นใยจะถูกกัดกร่อนให้ไหม้ได้ นอกจากนี้ยังทำลายเนื้อไม้ กระดาษ และพลาสติกบางชนิดได้ด้วย
- กรดทำปฏิกิริยากับหินปูนซึ่งเป็นสารประกอบของแคลเซียมคาร์บอเนต ทำให้หินปูนกร่อน จะได้แก๊สคาร์บอนไดออกไซด์ ซึ่งมีสมบัติทำให้น้ำปูนใสขุ่น
- สารละลายกรดทุกชนิดนำไฟฟ้าได้ดี เพราะกรดสามารถแตกตัวให้ไฮโดรเจนไอออน
- ทำปฏิกิริยากับเบสได้เกลือและน้ำ
- กรดทำปฏิกิริยากับโลหะได้แก๊สไฮโดรเจนซึ่งเป็นแก๊สที่เบา ติดไฟได้
ประเภทของสารละลายกรด
สารละลายกรดแบ่งเป็น 2 ประเภท ได้แก่
- กรดอินทรีย์ (Organic acid) เป็นกรดที่ได้จากธรรมชาติ จากสิ่งมีชีวิต เช่น
- กรดแอซิติก (acetic acid) หรือกรดน้ำส้ม ได้จากการหมักแป้งหรือน้ำตาลโดยใช้จุลินทรีย์ ซึ่งนิยมใช้ในการผลิตน้ำส้มสายชู
- กรดซิตริก (citric acid) หรือกรดมะนาว เป็นกรดที่อยู่ในผลไม้ที่มีรสเปรี้ยว เช่น ส้ม มะนาว
- กรดแอสคอร์บิก (ascorbic acid) หรือวิตามินซี มีอยู่ในผลไม้ที่มีรสเปรี้ยว
- กรดอะมิโน (amino acid) เป็นกรดที่ใช้สร้างโปรตีน มักพบในเนื้อสัตว์ ผลไม้เปลือกแข็ง หรือพืชตระกูลถั่ว
- กรดอนินทรีย์(Inorganic Acids) เป็นกรดที่ได้จากแร่ธาตุ จึงอาจเรียกว่ากรดแร่ก็ได้ มีความสามารถในการกัดกร่อนสูง ถ้าถูกผิวหนังหรือเนื้อเยื่อของร่างกายจะทำให้ไหม้ แสบ หรือมีผื่นคัน
ตัวอย่างเช่น
- กรดไฮโดรคลอริก (hydrochloric acid) หรือกรดเกลือ
- กรดไนตริก (nitric acid) หรือกรดดินประสิว
- กรดคาร์บอนิก (carbonic acid) หรือกรดหินปูน
- กรดซัลฟิวริก (sulfuric acid) หรือกรดกำมะถัน
สารละลายเบส
เบส คือ สารประกอบที่ทำปฏิกิริยากับกรด แล้วได้เกลือกับน้ำจะสามารถแตกตัวให้ไฮดรอกไซด์ไอออน (OH-) เบสทุกชนิดจะมีรสฝาด
สมบัติของสารละลายเบส
- เบสทุกชนิดมีรสฝาดหรือเฝื่อน
- เปลี่ยนสีกระดาษลิตมัสจากสีแดงเป็นสีน้ำเงิน (มีค่าpH มากกว่า 7)
- ทำปฏิกิริยากับน้ำมันพืช หรือน้ำมันหมู จะได้สารละลายที่มีฟองคล้ายสบู่
- ทำปฏิกิริยากับแอมโมเนียไนเตรตจะได้แก๊สที่มีกลิ่นฉุนของแอมโมเนีย
- สามารถกัดกร่อนโลหะ อะลูมิเนียมและสังกะสี และมีฟองแก๊สเกิดขึ้น
- ทำปฏิกิริยากับกรดได้เกลือและน้ำ เช่น สารละลายโซดาไฟ (โซเดียมไฮดรอกไซด์) ทำปฏิกิริยากับกรดเกลือ (กรดไฮโดรคลอริก) ได้เกลือโซเดียมคลอไรด์ หรือเกลือแกงที่ใช้ปรุงอาหาร นอกจากนี้โซดาไฟยังสามารถทำปฏิกิริยากับกรดไขมัน ได้เกลือโซเดียมของกรดไขมัน หรือที่เรียกว่า สบู่
ประเภทของเบส
ตัวอย่างสารละลายเบสในชีวิตประจำวันและสิ่งแวดล้อม มีดังต่อไปนี้
- สารประเภททำความสะอาด
- โซเดียมไฮดรอกไซด์ (NaOH) ใช้ทำสบู่
- แอมโมเนีย (CH3) น้ำยาล้างกระจก,น้ำยาปรับผ้านุ่ม
- โซเดียมคาร์บอเนต (Na2CO3) อุตสาหกรรมผงซักฟอก
- สารปรุงแต่งอาหาร
- โซเดียมไฮดรอกไซด (NaOH) ทำผงชูรส
- โซเดียมไบคาร์บอเนต (NaHCO3) ทำขนม
- สารที่ใช้ทางการเกษตร ได้แก่ ปุ๋ย
- ยูเรีย [CO(NH2)2] ใช้ทำปุ๋ย
- แคลเซียมไฮดรอกไซด์ [Ca(OH)2] แก้ดินเปรี้ยว
- ยารักษาโรค
- NH3(NH4)2CO3 แก้เป็นลม
- แคลเซียมไฮดรอกไซด์ [ Ca(OH)2] ลดกรดในกระเพาะอาหาร
- แมกนีเซียมไฮดรอกไซด์ [ Mg(OH)2] ลดกรดในกระเพาะอาหาร , ยาถ่าย
แหล่งที่มา
นงลักษณ์ สุวรรณพินิจและปรีชา สุวรรณพินิจ. (2537). สารและสมบัติของสาร ม.1. กรุงเทพฯ: ไฮเอ็ดพับลิชชิ่ง จำกัด.
วิไรรัตน์ นกน้อย. (ไม่ปรากฏวันเดือนปีที่จัดทำ). Education for science. สืบค้นเมื่อ 18 ตุลาคม 2560, จาก https://sites.google.com/site/kruwirairat/hnwy-kar-reiyn-ru-thi-4/4-4-smbati-khxng-sarlalay-krd---bes.
กลับไปที่เนื้อหา
การตรวจสอบความเป็นกรด – เบส ของสารละลาย
เราสามารถตรวจสอบความเป็นกรด-เบสของสารละลายได้ด้วยอินดิเคเตอร์ ซึ่งเป็นสารที่ใช้บอกสมบัติบางอย่างในปฏิกิริยาเคมี โดยการเปลี่ยนสีหรือการเปลี่ยนแปลงสมบัติบางอย่างที่มองเห็นได้ สารที่นำมาใช้ในการตรวจสอบความเป็นกรด-เบสของสารละลายต่างๆ เรียกว่า " อินดิเคเตอร์สำหรับกรด-เบส (acid-base indicator)"
อินดิเคเตอร์ (indicator) คือ สารที่ใช้ตรวจสอบไฮโดรเนียมไอออน (H3O¯) และไฮดรอกไซด์ไอออน (OH¯) ได้ เนื่องจากสารละลายที่เป็นกรดจะมีความเข้มข้นของไฮโดรเนียมไอออนมากกว่าสารละลายที่เป็นเบส
กรดเป็นสารประกอบไฮโดรเจน เมื่อละลายอยู่ในน้ำจะแตกตัวให้ไฮโดรเนียมไอออน เช่น
NHO3 +H2O → H3O+ +NO3¯
เบสเป็นไฮดรอกไซด์ของโลหะหรืออนุมูลที่มีค่าเทียบเท่าโลหะ ซึ่งเมื่อละลายอยู่ในน้ำจะแตกตัวให้ไฮดรอกไซด์ไอออน
NH3+ H2O → NH4+ + OH¯
อินดิเคเตอร์แต่ละชนิดจะมีการตรวจสอบความเป็นกรด-เบสของสารละลายแตกต่าง กัน อินดิเคเตอร์ที่นิยมใช้กันมากมี 2 ประเภท คือ กระดาษลิตมัสและยูนิเวอร์ซัลอินดิเคเตอร์
1. กระดาษลิตมัส เป็นอินดิเคเตอร์ที่เรารู้จักกันดี กระดาษลิตมัสมี 2 สี ได้แก่ กระดาษลิตมัสสีแดงและกระดาษลิตมัสสีน้ำเงิน
เมื่อใช้กระดาษลิตมัสตรวจสอบสารละลายจะสามารถจำแนกสารได้เป็น 3 ประเภท ดังนี้
+ สารละลายที่มีสมบัติเป็นกรด จะเปลี่ยนสีกระดาษลิตมัสจากสีน้ำเงินไปเป็นสีแดง
+ สารละลายที่มีสมบัติเป็นเบส จะเปลี่ยนสีกระดาษลิตมัสจากสีแดงไปเป็นสีน้ำเงิน
+ สารละลายที่มีสมบัติเป็นกลาง จะไม่ทำปฏิกิริยากับกระดาษลิตมัสทั้งสีน้ำเงินและสีแดง กระดาษลิตมัสจึงไม่เปลี่ยนสี
2. ยูนิเวอร์ซัลอินดิเคเตอร์ เป็นอินดิเคเตอร์ที่มีการ เปลี่ยนสีเกือบทุกค่า pH จึงใช้ทดสอบหาค่า pH ได้ดี อินดิเคเตอร์ชนิดนี้มีทั้งแบบที่เป็นกระดาษและแบบสารละลาย

รูปแสดงกระดาษยูนิเวอร์ซัลอินดิเคเตอร์
ที่มา http://119.46.166.126/self_all/selfaccess11/m5/chemistry5_2/lesson3/pic3_1.php
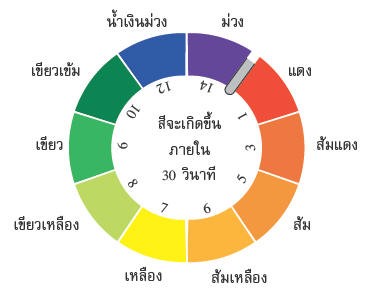
รูปแสดงการเปลี่ยนสีของกระดาษยูนิเวอร์ซัลอินดิเคเตอร์
ที่มา https://garnjanaporn.wordpress.com/tag/ยูนิเวอร์แซลอินดิเคเตอ/
ยูนิเวอร์ซัลอินดิเคเตอร์แบบสารละลายจะเปลี่ยนสีเมื่อใช้ทดสอบสารละลายที่มีค่า pH อยู่ในช่วงที่แตกต่างกัน ดังตัวอย่างต่อไปนี้
+ ฟีนอล์ฟทาลีน เป็นสารละลายใสไม่มีสีซึ่งจะเปลี่ยนเป็นสีชมพู เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 8.3-10.0
+ เมทิลเรด เป็นสารละลายสีแดงซึ่งจะเปลี่ยนเป็นสีเหลือง เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 4.2-6.2
+ บรอมไทมอลบลู เป็นสารละลายสีเหลืองซึ่งจะเปลี่ยนเป็นสีน้ำเงิน เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 6.0-7.6
+ ฟีนอลเรด เป็นสารละลายสีเหลืองซึ่งจะเปลี่ยนเป็นสีแดง เมื่อใช้ทดสอบความเป็นกรด-เบสของสารละลายที่มีค่า pH อยู่ระหว่าง 6.8-8.4
ตารางแสดงช่วงการเปลี่ยนสีของอินดิเตอร์เตอร์บางชนิด
|
อินดิเคเตอร์ |
ช่วง pH ที่เปลี่ยนสี |
สีที่เปลี่ยน |
|
เมทิลออเรนจ์ เมทิลเรด ลิตมัส บรอมไทมอลบลู ฟีนอลเรด ฟีนอล์ฟทาลีน |
3.1-4.4 4.2-6.3 5.0-8.0 6.0-7.6 6.8-8.4 8.3-10.0 |
แดง-เหลือง แดง-เหลือง แดง-น้ำเงิน เหลือง-น้ำเงิน เหลือง-แดง ไม่มีสี-ชมพูเข้ม |
การแปรความหมาย เช่น
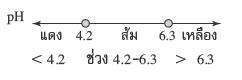
1) เมทิลเรด
ช่วง pH ที่เปลี่ยนสี คือ 4.2-6.3 สีที่เปลี่ยน คือ แดง-เหลือง หมายถึง ถ้าสารละลายมี pH ต่ำกว่า 4.2 จะมีสีแดง ถ้าสารละลายมี pH ช่วง 4.2-6.3 จะมีสีส้ม
(สีผสมของสีแดงกับสีเหลือง)ถ้าสารละลายมี pH มากกว่า 6.3 จะมีสีเหลือง
2) ฟีนอล์ฟทาลีน
ช่วง pH ที่เปลี่ยนสี คือ 8.3- 10.0 สีที่เปลี่ยน คือ ไม่มีสี-ชมพู หมายถึง ถ้าสารละลายมี pH ต่ำกว่า 8.3 จะไม่มีสี ถ้าสารละลายมี pH อยู่ในช่วง 8.3-10.0 จะมีสีชมพูอ่อน (ไม่มีสีผสมกับสีชมพู)ถ้าสารละลายมี pH มากกว่า 10.0 จะมีสีชมพูเข้ม

ความรู้เพิ่มเติม
อินดิเคเตอร์จากธรรมชาติ คือ สารธรรมชาติที่สกัดได้จากส่วนต่างๆ ของพืช สามารถใช้เพื่อตรวจสอบความเป็นกรด-เบสของสารละลายได้
ตารางแสดงช่วงการเปลี่ยนสีของอินดิเคเตอร์จากธรรมชาติบางชนิด
|
ชนิดของพืช |
ช่วง pH ที่เปลี่ยนสี |
สีที่มีการเปลี่ยนแปลง |
|
อัญชัน กุหลาบ กระเจี๊ยบ ชงโค บานไม่รู้โรย ดาวเรือง ผกากรอง |
1-3 3-4 6-7 6-7 8-9 9-10 10-11 |
แดง-ม่วง ชมพู-ไม่มีสี แดง- เขียว ชมพู-เขียว แดง-ม่วง ไม่มีสี-เหลือง ไม่มีสี-เหลือง |
การใช้อินดิเคเตอร์ในการทดสอบหาค่า pH ของสารละลายนั้นจะทราบค่า pH โดยประมาณเท่านั้น ถ้าต้องการทราบค่า pH ที่แท้จริงจะต้องใช้เครื่องมือวัด pH ที่เรียกว่า "พีเอชมิเตอร์ (pH meter)" ซึ่งเป็นเครื่องมือที่สามารถตรวจวัดค่า pH ของสารละลายได้เป็นเวลานานติดต่อกัน ทำให้ตรวจสอบการเปลี่ยนแปลงความเป็นกรด-เบสของสารละลายได้ และค่า pH ที่อ่านได้จะมีความละเอียดมากกว่าการใช้อินดิเคเตอร์

รูปแสดงพีเอชมิเตอร์
ที่มา https://sites.google.com/site/smbatikhxngsarlalaykrdbes/3-kar-trwc-sxb-sarlalay-krd-bes
แหล่งที่มา
นงลักษณ์ สุวรรณพินิจและปรีชา สุวรรณพินิจ. (2537). สารและสมบัติของสาร ม.1. กรุงเทพฯ: ไฮเอ็ดพับลิชชิ่ง จำกัด.
บริษัท แม็คเอ็ดดูเคชั่น จำกัด. (ไม่ปรากฏวันเดือนปีที่จัดทำ). การตรวจสอบความเป็นกรด – เบส ของสารละลาย. สืบค้นเมื่อ 18 ตุลาคม 2560, จาก http://www.maceducation.com/e-knowledge/2412212100/15.htm.
กลับไปที่เนื้อหา
กรดและเบสในชีวิตประจำวัน
สารละลายกรด – เบสในชีวิตประจำวันมีอยู่มากมาย ซึ่งสามารถจำแนกได้ดังนี้
- สารประเภททำความสะอาด
บางชนิดก็มีสมบัติเป็นเบส เช่น สบู่ ผงซักฟอก น้ำยาล้างจาน
บางชนิดมีสมบัติเป็นกรด เช่น น้ำยาล้าง ห้องน้ำ และเครื่องสุขภัณฑ์

ภาพ สารประเภททำความสะอาด
ที่มา : http://story.yenta4.com/AcidBaseLearning/2008/06/01/public-16
- สารที่ใช้ทางการเกษตรได้แก่ ปุ๋ย
บางชนิดก็มีสมบัติเป็นเบส เช่น ยูเรีย
บางชนิดมีสมบัติเป็นกรด เช่น แอมโมเนียมคลอไรค์
บางชนิดมีสมบัติเป็นกลาง เช่น โพแทสเซียมไนเตรต
- สารปรุงแต่งอาหาร
บางชนิดก็มีสมบัติเป็นเบส เช่น น้ำปูนใส น้ำขี้เถ้า
บางชนิดมีสมบัติเป็นกรด เช่น น้ำส้มสายชู น้ำมะนาว น้ำมะขาม
บางชนิดมีสมบัติเป็นกลาง เช่น ผงชูรส เกลือแกง น้ำตาลทราย ฯลฯ

ภาพ สารปรุงแต่งอาหาร
ที่มา : http://story.yenta4.com/AcidBaseLearning/2008/06/01/public-16
- ยารักษาโรค
บางชนิดก็มีสมบัติเป็นเบส เช่น ยาแอสไพริน วิตามินซี
บางชนิดมีสมบัติเป็นกรด เช่น ยาลดกรด ยาธาตุ
ภาพ ยารักษาโรค
ที่มา : http://story.yenta4.com/AcidBaseLearning/2008/06/01/public-16
- เครื่องสำอาง
บางชนิดมีสมบัติเป็นกลาง เช่น น้ำหอม สเปรย์ฉีดผม ยารักษาสิวฝ้า
สารละลายกรด-เบสในชีวิตประจำวันและในสิ่งมีชีวิต
*ตัวอย่างสารละลายกรดในชีวิตประจำวันและในสิ่งแวดล้อม มีดังต่อไป
- กรดtartaric [C4H6O6] พบในมะขามป้อม ฝรั่ง
- กรดแอซิติก (acetic acid) [CH3COOH] ใช้ในการผลิตน้ำส้มสายชู
– กรดซิตริก (citric acid) [C6H8O7]เป็นกรดที่อยู่ในผลไม้ที่มีรสเปรี้ยว เช่น ส้ม มะนาว
– กรดแอสคอร์บิก (ascorbic acid) [C6H8O6] มีอยู่ในผลไม้ที่มีรสเปรี้ยว วิตามิน C
– กรดอะมิโน (amino acid) เป็นกรดที่ใช้สร้างโปรตีน มักพบในเนื้อสัตว์ ผลไม้
- กรดซัลฟิวริก [H2SO4] ทำปุ๋ยเคมี
- กรดboric [H3BO3] ยาฆ่าเชื้อโรค , น้ำยาล้างตา
- กรดไฮโดรคลอริก [HCl] น้ำยาล้างสุขภัณฑ์
- กรดออกซาลิก [H2C2O2] กำจัดรอยเปื้อนสนิม
- กรดคาร์บอนิก [H2CO3] เป็นส่วนประกอบของน้ำอัดลม
*ตัวอย่างสารละลายเบสในชีวิตประจำวันและสิ่งแวดล้อม มีดังต่อไปนี้
1. สารประเภททำความสะอาด
– NaOH ใช้ทำสบู่
– แอมโมเนีย (NH3) น้ำยาล้างกระจก,น้ำยาปรับผ้านุ่ม
– Na2CO3 อุตสาหกรรมผงซักฟอก
2. สารปรุงแต่งอาหาร
- NaOH ทำผงชูรส
- NaHCO3 ทำขนม
3. สารที่ใช้ทางการเกษตร ได้แก่ ปุ๋ย
– ยูเรีย
– Ca(OH)2 แก้ดินเปรี้ยว
4. ยารักษาโรค
-NH3-(NH4)2CO3 แก้เป็นลม
- Ca(OH)2 ลดกรดในกระเพาะอาหาร
- Mg(OH)2 ลดกรดในกระเพาะอาหาร , ยาถ่าย
สารเคมีที่ใช้ในบ้าน
ในแต่ละวันเราต้องใช้สารละลายกรด – เบส หลายชนิด บางชนิดอยู่ในอาหารที่เรารับประทาน เราใช้สารละลายกรด – เบส ในการทำความสะอาด เครื่องใช้ ของใช้ พื้นห้องน้ำ สุขภัณฑ์ สารที่ทำความสะอาดร่างกายบางชนิดมีสมบัติเป็นเบส สารละลายหลายชนิดในร่างกายของเราก็มีคุณสมบัติเป็นกรด – เบส เช่น
น้ำย่อยในกระเพาะอาหารของคนเรามี pH อยู่ใน ช่วง 1.6 – 2.5 ซึ่งมีคุณสมบัติเป็นกรด เพื่อทำหน้าที่ย่อยโปรตีน ในแต่ละวันเราต้องใช้สารทำความสะอาดเพื่อกำจัดฝุ่นละออง เหงื่อไคล และสิ่งสกปรกออกจากผิวหนังๆแต่ละส่วนของร่างกายจึงใช้ สารทำความสะอาดแตกต่างกัน เช่น ใช้แชมพูทำความสะอาดเส้นผม
ใช้สบู่ทำความสะอาดผิวหนัง บางคนใช้สารทำความสะอาดที่กับใบหน้าโดยเฉพาะ นอกจากประสิทธิในกำจัดสิ่งสกปรกแล้ว สมบัติอื่นๆ ของสารทำความสะอาดที่ใช้กับร่างกาย เช่น กลิ่น สี รวมทั้งความเป็น กรด – เบส ก็เป็นปัจจัยหนึ่งที่เราต้องคำนึงถึงด้วยเมื่อจะเลือกซื้อสารทำความสะอาดกับร่างกาย ในสมัยก่อน สารทำความสะอาดที่ผสมอยู่ในแชมพูส่วนใหญ่เป็นสารประเภทเดียวกับสบู่ เมื่อสระผมด้วยน้ำกระด้างจึงเกิดไคลสบู่จับอยู่ตามเส้นผม คนในสมัยก่อนจึงนิยมชโลมผมด้วยน้ำมะกรูดหรือน้ำมะนาวเพื่อกำจัดไคลสบู่ออกจากเส้นผมนั่นเอง
ปัจจุบันนี้ใช้สารสังเคราะห์ซึ้งมีสมบัติเป็นสารลดแรงตึงผิวที่สามารถกำจัดสิ่งสกปรกออกจากเส้นผมได้ดีกว่าสบู่มาก นอกจากนี้ยังอาจเติมสารปรับ pH กลิ่น สี ให้น่าใช้และเติมสารที่ทำให้เนื้อแชมพูข้น บางคนนิยมใช้ครีมนวดผมหลังจากที่สระผมแล้ว เพื่อปรับสภาพเส้นผม
การใช้สารรอบตัวโดยเฉพาะสารที่มีสมบัติกัดกร่อน เช่น กรด – เบส นอกจากจะคำนึงถึงสมบัติของสารที่สอดคล้องกับวัตถุประสงค์ของการใช้แล้ว ยังจะต้องคำนึงถึงผลของการใช้สารที่อาจมีต่อสิ่งมีชีวิตอื่นและสิ่งแวดล้อมด้วย จึงควรศึกษาสมบัติของสาร วิธีใช้ และวิธีป้องกันอันตรายอย่างถูกต้อง
เราอาจจะสรุป pH ของสารละลายในชีวิตประจำวันได้ดังนี้
- ของเหลวบางชนิดอาจจะมีช่วง pH กว้าง และบางชนิดมีช่วง pH แคบตามข้อมูลในตาราง
- ถ้ารับประทานอาหารประเภทผัก ปัสสาวะจะมี pH สูง แต่ถ้ารับประทานเนื้อสัตว์มาก ปัสสาวะจะมี pH ต่ำ
- ในร่างกายของคนเราของเหลวบางชนิดมี pH แปรไปได้ในช่วงค่อนข้างกว้าง โดยที่ร่างกายยังคงอยู่ในสภาพปกติไม่เจ็บป่วย แต่ของเหลวบางชนิดในคนปกติมี pH ค่อนข้างคงที่ เช่น เลือดมีค่า pH แปรไปได้เพียง 0.10 เท่านั้น สำหรับคนที่เป็นโรคเบาหวานรุนแรง ค่า pH ของเลือดอาจลดต่ำลงกว่า 7.35 ทำให้เกิดอาการคลื่นไส้ ถ้าลดลงต่ำมากๆ อาจหมดสติถึงตายได้ อย่างไรก็ตาม ปกติในร่างกายของคนจะมีระบบที่ควบคุมค่า pH ของเลือดไว้ให้คงที่
- ในน้ำฝนซึ่งน่าจะมีสมบัติเป็นกลาง แต่พบว่ามี pH ประมาณ 5.6 - 6.0 เท่านั้น และปัจจุบันในประเทศอุตสาหกรรม pH ของน้ำฝนมีค่าต่ำถึง 2.8 จากการตรวจสอบพบว่านอกจากมี CO2 ละลายอยู่แล้วยังมี H2SO4 และ HNO3 ละลายปนอยู่ด้วย
แหล่งที่มา
นงลักษณ์ สุวรรณพินิจและปรีชา สุวรรณพินิจ. (2537). สารและสมบัติของสาร ม.1. กรุงเทพฯ: ไฮเอ็ดพับลิชชิ่ง จำกัด.
วราพร ทิพันธ์. (2556, ธันวาคม). Education for science. สืบค้นเมื่อ 18 ตุลาคม 2560, จาก https://sites.google.com/site/kruwirairat/hnwy-kar-reiyn-ru-thi-4/4-4-smbati-khxng-sarlalay-krd---bes.
กลับไปที่เนื้อหา



