เคมีอินทรีย์
สารอะโรมาติกในชีวิตประจำวัน
สารประกอบอะโรเมติก คือ สารประกอบไฮโดรคาร์บอนไม่อิ่มตัวที่มีคาร์บอนต่อกันเป็นวง มีจำนวน อิเล็กตรอนเป็น 4n+2 เมื่อ n = 1, 2,3 และอิเล็กตรอนเหล่านี้ไม่อยู่ประจำที่สารที่เราคุ้นเคยได้แก่ เบนซีน ซึ่งคาร์บอนทั้งหกอะตอมต่อกันเป็นหกเหลี่ยมและคาร์บอนทุก ๆ อะตอมอยู่ในระนาบเดียวกันและมีจำนวน 6 อิเล็กตรอน แต่อะตอมของคาร์บอนมีความยาวเท่ากัน คือ 139 พิโกเมตร ซึ่งเป็นค่าระหว่างความยาวพันธะของคาร์บอนที่เป็นพันธะเดี่ยว (154 พิโกเมตร) กับพันธะคู่(134 พิโกเมตร) และมีมุมระหว่างพันธะเท่ากันทุกมุม เบนซีน (benzene) และอนุพันธ์ของเบนซีน จัดเป็นสารประกอบอะโรมาติกไฮโดรคาร์บอนชนิดหนึ่งที่พบเห็นและใช้กันอย่างแพร่หลายและเป็นโมเลกุลที่เล็กที่สุดของสารประกอบอะโรมาติก
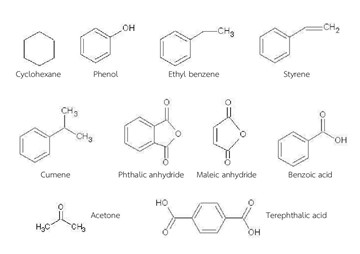
ภาพประกอบบทเรียนสารอะโรมาติกในชีวิตประจำวัน
ที่มา : http://tamagozzilla.blogspot.com/2012/10/mo-memoir-wednesday-10-october- 2555.html
ประโยชน์ของเบนซีนและอนุพันธ์
โดยทั่วไปนิยมใช้เบนซีนเป็นตัวทำละลายและเป็นสารตั้งต้นในการสังเคราะห์สารประกอบต่าง ๆ แต่การสูดดมเบนซีนในปริมาณมาก ๆ ทำให้เกิดอาการคลื่นไส้และอาจถึงตายได้เนื่องจากระบบหายใจล้มเหลว นอกจากนี้การที่ต้องสัมผัสกับเบนซีนต่อเนื่องนาน ๆ จะทำให้ไขอ่อนในโพรงกระดูกซึ่งทำหน้าที่สร้างเม็ดเลือดถูกทำลาย ดังนั้นห้องปฏิบัติการเกี่ยวกับเบนซีนจึงต้องมีระบบถ่ายเทอากาศอย่างดีและถ้าไม่จำเป็นควรใช้ โทลูอีนเป็นตัวทำละลายแทน
ในทางอุตสาหกรรมใช้ โทลูอีน เป็นตัวทำละลายสำหรับแล็กเกอร์ ใช้ทำสี ยาและวัตถุระเบิด ส่วน ไซลีน นิยมใช้เป็นตัวทำละลายกรีสและน้ำมัน นอกจากนี้ยังใช้ทำความสะอาดสไลด์และเลนส์กล้องจุลทรรศน์ด้วย สำหรับ พาราไซลีน นั้นสามารถถูกออกซิไดส์ให้กรด terephthalic ซึ่งใช้เป็นสารตั้งต้นในการผลิตเส้นใยโพลีเอสเตอร์ (dacron) ที่ใช้ในอุตสาหกรรม การผลิตสินค้าใช้ ไนโตรเบนซีน ในการผลิตอนิลีนซึ่งเป็นสารตั้งต้นในการผลิตสีย้อมและยาต่าง ๆ ฟีนอล ใช้ในการผลิตสีย้อม ยารักษาโรค ยาฆ่าเชื้อโรค พลาสติก เช่น เบคิไลท ( bakelite ) วัตถุระเบิด เช่น กรดพิคริก และเป็นยาป้องกันเชื้อโรค เช่น sucrets เบนซีนนั้นใช้เป็นสารตั้งต้นในการผลิต
- ไซโคลเฮกเซน (Cyclohexane - C6H12) โดยการเติมไฮโดรเจนกลับเข้าไปที่วงแหวน ไซโคลเฮกเซนใช้เป็นสารตั้งต้นในการผลิต caprolactam ซึ่งนำไปสู่การผลิตเส้นใยไนลอน
- เอทิลเบนซีน โดยนำเบนซีนมาทำปฏิกิริยากับเอทิลีน เส้นทางนี้เป็นเส้นทางหลักในการผลิตเอทิลเบนซีน เอทิลเบนซีนที่ได้จะถูกเปลี่ยนไปเป็น Styrene (C6H5-CH=CH2) ซึ่งเป็นสารตั้งต้นในการผลิตพอลิสไตรีน (Polystyrene - PS) โรงงานที่ผลิตพอลิสไตรีนก็มักจะมีหน่วยผลิตเอทิลเบนซีนและสไตรีนของตัวเอง
- คิวมีน (Cumene - C6H5-(CH3CHCH3)) โดยนำเบนซีนไปทำปฏิกิริยากับโพรพิลีน คิวมีนนี้ใช้เป็นสารตั้งต้นในการผลิตฟีนอล (Phenol - C6H5-OH) โดยจะได้อะซีโทน (acetone - H3C-CO-CH3) เป็นผลิตภัณฑ์ร่วม โรงงานที่ผลิตฟีนอลก็มักจะมีหน่วยผลิตคิวมีนของตัวเองเช่นเดียวกัน
ปัญหาของเบนซีน
เมื่อร่างกายของคนเราได้รับสารเคมีเข้าไป ร่างกายจะขับออกโดยการเปลี่ยนสารประกอบนั้นให้กลายเป็นสารประกอบที่ละลายน้ำได้ เพื่อที่จะได้ระบายออกผ่านทางปัสสาวะเนื่องจากโมเลกุลอะโรมาติกเป็นโมเลกุลไม่มีขั้ว ดังนั้นเมื่อร่างกายรับเข้าไปก็จะไปสะสมในไขมัน ในการขับโมเลกุล อะโรมาติกออกจากร่างกาย ร่างกายจะต้องทำการออกซิไดซ์โมเลกุลเหล่านี้ให้เกิดหมู่ฟังก์ชันที่มีขั้ว เพื่อที่จะได้ละลายน้ำได้ และเข้าสู่ระบบโลหิตก่อนจะไปถูกขับออกทางปัสสาวะผ่านทางไตสารประกอบอะโรมาติกที่มีหมู่อัลคิลเกาะอยู่นั้น ร่างกายจะทำการออกซิไดซ์หมู่อัลคิลให้กลายเป็นหมู่ที่มีขั้ว (เช่นเปลี่ยนหมู่ -CH3 ให้กลายเป็น -COOH) แทนที่จะทำการออกซิไดซ์วงแหวนโดยตรง ทั้งนี้เพราะการออกซิไดซ์หมู่อัลคิลนั้นทำได้ง่ายกว่าการออกซิไดซ์วงแหวนแต่เนื่องจากเบนซีนไม่มีหมู่อัลคิลเกาะอยู่ ดังนั้นการขับเบนซีนออกจากร่างกายจึงต้องพึ่งปฏิกิริยาการออกซิไดซ์วงแหวนโดยตรง ผลิตภัณฑ์ที่เกิดจากการออกซิไดซ์วงแหวนเบนซีนนี้ถูกจัดว่าเป็นสารก่อมะเร็งในอดีตนั้นเบนซีนส่วนที่เกินความต้องการของอุตสาหกรรมปิโตรเคมีสามารถผลักเข้าสู่การผลิตน้ำมันแก๊สโซลีนได้ แต่ในปัจจุบันเนื่องจากมีการจำกัดปริมาณเบนซีนในน้ำมันแก๊สโซลีนให้ต่ำลงไปอีก และในบางกระบวนการนั้นก็ได้มีการใช้สารตั้งต้นตัวอื่นมาใช้แทนเบนซีน (เช่นการผลิตมาเลอิกแอนไฮดรายที่เปลี่ยนจากเบนซีนไปเป็นไฮโดรคาร์บอน C4) ทำให้การใช้งานเบนซีนนั้นถูกจำกัดมากยิ่งขึ้น และนี่คือโจทย์ที่เราได้รับมาว่าจะจัดการอย่างไรกับเบนซีนส่วนเกินนี้
โทษของสารประกอบอะโรมาติก
สาร PAH ที่พบในการใหม้เกรียมของอาหาร ปิ้ง ย่าง อาหารรมควัน ไก่ย่า หมูปิ้ง สารนี้เกิดจากในขณะที่เราย่างน้ำมันของเนื้อจะหยดลงเตาไฟเเละเขม่าจะลอยมาเกาะติดกับเนื้อ เเล้วเรานำไปรับประทานอาจส่งผลเสียต่อสุขภาพได้หากเรารับประทานบ่อยหรือรับประทานมาก อาจไปสะสมในร่างกายเป็นสาเหตุให้เกิดโรคมะเร็ง โพลีไซคลิกอะโรมาติกไฮโดรคาร์บอน หรือ พีเอเอช เป็นสารประกอบไฮโดรคาร์บอนที่ประกอบด้วยวงเบนซีนตั้งแต่ 2 วงขึ้นไป จัดเรียงเป็นเส้นตรง เป็นมุม หรือเป็นกลุ่ม มีเฉพาะอะตอมของไฮโดรเจนและคาร์บอน ส่วนใหญ่ไม่ละลายน้ำแต่ละลายได้ดีในไขมัน PAHs เป็นสารที่ค่อนข้างร้ายเเรงมาก ส่วนใหญ่เป็นสารเริ่มต้นของสารกลายพันธุ์(Premutagen)และสารเริ่มต้นของสารก่อมะเร็ง (Precarcinogen)พบในเขม่าควันไฟ ไอเสียของเครื่องยนต์ น้ำมันดิบ นอกจากนี้ยังเกิดจากการเผาไหม้ไม่สมบูรณ์ของสารอินทรีย์ เช่น ไขมันที่อยู่ในเนื้อสัตว์ น้ำมัน และไฮโดรคาร์บอนชนิดอื่นๆ ดังนั้นจึงพบสารชนิดนี้ในส่วนที่ไหม้เกรียมของอาหาร ปิ้ง ย่าง อาหารทอดกรอบ อาหารรมควัน นอกจากนี้ยังพบสาร PAH คล้ายคลึงกับการเผาไหม้ในเครื่องยนต์ บุหรี่ และเตาเผาเชื้อเพลิงในโรงงานอุตสาหกรรม สารกลุ่มนี้ได้รับการยอมรับว่าทำให้เกิดมะเร็งในคนได้ ถ้าได้รับการสัมผัสทางผิวหนังก็จะเป็นมะเร็งที่ผิวหนัง ถ้าได้รับการสูดดมเข้าไปก็จะเป็นมะเร็งที่ปอด
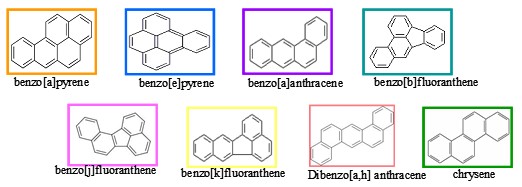
ภาพที่ 2 สารประกอบ PAHs 8 ชนิดที่จัดว่าเป็นสารก่อมะเร็ง
ที่มา : http://www.p2s.psu.ac.th/index.php/psu-research/2014-09-09-02-01-15/43-2015-07-06-08-33-27
กลับไปที่เนื้อหา
สารอินทรีย์ที่ควรรู้จัก
สารอินทรีย์ หมายถึง สารที่มีธาตุคาร์บอน เป็นองค์ประกอบหลัก และมีธาตุอื่นๆเป็นองค์ประกอบร่วม เช่น ธาตุO, N, P, S, Cl,และ Br เป็นต้น ดังนั้นสารอินทรีย์และสารอนินทรีย์ทุกชนิดจะต้องมีธาตุ C อยู่ด้วยเสมอ จึงกล่าวได้ว่าสารอินทรีย์ก็คือสารประกอบของคาร์บอน(ยกเว้นสารประกอบของคาร์บอนบางชนิด) เดิมนักเคมีเชื่อกันว่าสารอินทรีย์จะต้องเกิดจากสิ่งมีชีวิตเท่านั้น อาจจะเกิดอยู่ในธรรมชาติหรือสังเคราะห์ขึ้นจากสารอินทรีย์ด้วยกัน แต่จะสังเคราะห์จากสารอนินทรีย์ไม่ได้ จนกระทั่งประมาณปี ค.ศ. 1776 Carl Wilhelm Scheele นักวิทยาศาสตร์ชาวสวีเดนจึงสามารถสังเคราะห์สารอินทรีย์จากสาร อนินทรีย์ได้ โดยการเตรียมกรดออกซาลิกจากปฏิกิริยาระหว่างกรดไนตริกเข้มข้นกับน้ำตาลอ้อย แต่ก็ยังไม่เป็นที่ยอมรับกันนัก
สารอินทรีย์ที่ควรรู้จัก
1.ฟอร์มาลีน (Formalin) ลักษณะทั่วไปของฟอร์มาลินเป็นของเหลวใส ไม่มีสี มีกลิ่นฉุนเฉพาะตัว ใช้ในอุตสาหกรรมผลิตเคมีภัณฑ์พลาสติกสิ่งทอ และใช้ในการรักษาผ้าไม่ให้ย่นหรือยับ ในทางการแพทย์ใช้ในความเข้มข้นต่าง ๆ กันตั้งแต่ร้อยละ 10 ขึ้นไป ซึ่งขึ้นอยู่กับวัตถุประสงค์ของการใช้เป็นหลัก เช่น ใช้ฆ่าเชื้อโรค (germicide) และฆ่าเชื้อรา (fungicide) และเป็นน้ำยาดองศพ เป็นต้น นอกจากนี้ในความเข้มข้นประมาณร้อยละ 0.004 จะช่วยป้องกันการขึ้นราในการเก็บรักษาข้าวสาลีหรือกันการเน่าเสียในพวกข้าวโอ๊ตหลังจากเก็บเกี่ยว และใช้เพื่อป้องกันแมลงในพวกธัญญพืชหลังการเก็บเกี่ยวและที่ใช้มากในส่วนผสมของน้ำฆ่าเชื้อ และทำความสะอาด ใช้ในอุตสาหกรรมกระดาษ อุตสาหกรรมสิ่งทอ และการผลิตสี รวมถึงการใช้สำหรับรักษาสภาพร่างกายของสัตว์หรือศพ ฟอร์มาลีนที่ใช้กันทั่วไป เป็นสารที่เตรียมได้จากการนำฟอร์มัลดีไฮด์ (Formaldehyde) กับน้ำ ที่ความเข้มข้นของฟอร์มัลดีไฮด์ประมาณ 37-50% โดยน้ำหนัก และมักมีส่วนผสมของเมทานอลประมาณ 10-15%ฟอร์มัลดีไฮด์มีความสามารถละลายน้ำได้ดีมาก และสามารถรวมตัวกันเป็น โพลิเมอร์เมื่อความเข้มข้นมากขึ้น แต่การรวมตัวกันของฟอร์มัลดีไฮด์จะลดลงเมื่อเติมเมทานอลผสมด้วย เช่น สารละลายฟอร์มัลดีไฮด์ 37% ผสมกับเมทานอล 7% ทำให้สารละลายมีความเสถียรที่อุณหภูมิ 21 องศาเซลเซียส ส่วนารละลายฟอร์มัลดีไฮด์ 37% ผสมกับเมทานอล 1% ทำให้สารละลายมีความเสถียรที่อุณหภูมิ 40.5 องศาเซลเซียส แต่หากไม่ผสมเมทานอลแล้ว สารละลายจะมีความเสถียรที่อุณหภูมิ 67-71 องศาเซลเซียส
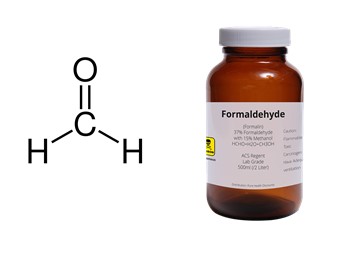
ภาพที่ 3 แสดงตัวอย่างสารละลายฟอร์มาลีนและโครงสร้างของฟอร์มาลดีไฮด์
ที่มา : https://pixabay.com/ , burlesonmatthewและ https://th.wikipedia.org/wiki/ฟอร์มาลดีไฮด์#/media/File:Structural_formula_of_formaldehyde.svg
- น้ำยาล้างเล็บส่วนประกอบที่สำคัญของน้ำยาล้างเล็บคือ อะซีโตน หรือ Acetone โดย อะซีโตนเป็นตัวทำละลายอินทรีย์ ที่ไม่มีสี มีความเป็นพิษต่ำ ระเหยง่าย จึงมักถูกนำมาใช้เป็นตัวทำละลายในอุตสาหกรรมและใช้ในงานด้านเภสัชกรรม โดยอะซีโตนที่มีความเข้มข้นมากกว่า 80% มีฤทธิ์เป็นยาฆ่าเชื้อ (antiseptic) นอกจากนี้ อะซีโตนยังถูกสร้างขึ้นจากขนวนการเมตาโบลิซึมในร่างกาย โดยเป็นหนึ่งใน Ketone bodies ซึ่งพบในเลือด เมื่อผู้ป่วยเกิดภาวะเลือดเป็นกรดจากสารคีโตน (ketoacidosis) จากภาวะเลือดเป็นกรดจากเบาหวาน(diabetic acidosis) หรือ ภาวะเลือดเป็นกรดจากการอดอาหาร (starvation acidosis) ซึ่งถ้ามีอะซีโตนในเลือดในปริมาณมากจะสามารถได้กลิ่นอะซีโตนจากลมหายใจของผู้ป่วยอะซิโตนถูกค้นพบครั้งแรกโดย Schardinger จากกระบวนการหมักของแบคทีเรียในสภาวะไม่มีออกซิเจน โดยสามารถผลิตได้จากแบคทีเรียในกลุ่ม Cl. acetobutylicum และCl. beijerinckii ซึ่งวิธีนี้มีต้นทุนค่อนข้างสูง ทั้งนี้ ผลิตภัณฑ์อะซิโตนส่วนมากที่มีใช้ในปัจจุบันจะได้จากกระบวนการสังเคราะห์จากปิโตรเลียม
แต่ เนื่องจากในปัจจุบันได้มีการกวดขันเรื่องการใช้ยาเสพติดที่เป็นสารระเหยเช่น กาว ทินเนอร์ แลคเกอร์ มากขึ้น ทำให้วัยรุ่นที่ติดสารระเหยหันมาใช้ยาทาเล็บและน้ำยาล้างเล็บ ซึ่งมีอะซีโตนเป็นองค์ประกอบหลัก หยดใส่สำลีหรือทามือแล้วสูดดมแทน เนื่องจากยาทาเล็บและน้ำยาล้างเล็บหาซื้อได้ง่ายกว่าและมีความเสี่ยงต่อการถูกจับกุมและดำเนินคดียากกว่าการดมกาว หรือ ทินเนอร์ นอกจากนี้การสูดดมอะซีโตนในความเข้มข้นสูงจะทำให้เกิดอาการทางระบบประสาทและเกิดการเสพติดได้แช่นเดียวกับสารระเหยทั่วไป
การละลายของสีทาเล็บในอะซิโตน
อะซิโตนเป็นโมเลกุลโคเวเลนต์มีขั้ว ส่วนที่มีขั้วคือหมู่คาร์บอนิล ส่วนสีทาเล็บทั่วไปที่ใช้กันอยู่มีส่วนประกอบที่สำคัญคือ ไนโตรเซลลูโลส (Nitrocellulose) ฟอร์มาลดีไฮด์ (Formaldehyde) เรซิน โทลูอีน (Toluene) ไดบิวทิว พทาเลต (Dibutyl Phthalate) ซึ่งส่วนประกอบเหล่านี้มีสารที่มีสภาพขั้วเหมือนกันกับอะซิโตน ดังนั้นเมื่อผสมอะซิโตนลงไปในน้ำยาล้างเล็บ น้ำยาล้างเล็บนั้นก็สามารถล้างสีทาเล็บได้ทั้งนี้เนื่องจากน้ำยาล้างเล็บและสีทาเล็บมีสมบัติการละลายที่คล้ายคลึงกัน การที่สารชนิดหนึ่งจะละลายในตัวทำละลายหนึ่งๆได้นั้น สารทั้งสองชนิดจะต้องมีสมบัติเหมือนกันตามกฎ "Like dissolves like" นั่นคือ ตัวละลายที่มีขั้วจะละลายในตัวทำละลายที่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลมีขั้วเป็นแรงไดโพล-ไดโพล (Dipole-Dipole) แต่จะไม่ละลายในตัวทำละลายไม่มีขั้ว ตัวอย่างเช่น เอทานอล (CH3CH2OH) ละลายในน้ำ (H2O) แต่ไม่ละลายในเฮกเซน (C6H14) ในทางตรงข้าม ตัวละลายที่ไม่มีขั้วจะละลายในตัวทำละลายไม่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลไม่มีขั้วเป็นแรงแวนเดอร์วาลล์ (Van der Waals force) เหมือนกัน ตัวอย่างเช่น คาร์บอนเตตระคลอไรด์ (CCl4) ละลายในเบนซีน (C6H6) แต่ไม่ละลายในน้ำ
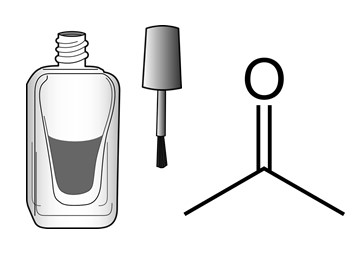
ภาพที่ 4 แสดงโครงสร้างและสารละลายอะซีโตนที่ใช้เป็นน้ำยาล้างเล็บ
ที่มา : https://pixabay.com/ ,Clker-Free-Vector-Images และ https://en.wikipedia.org/wiki/File:Acetone-2D-skeletal.svg
กลับไปที่เนื้อหา
แอลกอฮอล์ใกล้ตัว
หากกล่าวถึงแอลกอฮอล์ที่เราคุ้นเคยคงหนี้ไม่พ้นเอทิลแอลกอฮอล์หรือเอทานอล เอทิลแอลกอฮอล์ หรือเรียก เอทานอล ก่อนอื่นมีข้อมูลว่า เอทิลแอลกอฮอล์ มีการค้นพบมานานหลายพันมีมาแล้วตั้งแต่อียิปต์โบราณ เพราะมีการดื่มสุรามานาน มีการเลี้ยงฉลองจึงกล่าวได้มาเราได้ทำการหมักมาใช้ดื่มมันมานานนับพันปีมาแล้ว น้ำพืชที่ให้แป้งและน้ำตาลมาหมักกับยีสต์ จากนั้นก็นำมากลั่นเพื่อให้ได้เอทิลแอลกอฮอล์ออกมา ปกติจะได้เอทิลแอลกอฮอล์ 12% ของปริมาณน้ำหมักที่ได้ ส่วนใหญ่ถ้าพูดถึงแอลกอฮอล์ มักจะนึกถึงแอลกอฮอล์ที่อยู่ในเครื่องดื่มที่มีแอลกอฮอล์ เช่นเหล้า เบียร์ วิสกี้ บรั่นดี ซึ่งเป็นแอลกอฮอล์ชนิดเอทานอลนั่นเอง เอทานอลมีความแตกต่างจากอาหารตรงที่ว่าถึงแม้จะเผาผลาญให้พลังงานแก่ร่างกาย ได้ แต่ไม่มีสารอาหารอื่นเลย เครื่องดื่มที่มีแอลกอฮอล์แต่ละประเภทจะมีปริมาณของเอทานอลแตกต่างกัน เช่น เบียร์มีปริมาณแอลกอฮอล์น้อยประมาณ 4 – 6% โดยปริมาตร ส่วนสุราชนิดต่าง เช่น วิสกี้ บรั่นดี วอดก้า แม่โขง เป็นเหล้าชนิดกลั่นมีปริมาณแอลกอฮอล์สูงกว่า ประมาณ 40 – 50% โดยปริมาตรเอทานอลมีสมบัติเป็นของเหลว ใส ไม่มีสี มีกลิ่นหอม ติดไฟให้ความร้อนสูง ไม่มีเขม่าละลายน้ำได้ดี เตรียมได้จากการหมักแป้ง น้ำตาลหรือผลไม้ โดยมียีสต์เป็นตัวเร่ง เพื่อเปลี่ยนแป้งจากพืชให้เป็นน้ำตาล แล้วเปลี่ยนจากน้ำตาลเป็นเอทานอล จากนั้นนำเอทานอลที่ได้ไปกลั่นเพื่อให้บริสุทธิ์มากขึ้น วัตถุดิบที่ใช้หมักเป็นได้ทั้งพืชและผลิตภัณฑ์ของพืชบางชนิด เช่น อ้อย น้ำตาลกากน้ำตาล กากอ้อย แป้ง มันสำปะหลัง มันเทศ ธัญพืชต่างๆ เช่น ข้าวโพด ข้าว ข้าวสาลี ข้าวบาร์เลย์ ข้าวฟ่าง เอทานอลนอกจากจะเป็นส่วนผสมในเครื่องดื่มที่มีแอลกอฮอล์แล้วยังมีประโยชน์อีกหลายอย่าง เช่น
– เอทานอลเข้มข้นร้อยละ 70 ใช้เป็นยาล้างแผล ส่วนใหญ่ที่ขายตามร้านค้ามักเป็นสีฟ้าเนื่องจากใส่สี (จริง ๆ เอทานอลไม่มีสี) มีฤทธิ์ในการทำลายเชื้อแบคทีเรีย เชื้อวัณโรค เชื้อราและเชื้อไวรัส แต่ไม่สามารถทำลายสปอร์ของเชื้อแบคทีเรียได้
– ใช้เป็นตัวทำละลายทั้งทางด้านอุตสาหกรรมและทางเภสัชกรรม เช่น เป็นตัวทำละลายในยาแก้ไอ
– นำไปผสมกับน้ำมันเชื้อเพลิงเพื่อแก้ปัญหาวิกฤตการณ์น้ำมันราคาแพง โดยใช้เอทานอลที่มีความบริสุทธิ์ตั้งแต่ 95% โดยปริมาตรไปผสมกับน้ำมัน ถ้านำไปผสมกับน้ำมันดีเซล อัตราส่วน 15 % จะเรียกว่า ดีโซฮอล์ แต่ถ้าผสมกับน้ำมันเบนซินจะเรียกว่า แก๊สโซฮอล์ โดยผสมในอัตราส่วน 10% บางครั้งจึงเรียกว่า น้ำมัน E-10 เนื่องจากเอทานอลมีสมบัติช่วยเพิ่มปริมาณออกซิเจนในน้ำมัน จึงทำให้การเผาไหม้สมบูรณ์ยิ่งขึ้นและเป็นการลดมลพิษในอากาศ
ลักษณะของเอทิลแอลกอฮอล์เป็นของเหลว ใส ไม่มีสี ระเหยได้ง่าย มีจุดเดือด 78 องศาเซลเซียส มีอันตรายต่อร่างกายน้อย ใช้ดื่มกินได้ ซึ่งก็กลายมาเป็น เหล้า เบียร์ วิสกี้ ไวท์ เครื่องดื่มของมึนเมา เมื่อเข้าสู่ร่างกายปริมาณหนึ่งจะซึม มึนเมา มากน้อยขึ้นอยู่กับปริมาณที่ร่างกายได้รับเข้าไป เมื่อดื่มทำให้เส้นเลือดขยายตัวช่วยผ่อนคลาย
การนำไปใช้ประโยชน์ ในภาคอุตสาหกรรมนำไปใช้ประโยชน์ได้หลากหลาย เป็นสารตั้งต้น ในการทางการแพทย์นำไปใช้เกี่ยวกับยาบางชนิด ใช้ในการฆ่าเชื้อโรค หรือเป็นส่วนผสมของเครื่องสำอาง อย่างเช่น น้ำหอม สบู่ เป็นต้น และที่ใช้ในสุรา หรือของมึนเมาทุกชนิด ใช้ในการรื่นเริง การพบปะสังสรรค์
การเตรียมเอทานอล
1) ได้จากการหมักน้ำตาลผลไม้ (กลูโคสกับยีสต์) ในที่ที่ไม่มีออกซิเจนโดยเอนไซม์จากยีสต์จะเป็นตัวเร่ง ดังสมการ
C6H12O6 -------> 2CH3CH2OH(aq) + 2CO2(g)
เรียกว่า การหมักหรือเฟอร์เมนเทชัน (fermentation)
2) เตรียมได้จากการหมักแป้งที่ได้จากธัญพืชกับยีสต์ในที่ที่ไม่มีออกซิเจน เอนไซม์จากยีสต์หรือแบคทีเรียจะทำให้เกิดปฏิกิริยา
3) เตรียมเอทานอลในอุตสาหกรรม ได้จาการนำเอทิลีนมาทำปฏิกิริยาไฮโดรไลซิส โดยใช้กรดซัลฟิวริกเข้มข้นร้อยละ 98 โดยมวลต่อปริมาตรเป็นตัวเร่งปฏิกิริยา
ความรู้เพิ่มเติมเกี่ยวกับการนำเอทาทานอลไปผลิตแก๊สโซฮอลล์
แก๊สโซฮอล์คือส่วนผสมของน้ำมันเบนซินกับเอทานอล ซึ่งเป็นแอลกอฮอล์บริสุทธิ์ ซึ่งเอทานอลสามารถผลิตได้จากพืชที่ปลูกในประเทศ เช่น อ้อย มันสำปะหลัง รวมทั้งธัญพืช เช่น ข้าวฟ่าง ข้าว และ ข้าวโพด เป็นต้น
ปัจจุบันประเทศไทย โดยกระทรวงพลังงาน อนุญาตให้มีการผลิตแก๊สโซฮอล์ 3 ชนิด คือ
1.น้ำมันแก๊สโซฮอล์ E10 แบ่งเป็น
1.1 น้ำมันแก๊สโซฮอล์ ออกเทน 91
1.2 น้ำมันแก๊สโซฮอล์ ออกเทน 95
โดยมีส่วนผสมของเอทานอลไม่เกินร้อยละ 10 และไม่ต่ำกว่าร้อยละ 9 กับ น้ำมันเบนซินพื้นฐานร้อยละ 90 โดยปริมาตร สามารถใช้แทนหรือสลับกับน้ำมันเบนซิน 95และ 91 ได้ตามปกติโดยไม่ต้องดัดแปลงเครื่องยนต์
2.น้ำมันแก๊สโซฮอล์ E20 มีส่วนผสมของเอทานอลไม่เกินร้อยละ 20 และไม่ต่ำกว่าร้อยละ 19 กับ น้ำมันเบนซินพื้นฐานร้อยละ 80 โดยปริมาตร
3.น้ำมันแก๊สโซฮอล์ E85 มีส่วนผสมของเอทานอลร้อยละ 85 กับ น้ำมันเบนซินพื้นฐานร้อยละ 15 โดยปริมาตรหรือมีเอทานอลไม่ต่ำกว่าร้อยละ75
โดยเอทานอลที่ใช้ผสมจะอยู่ในรูปของเอทานอลแปลงสภาพ
กระบวนการผลิตเอทานอลจากมันสำปะหลัง
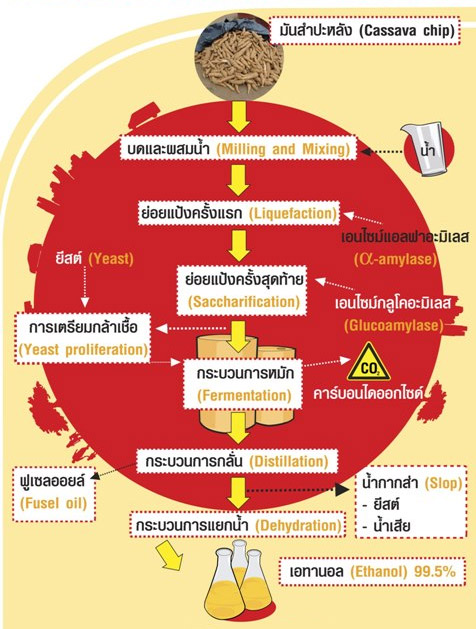
ภาพที่ 5 ภาพกระบวนการผลิตเอทานอลจากมันสำปะหลัง
ที่มา http://www.thaisugarmillers.com/tsmc-04-02.html
สัดส่วนการผลิตเอทานอลจากมันสำปะหลัง
หัวมันสด 1 ตัน ผลิตเอทานอลได้ 140 ลิตร
มันเส้น 1 ตัน ผลิตเอทานอลได้ 333 ลิตร
แป้งมัน 1 ตัน ผลิตเอทานอลได้ 500 ลิตร
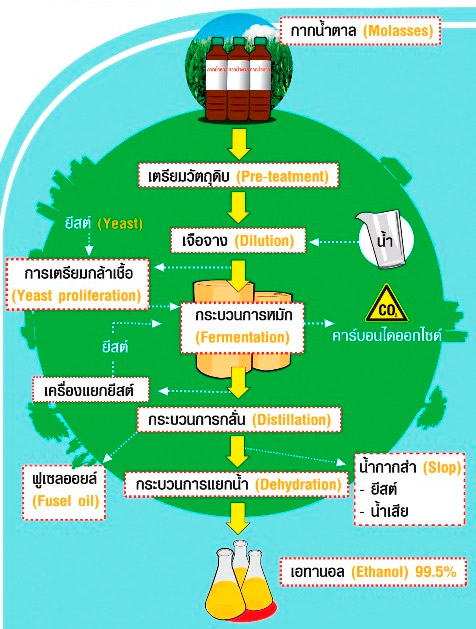
ภาพที่ 6 ภาพกระบวนการผลิตเอทานอลจากกากน้ำตาล
ที่มา : http://www.thaisugarmillers.com/tsmc-04-02.html
สัดส่วนการผลิตเอทานอลจากน้ำตาล
อ้อย 1 ตัน ผลิตเอทานอลได้ 70 ลิตร
กากน้ำตาล 1 ตัน ผลิตเอทานอลได้ 238 ลิตร
2.เมทานอล(CH3OH) มวลโมเลกุลเท่ากับ 32 มีจุดเดือด 64.6 OC ละลายน้ำได้ดี กลิ่นเหมือนเอทานอล เป็นแอลกอฮอล์ที่มีประโยชน์และโทษ
ประโยชน์
- ใช้เป็นเชื้อเพลิงในตะเกียงแอลกอฮอล์ในห้องปฏิบัติการ
-ใช้เป็นสารตั้งต้นในการผลิตยา พลสาติก และฟอร์มัลดีไฮด์
2CH3OH(g) + O2(g) 2HCOH + 2H2O
ฟอร์มัลดีไฮด์
โทษ
- ถ้าถูกผิวหนังจะทำลายผิวหนัง ทำให้เซลล์ผิวหนังตาย
-ถ้าเมทานอลเข้าสู่ร่างกายจะถูกออกซิไดส์เป็นฟอร์มาลดีไฮด์ ทำให้ปวดศีรษะ ตาบอดหรือมีอันตรายถึงชีวิต
การเตรียมเมทานอล
1) เตรียมจากการกลั่นไม้ในที่ไม่มีอากาศ เดิมเรียกว่า “แอลกอฮอล์ไม้”
2) ในอุตสาหกรรมเตรียมจากปฏิกิริยาระหว่าง CO และ H2 โดยมีออกไซด์ของโลหะแทรนซิชันเป็นตัวเร่งปฏิกิริยา เช่น Fe2O3 , Cr2O3 ดังสมการ
CO(g) + 2H2(g) CH3OH(aq)
แหล่งที่มา
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์องค์ประกอบพื้นฐานทางเคมี. กรุงเทพฯ: เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนเคมีพื้นฐานและเพิ่มเติม ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 4 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
ศรีลักษณ์ ผลวัฒนะ, และคณะ.(2551). หนังสือเรียนเสริมฯ สารและสมบัติของสาร ม.4-6 ช.4 สำนักพิมพ์แม็ค บจก.
ธนพล ฉิมพาลี. อะโรมาติก ไฮโดรคาร์บอน. สืบค้นเมื่อวันที่ 11 ธันวาคม 2561.จาก http://pumpchimpalee.blogspot.com/2011/07/blog-post_21.html
จุฬาลงกรณ์มหาวิทยาลัย, มหาวิทยาลัย. (ม.ป.ป.). เอกสารข้อมูลความปลอดภัย. สืบค้นเมื่อ 12 ธันวาคม 2561,จาก http://www.chemtrack.org/MSDSSG/Trf/msdst/msdst67-64-1.html
ชัยวัฒน์ เจนวาณิชย์. (2547). พจนานุกรมเคมี. กรุงเทพฯ: โอเดียนสโตร์.
ศรีลักษณ์ ผลวัฒนะ และประดับ นาคแก้ว. (2553). หนังสือเรียนแม็ค เคมีเพิ่มเติม ชั้น ม.6. สำนักพิมพ์แม็ค บจก.
ชัยวัฒน์ เจนวาณิชย์. (2547). พจนานุกรมเคมี. กรุงเทพฯ: โอเดียนสโตร์.
กลับไปที่เนื้อหา



