ทฤษฎีเทอร์โมไดนามิกส์
กฎของเทอร์โมไดนามิกส์ (Laws of Thermodynamics)
โดยทั่วไปแล้วเราจะรู้กันโดยทั่วไปว่ากฎของเทอร์โมไดนามิกส์นั้นมีอยู่ 3 ข้อ ซึ่งเราจะได้เรียนรู้ถึงแนวคิดและความสำคัญของกฎแต่ละข้อต่อไป แต่ก่อนอื่นเราควรที่จะมาเรียนรู้กฎข้อที่ ศูนย์ ของเทอร์โมไดนามิกส์ก่อน (ที่เป็นกฎข้อที่ ศูนย์ ก็เพราะว่าแนวคิดนี้จริงๆแล้ว เป็นส่วนหนึ่งของกฎข้อที่ 1)
กฎข้อที่ ศูนย์กล่าวว่า “หากเรามีระบบ (หรือวัตถุ) อยู่ 3 ระบบ เช่น ระบบ ก, ข, ค แล้วระบบทั้งสามนี้สัมผัสกันอยู่และสามารถถ่ายเทความร้อนไปมาระหว่างกันได้ ถ้าหากว่า ระบบ ก กับ ระบบ ข อยู่ในสภาวะสมดุลกันทางความร้อน (มีความร้อนเท่ากันนั่นเอง) และ ระบบ ข กับ ระบบ ค อยู่ในสภาวะสมดุลกันทางความร้อนเช่นกัน นั่นย่อมหมายความว่า ระบบ ก กับ ระบบ ค อยู่ในสภาวะสมดุลกันทางความร้อนเหมือนกัน”
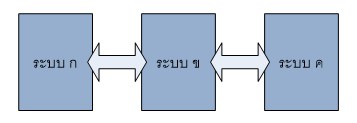
กฎข้อนี้จริงๆแล้วเป็นแนวคิด ซึ่งที่เป็นที่มาของการสร้างเทอร์โมมิเตอร์คนส่วนใหญ่ไม่ได้สนใจหรอกว่า หลักการของเทอร์โมมิเตอร์ เป็นอย่างไรเพราะเป็นอะไรที่ง่ายเหลือเกิน การนำเทอร์โมมิเตอร์ (สมมุติว่าเป็นระบบ ข) ให้ไปสัมผัสแล้วเกิดสมดุลทางความร้อนกับระบบกทำให้เราสามารถบอกว่าระบบกมีพลังงานอยู่เท่าไหร่ โดยพิจารณาจากการเปลี่ยนแปลงสมบัติทางกายภาพของสารที่อยู่ภายในเทอร์โมมิเตอร์ ซึ่งส่วนใหญ่แล้ว จะพิจารณาการขยายตัวของ ปรอท หรือ แอลกอฮอล์ ซึ่งตัวแปรที่เรากำหนดขึ้นเพื่อบ่งบอกถึงปริมาณของพลังงานก็คืออุณหภูมินั่นเอง จากกฎข้อ ศูนย์ จะทำให้บอกได้ว่า ถ้าเรานำเทอร์โมมิเตอร์ไปสัมผัสแล้วเกิดสมดุลทางความร้อนกับระบบอื่น เช่น ระบบคแล้ว สารที่อยู่ภายในเทอร์โมมิเตอร์เกิดการขยายตัวเท่ากัน แสดงว่าระบบกและคมีพลังงานเท่ากัน ดังนั้นเมื่อนำทั้งสองระบบมาสัมผัสกันจะไม่ทำให้เกิดการถ่ายเทความร้อน
อุณหภูมิ(Temperature)คือ คุณสมบัติ หรือตัวแปรหนึ่งที่มีความสำคัญมาก ทางเทอร์โมไดนามิกส์ เพราะว่าเป็นตัวแปรที่บ่งบอกถึงปริมาณพลังงานของระบบ รวมไปทั้งบอกทิศทางการไหลของพลังงาน ซึ่งจะไหลจากระบบที่มีพลังงานสูงไปสู่พลังงานต่ำนั่นเอง ในช่วงแรกของการใช้เทอม อุณหภูมินั้นได้กำหนดให้จุดหลอมเหลวของน้ำเท่ากับ ศูนย์ และจุดเดือดของน้ำเท่ากับ 100 (ระบบนี้ คือ สเกลแบบ Celsius) แล้วก็กำหนดให้การขยายตัวของเหลวที่ใช้ในหลอด capillary ของเทอร์โมมิเตอร์ที่เกิดขึ้นในช่วงอุณหภูมินี้เท่ากับ100oC แล้วก็ทำการแบ่งสเกลของการขยายตัวออกเป็น 100 ช่วงสเกล แต่ว่าข้อเสียของระบบนี้คือ การขยายตัวของของเหลวแต่ละชนิด เช่น ปรอท กับ แอลกอฮอล์ ที่พลังงานเท่ากันอาจแตกต่างกันเล็กน้อย ทำให้ค่าอุณหภูมิที่วัดได้เกิดการคลาดเคลื่อนได้ ดังนั้นสเกลที่มีความถูกต้องมากกว่า คือ สเกลแบบ Kelvin, K (thermodynamic temperature scale) ซึ่งพิจารณาจากการเปลี่ยนแปลงความดันของแก๊สสมบูรณ์แบบ (perfect gas) ต่อไปนี้อุณหภูมิที่จะกล่าวถึงในบทเรียนทั้งหมดจะอยู่ในสเกลแบบ Kelvin ซึ่งมีความสัมพันธ์กับสเกล Celsius ดังนี้
![]()
กฎข้อที่ 1 ของเทอร์โมไดนามิกส์
แนวคิดของกฎข้อที่หนึ่งนั้นเกี่ยวข้องโดยตรงกับ กฎของการอนุรักษ์พลังงาน (conservation of energy) ซึ่งกล่าวว่า “ในกระบวนการเปลี่ยนแปลงต่างๆ นั้น พลังงานจะไม่ถูกสร้างขึ้นมาใหม่และไม่มีการสูญหายไป แต่สามารถเปลี่ยนไปอยู่ในรูปอื่นได้” กฎข้อหนึ่งจะบ่งบอกถึงการเปลี่ยนแปลงพลังงานที่เกิดขึ้นภายในระบบต่างๆ เมื่อมีการเปลี่ยนแปลงทั้งทางเคมีและทางกายภาพ
ในการอธิบายกฎข้อนี้ก็จะมีการกำหนดตัวแปรอีกหลายชนิดขึ้นมา ซึ่งได้แก่ พลังงานภายใน (Internal Energy, U), ความร้อน (Heat, q), งาน (Work, w), เอนทาลปี (Enthalpy, H) รวมทั้งความจุความร้อน (Heat Capacity, C) ซึ่งจะได้อธิบายโดยละเอียดในหน้าต่อไป
กฎข้อที่ 1 ของเทอร์โมไดนามิกส์ (1stLaw of Thermodynamics)
ก่อนอื่นเรามาทำความรู้จักกับเทอมพื้นฐานต่างๆที่มีความสำคัญในการทำความเข้าใจในเนื้อหาของกฎข้อนี้
สำหรับการศึกษาในหัวข้อนี้ เรากำหนดให้จักรวาลสามารถแบ่งออกได้เป็นสองส่วน1) ระบบ (system)คือ อะไรก็ได้ในจักรวาลนี้ ที่เราสนใจที่จะศึกษาทำความเข้าใจ ซึ่งอาจจะเป็นเครื่องยนต์, ปฏิกิริยาเคมี, เซลล์ของสิ่งมีชีวิต และอื่นๆ2)สิ่งแวดล้อม (surrounding)คือ บริเวณอื่นที่เราใช้ในการสังเกตการเปลี่ยนแปลงที่เกิดขึ้นภายในระบบ
โดยทั่วไประบบสามารถแบ่งออกได้เป็นดังนี้
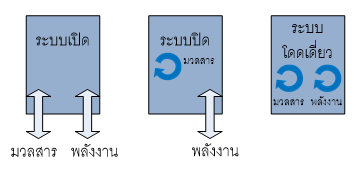
1)ระบบเปิด(open system) คือ ระบบที่สามารถเกิดการถ่ายเทมวลสาร เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้
2)ระบบปิด(closed system) คือ ระบบที่ไม่สามารถเกิดการถ่ายเทมวลสาร เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้(แต่อาจเกิดการถ่ายเทพลังงานได้)
3)ระบบโดดเดี่ยว(isolated system) คือ ระบบที่ไม่สามารถเกิดการถ่ายเทมวลสารและพลังงาน เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้
การศึกษาวิชาเทอร์โมไดนามิกส์ ส่วนใหญ่จะสนใจการเปลี่ยนแปลงพลังงานที่เกิดขึ้นเมื่อเกิดกระบวนการต่างๆ เช่น การหลอมเหลวของสสาร, การเกิดปฏิกิริยาเคมี และอื่นๆ สำหรับกระบวนการที่เกิดขึ้นแล้วมีการให้พลังงานกับสิ่งแวดล้อม เราเรียกว่ากระบวนการแบบคายความร้อน(exothermic process) ตัวอย่างของกระบวนการเปลี่ยนแปลงแบบนี้ก็ได้แก่ การเผาไหม้ต่างๆ ในทางตรงกันข้ามถ้ากระบวนการที่เกิดขึ้นแล้วมีการรับพลังงานจากสิ่งแวดล้อม เราเรียกว่ากระบวนการแบบดูดความร้อน(endothermic process) ซึ่งได้แก่ การหลอมเหลว, การระเหย ของสสาร
ตอนนี้เราพอจะรู้และคุ้นเคยกับเทอมต่างๆบ้างแล้ว งั้นเรามาเริ่มทำความรู้จักกับแนวคิดและหลักการเกี่ยวกับกฎข้อที่หนึ่งกันเลย
กฎข้อที่ 1 ของเทอร์โมไดนามิกส์
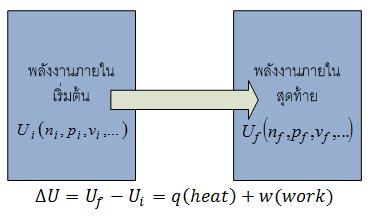
ในเทอร์โมไดนามิกส์นั้น เรากำหนดให้พลังงานทั้งหมดของระบบเรียกว่าพลังงานภายใน(Internal Energy,U) ซึ่งค่าของพลังงานภายในขึ้นอยู่กับค่าตัวแปรต่างๆ เช่น จำนวนโมล (n), ความดัน (p), ปริมาตร (v), อุณหภูมิ (T),... ซึ่งเราสามารถเขียนแทนด้วยเทอม U(n,p,v,..) ดังนั้นการเปลี่ยนแปลงพลังงานภายในจะเกิดขึ้นเมื่อมีการเปลี่ยนแปลงค่าของตัวแปรเหล่านี้ ดังแสดงในรูป

ตัวอย่างที่ 1
ลองมาพิจารณาให้ลึกลงไปในตัวอย่างของการขยายตัวแบบผันกลับได้ ของแก๊สสมบูรณ์แบบ (perfect gas ) ที่เกิดขึ้นที่อุณหภูมิคงที (Isothermal reversible expansion) ว่าเราจะหาความสัมพันธ์ที่ชัดเจนกว่านี้ได้หรือเปล่า
จากสมการแสดงความสัมพันธ์ระหว่าง ความดัน (p), ปริมาตร (V), อุณหภูมิ (T), จำนวนโมล (n) ของแก๊สสมบูรณ์แบบ จะได้ว่า
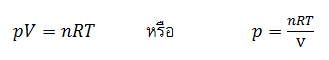
เมื่อนำค่า p ไปแทนลงในสมการที่ 3 แล้วจัดรูปใหม่ จะได้ดังนี้
![]()
ดังนั้นสมการนี้สามารถนำไปใช้ในการคำนวณหางานที่เกิดขึ้น เมื่อมีการขยายตัวของระบบที่มีแก๊สสมบูรณ์แบบบรรจุอยู่ภายใน และเกิดที่อุณหภูมิคงที่(ลองใช้สมการนี้คำนวณดูซิว่า แก๊ส 1 โมล เมื่อขยายตัวเป็น 2 เท่า ที่ 298 K จะเกิด งานเท่าใด?)

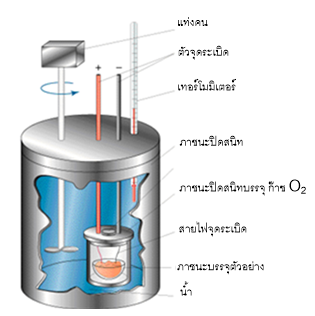
ผนังรอบนอกสุดเป็นฉนวนที่ไม่ยอมให้ความร้อนผ่านได้ ในขณะที่ผนังด้านในนำความร้อนได้เป็นอย่างดี หลักการทำงานอย่างง่ายมีดังนี้ สารตัวอย่างที่อยู่ภายในบรรยากาศอิ่มตัวของ ออกซิเจน ถูกเผาโดยการจุดระเบิดจากวงจรไฟฟ้าภายนอก พลังงานที่เกิดขึ้นจะถูกถ่ายเทสู่น้ำที่บรรจุอยู่รอบนอก ทำให้อุณหภูมิของน้ำเพิ่มขึ้น ซึ่งเราสามารถวัดได้โดยใช้เทอร์โมมิเตอร์ ซึ่งทำให้เราสามารถวัดพลังงานทั้งหมดที่เกิดขึ้นได้

ถึงตรงนี้จะเห็นว่าเราได้นำเทอมใหม่เข้ามาใช้อีก 1 เทอม คือ ค่านี้มีความสำคัญมากในการหาความร้อนของกระบวนการต่างๆ และมีหลายชนิดดังจะกล่าวต่อไป ค่าของ โดยทั่วไปแล้วจะ เรียกว่าค่าความจุความร้อนเราลองมาดูกันซิว่าค่านี้มีอะไรบ้างและหาได้อย่างไร
ความจุความร้อน(Heat Capacity)

ตัวห้อย V บ่งบอกว่าปริมาตรคงที่ในกระบวนการนี้ ถ้าการเปลี่ยนแปลงนี้เกิดขึ้นทีละน้อยๆ เราสามารถเขียนสมการที่ 2 ในรูปของ partial differential ได้ดังนี้

จากสมการที่1, 2เราสามารถหาการเปลี่ยนแปลงพลังงานภายใน หรือความร้อนของระบบจากการเปลี่ยนแปลงอุณหภูมิได้ (ถ้าเรารู้ค่าความจุความร้อนของระบบนั้น)
![]()
สมการที่ 5 นี้ เป็นสมการที่สำคัญมาก ที่ใช้ในการหาค่าความร้อนของกระบวนการต่างๆ ที่เกิดขึ้นรวมทั้งปฏิกิริยาเคมีต่างๆด้วย แต่ว่าจะใช้สมการนี้ได้ต้องมีข้อแม้ว่า กระบวนการที่เกิดขึ้นเกิดที่ปริมาตรคงที่ (เงื่อนไขนี้ค่อนข้างสำคัญ!)

เอนทาลปี (Enthalpy, H)
จริงๆ แล้วเราต้องทำการ derive สมการต่างๆ หลายสมการ ก่อนที่เราจะได้สมการที่เป็นนิยามของ เอนทาลปี แต่ว่าเพื่อเป็นการลดความยุ่งยาก จึงจะไม่ทำการแสดงที่มาของสมการอย่างละเอียด จะแสดงเฉพาะที่จำเป็นเท่านั้น สิ่งที่ต้องจำตอนนี้คือเอนทาลปี เป็นพลังงานอีกรูปหนึ่งที่แตกต่างจากพลังงานภายใน ความสัมพันธ์ระหว่างพลังงานภายในกับเอนทาลปี มีดังนี้


นั่นคือเราจะได้ว่าสำหรับกระบวนการต่างๆ ที่เกิดขึ้นโดยที่ความดันของระบบไม่มีการเปลี่ยนแปลงการเพิ่มขึ้นของเอนทาลปีของระบบจะมีค่าเท่ากับความร้อนที่ให้เข้าไปเพื่อเป็นการเปรียบเทียบให้ชัดเจน จะยกสมการแสดงการเปลี่ยนแปลงพลังงานภายในมาไว้ตรงนี้
![]()
นั่นคือเราจะได้ว่า สำหรับกระบวนการต่างๆ ที่เกิดขึ้นโดยที่ปริมาตรของระบบไม่มีการเปลี่ยนแปลง การเพิ่มขึ้นของพลังงานภายในของระบบจะมีค่าเท่ากับความร้อนที่ให้เข้าไป
ค่าการเปลี่ยนแปลง เอนทาลปี โดยปกติแล้วจะวัดง่ายกว่า ค่าการเปลี่ยนแปลงพลังงานภายในมาก เพราะว่าการควบคุมให้ความดันของระบบคงที่นั้นทำได้ง่ายกว่าการควบคุมปริมาตร เพราะว่าสามารถทำได้ด้วยการปล่อยให้กระบวนการที่เกิดขึ้นเกิดที่ความดันบรรยากาศ ยกตัวอย่างเช่น การหลอมเหลว, การกลายเป็นไอ, การเกิดปฏิกิริยาเคมีต่างๆ ซึ่งโดยทั่วไปเราจะสังเกตุกระบวนการเหล่านี้ที่ความดันคงที่ของ 1 บรรยากาศ แต่ว่าการจะควบคุมให้ปริมาตรคงที่นั้นต้องอาศัยเครื่องมือพิเศษ เช่น Bomb Calorimeter ดังที่กล่าวมาแล้วดังนั้นค่าความร้อนที่ต้องใช้ในกระบวนการเหล่านี้ จึงสอดคล้องกับการเปลี่ยนแปลงของ เอนทาลปี

หรือสามารถเขียนในรูปของpartial differentialได้ดังนี้








เอนทาลปีของการเกิดพันธะและการสลายพันธะ
ค่าเอนทาลปีนี้ค่อนข้างมีความสำคัญมากในการคำนวณการเปลี่ยนแปลงเอนทาลปีของปฏิกิริยาเคมีต่างๆ

จะสังเกตุเห็นว่า ค่าเอนทาลปีของการสลายพันธะ มีค่าเป็นบวก นั่นคือต้องเกิดการดูดความร้อนจากสิ่งแวดล้อม สำหรับเอนทาลปีของการเกิดพันธะ (bond formation enthalpy) จะมีลักษณะตรงกันข้ามกับการสลายพันธะ คือ

ตัวอย่างที่1
จงใช้ค่าพลังงานพันธะเฉลี่ยในการคำนวณหาค่าการเปลี่ยนแปลงของเอนทาลปีสำหรับการเกิดปฏิกิริยานี้
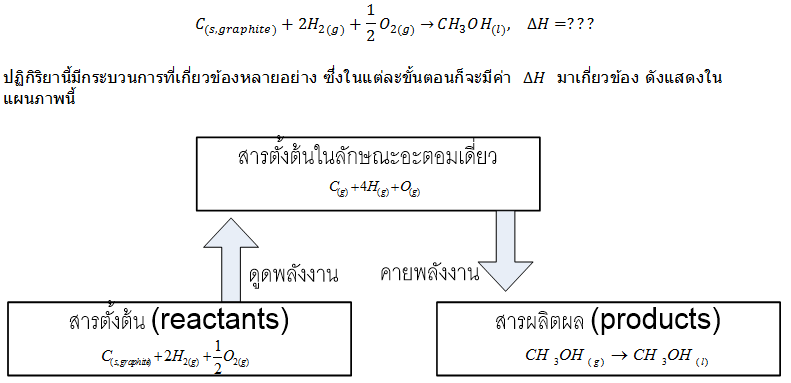



Hess' Law
กฎของเฮสส์ เป็นการประยุกต์ใช้ของกฎข้อหนึ่งของเทอร์โมไดนามิกส์ ที่มีความสำคัญมากในการคำนวณหาการเปลี่ยนแปลงเอนทาลปีของปฏิกิริยาหนึ่งๆ โดยการนำการเปลี่ยนแปลงเอนทาลปีของปฏิกิริยาย่อยๆมารวมกัน ลองพิจารณาดูตัวอย่างนี้ เพื่อที่จะทำให้เข้าใจการนำไปใช้มากขึ้น
ตัวอย่าง การใช้Hess' Law
กำหนดปฏิกิริยาเหล่านี้ให้
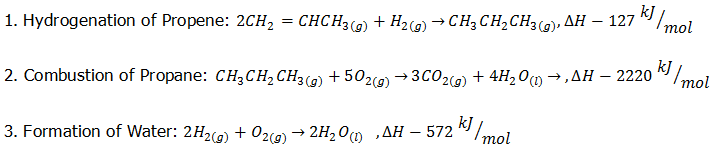
จงหาค่า การเปลี่ยนแปลงเอนทาลปีสำหรับปฏิกิริยา Combustion of Propene
วิธีคิด

ลองพิจารณาสมการที่ 1 และ 2 จะเห็นว่าเมื่อนำทั้งสองข้างของสมการมารวมกัน จะได้ดังนี้ (สารที่มีสีแดง หมายความว่า มีเหมือนกันทั้งสองข้างของสมการซึ่งทำให้หักล้างกันได้)

ในการย้ายข้างของสมการนั้น เราต้องทำการเปลี่ยนเครื่องหมายของค่าDHแล้วการหารสมการเราก็ต้องหารค่าDHด้วย จากนั้นก็นำสมการที่ได้มารวมกับสมการที่ได้จากการรวมสองสมการแรก ซึ่งจะทำให้ได้สมการนี้
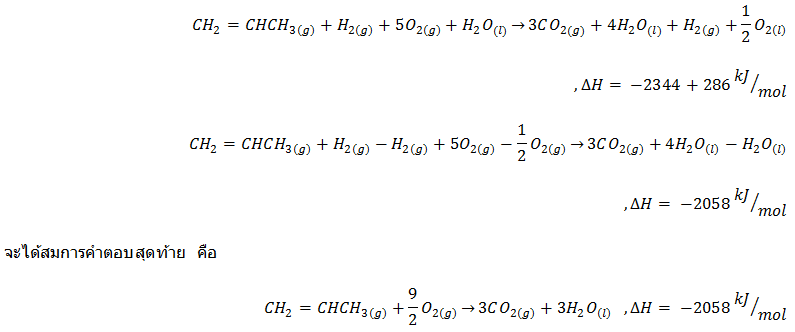

ถึงตรงนี้ถือว่าเราได้รียนรู้เกี่ยวกฎข้อ1และการนำไปใช้พอสมควร ต่อไปเรามาดูกฎข้อที่2ของเทอร์โมไดนามิกส์
กฎข้อที่ 2 ของเทอร์โมไดนามิกส์
กฎข้อที่ 2 อธิบายเกี่ยวกับตัวแปรที่เป็นตัวกำหนดทิศทางของการเกิดกระบวนการต่างๆไม่ว่าจะเป็นทางกายภาพหรือทางเคมี (driving force of physical and chemical change) ซึ่งตัวแปรที่สำคัญเกี่ยวกับการกำหนดทิศทางของการเกิดกระบวนการต่างๆ คือเอนโทรปี(Entropy, S)ในส่วนนี้ของบทเรียนก็จะกล่าวถึงนิยามของตัวแปรตัวนี้ และวิธีการคำนวณที่เกี่ยวข้อง
กฎข้อที่ 1 อธิบายเกี่ยวกับการเปลี่ยนแปลงพลังงานของระบบเมื่อเกิดกระบวนการต่างๆ ในกฎข้อที่ 2 นั้นจะอธิบายเกี่ยวกับตัวแปรที่เป็นตัวกำหนดทิศทางของการเกิดกระบวนการต่างๆไม่ว่าจะเป็นทางกายภาพหรือทางเคมี (driving force of physical and chemical change) ซึ่งตัวแปรที่สำคัญเกี่ยวกับการกำหนดทิศทางของการเกิดกระบวนการต่างๆ คือเอนโทรปี(entropy, S)ในส่วนนี้ของบทเรียนก็จะกล่าวถึงตัวแปรตัวนี้ และวิธีการคำนวณที่เกี่ยวข้อง
หลายๆกระบวนการในธรรมชาติสามารถเกิดขึ้นได้เองโดยที่ไม่ต้องไปทำอะไรกับระบบเลย ในขณะที่บางกระบวนการไม่สามารถเกิดขึ้นได้เอง กระบวนการที่เกิดขึ้นได้เองจะเรียกว่าspontaneous change หรือ natural changeตัวอย่างของกระบวนการเหล่านี้ได้แก่ การขยายตัวของแก๊สจากปริมาตรน้อยไปสู่ปริมาตรมากขึ้น, การเย็นตัวลงของวัตถุร้อนไปสู่อุณหภูมิของสิ่งแวดล้อม หรือ การเกิดปฏิกิริยาบางชนิดที่สามารถเกิดได้ในทิศทางเดียว เราสามารถทำให้แก๊สมีปริมาตรลดลงได้, ทำให้ปฏิกิริยาเกิดในทิศทางตรงข้ามได้ แต่ว่าการที่จะทำได้ต้องอาศัยการทำงานเข้ามาช่วยให้เกิดขึ้น นั่นคือ ไม่ใช่กระบวนการที่เกิดขึ้นเองโดยธรรมชาติ
การขยายตัวของแก็สให้เต็มปริมาตรของภาชนะที่บรรจุเป็นกระบวนการที่เกิดขึ้นได้เอง (spontaneous process or natural process)
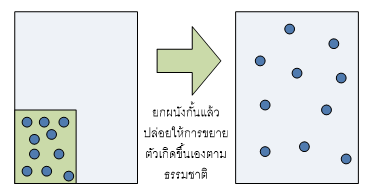
“การเกิดกระบวนการนี้ทำให้ระบบเกิดความไม่เป็นระเบียบมากขึ้น”
จากการสังเกตุพิจารณากระบวนการที่เกิดขึ้นเองได้ในหลายๆแง่มุมพบว่า "กระบวนการที่เกิดขึ้นได้เองจะเกิดขึ้นได้เมื่อการเปลี่ยนแปลงนั้นทำให้ระบบมีความไม่เป็นระเบียบมากขึ้น"ซึ่งความไม่เป็นระเบียบที่ว่านี้หมายความรวมถึง การเกิดการกระจายตัว (dispersal) ของวัตถุ,สสาร, อะตอม,โมเลกุล หรือแม้แต่ การกระจายตัวของพลังงาน
เราจะเริ่มจากการนิยามตัวแปรทางเทอร์โมไดนามิกส์ที่จะเป็นตัวบ่งบอกทิศทางของการเกิด spontaneous change หรือในอีกแง่หนึ่งคือ ตัวแปรที่บ่งบอกถึงความไม่เป็นระเบียบของระบบ ซึ่งตัวแปรนี้ คือเอนโทรปี, Sนั่นเอง ดังนั้นเราสามารถเขียนกฏข้อ 2 ได้ว่า

กระบวนการที่ผันกลับไม่ได้ (irreversible process) เป็นกระบวนการที่เกิดขึ้นได้เอง(เพราะเกิดกระบวนการไปข้างหน้าได้อย่างเดียว) ดังนั้นการเกิดกระบวนการที่ผันกลับไม่ได้จะทำให้ เอนโทรปี ของระบบเพิ่มขึ้น ในทางตรงข้าม สำหรับกระบวนการที่ผันกลับได้ (reversible process) ระบบอยู่ในสภาวะสมดุลกับสิ่งแวดล้อมตลอดเวลาขณะเกิดการเปลี่ยนแปลง ดังนั้นในกระบวนการเหล่านี้จะไม่ทำให้เอนโทรปีเพิ่มขึ้น (เพราะว่ากระบวนการสามารถเกิดขึ้นในทิศทางไปข้างหน้าและย้อนกลับได้ตลอดเวลา) แต่ว่าการเกิดกระบวนการที่ผันกลับได้อาจทำให้ เกิดการโยกย้าย (transfer) ของเอนโทรปีจากส่วนหนึ่งของระบบโดดเดี่ยวไปสู่อีกส่วนหนึ่งของระบบได้
จริงๆแล้วต้องมีการแก้สมการหลายขั้นตอนเพื่อให้ได้ความสัมพันธ์ของเอนโทรปีกับตัวแปรอื่นทางเทอร์โมไดนามิกส์ ที่ได้นิยามในกฎข้อที่ 1 แต่ในที่นี้จะยกความสัมพันธ์นั้นมาใช้เลย เพื่อลดความยุ่งยากของเนื้อหา
นิยามของเอนโทรปี
![]()

(อย่าสับสนตรงนี้กับย่อหน้าก่อนหน้านี้ เพราะว่าตรงนี้พูดถึงเฉพาะ เอนโทรปีของระบบที่สนใจเท่านั้น ซึ่งบรรจุอยู่ภายในระบบโดดเดี่ยว การเปลี่ยนแปลงเอนโทรปีของระบบโดดเดี่ยวยังคงมีค่าเท่ากับศูนย์สำหรับกระบวนการเปลี่ยนแปลงที่ผันกลับได้)
![]()
ตัวอย่างที่1:การขยายตัวของแก๊สที่อุณหภูมิคงที่
ลองมาดูตัวอย่างการเกิดการขยายตัวของแก๊สสมบูรณ์แบบ โดยเกิดที่อุณหภูมิคงที่(isothermal expansion of perfect gas)ว่าจะสอดคล้องกับการเปลี่ยนแปลงเอนโทรปีอย่างไร (การเปลี่ยนแปลงนี้สอดคล้องกับรูปแรก ที่ยกมาเป็นตัวอย่างของการขยายตัวของแก๊ส)
จากสมการที่2จะได้ว่าที่อุณหภูมิคงที่

จะเห็นว่าค่าเอนโทรปีเพิ่มขึ้นเมื่อแก๊สขยายตัว ซึ่งสอดคล้องกับการเพิ่มขึ้นของความไม่เป็นระเบียบของระบบ
การderiveสมการในลักษณะเดียวกันสำหรับการเปลี่ยนแปลงเอนโทรปีของแก๊สสมบูรณ์แบบ ที่เกิดการเปลี่ยนแปลงความดันของระบบจากpiไปเป็นpfจะได้ความสัมพันธ์นี้ (ให้นักศึกษาที่สนใจลองทำการderiveสมการดูเอง)
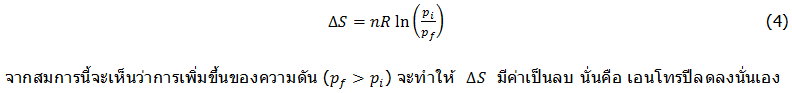
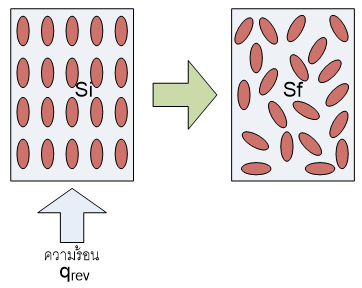
ตัวอย่างที่2:การเปลี่ยนสถานะ
กระบวนการเปลี่ยนแปลงที่ผันกลับได้ที่ค่อนข้างจะคุ้นเคยอย่างหนึ่งคือ การเปลี่ยนแปลงสถานะ(phase transition)ของสสาร ซึ่งการเปลี่ยนแปลงประเภทนี้จะเกิดขึ้นที่อุณหภูมิคงที่ค่าหนึ่ง และมีการเปลี่ยนแปลงเอนโทรปีค่อนข้างมาก

การเปลี่ยนแปลงเอนโทรปีสำหรับกระบวนการที่ผันกลับไม่ได้(irreversible process)
สำหรับสมการของการเปลี่ยนแปลงเอนโทรปีของกระบวนการที่ผันกลับไม่ได้ จะแตกต่างจากของกระบวนการที่ผันกลับได้เล็กน้อย ดังแสดงในสมการนี้
![]()
โดยที่qคือ ความร้อนที่ให้เข้าไปในระบบ เครื่องหมายมากกว่าใช้สำหรับกระบวนที่ผันกลับไม่ได้ ในขณะที่เครื่องหมายเท่ากับจะใช้สำหรับกระบวนการที่ผันกลับได้ ดังที่ได้กล่าวมาแล้วก่อนหน้านี้สมการนี้สามารถใช้สำหรับกระบวนการที่เกิดขึ้นเองได้ด้วย
ถึงตรงนี้เราพอจะรู้เกี่ยวกับกฎข้อที่ 2 แล้วคือ อะไร และมีสมการที่สำคัญอะไรบ้างที่เกี่ยวข้อง ต่อไปเราจะมาดูกฎข้อที่3ว่าคืออะไรและมีความสำคัญอย่างไร
กฎข้อที่ 3 ของเทอร์โมไดนามิกส์
ในการที่จะหาค่าเอนโทรปีของระบบที่อุณหภูมิใดๆนั้นจำเป็นต้องอาศัย กฎข้อที่ 3 ซึ่งนิยามเอนโทรปีของระบบที่ ศูนย์องศาเคลวิน ดังนี้ "ค่าเอนโทรปีของระบบผลึกที่สมบูรณ์แบบที่อุณหภูมิศูนย์องศาเคลวินจะมีค่าเป็น ศูนย์"
ในกฎข้อที่ 2 ได้กล่าวถึงการเปลี่ยนแปลงเอนโทรปีเมื่อเกิดกระบวนการต่างๆ แต่ว่าค่าที่คำนวณได้จากกฎข้อที่ 2 นั้นเป็นเพียงค่าการเปลี่ยนแปลงเอนโทรปี(DS)เท่านั้นในการที่จะหาค่าเอนโทรปีของระบบที่อุณหภูมิใดๆนั้นจำเป็นต้องอาศัยกฎข้อที่3ซึ่งนิยามเอนโทรปีของระบบที่ ศูนย์องศาเคลวิน ดังนี้
"ที่อุณหภูมิ 0 K อะตอมที่อยู่ในผลึกที่สมบูรณ์แบบ(perfect crystal)จะไม่เกิดการเคลื่อนที่ (เนื่องจากไม่มีพลังงานความร้อน) ดังนั้นอะตอมเหล่านี้จะจัดเรียงอยู่อย่างเป็นระเบียบที่สุด นั่นคือ จัดเรียงตัวได้เพียงแบบเดียวเท่านั้นหรือ จะกล่าวได้ว่า ระบบไม่มีความไม่เป็นระเบียบเหลืออยู่เลย เพราะฉะนั้นค่าเอนโทรปีของระบบผลึกที่สมบูรณ์แบบที่อุณหภูมิศูนย์องศาเคลวินจะมีค่าเป็น ศูนย์" นั่นคือ
![]()
จากกฎข้อ 3 นี้ทำให้สามารถคำนวณค่าเอนโทรปีของสสารหรือโมเลกุลที่อุณหภูมิต่างๆ ได้ โดยการอินติเกรตค่าเอนโทรปีที่อุณหภูมิเริ่มจาก 0 K จนถึงอุณหภูมิที่ต้องการ ในที่นี้จะไม่กล่าวถึงวิธีการหาค่าเอนโทรปีนี้ เพราะค่อนข้างจะยุ่งยากและต้องอธิบายตัวแปรอีกหลายชนิดที่เกี่ยวข้องกับการคำนวณ
ในหนังสือ เคมีเชิงฟิสิกส์ ทั่วไปจะบันทึกค่าเอนโทรปีของสารแต่ละชนิดไว้ที่อุณหภูมิต่างๆ ในตารางนี้แสดงตัวอย่างค่า เอนโทรปี ที่ 298 K ของสารประกอบบางชนิด
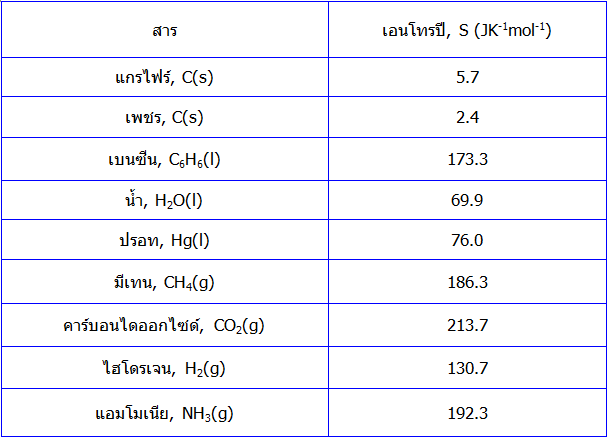
จะสังเกตได้ว่าโดยทั่วไปแล้วค่าเอนโทรปีของแก๊สจะมากกว่าค่าเอนโทรปีของของเหลว ส่วนค่าเอนโทรปีของของแข็งจะมีค่าน้อยที่สุดค่าเอนโทรปีเหล่านี้สามารถนำไปหาค่าการเปลี่ยนแปลง เอนโทรปีของการเกิดปฏิกิริยาทางเคมีต่างๆ ได้ ในลักษณะเดียวกันกับการคำนวณการเปลี่ยนแปลงเอนทาลปีของปฏิกิริยาดังที่ได้กล่าวมาแล้วในกฎข้อที่ 1
ลองพิจาณาการเกิดปฏิกิริยาเคมีทั่วๆไป (A, B, C, D แทนอะตอม หรือ โมเลกุล)
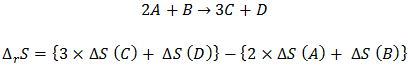
นั่นคือ การนำเอาค่าเอนโทรปีต่อโมลที่สภาวะมาตรฐานมาทำการบวกลบกันให้สอดคล้องกับสมการเคมี



