ทำไมขั้วไฟฟ้าในเชิงเคมีจึงต่างกับขั้วไฟฟ้าในเชิงฟิสิกส์
น้อง ๆ ที่เรียนสายวิทยาศาสตร์หรือน้อง ๆ ที่กำลังเตรียมตัวเข้ามหาวิทยาลัยอาจเคยได้ยินหรือได้เรียนในเรื่องไฟฟ้าเคมีกันมาบ้างแล้ว แต่น้อง ๆ ทราบหรือไม่ว่าคุณครูเคยบอกว่าขั้วไฟฟ้าในทางเคมีกับฟิสิกส์นั้นแตกต่างกัน เหตุใดจึงมีความแตกต่างเล่า เคยสงสัยกันหรือไม่ วันนี้ผู้เขียนนำเอาเกร็ดความรู้เกี่ยวกับไฟฟ้าเคมีมาฝากค่ะ ซึ่งความรู้ที่เราจะได้เรียนรู้กันนั้นผู้เขียนได้อ่านเจอข้อมูลดีๆ จากค่ายการศึกษาค่ายหนึ่งเลยอยากนำมาฝากให้ได้อ่านกัน เราจะมาคลายข้อสงสัยกันว่าทำไมขั้วไฟฟ้าในเชิงเคมีและฟิสิกส์จึงมีความแตกต่างกัน ตามไปศึกษาข้อมูลกันได้เลย
ภาพที่ 1 เซลล์กัลวานิก
ที่มา https://pixabay.com, Clker-Free-Vector-Images
เซลล์ไฟฟ้าเคมีคืออะไร?
เซลล์ไฟฟ้าเคมี (Electrochemical cell) คือ เครื่องมือหรืออุปกรณ์ทางเคมีที่เกิดจากการเปลี่ยนแปลงพลังงานเคมีเป็นพลังงานไฟฟ้า หรือไฟฟ้าเป็นเคมี เซลล์ไฟฟ้าเคมีแบ่งออกเป็น 2 ประเภทคือ เซลล์กัลวานิก และ เซลล์อิเล็กโทรไลต์ ซึ่งในวันนี้เราจะกล่าวถึงเซลล์กัลวานิกกันนะคะ
เซลล์กัลวานิก คือ เป็นเซลล์ไฟฟ้าเคมีที่เกิดปฏิกิริยาเคมีแล้วให้กระแสไฟฟ้า ตัวอย่างเช่น เซลล์ไฟฟ้าเคมี ถ่านไฟฉาย แบตเตอรี่รถยนต์ และเซลล์เชื้อเพลิงที่มนุษย์อวกาศใช้ในการเดินทางไปสำรวจดวงจันทร์ (ต้องเกิดปฏิกิริยาเคมีก่อน จึงจะได้กระแสไฟฟ้าออกมา)
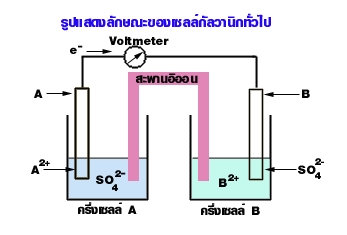
ภาพที่ 2 ลักษณะทั่วไปของเซลล์กัลวานิก
ที่มา https://web.ku.ac.th › snet5 › topic9 › galvanic
จากรูปพบว่าเข็มของโวลต์มิเตอร์เบนจาก A ไปยัง B แสดงว่าอิเล็กตรอนไหลจาก A ไปยัง B เราต้องการทราบสิ่งต่อไปนี้
- ขั้วบวกและขั้วลบ
ขั้วบวก คือ ขั้วที่มีอิเล็กตรอนหนาแน่นน้อยกว่า หรือขั้ว e ไหลเข้า ได้แก่ ขั้ว B
ขั้วลบ คือ ขั้วที่มีอิเล็กตรอนหนาแน่นมากกว่า หรือขั้ว e ไหลออก ได้แก่ ขั้ว A
- ขั้วแอโนด (Anode) และขั้วแคโทด (Cathode)
แอโนด คือขั้วที่เกิดปฏิกิริยาออกซิเดชัน ได้แก่ ขั้ว A เพราะให้ e
แคโทด คือขั้วที่เกิดปฏิกิริยารีดักชัน ได้แก่ ขั้ว B เพราะรับ e
- แผนภาพเซลล์กัลวานิก เขียนได้ดังนี้
เขียนครึ่งเซลล์แอโนดไว้ทางซ้าย ครึ่งเซลล์แคโทดไว้ทางขวา คั่นกลางด้วยสะพานอิออน ซึ่งใช้เครื่องหมาย || หรือ // สำหรับครึ่งเซลล์แอโนดและแคโทดเขียนอิเล็กโทรดไว้ซ้ายสุดและขวาสุด ภายในครึ่งเซลล์ ถ้าต่างวัฏภาคกันใช้เครื่องหมาย / คั่น
หมายเหตุ สารละลายที่ทราบความเข้มข้นให้เขียนระบุไว้ในวงเล็บ และถ้าครึ่งเซลล์ที่เป็นก๊าซให้ระบุความดันลงในวงเล็บด้วย
ตัวอย่าง การเขียนแผนภาพเซลล์ไฟฟ้าเคมี ซึ่งสามารถเขียนได้ดังนี้
A | A2+(aq) || B2+(aq) | B หรือ A | A2+ || B2+ | B
จากเกร็ดความรู้เรื่องเซลล์กัลวานิกในเชิงเคมีดังที่ได้กล่าวมาแล้วข้างต้นนั้น พบว่า
“ขั้วบวก เรียกว่า แคโทด เป็นขั้วที่เกิดปฏิกิริยารีดักชัน หรือขั้วที่อิเล็กตรอนไหลเข้าหา ขั้วลบ เรียกว่า แอโนด เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน หรือขั้วที่อิเล็กตรอนไหลออก”
หากเราลองมามองในมุมการไหลของกระแสไฟฟ้าในเชิงฟิสิกส์ล่ะ ขั้วไฟฟ้าใดเป็นแอโนด ขั้วไฟฟ้าใดเป็นแคโทด ลองตามไปศึกษาความเหมือนความต่างกันดีกว่าค่ะ
ขั้วไฟฟ้าในเชิงฟิสิกส์จะเกี่ยวข้องกับอุปกรณ์อิเล็กทรอนิกส์ชนิดหนึ่งที่เรียกว่า ไดโอด ซึ่งไดโอดเป็นอุปกรณ์อิเล็กทรอนิกส์ที่ทำจากสารกึ่งตัวนำ ช่วยควบคุมให้กระแสไฟฟ้าจากภายนอกไหลผ่านได้ทิศทางเดียว และป้องกันกระแสไฟฟ้าไหลย้อนกลับ จากอุปกรณ์ประเภทขดลวดต่าง ๆ ไดโอดประกอบด้วยขั้ว 2 ขั้ว คือ แอโนด (Anode : A) ต้องต่อกับถ่านไฟฉายขั้วบวก (+) และแคโทด (Cathode : K) ต้องต่อกับถ่านไฟฉายขั้วลบ (-) การต่อไดโอดเข้ากับวงจรต้องต่อให้ถูกขั้ว ถ้าต่อผิดขั้วไดโอดจะไม่ยอมให้กระแสไฟฟ้าไหลผ่าน ทำให้เครื่องใช้ไฟฟ้าทำงานในวงจรไม่ได้ซึ่งสัญลักษณ์ของไดโอดในวงจรไฟฟ้า เป็น
ไดโอดบางชนิดเมื่อมีกระแสไฟฟ้าไหลผ่านจะให้แสงสว่างออกมา เราเรียกว่า ไดโอดเปล่งแสง หรือ แอลอีดี (LED) ซึ่งย่อมาจาก Light Emitting Diode และมีสัญลักษณ์ในวงจรเป็น
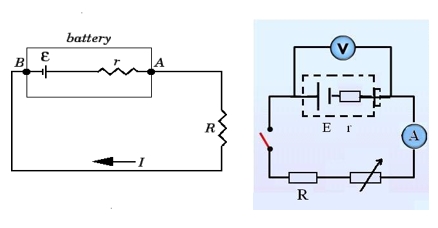
ภาพที่ 3 แสดงวงจรการไหลของกระแสไฟฟ้าในแบตเตอรี่
ที่มา https://voer.edu.vn/c/electromotive-force-terminal-voltage/
จากภาพจะเห็นได้ว่าวงจรไฟฟ้าในเชิงฟิสิกส์นั้น เมื่อต่อวงจรให้ครบถ้วนสมบูรณ์พร้อมใช้งานแล้วเมื่อปล่อยกระแสไฟฟ้าเข้าไฟในวงจรทำให้เกิดการทำงานครบวงจร จะพบว่ากระแสไฟฟ้าจะไหลจากขั้วบวกไปหาขั้วลบ ซึ่งทำให้เราพบอีกว่ากระแสไฟฟ้าไหลจาก A ไปหา B ทำให้เราทราบว่า A คือ ขั้วแอโนด หรือ ขั้วบวก และ B คือ ขั้วแคโทด หรือ ขั้วลบ นั่นเอง
โดยสรุปจากเกร็ดความรู้วงจรไฟฟ้าอิเล็กทรอนิกส์ ในเชิงฟิสิกส์เกี่ยวกับการทำงานของไดโอด ทำให้ทราบว่า “ ขั้วบวก เรียกว่า แอโนด เป็นขั้วที่กระแสไฟฟ้า (I) ไหลออก ขั้วลบ เรียกว่า แคโทด เป็นขั้วที่กระแสไฟฟ้า (I) ไหลเข้าหา ”
***หลักการทำงานของขั้วไฟฟ้าในเชิงฟิสิกส์จะเหมือนกันกับเซลล์อิเล็กโทรไลต์ ในไฟฟ้าเคมี
ที่จะได้กล่าวในครั้งต่อไปค่ะ***
แหล่งที่มา
บทเรียนออนไลน์. เซลล์ไฟฟ้าเคมี: เซลล์กัลวานิก และ เซลล์อิเล็กโทรไลต์. สืบค้นเมื่อ 20 ตุลาคม 2562. จาก https://www.scimath.org/lesson-chemistry/item/
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือแบบเรียนเคมีเพิ่มเติม เล่ม 4 ฉบับปรับปรุง พ.ศ. 2560. เซลล์ไฟฟ้าเคมี ศูนย์หนังสือจุฬาลงกรณ์มหาวิทยาลัย: กรุงเทพฯ
เอกสารประกอบคำบรรยาย วิชาเคมี ของโครงการส่งเสริมความสามารถพิเศษภาคฤดูร้อน Brands's Summer Camp มหาวิทยาลัยเกษตรศาสตร์ สืบค้นเมื่อ 20 ตุลาคม 2562. จาก https://web.ku.ac.th/schoolnet/snet5/topic9/galvanic.html/
อิเล็กทรอนิกส์เบื้องต้น: การต่อวงจรอิเล็กทรอนิกส์/ ไดโอด. สืบค้นเมื่อ 20 ตุลาคม 2562. จาก http://www.rmutphysics.com/
-
คำที่เกี่ยวข้อง



