เซลล์อิเลคโทรไลต์กับแบตเตอรี่รถยนต์เกี่ยวกันอย่างไรนะ
วันนี้ผู้เขียนนำเอาเกร็ดความรู้เกี่ยวกับไฟฟ้าเคมีมาฝาก ซึ่งเราจะคลายข้อสงสัยเกี่ยวกับขั้วไฟฟ้าในเซลล์อิเล็กโทรไลต์ในเชิงเคมี ว่ามีความเหมือนหรือต่างกับขั้วไฟฟ้าในเชิงฟิสิกส์กันต่อ (ก่อนอ่านบทความนี้แนะนำให้กลับไปอ่านบทความเรื่อง "ทำไมขั้วไฟฟ้าในเชิงเคมีจึงต่างกับขั้วไฟฟ้าในเชิงฟิสิกส์" ทำไมขั้วไฟฟ้าในเชิงเคมีจึงต่างกับขั้วไฟฟ้าในเชิงฟิสิกส์" กันก่อน )

ภาพที่ 1 การประจุไฟในรถยนต์ไฟฟ้า
ที่มา https://pixabay.com , MikesPhotos
เซลล์อิเล็กโทรไลต์ (Electrolytic Cell) คือ เซลล์ไฟฟ้าเคมีที่เปลี่ยนพลังงานไฟฟ้าเป็นพลังงานเคมี เกิดจาก การผ่านกระแสไฟฟ้าเข้าไปในเซลล์ แล้วเกิดปฏิกิริยาเคมีขึ้น เช่น เซลล์แยกน้ำด้วยไฟฟ้า การชุบโลหะด้วยไฟฟ้า การใช้ปฏิกิริยาเคมีทำให้เกิดกระแสไฟฟ้าหรือการใช้กระแสไฟฟ้าทำให้เกิดการเปลี่ยนแปลงทางเคมีเกิดได้ในเซลล์ไฟฟ้าเคมี (Electrochemical Cell)
กระบวนการอิเล็กโทรไลซิส (Electrolysis) คือ กระบวนการผ่านกระแสไฟฟ้า (D.C.) จากภายนอกเข้าไปในสารละลายอิเล็กโทรไลต์ แล้วทำให้เกิดปฏิกิริยาเคมี ตัวอย่างเช่น อิเล็กโทรลิซึม และการชุบ (ขบวนการที่ผ่านกระแสไฟฟ้า ทำให้เกิดปฏิกิริยาเคมี)
เครื่องมือที่ใช้แยกสารละลายด้วยไฟฟ้าเรียกว่า เซลล์อิเล็กโทรไลต์ หรืออิเล็กโทรลิติกเซลล์ ประกอบด้วย ขั้วไฟฟ้า ภาชนะบรรจุสารละลายอิเล็กโทรไลต์ และเครื่องกำเนิดกระแสตรง (D.C) เช่น เซลล์ไฟฟ้า หรือ แบตเตอรี่
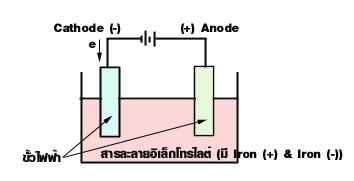
ภาพที่ 2 การทำงานของเซลล์อิเล็กโทรไลต์
ที่มา https://web.ku.ac.th/schoolnet/snet5/topic9/electrolite.html
ส่วนประกอบของเซลล์อิเล็กโทรไลต์
- ขั้วไฟฟ้า (Electrode) คือ แผ่นตัวนำที่จุ่มในสารละลายอิเล็กโทรไลต์ แล้วต่อกับเซลล์ไฟฟ้าหรือแบตเตอรี่ โดยทั่วไปมักจะใช้ขั้วเฉื่อย เช่น ขั้ว Pt ขั้วไฟฟ้าแบ่งเป็นแอโนด และ แคโทด
สารละลายอิเล็กโทรไลต์ คือสารละลายที่นำไฟฟ้าได้ เพราะมี ไอออนบวก (+) และ ไอออนลบ (-) รวมอยู่ในสารละลายเดียวกัน
ขั้วแอโนด (Anode) เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน ซึ่งเป็นขั้วบวก (+) ที่ต่อเข้ากับขั้วบวกของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
ขั้วแคโทด (Cathode) เป็นขั้วที่เกิดปฏิกิริยารีดักชัน ซึ่งเป็นขั้วลบ (-) ที่ต่อเข้ากับขั้วลบของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
- สำหรับไอออนบวก (+) จะวิ่งไปรับอิเล็กตรอนที่ขั้วลบ เกิดปฏิกิริยารีดักชันจึงเรียกขั้วลบว่า แคโทด และเรียกไอออนบวกว่า แคทไอออน (Cathion) ส่วนไอออนลบ (-) จะเป็นผู้ให้อิเล็กตรอน ที่ขั้วบวกเกิดปฏิกิริยาออกซิเดชันเรียกว่าแอโนด และเรียก ไอออนลบ (-) ว่า แอนไอออน (Anion)
ดังนั้น ที่ Anode มี Anion คือ ไอออนลบ และที่ Cathode มี Cathion คือ ไอออนบวก ส่วน Anode (Oxidation) ตรงกับขั้วบวก Cathode (Reduction) ตรงกับขั้วลบ
จากเกร็ดความรู้เรื่องเซลล์อิเล็กโทรไลต์ในเชิงเคมีดังที่ได้กล่าวมาแล้วข้างต้นนั้น พบว่า “ ขั้วบวก เรียกว่า แอโนด เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน หรือขั้วที่รับอิเล็กตรอน ขั้วลบ เรียกว่า แคโทด เป็นขั้วที่เกิดปฏิกิริยารีดักชัน หรือขั้วที่ให้อิเล็กตรอน ”

ตารางที่ 1 เปรียบเทียบสมบัติและการเกิดปฏิกิริยาของเซลล์กัลวานิกและเซลล์อิเล็กโทรไลต์
ตัวอย่างเซลล์อิเล็กโทรไลต์ที่เราจะเห็นได้เด่นชัดก็คือ แบตเตอรี่รถยนต์ น้องๆ ลองสังเกตดูนะคะว่า เวลาเราจะเปลี่ยนแบตเตอรี่รถยนต์แต่ละครั้งเราจะต้องประจุไฟฟ้าเข้าไปก่อนเพื่อให้ปฏิกิริยาเคมีในส่วนของแบตเตอรี่เกิดขึ้นจนเป็นกระแสไฟฟ้าหมุนเวียนในเครื่องยนต์ของเรา แต่.....เคยสงสัยไหมว่า ที่แท้จริงแล้ว แบตเตอรี่ที่อ่อนกำลังลงไป เราสามารถนำกลับมาประจุไฟฟ้าเข้าไป และนำกลับมาใช้ใหม่ได้อีกหรือไม่
แบตเตอรี่ (Battery) คือ อุปกรณ์ที่ทำหน้าที่จัดเก็บพลังงานเพื่อไว้ใช้ต่อไป ถือเป็นอุปกรณ์ที่สามารถแปลงพลังงานเคมี ให้เป็นไฟฟ้าได้โดยตรงด้วยการใช้เซลล์กัลวานิก (Galvanic Cell) ที่ประกอบด้วยขั้วบวกและขั้วลบ พร้อมกับสารละลาย อิเล็กโตรไลต์ (Electrolyte Solution) แบตเตอรี่อาจประกอบด้วย
เซลล์กัลวานิกเพียง 1 เซลล์ หรือมากกว่าก็ได้
ภาพที่ 3 สัญลักษณ์แบบอิเล็กทรอนิกส์สำหรับแบตเตอรี่ในแผนภาพวงจร
ที่มา https://wikipedia.com/wiki/แบตเตอรี่
แบตเตอรี่ชนิดตะกั่ว-กรด เป็นแบตเตอรี่ซึ่งใช้ในรถยนต์และรถมอเตอร์ไซค์ โดยมีปริมาณตะกั่วบรรจุไว้ตามกำหนด และมีกรดกำมะถันเป็นตัวช่วยในการเกิดปฏิกิริยาไฟฟ้าเคมี ส่วนใหญ่แบตเตอรี่ประเภทนี้สามารถนำมาอัดประจุไฟไหม้ได้ แต่เมื่อหมดอายุควรนำกากแบตเตอรี่ที่ใช้แล้วไปรีไซเคิลแบตเตอรี่มีส่วนประกอบดังนี้ เปลือกนอก ซึ่งทำด้วยพลาสติกหรือยางแข็ง ฝาครอบส่วนบนของแบตเตอรี่ ขั้วของแบตเตอรี่ สะพานไฟ แผ่นธาตุบวก และแผ่นธาตุลบ แผ่นกั้นซึ่งทำจากไฟเบอร์กลาส ที่เจาะรูพรุน
ในปัจจุบันแบตเตอรี่รถยนต์จะมีอยู่ 2 แบบคือ แบบที่ต้องคอยตรวจดูระดับน้ำกรดในแบตเตอรี่ กับแบบที่ไม่ต้องตรวจดูระดับน้ำกรดเลยตลอดอายุการใช้งาน แบตเตอรี่ใหม่ๆ ที่ยังไม่มีน้ำกรด ที่ฝาปิดจะมีกระดาษกาวปิดไว้เพื่อป้องกันความชื้นเข้าไปในแบตเตอรี่ ซึ่งจะทำให้แบตเตอรี่เสื่อมสภาพ เมื่อเติมน้ำกรดเข้าไปแล้วทำการประจุนำมาใช้งาน กระดาษกาวที่ปิดนี้จะต้องแกะออกให้หมด เพื่อไม่ให้แบตเตอรี่เกิดระเบิดขึ้นได้

ภาพที่ 4 เซลล์แบตเตอรี่รถยนต์
ที่มา https://www.pixabay.com/,Clker-Free-Vector-Images
สำหรับแบตเตอรี่ปฐมภูมิจะถูกใช้เพียงครั้งเดียวหรือ "ใช้แล้วทิ้ง" นั่นเอง ซึ่งวัสดุที่ใช้ทำขั้วไฟฟ้าจะมีการเปลี่ยนแปลงอย่างถาวรในช่วงปล่อยประจุออก ตัวอย่างที่พบบ่อยก็คือ แบตเตอรี่อัลคาไลน์ ที่ใช้สำหรับ ไฟฉาย และอีกหลายอุปกรณ์พกพา แบตเตอรี่ทุติยภูมิ (แบตเตอรี่ประจุใหม่ได้) สามารถดิสชาร์จและชาร์จใหม่ได้หลายครั้ง ในการนี้องค์ประกอบเดิมของขั้วไฟฟ้าสามารถเรียกคืนสภาพเดิมได้โดยกระแสย้อนกลับ ตัวอย่างเช่น แบตเตอรี่ตะกั่วกรด ที่ใช้ในยานพาหนะและแบตเตอรี่ ลิเธียมไอออน ที่ใช้สำหรับอุปกรณ์อิเล็กทรอนิกส์แบบเคลื่อนย้ายได้นั่นเอง
แหล่งที่มา
บทเรียนออนไลน์. เซลล์ไฟฟ้าเคมี: เซลล์กัลวานิก และ เซลล์อิเล็กโทรไลต์. สืบค้นเมื่อ 20 ตุลาคม 2562. จาก https://www.scimath.org/lesson-chemistry/item/
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือแบบเรียนเคมีเพิ่มเติม เล่ม 4 ฉบับปรับปรุง พ.ศ. 2560. เซลล์ไฟฟ้าเคมี ศูนย์หนังสือจุฬาลงกรณ์มหาวิทยาลัย: กรุงเทพฯ
เอกสารประกอบคำบรรยาย วิชาเคมี ของโครงการส่งเสริมความสามารถพิเศษภาคฤดูร้อน Brands's Summer Camp มหาวิทยาลัยเกษตรศาสตร์ . สืบค้นเมื่อ 20 ตุลาคม 2562. จาก https://web.ku.ac.th/schoolnet/snet5/topic9/galvanic.html/
อิเล็กทรอนิกส์เบื้องต้น: การต่อวงจรอิเล็กทรอนิกส์/ ไดโอด . สืบค้นเมื่อ 20 ตุลาคม 2562. จาก http://www.rmutphysics.com/
-
คำที่เกี่ยวข้อง



