แบตเตอรี่: ตอนที่ 1 อุปกรณ์พลังงานแห่งอนาคต
ในอนาคตอันใกล้ เราจะเข้าสู่ยุคที่สิ่งต่าง ๆ รอบตัวเราสามารถเชื่อมต่อและสื่อสารกันได้ หรือที่เรียกว่า "อินเทอร์เน็ตในทุกสรรพสิ่ง" หรือ Internet of Things (อดิศร เตือนตรานนท์, 2557) ซึ่งจะส่งผลให้การดำรงชีวิตของผู้คนมีความสะดวกสบายยิ่งขึ้นอีก ซึ่งอุปกรณ์พื้นฐานที่สำคัญของ "สรรพสิ่ง" อันขาดไม่ได้คือ "แบตเตอรี่" ที่ใช้กักเก็บและให้พลังงานเพื่อหล่อเลี้ยงอุปกรณ์และเครื่องใช้จำนวนหลายล้านชิ้นให้ทำงานได้ตามที่ต้องการ

รูปที่ 1 (ซ้ายมือ แผนภาพแสดงการเชื่อมโยงของสรรพสิ่ง ในยุค "อินเทอร์เน็ในทุกสรรพสิ่ง"
และ (ขวามือบน) การใช้แบตเตอรี่สำหรับจัดเก็บพลังงานทดแทน
และ (ขวามือล่าง) แบตเตอรี่ของรถไฟฟ้า Tesla Model S
ที่มา: Jack Wallen: http://www.energy.gov, http://insideevs.com/
นอกจากแบตเตอรี่จะมีความสำคัญในยุคอินเทอร์เน็ตในทุกสรรพสิ่งแล้ว ในอนาคตที่โลกต้องเผชิญปัญหาความต้องการด้านพลังงานและปัญหาสภาวะโลกร้อน แบตเตอรี่ยังเป็นอุปกรณ์สำคัญสำหรับเก็บสำรองพลังงานสะอาดที่ไม่เสถียร เช่น พลังงานแสงอาทิตย์ หรือ พลังงานลม ไว้ใช้ในยามที่โลกไม่สามารถผลิตไฟฟ้าจากแหล่งพลังงานเหล่านี้ได้ จากความก้าวหน้าของพัฒนาการเทคโนโลยีแบตเตอรี่ การใช้แบตเตอรี่เป็นแหล่งพลังงานสำหรับการขับเคลื่อนยานพาหนะที่เริ่มมีจำนวนมากขึ้นตลอดเวลา
การเรียนรู้เพื่อเข้าใจเรื่องวิทยาศาสตร์และเทคโนโลยีของแบตเตอรี่ รวมทั้งแนวทางการใช้แบตเตอรี่อย่างถูกต้อง ปลอดภัยและเป็นมิตรกับสิ่งแวดล้อม จึงเป็นเรื่องที่มีความสำคัญในการดำรงชีวิตทั้งในปัจจุบันและในอนาคต
แบตเตอรี่คืออะไร
แบตเตอรี่คือ อุปกรณ์ที่ประกอบด้วยเซลล์ไฟฟ้าเคมี (electrochemical cell) ตั้งแต่หนึ่งเซลล์ขึ้นไป โดยแต่ละเซลล์มีการเชื่อมต่อกันทางไฟฟ้า จึงสามารถเปลี่ยนพลังงานเคมีที่มีสะสมเป็นพลังงานไฟฟ้าได้
เซลล์ไฟฟ้าเคมี (electrochemical cell) ประกอบด้วยขั้วไฟฟ้า (electrode) อย่างน้อยสองขั้วที่ทำจากวัสดุที่นำไฟฟ้าและอิเล็กโทรไลต์ (electrolyte) ซึ่งส่วนใหญ่เป็นของเหลวเมื่อมีการต่อขั้ทั้งสองขั้วของเซลล์ไฟฟ้าเคมีด้วยตัวนำไฟฟ้าเช่น สายไฟ อิเล็กตรอนจะเคลื่อนที่จากขั้วหนึ่งไปยังอีกขั้วหนึ่งโดยทิศทางการเคลื่อนที่จะขึ้นกับสมบัติของขั้วไฟฟ้าและอิเล็กโทรไลต์ การเคลื่อนที่ของอิเล็กตรอนอย่างต่อเนื่องระหว่างขั้วทั้งสองของเซลล์ไฟฟ้าเคมีผ่านตัวนำ ทำให้เกิด"กระแสไฟฟ้า" ที่นำไปใช้งานได้
เพื่อให้เข้าใจชัดเจนยิ่งขึ้น นักเรียนสามารถชมคลิปวีดิทัศน์แสดงการทำงานของเซลล์ไฟฟ้าเคมีได้ที่เว็บไซต์ https://youtu.be/C26pH8kC_Wk
แบตเตอรี่ นอกจากจะประกอบด้วยเซลล์ไฟฟ้าเคมีที่มีการต่อกันแล้ว ยังมีตัวแบ่ง (separator) ที่ทำหน้าที่คั่นระหว่างขั้วไฟฟ้าของเซลล์ไฟฟ้าเคมีที่นำมาต่อกันเพื่อไม่ให้ทำปฏิกิริยากัน ดังนั้น โดยสรุปองค์ประกอบหลักของแบตเตอรี่มี 4 องค์ประกอบหลัก ได้แก่
- ขั้วลบ หรือ แอโนด (anode) เป็นขั้วที่เมื่อทำปฏิกิริยาเคมีกับอิเล็กโทรไลต์แล้วจะให้อิเล็กตรอน
- ขั้วบวก หรือ แคโทด (cathode) เป็นขั้วที่เมื่อทำปฏิกิริยาเคมีกับอิเล็กโทรไลต์แล้ว จะเกิดสมบัติในการดึงดูดอิเล็กตรอน
- อิเล็กโทรไลต์ (electrolyte) เป็นสารที่อาจอยู่ในสถานะใดก็ได้ ซึ่งส่วนใหญ่เป็นสารละลายที่ประกอบด้วยอนุภาคที่มีประจุที่พร้อมเคลื่อนที่หรือนำกระแสไฟฟ้า
- ตัวแบ่ง (separator) เป็นวัสดุที่เป็นฉนวนไฟฟ้าทำหน้าที่แบ่งคั่นระหว่างขั้วสองขั้ว
สัญลักษณ์ของแบตเตอรี่ในแผนภาพแสดงวงจรไฟฟ้าคือ
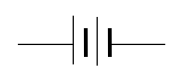
โดยที่เส้นยาวบางระบุขั้วบวก ส่วนเส้นสั้นหนาระบุขั้วลบ

รูปที่ 2 (บน) เซลล์ฟฟ้าเคมีที่มีการต่อขั้วทั้งสองกับหลอดไฟ และ (ล่าง) ภาพตัดแสดงส่วนประกอบของถ่านไฟฉาย
ซึ่งเป็นเซลล์ไฟฟ้าเคมีที่มีแท่งแกรไฟต์ที่อยู่ตรงกลางและกล่องสังกะสีเป็นขั้วไฟฟ้าแต่ละขั้ว
และมีอิเล็กโทรไลด์ที่มีลักษณะเป็นของผสมเหนียวขึ้น ประกอบด้วยส่วนผสมของสารหลายชนิด
ที่มา: หนังสือเรียนรายวิชาเพิ่มเติม เคมี เล่ม 4 ขั้น ม.4-6 สสวท.
ประวัติการค้นพบและการพัฒนาของแบตเตอรี่
จากหลักฐานการค้นพบทางโบราณคดี ทำให้มีการคาดการณ์ว่า มนุษย์ได้มีการประดิษฐ์แบตเตอรี่เมื่อกว่า 2,000 ปีก่อนนี้ โดยแบตเตอรี่ที่ค้นพบอยู่ในประเทศอิรัก มีลักษณะเป็นไหที่ทำด้วยดินเหนียว โดยมีท่อกลวงฃเป็นทรงกระบอกทองแดงติดตั้งที่ตรงกลางไห และมีแท่งเหล็กอยู่ตรงแกนกลางของท่อ

รูปที่ 3 ภาพของแบตเตอรี่ที่ใช้เมื่อประมาณ 2,000 กว่าปีที่แล้ว
ที่มา: https://wiredweirdworld.wordpress.com
ในปี ค.ศ. 1791 กัลวานี (Luigi Galvani) ได้สังเกตเห็นว่า เมื่อเขาใช้แท่งโลหะยาวจิ้มที่ขาของกบที่เสียชีวิตแล้วขาของกบจะกระตุก เขาจึงคิดว่า การจิ้มขากบด้วยแท่งโลหะเป็นการให้ "ลังชีวิต" แก่กบ ในภายหลัง เขาได้เรียนรู้ว่าเนื่องจากตัวกบที่เสียชีวิตแล้วนั้นวางอยู่บนแผ่นโลหะ ที่ต่างชนิดกับแท่งโลหะ เมื่อใช้แท่งโลหะสัมผัส ขากบจะเกิดกระแสไฟฟ้าไหล ขากบจึงกระตุก

รูปที่ 4 กัลวานี (Luigi Galvan) นักฟิสิกส์และแพทย์ชาวอิตาเลียน (ค.ศ. 1737-1798)
ที่มา: http://www.museopalazzopoggi.unibo.it
ในปี ค.ศ. 1799 เมื่อวอลตา (Alessandro Volta) นักฟิสิกส์ชาวอิตาเลียน ทราบผลการทดลองของกัลป์วานี เขาได้พิจารณาเห็นว่า สาเหตุที่ทำให้ขากบกระตุกเนื่องจากการมีปฏิกิริยาเคมีบางอย่างระหว่างแท่งโลหะที่นำมาจิ้มขากบกับแผ่นโลหะที่ใช้วางตัวกบ เขาจึงทดลองนำแผ่นโลหะต่างชนิดกันสองแผ่นมาแนบที่ลิ้นด้านบนและลิ้นด้านล่างในปากของเขาเพื่อทดสอบปฏิกิริยาของลิ้นต่อสิ่งที่ไหลระหว่างแผ่นโลหะทั้งสอง ผลปรากฏว่าลิ้นของเขารับรู้ของเหลวที่มีรสชาติเหมือนกรด

รูปที่ 5 วอลดา (Alessandro Volta) นักฟิสิกส์ชาวอิตาเลียน (ค.ศ. 1745 - 1827)
ที่มา: http://www.anthroposophie.net/

รูปที่ 6 Voltaic pile ในพิพิธภัณฑ์แสดงงานของวอลตาที่เมืองโคโม ประเทศอิตาลี (ภาพโดย GuidoB)
ที่มา: https://en.wikipedia.org/
ต่อมา เขาได้ทดลองนำกระดาษที่เปียกชุ่มด้วยน้ำเกลือมาเป็นวัสดุแทนลิ้นของเขา แล้วนำแผ่นโลหะ 2 ชนิดได้แก่ สังกะสี และ เงิน มาประกบ จากนั้นนำวัสดุทั้งสองมาวางซ้อนกันเป็นชั้น ๆ หลายชั้น และได้เชื่อมต่อส่วนบนสุดของชั้นกับส่วนล่างสุดด้วยลวดโลหะ เขาพบว่า อุปกรณ์นี้สามารถให้กำเนิดกระแสไฟฟ้าได้
อุปกรณ์ของวอลตา ต่อมาได้รับการตั้งชื่อว่า Voltaic pile ซึ่งถือได้ว่าเป็นซลล์ไฟฟ้าเคมีเซลล์แรกของโลกในเวลาต่อมา วอลตาได้พัฒนา Voltaic pile ให้จ่ายกระแสไฟฟ้าอย่างเสถียรยิ่งขึ้น และนานมากขึ้น ด้วยการเปลี่ยนคู่แผ่นโลหะเป็นสังกะสีกับทองแดง และเปลี่ยนอิเล็กโทรไลต์เป็นกรดซัลฟิวริกผสมกับน้ำ หรือน้ำเกลือ ซึ่งสามารถเขียนสมการปฏิกิริยาเคมีที่เกิดขึ้นได้ดังนี้
![]()
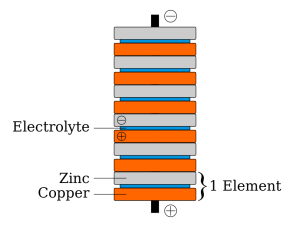
รูปที่ 7 แผนภาพแสดงส่วนประกอบของ Voltage pile (ภาพโดย Luigi Chiesa)
ที่มา: https://en.wikipedia.org/wiki/Voltaic_pile
ในปี ค.ศ. 1836 แดเนียล (John F. Daniell นักเคมีชาวอังกฤษได้พัฒนาเซลล์ไฟฟ้าเคมีเป็นการต่อยอด Voltage pileเซลล์ดังกล่าวจึงมีชื่อว่า Daniel cel ซึ่งประกอบด้วยหม้อที่ทำด้วยทองแดงบรรจุสารละลายคอปเปอร์ซัลเฟต ในหม้อมีภาชนะที่ทำด้วยกระเบื้อง ในภาชนะมีกรดซัลฟูริกและแผ่นสังกะสีจุ่มอยู่ ดังแสดงในรูปที่ 9

รูปที่ 8 Daniell cell
ที่มา: https://en.wikipedia.org/wiki/Daniell_cell
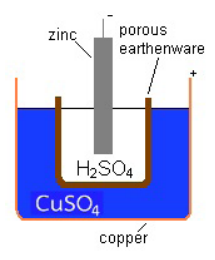
รูปที่ 9 ภาพวาดแสดงส่วนประกอบของ Daniell cell
เซลล์ไฟฟ้ของแดเนียลให้กระแสไฟฟ้ที่เสถียรกว่าและนานกว่าเซลล์ของวอลตา จึงกลายเป็นแบตเตอรี่มาตรฐานของวการอุตสาหกรรมในสมัยนั้น และเป็นเซลล์ฟฟ้าเซลล์แรกที่สามารถนำไปใช้ในอุปกรณ์ไฟฟ้าต่าง ๆ ได้จริง โดยเฉพาะในการนำไปใช้กับเครื่องโทรเลข
อย่างไรก็ตาม เซลล์ไฟฟ้าเคมีในแบตเตอรี่ที่ใช้อิเล็กโทรไลต์เป็นสารละลายมีความเสี่ยงสูงต่อการรั่วไหลของกระแสไฟสู่ภายนอก อีกทั้งภาชนะที่ใช้บรรจุเซลล์ไฟฟ้าเคมีแบบมีอิเล็กโทรไลต์มักทำด้วยแก้ว จึงทำให้เสี่ยงต่อการแตกเสียหาย เซลล์ไฟฟ้าเคมีที่ได้รับการพัฒนา ในช่วงแรกนี้ จึงไม่เหมาะสมกับการนำมาใช้ในอุปกรณ์พกพาต่าง ๆ
จนกระทั่งในช่วงปลายศตวรรษที่ 19 จึงได้มีการประดิษฐ์เซลล์ไฟฟ้าเคมีแบบที่ใช้อิเล็กโทรไลต์เป็นสารที่มีลักษณะเป็นแป้งเปียก (paste) ส่งผลให้มีการนำเซลล์ไฟฟ้าเคมีแบบนี้ไปใช้กับอุปกรณ์พกพาได้เป็นอย่างดี ในตอนที่ 2 จะกล่าวถึง ชนิดของแบตเตอรี่ และ ปฏิกิริยาเคมีในแบตเตอรี่ชนิดต่าง ๆ ที่ทุกคนคุ้นเคย รวมทั้งแนวทางการใช้แบตเตอรี่อย่างมีประสิทธิภาพและปลอดภัย
บทความนี้เป็นส่วนหนึ่งของนิตยสาร สสวท. ผู้อ่านสามารถติดตามบทความที่น่าสนใจเพิ่มเติมได้ที่ https://magazine.ipst.ac.th/
บรรณานุกรม
Buchman, I. Battery University. Retrieved June 2, 2016, from http://batteryuniversity.com/.
Rechargeable Battery Recycling Corporation & National Geographic Society. Battery Lesson Plan. Retrieved June 2, 2016, from http://www.panasonic.com/environmental/rbrc_lesson_plan.pdf.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. (2556). หนังสือเรียน รายวิชาเพิ่มเติม เคมี เล่ม 4 ชั้นมัธยมศึกษาปีที่ 4 - 6.กรุงเทพมหานคร: โรงพิมพ์องค์การค้า สกสค.
อดิสร เตือนตรานนท์. (2557). อินเทอร์เน็ตในทุกสรรพสิ่ง. กรุงเทพธุรกิจ (เทคโนโลยีปริทรรศน์), หน้า 9.
-
คำที่เกี่ยวข้อง



