เอนไซม์และการทำงานของเอนไซม์
ตัวยับยั้งและตัวเร่งเอนไซม์
สารบางชนิดมีผลต่อการทำงานโดยสารที่ทำให้เอนไซม์ทำงานลดลง เรียกว่า ตัวยับยั้ง (inhibitor) สารที่ทำ ให้เอนไซม์ทำงานเพิ่มขึ้นเรียกว่า ตัวเร่ง (activator)
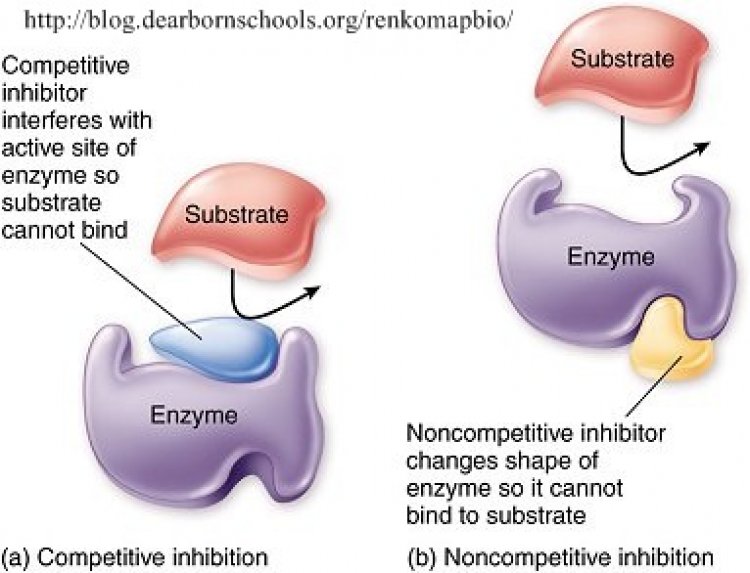
การยับยั้งแบบแก่งแย่ง
ตัวยับยั้งแบบแก่งแย่ง (Competitive inhibitor) มีโครงสร้างคล้ายสารตั้งต้น แย่งที่จับกับเอนไซม์ที่แอกทีฟไซต์ ทำให้สารตั้งต้นเอนไซม์ได้ลดลง ปฏิกิริยาจึงลดลงหรือหยุดชะงักไป
การยับยั้งแบบแอลโลสเตอริก
ตัวยับยั้งแบบแอลโลสเตอริก (allosteric inhibitor) ไม่ได้มีโครงสร้างเหมือนสารตั้งต้นและไม่ได้จับกับเอนไซม์ที่แอกทีฟไซด์ แต่จับเอนไซม์ที่แอลโลสเตอริกไซด์ (allosteric site) ที่มีอยู่ในเอนไซม์ บางชนิด (allosteric enzyme) ซึ่งมีผลให้เอนไซม์มีรูปร่างเปลี่ยนไปและทำงานได้ลดลง กรณีที่มีสารมาจับที่แอลโลสเตอริกไซด์ แล้วมีผลทำ ให้เอนไซม์นั้นทำ งานได้ดีขึ้น เรียกสารที่มาจับว่า ตัวเร่งแบบแอลโลสเตอริก (allosteric activator)
กลับไปที่เนื้อหา
เอนไซม์สามารถทำงานเร่งปฏิกิริยาเคมีได้ภายใต้สภาพอุณหภูมิ และความเป็นกรด-เบส (pH) ในระดับปานกลางของเซลล์ การเปลี่ยนแปลงอุณหภูมิ ความเป็นกรด – เบส ปริมาณสารเคมีบางชนิดที่มีผลทำ ให้โปรตีนเปลี่ยนแปลงรูปร่างไป จะมีผลต่อการทำ งานของเอนไซม์
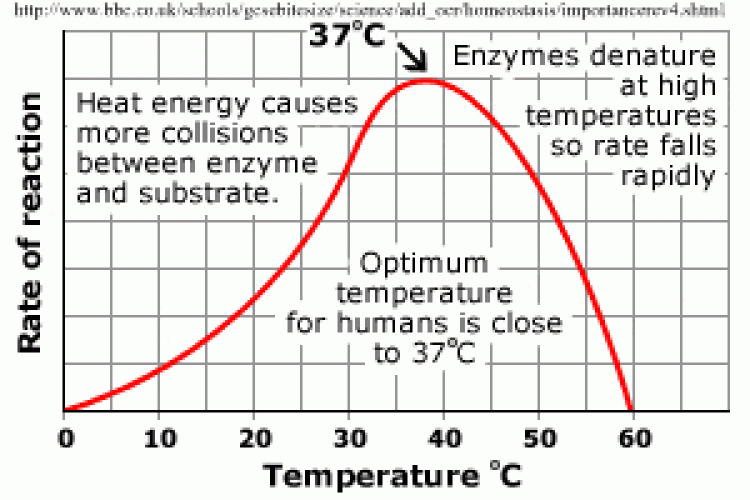
ผลของอุณหภูมิ
-เอนไซม์สิ่งมีชีวิตส่วนใหญ่ ช่วงอุณหภูมิเหมาะสมต่อการทำงานประมาณ 25–40OC แต่ที่ 45OCขึ้นไป เอนไซม์ซึ่งเป็นโปรตีนจะเสื่อมสภาพและเปลี่ยนรูปร่าง (denature) กล่าวคือ โมเลกุลเอนไซม์ที่ได้รับความร้อนจะคลายตัวเหยียดออก และแอกทีฟไซด์เปลี่ยน รูปร่างไป และทำงานไม่ได้
** เอนไซม์ของสาหร่ายสีเขียวแกมนํ้าเงินที่อาศัยอยู่ได้ในนํ้าพุร้อน สามารถทนอุณหภูมิสูงถึง 90OC และทำ งานได้ดีที่สุดที่อุณหภูมิ 72OC **
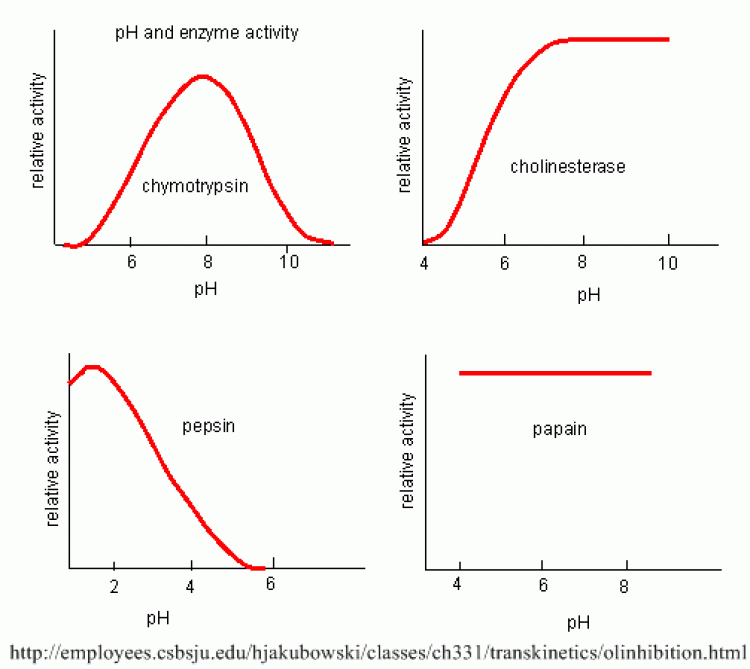
ผลของความเป็นกรด-เบส (pH)
- เอนไซม์ส่วนใหญ่ทำงานได้ดีที่ pH ประมาณ 7 ถ้า pH เปลี่ยนแปลงไปมากๆ เอนไซม์ก็จะเปลี่ยนสภาพ (denature) ไปได้
- เอนไซม์เร่งปฏิกิริยาย่อยอาหารบางชนิด เช่น เพปซิน เร่งปฏิกิริยาย่อยโปรตีนได้ดีที่ pH 1.5 – 2.5, ทริปซินที่ pH 7.5 – 8.5 เป็นต้น
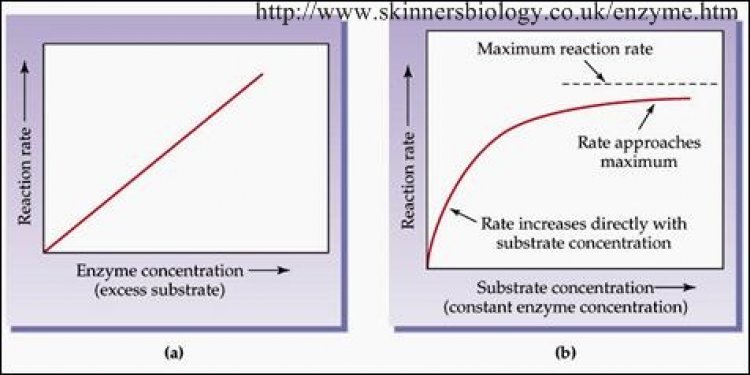
ผลของความเข้มข้นของสารตั้งต้นและเอนไซม์
- เมื่อกำหนดให้อุณหภูมิ, pH, ปริมาณเอนไซม์คงที่ เมื่อเพิ่มปริมาณสารตั้งต้น กล่าวคือ การเพิ่มเอนไซม์ในระยะแรกจะทำ ให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้น แต่เมื่อเอนไซม์มากเกินพอ ความเร็วของปฏิกิริยาจะไม่เพิ่มขึ้นอีก ทั้งนี้เพราะไม่มีสารตั้งต้นเหลือพอที่จะเข้าทำ ปฏิกิริยา
กลับไปที่เนื้อหา
การเกิดปฏิกิริยาเคมีใด ๆ ตัวอย่างเช่น ปฏิกิริยาที่สารตั้งต้น A เปลี่ยนแปลงเป็นสารผลิตภัณฑ์ P ต้องการพลังงานอิสระปริมาณหนึ่งใช้กระตุ้นให้มีการสลายและสร้างพันธะเคมีที่จะทำ ให้สาร A กลายเป็นสาร P พลังงานที่ต้องการใช้กระตุ้นให้เกิดปฏิกิริยาเคมี เรียกว่า พลังงานอิสระในการกระตุ้น (free energy of activation) โดยทั่วไปปฏิกิริยาเคมีสามารถเร่งให้เกิดเร็วขึ้นได้ 2 วิธี คือ
1. เพิ่มอุณหภูมิ มีผลทำให้โมเลกุลเคลื่อนไหวและพลังงานเพิ่มขึ้น
2. เติมคะตะลิสต์หรือตัวเร่งปฏิกิริยา มีผลทำให้ปฏิกิริยาต้องการพลังงานกระตุ้นลดตํ่ากว่าเดิม
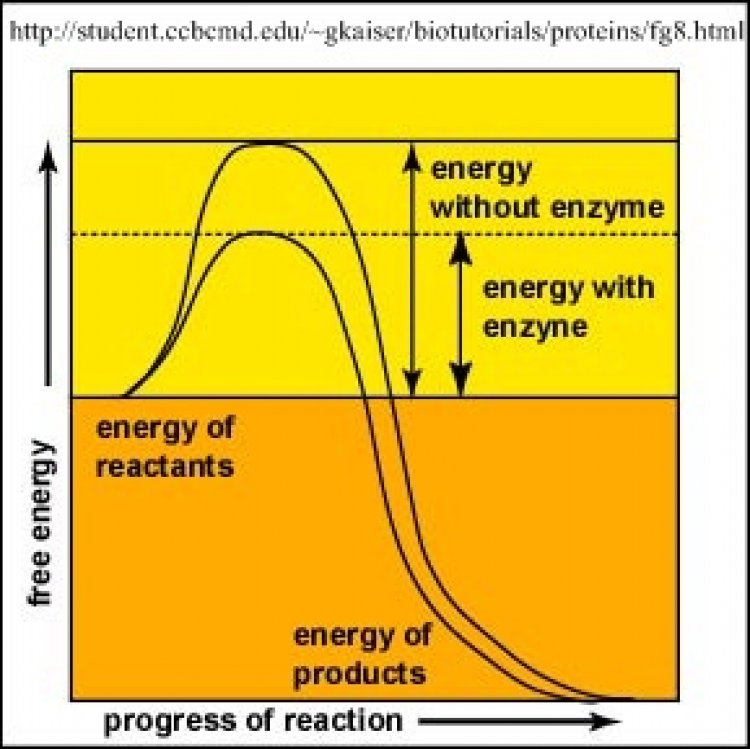
กลไกการเร่งปฏิกิริยาของเอนไซม์ อธิบายได้ว่า
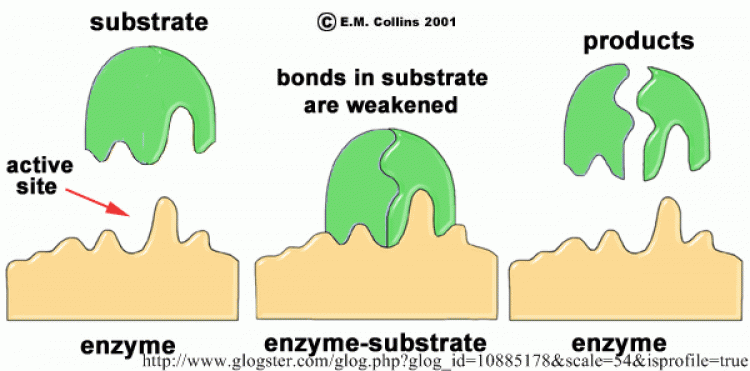
- โมเลกุลเอนไซม์ (E) จับชั่วคราวกับโมเลกุลสารตั้งต้น (S) เกิดสารประกอบเชิงซ้อน (enzyme-substrate complex หรือ ES)
- ในโครงสร้างของสาร ES โมเลกุลสารตั้งต้นอยู่ในสภาพดึงตึงหรือบิดเบี้ยว ซึ่งเปลี่ยนแปลงต่อไปเป็นผลิตภัณฑ์ (P) ได้ง่าย ดังนั้น สาร ES ต้องการพลังงานกระตุ้นในการเปลี่ยนแปลงเป็นสาร P ตํ่ากว่าที่สาร S ต้องการมาก
- สาร ES เปลี่ยนแปลงเป็นสาร P ได้รวดเร็ว พร้อมกับปล่อยโมเลกุลเอนไซม์เป็นอิสระในสภาพเดิม เอนไซม์สามารถจับกับสารตั้งต้นโมเลกุลใหม่เร่งปฏิกิริยาได้อีก
- ปฏิกิริยาที่มีเอนไซม์เป็นตัวเร่ง นอกจากเปลี่ยนแปลงจากสาร S → P แล้ว เอนไซม์ยังสามารถเร่งปฏิกิริยาย้อนกลับ จากสาร S → P ได้ด้วย ดังนั้นปฏิกิริยาที่มีเอนไซม์เป็นตัวเร่งจึงเขียนเป็นสมการที่มีหัวลูกศรทั้งไปและกลับได้ดังนี้
S + E --> ES --> P + E
กลับไปที่เนื้อหา
เอนไซม์ (enzyme) คือ สารเร่งปฏิกิริยาชีวเคมีในเซลล์ หรือ ไบโอคะตะลิสต์ (biocatalyst) มีผลทำ ให้ปฏิกิริยาชีวเคมีเกิดขึ้นรวดเร็ว
โครงสร้างเอนไซม์
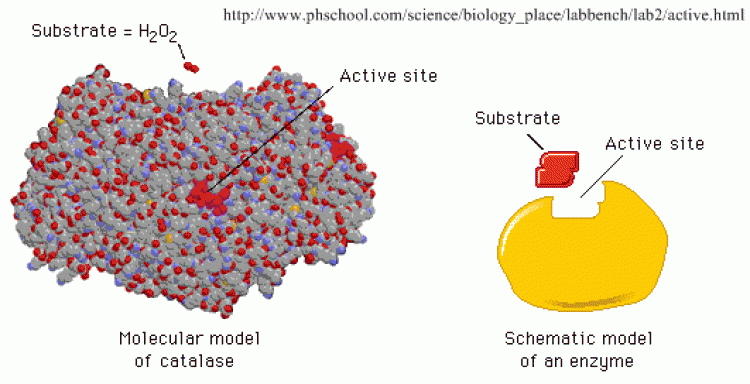
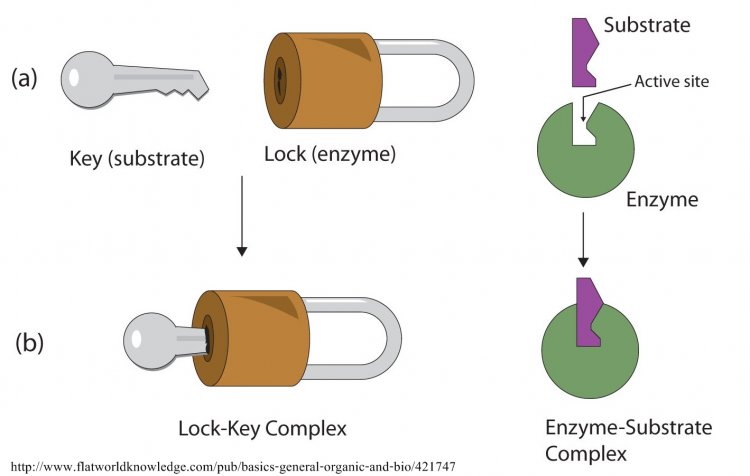
เอนไซม์เป็นโปรตีน อาจเป็นพอลิเพปไทด์สายเดียวหรือหลายสาย ซึ่งม้วนตัวเป็นทรงกลม เนื่องจากมีการจับกันระหว่างกลุ่มข้างของกรดอะมิโน และมีกลุ่มข้างบางกลุ่มเรียงตัวเป็นช่องหรือร่องที่มีลักษณะพิเศษ ทำหน้าที่เป็นบริเวณเร่งหรือแอกทีฟไซด์ (active site) ของเอนไซม์ ซึ่งจะจับกับโมเลกุลเฉพาะที่เข้ากันได้ และเกิดการเร่งปฏิกิริยาขึ้นซึ่งเป็น ความจำเพาะของเอนไซม์ต่อปฏิกิริยา และในปี พ.ศ. 2437 อีมิล ฟิเชอร์ (Emil Fischer) อธิบายความจำ เพาะของเอนไซม์โดยเปรียบเทียบกับแบบจำ ลองแม่กุญแจกับลูกกุญแจ (lock and key model) เอนไซม์เปรียบเป็นลูกกุญแจและสารตั้งต้นเป็นแม่กุญแจ
กลับไปที่เนื้อหา



