ปฏิกิริยาเคมีของกรดและเบส
ในบทเรียนนี้จะขอกล่าวถึงปฏิกิริยาระหว่างกรดกับโลหะ และการนำความรู้เกี่ยวกับปฏิกิริยาดังกล่าวไปประยุกต์ใช้ในชีวิตประจำวัน แต่ก่อนที่จะเรียนรู้เกี่ยวกับปฏิกิริยาระหว่างกรดกับโลหะนั้น เรามาทบทวนความรู้เกี่ยวกับกรด และโลหะกันก่อนค่ะ
กรด เป็นสารที่มีรสเปรี้ยว มีฤทธิ์กัดกร่อน สามารถเปลี่ยนสีลิตมัสสีน้ำเงินเป็นสีแดงได้ และถ้าอธิบายตามทฤษฎีกรดเบส ของนักเคมีที่สำคัญ ๆ สามารถอธิบายได้ดังนี้
อาร์เรเนียส นักเคมีชาวสวีเดนได้ให้นิยามไว้ว่า กรด คือ สารประกอบที่มีธาตุไฮโดรเจนเป็นธาตุหลักและเมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน ( H+ ) เช่น

ภาพนักวิทยาศาสตร์กำลังถ่ายเทสาร
ที่มา: https://pixabay.com, E Swamy
H2 O
HClO4 ( l ) -------------- > H+ ( aq ) + ClO4- ( aq )
H2 O
CH3COOH ( l ) -------------- > H+ ( aq ) + CH3COO- ( aq )
เบรินสเตด – ลาวรี ได้ให้นิยาม กรด คือสารที่มีสมบัติจ่ายโปรตอน ( Proton donor ) ให้แก่สารอื่นได้ ตัวอย่างเช่น เมื่อ HCl ทำปฏิกิริยากับ NH3 พบว่า HCl ให้ H+ แก่ NH3 ดังนั้น HCl ทำหน้าที่เป็นกรด ในขณะที่ NH3 ทำหน้าที่เป็นเบส
HCl ( aq ) + NH3 ( aq ) -------------- > NH4+ ( aq ) + Cl- ( aq )
กรด เบส
เมื่อกรดมีการให้โปรตอนไปแล้วส่วนของกรดที่เหลือเรียกว่า คู่เบส ( conjugate base ) ของกรด จะทำหน้าที่เป็นเบส หรือกล่าวคือ คู่เบสของกรดเบรินสเตด คือโมเลกุลหรือไอออนที่เหลืออยู่หลังจากกรดเสียโปรตอนไปแล้ว ในทางตรงข้ามเมื่อเบสรับโปรตอนแล้วจะได้คู่กรด ( conjugate acid ) ของเบสซึ่งทำหน้าที่เป็นกรดก็คือสารผลิตภัณฑ์ของเบสที่ได้รับโปรตอน
ดังนั้น กรดเบรินสเตดทุกตัวมีคู่เบส และเบสเบรินสเตดทุกตัวมีคู่กรด พิจารณาสมการต่อไปนี้
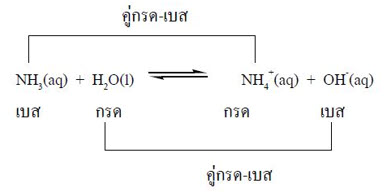
จากการพิจารณานิยามความเป็นกรด เบสของเบรินสเตด – ลาวรี จะเห็นได้ว่า หากโมเลกุลดังกล่าวไม่มีโปรตรอนจะไม่สามารถอธิบายได้ว่าโมเลกุลดังกล่าวเป็นกรดหรือเบสได้ และสารบางตัวเช่น BCl3 สามารถทำหน้าที่เป็นกรดได้ทั้งๆ ที่ไม่มีโปรตอนอยู่ในโมเลกุลซึ่งอธิบายโดยทฤษฎีของเบรินเสตด- ลาวลีไม่ได้
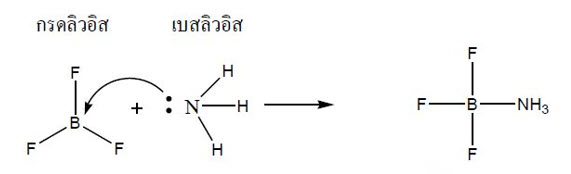
ลิวอิส จึงให้นิยาม กรด –เบส โดยอาศัยการรับและการให้คู่อิเล็กตรอน โดยกล่าวไว้ว่า กรด คือสารที่รับคู่อิเล็กตรอน ( Electron pair acceptor ) จากเบส แล้วเกิดพันธะโคเวเลนต์ ดังตัวอย่างต่อไปนี้
ในโมเลกุลของ NH3 มีอิเล็กตรอนอยู่เหลืออยู่ 1 คู่ เมื่อรวมตัวกับ BF3 ทำให้ BF3 รวมตัวกับ NH3 ตรงคู่อิเล็กตรอนนั้น NH3 จึงเป็นฝ่ายให้อิเล็กตรอนคู่ ส่วน BF3 เป็นฝ่ายรับอิเล็กตรอนคู่ ดังนั้น NH3 ก็เป็นเบสและ BF3 ก็เป็นกรด
โลหะ คือ วัสดุที่ประกอบด้วยธาตุโลหะที่มีอิเล็กตรอนอิสระอยู่มากมาย อิเล็กตรอนเหล่านี้ไม่ได้เป็นของอะตอมใดอะตอมหนึ่งโดยเฉพาะ มีการเคลื่อนที่ไปมาอย่างอิสระ เรียกว่าทะเลอิเล็กตรอน ทำให้มันมีคุณสมบัติพิเศษหลายประการ เช่น เป็นตัวนำไฟฟ้าและความร้อนได้ดีมาก ไม่ยอมให้แสงผ่าน ผิวของโลหะที่ขัดเรียบจะเป็นมันวาว ตัวอย่างของโลหะได้แก่ สังกะสีแมกนีเซียม อลูมิเนียม ดีบุก ทองแดง นิกเกิล และตะกั่ว
เมื่อเราทบทวนความรู้เกี่ยวกับนิยามของกรดกับโลหะกันแล้ว เราก็มาเข้าเรื่องกันเลยว่าเมื่อเรานำโลหะชนิดต่าง ๆ มาทำปฏิกิริยากับกรดแล้วจะเกิดอะไรขึ้น มีโลหะชนิดใดบ้างที่สามารถทำปฏิกิริยากับกรดได้ และมีโลหะชนิดใดที่ไม่ทำปฏิกิริยากับกรดเลย
ปฏิกิริยาระหว่างกรดกับโลหะ
เมื่อนำโลหะมาทำปฏิกิริยากับกรด จะเกิดผลิตภัณฑ์เป็นเกลือของกรด และแก๊สไฮโดรเจน
โลหะ + กรด -------------- > เกลือ + แก๊สไฮโดรเจน
โลหะแต่ละชนิดมีความสามารถและอัตราเร็วในการเกิดปฏิกิริยากับกรดต่างกัน โลหะที่สามารถเกิดปฏิกิริยากับกรดได้ เช่น สังกะสี ( Zn ), แมกนีเซียม ( Mg ), ทองแดง ( Cu ), เงิน ( Ag ), อะลูมิเนียม ( Al ), เหล็ก ( Fe ) และ โซเดียม ( Na ) ตัวอย่างดังปฏิกิริยา
Zn ( s ) + H2SO4 ( aq ) -------------- > ZnSO4 ( aq ) + H2 ( g )
Mg ( s ) + 2HCl ( aq ) -------------- > MgCl2 ( aq ) + H2 ( g )
Zn ( s ) + HCl ( aq ) -------------- > ZnCl2 ( aq ) + H2 ( g )
อัตราของการเกิดปฏิกิริยาระหว่างกรดกับโลหะแต่ละชนิดก็แตกต่างกันด้วย ขึ้นอยู่กับธรรมชาติของสารตั้งต้น โดยโลหะที่ทำปฏิกิริยาที่รวดเร็วและรุนแรงมากกับกรดคือ โลหะโซเดียม ( Na ) โลหะที่ไม่ทำปฏิกิริยากับกรด หรือเกิดน้อยมาก ได้แก่ โลหะเงิน ทองคำ ทองคำขาว เงิน และปรอท ซึ่งในที่นี้จะขอยกตัวอย่างเปรียบเทียบอัตราการเกิดปฏิกิริยาระหว่างกรดกับโลหะจากบทเรียนเรื่องสารและสมบัติของสาร ม. 4 -6 ระหว่าง แมกนีเซียม สังกะสี และทองแดง โลหะชนิดใดมีอัตราการทำปฏิกิริยากับกรดไฮโดรคลอริกได้เร็วที่สุด เมื่อเราทำการทดลองใส่โลหะทั้ง 3 ชนิด ลงในกรดไฮโดรคลอริก โดยสวมลูกโป่งไว้ที่ปลายหลอดทดลองแต่ละหลอดเพื่อเก็บแก๊สที่เกิดจากปฏิกิริยาของสารแต่ละคู่ ( ดูตัวอย่าง ปฏิกิริยาระหว่างแมกนีเชียม สังกะสี และโซเดียม กับสารละลายกรดไฮโดรคลอริก ได้จากคลิปวีดีโอนี้ (https://youtu.be/1FH6V8IU49Q?t=147) จะเห็นได้ว่าในระยะเวลาเท่ากันปริมาณแก๊สที่เกิดขึ้นในแต่ละหลอดซึ่งสังเกตได้จากขนาดของลูกโป่งจะแตกต่างกัน ซึ่งเป็นประจักษ์พยานที่เกิดขึ้นจากปฏิกิริยาของสารในหลอดทดลองแต่ละหลอด จึงอธิบายได้ว่าเมื่อนำโลหะแมกนีซียม สังกะสี และทองแดง มาทำปฏิกิริยากับกรดไฮโดรคลอริกแล้ว แมกนีเซียม สังกะสี มีอัตราการเกิดปฏิกิริยาได้เร็วกว่าทองแดง ตามลำดับ
แก๊สที่ได้จากปฏิกิริยาระหว่างกรดกับโลหะ คือ แก๊สไฮโดรเจน ซึ่งมีวิธีการทดสอบได้โดย การใช้ไม้ขีดไฟที่ลุกเป็นเปลว จ่อที่ปากหลอดทดลองที่เก็บแก๊ส แก๊สจะติดไฟ แล้วทำให้เปลวไฟสว่างมากขึ้น และมีเสียงดัง “เป๊าะ” เกิดขึ้นด้วย เมื่อแก๊สไฮโดรเจนหมดไป ความสว่างของเปลวไฟก็จะลดลงเหลือเท่าเดิม
เมื่อน้อง ๆ ทราบกันแล้วว่าโลหะบางชนิดและกรดสามารถทำปฏิกิริยากันได้ ดังนั้น จึงควรมีการระมัดระวังในการใช้ภาชนะหรือสิ่งของที่เป็นโลหะ กับสารละลายที่มีฤทธิ์เป็นกรด เพราะจะเกิดผลกระทบจากปฏิกิริยาได้
แหล่งที่มา
สุทธิดา จำรัส. ตัวอย่างการทดสอบแก๊สไฮโดรเจน 3 . สืบค้นเมื่อวันที่ 19 มิถุนายน 2562 . จาก https://www.youtube.com/watch?v=Oy73q2nYStw
สสวท. ( 2554 ). หนังสือเรียนรายวิชาพื้นฐาน วิทยาศาสตร์ สารและสมบัติของสาร สำหรับนักเรียนที่ไม่เน้นวิทยาศาสตร์ ( พิมพ์ครั้งที่ 3 ). กรุงเทพ: องค์การค้าของ สกสค.
Chemiday. ( 2018, 2 Feb ). Zinc react with sulfuric acid. สืบค้นเมื่อวันที่ 23 มิถุนายน 2562. จาก https://chemiday.com/en/reaction/3-1-0-984
DLIT Resources คลังสื่อการสอน. ปฎิกิริยาระหว่างแมกนีเซียม สังกะสี และทองแดงกับสารละลายกรดไฮโดรคลอริก วิทยาศาสตร์ ม.4-6 (เคมี). สืบค้นเมื่อวันที่ 19 มิถุนายน 2562.จาก https://www.youtube.com/watch?v=1FH6V8IU49Q
Siamchemi. โลหะเงิน ( Silver ) คุณสมบัติและประโยชน์ของโลหะเงิน. สืบค้นเมื่อวันที่ 19 มิถุนายน 2562. จาก https://www.siamchemi.com/โลหะเงิน/
กลับไปที่เนื้อหา
ปฏิกิริยาระหว่างเบสกับโลหะ
วันนี้ผู้เขียนมีโอกาสได้อ่านบทความเกี่ยวกับอุบัติเหตุในห้องปฏิบัติการ ของกรมโรงงานอุตสาหกรรม ที่เขียนโดยคุณริกาญจน์ ฉัตรสกุลวิไล ได้รับความรู้ที่สามารถสรุปได้ว่า ในการป้องกันอุบัติเหตุ ในห้องปฏิบัติการนั้นผู้ปฏิบัติงานจำเป็นต้องมีความรู้เกี่ยวกับ การใช้สารเคมีที่ถูกวิธี และการที่มีความรู้ความเข้าใจเกี่ยวกับปฏิกิริยาของสารต่าง ๆ ซึ่งอาจเกิดปฏิกิริยารุนแรง เกิดผลิตภัณฑ์ที่เป็นแก๊สไวไฟ เกิดการระเบิด หรือแก๊สพิษขึ้น จะช่วยลดหรือป้องกันอุบัติเหตุในการปฏิบัติงานในห้องปฏิบัติการได้
สารเคมีที่ทำปฏิกิริยากันแล้วเกิดแก๊สไวไฟ มีหลายชนิดได้แก่ น้ำ กับสารประกอบโลหะไฮไดรด์ เช่น ลิเทียมไฮไดรด์ อะลูมิเนียมไฮไดรด์ กรดกับโลหะอะลูมิเนียม แมกนีเซียม สังกะสี โครเมียม เหล็ก ดีบุก นิกเกิล และตะกั่ว เมื่อเกิดปฏิกิริยากันแล้วจะให้แก๊สไฮโดรเจน ซึ่งปฏิกิริยาระหว่างกรดกับโลหะ ผู้เขียนได้เคยอธิบายไว้แล้วในบทเรียน เรื่องปฏิกิริยาระหว่างกรดกับโลหะ ในบทเรียนนี้จะขอกล่าวในรายละเอียดของเบสกับโลหะ ซึ่งผลิตภัณฑ์ของปฏิกิริยานั้นเกิด แก๊สไฮโดรเจน ซึ่งเป็นมีสมบัติติดไฟได้ง่าย ก่อนจะเรียนรู้ถึงปฏิกิริยา เรามาทบทวนความรู้ที่เกี่ยวข้องกันก่อนนะคะ
เบส คือ สารที่มีค่า pH มากกว่า 7 ขึ้นไป มีรสฝาดหรือขม เปลี่ยนสีกระดาษลิตมัสจากสีแดงเป็น สีน้ำเงิน เมื่อละลายน้ำแล้วจะลื่นคล้ายสบู่ เป็นสารละลายอิเล็กโตรไลต์ สามารถนำไฟฟ้าได้ เปลี่ยนสีฟีนอล์ฟทาลีน จากไม่มีสี เป็นสีชมพู หรือสีแดง และถ้าอธิบายตามทฤษฎีกรด-เบส ของนักเคมีที่สำคัญ ๆ สามารถอธิบายได้ดังนี้
อาร์เรเนียส นักเคมีชาวสวีเดนได้ให้นิยามไว้ว่า เบส คือ เป็นสารอิเล็กโทรไลต์ที่ละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน ( OH- ) เช่น
KOH ( s ) + H2O ( l ) -------------- > K+ ( aq ) + OH- (aq)
Ca (OH)2 ( s ) + H2O ( l ) -------------- > Ca2+ ( aq ) + 2OH- (aq)
เบรินสเตด – ลาวรี ได้ให้นิยาม เบส คือสารที่มีสมบัติรับโปรตอน ( Proton accepter ) จากสารอื่น ตัวอย่างเช่น เมื่อ HCl ทำปฏิกิริยากับ NH3 พบว่า HCl ให้ H+ แก่ NH3 ดังนั้น HCl ทำหน้าที่เป็นกรด ในขณะที่ NH3 ทำหน้าที่เป็นเบส ดังปฏิกิริยา A
HCl ( aq ) + NH3 ( aq ) -------------- > NH4+ ( aq ) + Cl- ( aq ) ……….. ปฏิกิริยา A
กรด เบส
NH3 ( g ) + H2O ( l ) -------------- > NH4+ ( aq ) + OH- (aq) ……….. ปฏิกิริยา B
เบส กรด
จากปฏิกิริยา B เมื่อ H2O ทำปฏิกิริยากับ NH3 พบว่า H2O ให้ H+ แก่ NH3 ดังนั้น H2O ทำหน้าที่เป็นกรด ในขณะที่ NH3 ทำหน้าที่เป็นเบส
ลิวอิส ให้นิยาม กรด –เบส โดยอาศัยการรับและการให้คู่อิเล็กตรอน โดยกล่าวไว้ว่า เบส คือสารที่สามารถให้คู่อิเล็กตรอน ( Electron pair donor ) กับกรด แล้วเกิดพันธะโคเวเลนต์ ดังตัวอย่างต่อไปนี้

ในโมเลกุลของ NH3 มีอิเล็กตรอนอยู่เหลืออยู่ 1 คู่ เมื่อรวมตัวกับ BF3 ทำให้ BF3 รวมตัวกับ NH3 ตรงคู่อิเล็กตรอนนั้น NH3 จึงเป็นฝ่ายให้อิเล็กตรอนคู่ ส่วน BF3 เป็นฝ่ายรับอิเล็กตรอนคู่ ดังนั้น NH3 ก็เป็นเบสและ BF3 ก็เป็นกรด
ประเภทของเบส
เมื่อจำแนกประเภทของเบสตามการแตกตัวให้ไฮดรอกไซด์ไอออน ( OH- ) สามารถแบ่งออกได้ 2 ประเภทได้แก่
- เบสแก่ คือ เบสที่แตกตัวให้ไฮดรอกไซด์ไอออน ( OH- ) ได้ 100% โดยไม่ขึ้นกับความเข้มข้น ได้แก่ CsOH, RbOH, KOH, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2 ( OH- ของหมู่ IA และ IIA )
- เบสอ่อน คือ เบสที่แตกตัวให้ไฮดรอกไซด์ไอออน ( OH- ) ไม่ 100% เช่น NH3, NH4OH ซึ่งสารละลายเบสอ่อน ถ้ามีความเข้มข้นเท่ากับสารละลายเบสแก่ จะนำไฟฟ้าได้น้อยกว่าเบสแก่ ทำปฏิกิริยากับโลหะสังกะสีหรือเกลือแอมโมเนียมได้ช้ากว่าเบสแก่ และ มีค่า pH น้อยกว่าเบสแก่
ตัวอย่างสารในชีวิตประจำวันของเราที่มีฤทธิ์เป็นเบส ได้แก่ ยาลดกรด น้ำขี้เถ้า สบู่ ผงซักฟอก ผงฟู น้ำปูนใสน้ำยาล้างจาน ( บางยี่ห้อ ) และยาสีฟัน
ปฏิกิริยาระหว่างเบสกับโลหะ
จากการศึกษาค้นคว้าของผู้เขียน พบว่ามีโลหะที่ทำปฏิกิริยากับสารละลายเบสได้ คือ อะลูมิเนียม และ สังกะสี เมื่อทําปฏิกิริยากันแล้ว จะมีฟองแก๊สและความร้อนเกิดขึ้น ดังสมการ
เบส + อะลูมิเนียม/สังกะสี -------------- > เกลือ + แก๊สไฮโดรเจน
ตัวอย่าง การเกิดปฏิกิริยาระหว่างโลหะอะลูมิเนียม และสังกะสี กับสารละลายโซเดียมไฮดรอกไซด์ และสารละลายโพแตสเซียมไฮดรอกไซด์ ดังสมการ
2Al ( s ) + 2NaOH ( aq ) -------------- > 2NaAlO2 + 3H2 ( g )
Zn ( s ) + NaOH ( aq ) -------------- > Na2ZnO2 + H2 ( g )
2Al ( s ) + 2KOH ( aq ) + 6H2O -------------- > 2K[Al(OH)4] + 3H2 ( g )
จากปฏิกิริยาระหว่างเบสกับโลหะอะลูมิเนียมและสังกะสี จะเห็นได้ว่ามีแก๊สไฮโดรเจน ที่ติดไฟได้ง่ายเกิดขึ้น ดังนั้น เมื่อปฏิบัติงานทั้งในและนอกห้องปฏิบัติการเกี่ยวกับปฏิกิริยาดังกล่าว จึงจำเป็นต้องปฏิบัติการด้วยความระมัดระวังอยู่เสมอ วิธีป้องกันที่ดีที่สุดคือ ไม่ใช้ หรือไม่ปล่อยให้มีเปลวไฟในห้องปฏิบัติการ หรือใกล้บริเวณที่ทำปฏิกิริยา เพื่อป้องกันการเกิดเพลิงไหม้ ในขั้นการกำจัดของเสียที่เป็นสารละลายกรดและสารละลายเบสที่มีความเข้มข้นมากกว่า 10% ต้องทำให้เป็นกลางก่อน แล้วจึงเทลงท่อน้ำทิ้งและเปิดน้ำตามปริมาณมาก ๆ เพื่อป้องกันการกัดกร่อน และการเกิดปฏิกิริยาที่ไม่พึงประสงค์ซึ่งอาจก่อให้เกิดอันตรายได้
แหล่งที่มา
ณษมา ชัยพฤกษ์ และณิชาภัทร คำสอน. ทฤษฎีกรด-เบส. สืบค้นเมื่อวันที่ 22 มิถุนายน 2562. จาก https://sites.google.com/a/tupr.ac.th/krd-bes/thvsdi-krd-bes
ริกาญจน์ ฉัตรสกุลวิไล . อุบัติเหตุในห้องปฏิบัติการ. สืบค้นเมื่อวันที่ 22 มิถุนายน 2562. จาก http://www2.diw.go.th/research/เอกสารเผยแพร่/อุบัติเหตุในห้องปฏิบัติการ.pdf
ศุภวรรณ ตันตยานนท์. เคมีกับความปลอดภัย ตอนที่ 1 อุบัติเหตุและการป้องกันอันตรายในห้องปฏิบัติการ :แนวปฏิบัติทั่วไป. สืบค้นเมื่อวันที่ 22 มิถุนายน 2562. จาก http://ww.chemsafety.research.chula.ac.th/html/content.html
Chemiday. ( 2018, 25 Feb ). Aluminum react with Potassium hydroxide and water. สืบค้นเมื่อวันที่ 23 มิถุนายน 2562. จาก https://chemiday.com/en/reaction/3-1-0-3052
กลับไปที่เนื้อหา
ปฏิกิริยาระหว่างกรดกับเบส
น้อง ๆ คงเคยได้ยินว่า เมื่อถูกแมลงเช่น ผึ้ง มด ต่อย ให้ใช้น้ำสบู่ สำลีชุบแอมโมเนีย หรือสารที่มีฤทธิ์เป็นเบสอ่อน ๆ เช็ดบริเวณที่ถูกแมลงต่อย หรือคนที่เป็นโรคกระเพาะ ให้รับประทานยาลดกรด ทำไมจึงเป็นเช่นนั้น ?
การกระทำดังกล่าวเป็นการนำความรู้เกี่ยวกับปฏิกิริยาของกรดกับเบสมาใช้ เนื่องจากว่าเหล็กในของแมลงต่างๆ เช่น ผึ้ง มด จะมีสมบัติเป็นกรด เมื่อถูกแมลงพวกนี้ต่อย การใช้เบสอ่อน ๆ หรือผงฟูซึ่งมีสมบัติเป็นเบส เช็ดบริเวณที่ถูกแมลงต่อย เป็นการลบล้างฤทธิ์
โรคกระเพาะ เกิดจากการที่มีกรดเกลือหลั่งลงไปในกระเพาะอาหารมากเกินไป อาจสืบเนื่องมาจาก ความเครียดของจิตใจหรือการกินอาหารที่ทำให้ระคายเคืองกระเพาะอาหารเข้าไป ทำให้เยื่อบุกระเพาะอักเสบหรือเป็นแผลในกระเพาะอาหารได้ ยาที่ใช้ในการรักษาจะต้องเป็นยาที่ไปลดความเข้มข้นของกรดเกลือในกระเพาะอาหาร โดยระงับการหลั่งของกรดเกลือ หรืออาจจะไประงับการสร้างกรดเกลือก็ได้ ยาต่างๆ เหล่านี้ได้แก่ยาที่มีส่วนผสมของสารพวกอลูมิเนียมไฮดรอกไซด์ แมกนีเซียมไฮดรอกไซด์ โซเดียมไบคาร์บอเนต สารเหล่านี้มีคุณสมบัติเป็นเบสจะทำปฏิกิริยาทางเคมีกับกรดเกลือ เป็นการลดความเข้มข้นของกรดเกลือในกระเพาะอาหารได้
นอกจากนี้ เกษตรกรยังมีการนำความรู้เกี่ยวกับปฏิกิริยาระหว่างกรดกับเบสไปใช้ในการปรับปรุงดินที่มีสภาพเป็นกรดซึ่งจะปลูกพืชไม่ได้ผลผลิตที่คุ้มทุน ต้องใส่ปูนขาวหรือดินมาร์ล ซึ่งเป็นเบสเพื่อลดความเป็นกรด
แต่ถ้าดินมีสภาพเป็นเบสมาก ก็จะมีการใส่ผงกำมะถัน เพื่อปรับสภาพดินให้เหมาะสมกับพืชที่ปลูก
ที่กล่าวมาข้างต้น เป็นเพียงบางส่วนของการนำความรู้เกี่ยวกับปฏิกิริยาระหว่างกรดกับเบสมาใช้ในชีวิตประจำวัน เรามาทำความเข้าใจเกี่ยวกับปฏิกิริยาระหว่างกรดและเบสกันว่ามีผลิตภัณฑ์อะไรเกิดขึ้นบ้างและผลิตภัณฑ์ที่เกิดขึ้นนั้นมีสมบัติอย่างไร
ปฏิกิริยาระหว่างกรดกับเบส
ปฏิกิริยาระหว่างกรดกับเบส มีชื่อเรียกปฏิกิริยาหลายอย่าง ได้แก่ ปฏิกิริยาสะเทิน ( Neutralization ) หรือปฏิกิริยาการสะเทิน หรือ ปฏิกิริยาลบล้างฤทธิ์ ซึ่งคำว่า “สะเทิน” หมายถึงการทำให้เป็นกลาง ซึ่งเมื่อนำกรดมาทำปฏิกิริยากับเบสจะเกิดการลดความเข้มข้น หรือลดความเป็นกรดเป็นเบสของสารตั้งต้นลง
เมื่อสารที่มีฤทธิ์เป็นกรดทำปฏิกิริยากับเบส จะเกิดผลิตภัณฑ์เป็นเกลือ และจะมีน้ำเกิดขึ้นเป็นส่วนใหญ่ ( ปฏิกิริยาสะเทินระหว่างกรดและเบสอาร์เรเนียส จะให้น้ำด้วยเสมอ ) แต่จะมีบางปฏิกิริยาที่ได้เกลือเพียงอย่างเดียว ดังสมการ
กรด + เบส -------------- > เกลือ + น้ำ
ชนิดของปฏิกิริยาระหว่างกรดและเบส มีดังนี้
- ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
ตัวอย่างปฏิกิริยา ได้แก่
H2SO4 ( aq ) + KOH ( aq ) -------------- > K2SO4 ( aq ) + 2H2O ( l )
HCl ( aq ) + NaOH ( aq ) -------------- > NaCl ( aq ) + H2O ( l )
HCl ( aq ) + KOH ( aq ) -------------- > KCl ( aq ) + H2O ( l )
- ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
ตัวอย่างปฏิกิริยา ได้แก่
HCl ( aq ) + NH4OH ( aq ) -------------- > NH4Cl ( aq ) + H2O ( l )
2 NH3 ( g ) + H2SO4 ( aq ) -------------- > (NH4)2SO4 ( s )
NH3 ( aq ) + HCl ( aq ) -------------- > NH4Cl ( s )
- ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
ตัวอย่างปฏิกิริยา ได้แก่
CH3COOH ( aq ) + NaOH ( aq ) ------- > CH3COONa ( aq ) + H2O ( l )
2CH3COOH ( aq ) + Ca(OH)2 ( aq ) ------- > (CH3COO)2Ca ( aq ) + 2H2O ( l )
2H3PO4 ( aq ) + 3Ba (OH)2 ( aq ) ------- > Ba (PO4)2 ( aq ) + 6H2O ( l )
- ปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อน
HCN ( aq ) + NH4OH ( aq ) ------- > NH4CN ( aq ) + H2O ( l )
H3PO4 ( aq ) + NH3 ( aq ) ------- > (NH4)3 PO4 ( aq )
ในการพิจารณาว่าเกลือที่เกิดจากปฏิกิริยาสะเทินนั้น มีสมบัติเป็นกรด กลาง หรือเบสนั้น สามารถพิจารณาจากสารตั้งต้นที่ทำปฏิกิริยากันดังนี้
- เกลือที่เกิดจากปฏิกิริยาระหว่างกรดแก่กับเบสแก่จะมีสมบัติเป็นกลาง เช่น
HCl ( aq ) + KOH ( aq ) ------- > KCl ( aq ) + H2O ( l )
กรดแก่ + เบสแก่ เกลือกลาง
- เกลือที่เกิดจากปฏิกิริยาระหว่างกรดแก่กับเบสอ่อนจะมีสมบัติเป็นกรด เช่น
2 NH3 ( g ) + H2SO4 ( aq ) ------- > (NH4)2SO4 ( s )
เบสอ่อน + กรดแก่ เกลือกรด
แอมโมเนียมซัลเฟต ((NH4)2SO4 ) เป็นสารเคมีที่ใช้ในอุตสาหกรรมผลิตปุ๋ย มีสมบัติเป็นกรด ช่วยปรับค่า pH ให้กับดิน
- เกลือที่เกิดจากปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่จะมีสมบัติเป็นเบส
CH3COOH ( aq ) + NaOH ( aq ) ------- > CH3COONa ( aq ) + H2O ( l )
กรดอ่อน + เบสแก่ เกลือเบส
- เกลือที่เกิดจากปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อนจะมีสมบัติเป็นกรด เบส หรือกลาง สามารถพิจาณาจากค่าคงที่การแตกตัวของกรด และเบส ( Ka, Kb ) โดย
- ถ้าสารตั้งต้นที่เป็นกรดอ่อนมีค่าคงที่การแตกตัวของกรด ( Ka ) มากกว่าค่าคงที่การแตกตัวของเบส ( Kb ) ของสารตั้งต้นที่เป็นเบสอ่อนแล้ว เกลือที่เกิดจากปฏิกิริยานี้จะมีสมบัติเป็นกรด เช่น
H3PO4 ( aq ) + NH3 ( aq ) ------- > (NH4)3 PO4 ( aq )
Ka = 7.5 x 10-3 Kb = 1.8 x 10-5 ------- > Ka > Kb = เกลือกรด
- ในทางตรงกันข้าม ถ้าสารตั้งต้นที่เป็นกรดอ่อนมีค่าคงที่การแตกตัวของกรด ( Ka ) น้อยกว่าค่าคงที่การแตกตัวของเบส ( Kb ) ของสารตั้งต้นที่เป็นเบสอ่อนแล้ว เกลือที่เกิดจากปฏิกิริยานี้จะมีสมบัติเป็นเบส
- ถ้าสารตั้งต้นที่เป็นกรดอ่อนมีค่าคงที่การแตกตัวของกรด ( Ka ) เท่ากับค่าคงที่การแตกตัวของเบส ( Kb ) ของสารตั้งต้นที่เป็นเบสอ่อนแล้ว เกลือที่เกิดจากปฏิกิริยานี้จะมีสมบัติเป็นกลาง
แหล่งที่มา
ศรีลักษณ์ ผลวัฒนะ. ( 2562 ). หนังสือเรียนรายวิชาเพิ่มเติมวิทยาสาสตร์ เคมีชั้นมัธยมศึกษาปีที่ 5 เล่ม 2 .( พิมพ์ครั้งที่ 1 ). กรุงเทพ ฯ : แม็คเอ็ดดูเคชั่น
The Angle of Chemistry. เรื่องกรด-เบส Ep.11 การเกิดเกลือ เเละปฏิกิริยาไฮโดรไลซิส. สืบค้นเมื่อวันที่ 22 มิถุนายน 2562. จาก https://www.youtube.com/watch?v=u2DA2X2nUCw
ปิยวัฒน์ มีทรัพย์ และคณะ. กรด เบส เกลือ. สืบค้นเมื่อวันที่ 22 มิถุนายน 2562. จาก https://chemistryprosite.wordpress.com/2017/03/05/featured-content-3/
กลับไปที่เนื้อหา
-
10514 ปฏิกิริยาเคมีของกรดและเบส /lesson-chemistry/item/10514-2019-07-18-01-38-45เพิ่มในรายการโปรด


