โครงสร้างอะตอม
อนุภาคมูลฐานของอะตอม
จากการศึกษาแบบจำลองของอะตอมของ Rutherford ทำให้ทราบว่าอะตอมประกอบด้วยอิเล็คตรอนและโปรตรอนโดยอิเล็คตรอนจะวิ่งอยู่รอบๆส่วนโปรตรอนจะรวมกันอยู่ตรงกลางเรียกว่านิวเคลียสและและมวลของโปรตรอนมีค่ามากกว่ามวลของอิเล็คตรอนอยู่ประมาณ 1800 เท่าจึ่งสามารถกล่าวได้ว่า
มวลอะตอม = มวลของนิวเคลียส = มวลรวมของโปรตรอน
แต่จากการหามวลอะตอมของธาตุต่าง ๆ พบว่ามวลอะตอมของธาตุยกเว้น H มีค่ามากกว่ามวลของนิวเคลียสมากกว่าเท่ากับ 2 เท่าทำให้ Rutherford สันนิษฐานว่าภายในนิวเคลียสน่าจะมีอนุภาคอีกชนิดหนึ่งซึ่งมีมวลใกล้เคียงกับโปรตรอนและเป็นกลางทางไฟฟ้า
ในปีค.ศ. 1930 (พ.ศ. 2473) W. Bothe และ H. Becker นักเคมีชาวเยอรมันได้ทดลองใช้อนุภาคแอลฟายิงแผ่นโลหะแบวิเลี่ยม (Be) ปรากฏว่าเกิดรังสีชนิดหนึ่งที่มีอำนาจทลุผ่านได้ดีและรังสีนี้เมื่อชนกับโมเลกุลของพาราฟินจะได้โปรตรอนออกมาต่อมาในปีค.ศ. 1932 (พ.ศ. 2475) JamesChadwick นักวิทยาศาสตร์อังกฤษได้เสนอว่ารังสีที่ชนแผ่นพาราฟินจนได้โปรตรอนออกมาแสดงว่าอะตอมจะต้องประกอบไปด้วยอนุภาคมากกว่าโปรตรอนและอิเล็คตรอนและตั้งชื่อให้อนุภาคใหม่ที่พบว่านิวตรอน (Neutron) นอกจากนี้ chadwick ยังได้พิสูจน์ว่าอนุภาคนิวตรอนไม่มีประจุ และคำนวณได้ว่านิวตรอนมีมวลใกล้เคียงกับโปรตรอน
การค้นพบนิวตรอนของแซควิค
(ก) การทดลองยิงอนุภาคแอลฟาผ่านแผ่นโลหะ
(ข) ก่อนและหลังการยิงอะตอมเบริลเลียมด้วยอนุภาคแอลฟา
จากการค้นพบนิวตรอน ทำให้ทราบว่าอะตอม ประกอบด้วยอนุภาคมูลฐาน 3 ชนิด คือ
- Electron ค้นพบโดย Thomson
- Proton ค้นพบโดย Glodstien
- Neutron ค้นพบโดย Chadwick
อนุภาคทั้ง 3 ชนิดนี้เรียกว่า อนุภาคมูลฐานของอะตอม ซึ่งมีสมบัติดังนี้
|
อนุภาค |
สัญลักษณ์ |
มวล(กรัม) |
เปรียบเทียบมวลกับอิเล็กตรอน |
ประจุไฟฟ้า (คูลอมบ์) |
ชนิดของประจุไฟฟ้า |
|
อิเล็กตรอน |
e |
9.109x10-28 |
1 |
1.602x10-19 |
-1 |
|
โปรตรอน |
P |
1.672x10-24 |
1836 |
1.602x10-19 |
+1 |
|
นิวตรอน |
n |
1.674x10-24 |
1836 |
- |
0 |
ไอโซโทป คือ ธาตุที่มีเลขอะตอมเหมือนกันแต่มีเลขมวลต่างกันหรือธาตุที่มีจำนวน Proton เท่ากันแต่มี
จำนวน neutron ต่างกัน เช่น

การหาไอโซโทปจะใช้เครื่องมือที่เรียกว่า Mass spectrometer
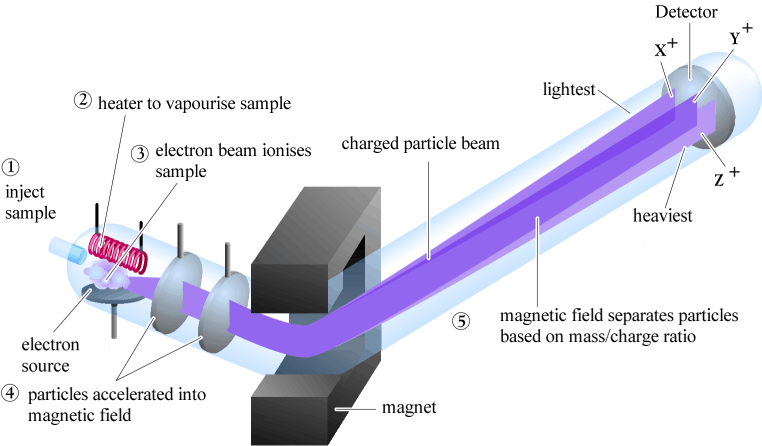
ภาพที่ 7 แสดงการทำงานของเครื่อง Mass spectrometer
ที่มา : http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch13/ch13-ms.html
วิธีการ เร่งไอออนบวกผ่านช่องแคบเข้าไปในสนามแม่เหล็ก ทิศทางของอนุภาคจะโค้งเบนได้มากน้อยเพียงใด ขึ้นอยู่กับมวลและประจุ
ถ้าประจุเท่ากัน : อนุภาคที่มีมวลเบาจะเบนไปมากกว่าอนุภาคที่มีมวลหนัก(หาไอโซโทป)
ถ้ามวลเท่ากัน : อนุภาคที่มีมวลเบาจะเบนไปมากกว่าอนุภาคที่มีประจุน้อย(หาเลขออกซิเดชัน)
เลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์
จากการศึกษาเกี่ยวกับโครงสร้างของอะตอม โดยมีข้อมูลต่างๆ จากการทดลองมาสนับสนุน สรุปได้ว่า อะตอมของธาตุต่างๆ จะประกอบด้วยอิเล็กตรอน โปรตอนและนิวตรอน (ยกเว้นอะตอมของธาตุไฮโดรเจน ที่ไม่มีนิวตรอน) ซึ่งมีจำนวนแตกต่างกันไป เลขที่แสดงจำนวนโปรตอนในนิวเคลียสของอะตอม เรียกว่าเลขอะตอม (atomic number, Z) เลขอะตอมจะเป็นค่าเฉพาะของธาตุ ธาตุชนิดเดียวกันจะมีเลขอะตอมเท่ากันเสมอ ซึ่งที่สภาวะปกติจะมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน ส่วนเลขที่แสดงจำนวนผลบวกของโปรตอนและจำนวนนิวตรอน เราเรียกว่า เลขมวล (mass number, A) ซึ่งในนิวเคลียสของอะตอม เลขมวลจะมีค่าใกล้เคียงกับเลขของอะตอม โดยผลต่างของเลขมวลกับเลขของอะตอมจะเท่ากับจำนวนนิวตรอนโดยสามารถเขียนสัญลักษณ์นิวเคลียร์ได้ คือ
เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียสของแต่ละอะตอมของธาตุ ในอะตอมที่เป็นกลางจะมีจำนวนโปรตอนเท่ากับจ้านวนอิเล็กตรอน ดังนั้นเลขเชิงอะตอมจึงบอกจำนวนของอิเล็กตรอนของธาตุได้ด้วย เนื่องจากอะตอมของธาตุชนิดเดียวกันมีค่าเลขเชิงอะตอมเท่ากันเสมอ เลขเชิงอะตอมจึงเป็นเอกลักษณ์ของธาตุชนิดเดียวกัน เช่น เลขเชิงอะตอมของฟอสฟอรัสเท่ากับ 15 นั้นคือทุกๆ อะตอมที่เป็นกลางของฟอสฟอรัสจะมี 15 โปรตอน และมี 15 อิเล็กตรอน และกล่าวได้ว่าอะตอมใดๆ ในจักรวาลถ้ามี 15 โปรตอนแล้ว จะเรียกว่า “ฟอสฟอรัส” ทั้งสิ้น
เลขมวล คือ ผลรวมของนิวตรอนและโปรตอนที่มีในนิวเคลียสของอะตอมของธาตุ นิวเคลียสในอะตอมอื่น ๆ ทั้งหมดจะมีทั้งโปรตอนและนิวตรอนอยู่ โดยทั่วไปแล้วเลขมวลหาได้ดังนี้
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
= เลขอะตอม + จำนวนนิวตรอน
จำนวนนิวตรอนในอะตอม = เลขมวล – เลขอะตอม
เช่น 2311Na ธาตุโซเดียม มีจำนวนโปรตอน (Z) = 11 มีจำนวนนิวตรอน = A – Z = 23 – 11 = 12 มีจำนวนอิเล็กตรอน = 11 (เท่ากับจำนวนโปรตอน)
ไอโซโทป (isotope) หมายถึง อะตอมของธาตุชนิดเดียวกันที่มีเลขอะตอม (Z) เท่ากัน แต่เลขมวล (A) ไม่เท่ากัน ตัวอย่างเช่น อะตอมของไฮโดรเจนมีเลขมวลสามชนิดโดยแตกต่างกันที่จำนวนนิวตรอน ได้แก่
ไฮโดรเจน (Hydrogen) มี 1 โปรตอนและไม่มีนิวตรอน มีสัญลักษณ์ 11H
ดิวทีเรียม (Deuterium) มี 1 โปรตอนและมี 1 นิวตรอน มีสัญลักษณ์ 21H
ทริเทียม (Tritium) มี 1 โปรตอนและมี 2 นิวตรอน มีสัญลักษณ์ 31H
สมบัติทางเคมีของธาตุถูกกำหนดโดยจำนวนโปรตอนและอิเล็กตรอนในอะตอม นิวตรอนไม่มีส่วนเกี่ยวข้องในการเปลี่ยนแปลงทางเคมีตามปกติ ดังนั้นไอโซโทปของธาตุเดียวกันจึงมีสมบัติทางเคมีเหมือนกันเกิดสารประกอบประเภทเดียวกันและมีความไวต่อปฏิกิริยาเคมี
ไอโซโทน (isotone) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีจำนวนนิวตรอนเท่ากัน แต่จำนวนโปรตอน เลขอะตอมและเลขมวลไม่เท่ากัน เช่น 3919K 4020Ca มีนิวตรอนเท่ากัน คือ 20
ไอโซบาร์ (isobar) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากันแต่เลขอะตอมต่างกัน เช่น 146C 147N
กลับไปที่เนื้อหา
สเปกตรัมของธาตุ
การเกิดสเปกตรัมอะตอม
การศึกษาสเปกตรัมอะตอมเปรียบเสมือนลายพิมพ์นิ้วมื้อของมนุษย์ซึ่งใช้พิสูจน์บุคคลได้เนื่องจากลายพิมพ์นิ้วมื้อแต่ละคนไม่เหมือนกันเป็นลักษณะเฉพาะบุคคลสเปกตรัมอะตอมก็เช่นกันเป็นลักษณะเฉพาะอะตอม ธาตุแต่ละชนิดจะมีชุดของสเปกตรัมอะตอมไม่เหมือนกันเลย ดังนั้นเราจึงใช้ข้อมูลที่อ่านได้จากชุดของสเปกตรัมเพื่อพิสูจน์อะตอมได้จากชุดของสเปกตรัมเพื่อพิสูจน์อะตอมได้
สเปกตรัมอะตอมเกิดขึ้นได้อย่างไร
แบบที่ 1: เกิดจากการเผาวัตถุแข็งหรือวัตถุเหลวให้ร้อน เช่น การเผาเกลือแกง (NaCl) จะได้ไอร้อน ของโซเดียมบริสุทธิ์ซึ่งจะปล่อยคลื่นแสงที่ประกอบด้วยคลื่นทุกย่านความถี่อย่างต่อเนื่อง สเปกตรัมที่เกิดจากวิธีนี้เรียกว่า สเปกตรัมต่อเนื่องแถบสว่าง (continuousbright spectrum)
แบบที่ 2: เกิดจากการเผาแก๊สให้ร้อนแทนที่จะเป็นวัตถุแข็งสเปกตรัมที่เกิดจากวิธีนี้เรียกว่าสเปกตรัมเส้นสว่าง (bright ling spectrum)
แบบที่ 3: เกิดจากการปล่อยให้คลื่นแสงที่มีความถี่ต่อเนื่อง(จากแบบที่ 1)ผ่านแก๊สเย็น สเปกตรัมที่ เกิดจากวิธีนี้ เรียกว่า สเปกตรัมต่อเนื่องกับเส้นมืด (continuous spectrum with dark lines)
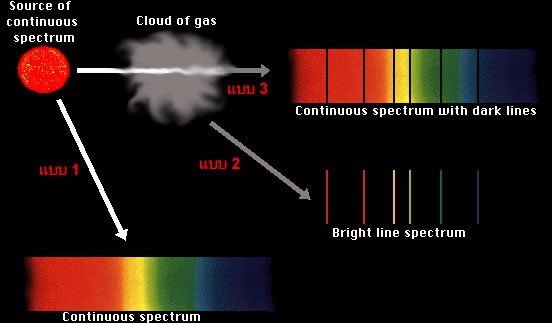
ภาพ แสดงสเปกตรัมต่อเนื่องกับเส้นมืด
ที่มา:http://www.electron.rmutphysics.com/news/index.php?option=com_content&task=view&id=675&Itemid=14
สังเกตตำแหน่งของเส้นสว่างในแบบที่ 2 จะเห็นได้ว่า ทุกเส้นจะอยู่ตรงตำแหน่งเดียวกับตำแหน่งของเส้นมืด ในแบบที่ 3 ทั้งที่เป็นเพราะแก๊สเย็นซึ่งอยู่ในสภาวะปกติ (ไม่ถูกกระตุ้น) ดูดกลืนคลื่นแสงที่มีความถี่ค่าตรงกัน กับความถี่ของคลื่นที่มันปลดปล่อยออกมาขณะร้อน นั้นหมายความว่า สถานะพลังงานของแก๊สต้องมีคุณลักษณะอะไรบางอย่างที่แน่นอนและกระบวนการเปลี่ยนแปลงระดับพลังงานต้องย้อนกลับได้
สเปกตรัมของไฮโดรเจนอะตอม
ทำไมต้องสนใจสเปกตรัมของไฮโดรเจนอะตอมนักวิทยาศาสตร์ให้ความสนใจศึกษาและเจาะลึกข้อมูลที่มาจากสเปกตรัมของไฮโดรเจนอะตอมมากเป็นพิเศษมากกว่าอะตอมของธาตุอื่นเพราะแม้ดวงอาทิตย์มีธาตุชนิดต่างๆจำนวนมากมายแต่ธาตุที่พบมากที่สุด คือ ธาตุไฮโดรเจน ชั้นบรรยากาศบนดวงอาทิตย์เพียง 2 ชั้นเท่านั้นที่มนุษย์สามารถมองเห็นได้ คือ ชั้นโฟโตสเฟียร์กับชั้นโครโมสเฟียร์เป็นชั้นบรรยากาศที่เย็นเพียงพอสำหรับธาตุไฮโดรเจนที่สามารถมีอยู่ได้ในรูปอะตอมและตรงนี้นี่เองที่เรามองเห็นสเปกตรัมการดูดกลืนและการคายคลื่นแสงของไฮโดรเจนอะตอม
การวิเคราะห์ข้อมูลจากลักษณะของสเปกตรัมเพื่อเสนอโครงสร้างอิเล็กดรอนของไฮโดรเจนอะตอมก่อนปี ค.ศ. 1913 ซึ่งเป็นปีที่นิล โบร์เสนอรูปแบบโครงสร้างอิเล็กตรอนของไฮโดรเจนอะตอมพร้อมทั้งแผนผังระดับพลังงานในอะตอมยังไม่มีใครพิสูจน์ทราบแน่ชัดว่ารูปแบบโครงสร้างที่ถูกต้องควรเป็นอย่างไรได้แต่เพียงพยายามตั้งสมมติฐานแล้วเสนอสมการทางคณิตศาสตร์อย่างง่ายเพื่อทำนายตำแหน่งของเส้นสเปกตรัมให้ตรงกับผลการวัดเท่านั้น
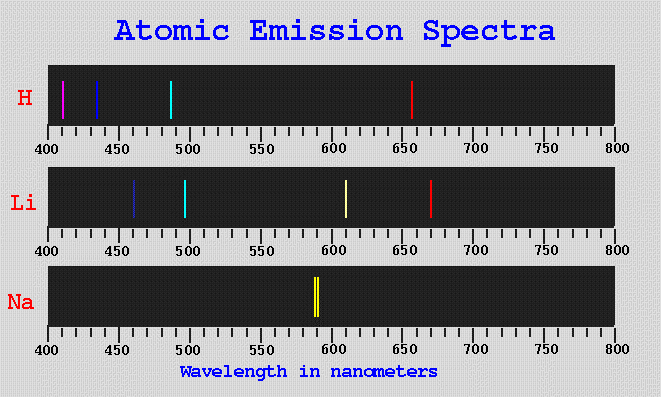
ภาพ แสดงตัวอย่างสเปกตรัมอะตอมแบบเส้นสว่างของธาตุบางตัว
ที่มา : http://cat.middlebury.edu/~chem/chemistry/class/general/ch103/hatom/intro.html
รูปแบบโครงสร้างพื้นฐานที่น่าจะนึกถึงมากที่สุด คือให้เปรียบเทียบกับระบบสุริยะโดยคิดว่าอะตอมไฮโดรเจนประกอบด้วยนิวเคลียส (เทียบได้กับดวงอาทิตย์) อยู่ตรงกึ่งกลางของระบบมีอิเล็กตรอนหนึ่งตัว(เทียบได้กับว่าระบบนี้มีดาวเคราะห์เพียงดวงเดียว) เคลื่อนที่รอบนิวเคลียสเป็นวงโคจรที่มีรัศมีขนาดต่างๆโดยมีเงื่อนไขว่าอิเล็กตรอนสามรถโคจรในวงโคจรได้ที่ละวงตามที่กำหนดเราจะเรียกเป็นวงที่ 1 , 2 ,.......n จากวงสุดท้ายตามลำดับเมื่ออิเล็กตรอนกระโดนจากวงในวงหนึ่งไปยังวงนอกอีกวงหนึ่งมันจะดูดกลื่นพลังงานค่าหนึ่งที่มีค่าแน่นอนทำให้เราได้สเปกตรัมการดูดกลื่นแต่ถ้าหล่นลงมาจากวงนอกวงเดิมเข้าสู่วงในเดิมมันจะปลดปล่อยพลังงานด้วยค่าเดียวกันและเราจะได้สเปกตรัมการปลดปล่อยกระบวนการดูดกลื่นและปลดปล่อยพลังงานด้วยวิธีนี้เราอาจสร้างสมการคณิตศาสตร์อย่างง่ายเพื่อทำนายตำแหน่ง
กลับไปที่เนื้อหา
การจัดเรียงอิเล็กตรอน
การจัดเรียงอิเล็กตรอนในระดับพลังงานหลัก (Shell/Energy level)
จากการศึกษาเรื่องพลังงานไอออไนเซชัน ทำให้นักวิทยาศาสตร์สามารถทราบว่าในแต่ละระดับพลังงานมีจำนวนอิเล็กตรอนได้มากที่สุดกี่อิเล็กตรอน โดยให้ n แทนลำดับที่ของพลังงาน (n = 1 , 2 , 3 , …ตามลำดับ) จำนวนอิเล็กตรอนที่มีได้มากที่สุดในแต่ละระดับพลังงาน = 2n2
ระดับพลังงาน n = 1 มีจำนวนอิเล็กตรอนได้มากที่สุด = 2n2 = 2 x 12 = 2
ระดับพลังงาน n = 2 มีจำนวนอิเล็กตรอนได้มากที่สุด = 2n2 = 2 x 22 = 8
ระดับพลังงาน n = 3 มีจำนวนอิเล็กตรอนได้มากที่สุด = 2n2 = 2 x 32 = 18
ระดับพลังงาน n = 4 มีจำนวนอิเล็กตรอนได้มากที่สุด = 2n2 = 2 x 42 = 32
แต่สูตรการหาจำนวนอิเล็กตรอนดังกล่าวใช้ได้กับระดับพลังงาน n = 1 ถึง n = 4 เท่านั้น เพราะในระดับพลังงานต่อ ๆ ไปจะมีอิเล็กตรอนไม่เกิน 32 นอกจากนั้นการศึกษาค่าพลังงานไอออไนเซชัน พบว่าอิเล็กตรอนวงนอกซึ่งเรียกว่า เวเลนซ์อิเล็กตรอน ของธาตุต่าง ๆ มีได้ไม่เกิน 8
เวเลนซ์อิเล็กตรอน คือ จำนวนอิเล็กตรอนในระดับพลังงานนอกสุดหรือสูงสุด ของแต่ละธาตุจะมีอิเล็กตรอนไม่เกิน 8
หลักการจัดอิเล็กตรอน การจัดอิเล็กตรอนจะต้องจัดอิเล็กตรอนในระดับพลังงานต่ำสุดก่อน แล้วจึงจัดในระดับพลังงานสูงขึ้นไป และอิเล็กตรอนวงนอกต้องไม่เกิน 8
ตัวอย่าง ธาตุ Mg มีเลขอะตอม = 12 แสดงว่า Mg มีโปรตรอนและอิเล็กตรอน = 12 ตัว ในการศึกษาค่า IE ลำดับต่าง ๆ IE1 – IE2 พบว่ามีค่าอยู่ 3 กลุ่ม ดังนี้
กลุ่มที่ 1 IE = 0.74 , 1.45 [IE1 , IE2]
กลุ่มที่ 2 IE = 0.73 , 10.54 , 13.63 , 18.0 , 21.71 , 25.66 , 31.65 , 35.64 [IE3 ... IE10]
กลุ่มที่ 3 IE = 170.0 , 189.37 [IE11 , IE12]
การจัดเรียงอิเล็กตรอนเป็น 2 8 2
การจัดเรียงอิเล็กตรอน มีความสัมพันธ์กับการจัดหมู่และคาบอย่างไร
- เวเลนซ์อิเล็กตรอน จะตรงกับเลขที่ของหมู่ ดังนั้น ธาตุที่อยู่หมู่เดียวกันจะมีเวเลนซ์อิเล็กตรอน เท่ากัน
- จำนวนระดับพลังงาน จะตรงกับเลขที่ของคาบ ดังนั้น ธาตุในคาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากัน เช่น 35Br มีการจัดเรียงอิเล็กตรอนดังนี้ 2 , 8 , 18 , 7 ดังนั้น Br จะอยู่ในหมู่ที่ 7 เพราะมีเวเลนซ์อิเล็กตรอน 7 และอยู่คาบที่ 4 เพราะมีจำนวนระดับพลังงาน 4
หลักการจัดเรียงอิเล็กตรอน
- จะต้องจัดเรียงอิเล็กตรอนเข้าในระดับพลังงานต่ำสุดให้เต็มก่อน จึงจัดให้อยู่ระดับพลังงานถัดไป
- เวเลนซ์อิเล็กตรอนจะเกิน 8 ไม่ได้
- จำนวนอิเล็กตรอนในระดับพลังงานถัดเข้าไปของธาตุในหมู่ IA , IIA เท่ากับ 8 ส่วนหมู่ IIIA - VIIIA เท่ากับ 18
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
การจัดอิเล็กตรอนในระดับพลังงานหลัก ทำให้แต่ละระดับพลังงานมีจำนวนอิเล็กตรอนมากจึงเกิดปัญหาว่าอิเล็กตรอนเหล่านั้นอยู่ในระดับพลังงานเดียวกันได้อย่างไร ทำไมจึงไม่ผลักกัน เพื่อแก้ปัญหาดังกล่าว นักวิทยาศาสตร์จึงได้ศึกษาเกี่ยวกับระดับพลังงานย่อยเพื่อกระจายอิเล็กตรอนในแต่ละระดับพลังงานหลัก เข้าสู่ระดับพลังงานย่อย โดยอาศัยรูปแบบโคจรของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นเกณฑ์ในการแบ่งอิเล็กตรอนเป็นกลุ่มย่อย ๆ และเรียกรูปแบบวงโคจรนี้ว่าออร์บิทัล (Orbital) โดย 1 ออร์บิทัลจะมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ระดับพลังงานย่อยมี 4 ระดับ คือ s, p, d, f โดยระดับพลังงานย่อยมี
s มี 1 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 2 อิเล็กตรอน
p มี 3 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 6 อิเล็กตรอน
d มี 5 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 10 อิเล็กตรอน
f มี 7 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 14 อิเล็กตรอน
หลักการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
- จัดอิเล็กตรอนในระดับพลังงานย่อยต่าง ๆ จะต้องจัดเข้าในระดับพลังงานย่อยที่มีพลังงานต่ำสุดก่อนแล้วจึงจัดเข้าสู่ระดับพลังงานย่อยที่มีพลังงานสูงขึ้น(ตามหลักของเอาฟบาว) ดังแผนผังต่อไปนี้
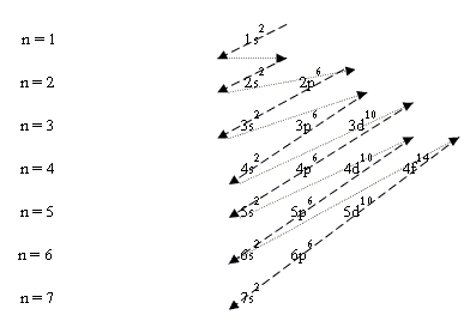
จากแผนภาพจัดเรียงอิเล็กตรอนเข้าสู่ระดับพลังงานย่อยได้ดังนี้
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
เช่น 17Cl มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย 1s2 2s2 2p6 3s2 3p5
21Se มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย 1s2 2s2 2p6 3s2 3p6 4s2 3d1
- อิเล็กตรอน2 ตัว ที่อยู่ในออร์บิทัลเดียวกัน จะต้องมีทิศทางการเคลื่อนที่สวนทางกันโดยแสดงทิศทางด้วยลูกศรตามหลักการของเพาลี
- การจัดอิเล็กตรอนเข้าสู่ระดับพลังงานย่อยถ้าอิเล็กตรอนบรรจุอยู่กึ่งหนึ่งหรือบรรจุเต็มออร์บิทัลจะมีโครงสร้างแบบเสถียร เช่น
24Cr มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย ดังนี้1s2 2s2 2p6 3s2 3p6 4s1 3d5 ไม่ใช่ 1s2 2s2 2p6 3s2 3p6 4s2 3d4
เพราะโครงสร้างแบบแรกเสถียรกว่า เพราะ 4s และ 3d จะบรรจุกึ่งหนึ่ง หรือเขียนโครงสร้างของอิเล็กตรอนแบบย่อ ๆ ได้ว่า (Ar) 4s1 3d5

ข้อสังเกตที่ได้จากการใช้จัดเรียงอิเล็กตรอนในอะตอม
- เลขอะตอมคู่จะอยู่ในหมู่คู่ เลขอะตอมคี่จะเป็นธาตุในหมู่คี่ เช่น
ธาตุ 14Si จะเป็นธาตุในหมู่ 4
ธาตุ 11Na จะเป็นธาตุในหมู่ 1
- ธาตุหมู่IA และ IIA ตั้งแต่คาบ 3 ขึ้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 8 เสมอ เช่น
11Na จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 1 12Mg จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 2
19K จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 1 20Ca จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 2
- ธาตุหมู่IIIA ถึง VIIIA ตั้งแต่หมู่ที่ IIIA คาบ 4 เป็นต้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 18 เสมอ เช่น
31Ga 2, 8, 18, 3 (หมู่ 3 คาบ 4)
33As 2, 8, 18, 5 (หมู่ 5 คาบ 4)
- ถ้าธาตุนั้นมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามข้อ2 และ 3 คือมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้น มีค่าตั้งแต่ 9 – 18 แต่วงนอกสุดมีเวเลนซ์อิเล็กตรอนเป็น 1หรือ 2 นักเรียนก็ทำนายได้ทันทีว่าเป็นธาตุแทรนซิชัน เช่น
29Cu 2, 8, 18, 1 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,18, 1
23V 2, 8, 8, 5 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,11, 2
หมายเหตุ ธาตุแทรนซิชันที่มีเลขอะตอมตั้งแต่ 21 – 30 จะมีเวเลนซ์อิเล็กตรอนเป็น 2 ยกเว้น Cu กับCr จะมีเวเลนซ์อิเล็กตรอนเป็น 1
แหล่งที่มา
การเกิดสเปกตรัมอะตอม. สืบค้นเมื่อ 22 มิถุนายน 2560, จาก
http://www.electron.rmutphysics.com/news/index.php?option=com_content&task=view&id=675&Itemid=14
Spectroscopy
Retrieved June 22, 2017, from
http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch13/ch13-ms.html
กลับไปที่เนื้อหา
-
7446 โครงสร้างอะตอม /lesson-chemistry/item/7446-2017-08-11-07-23-27เพิ่มในรายการโปรด


