สารละลายกรด เบส
ในแต่ละวันถ้าเรารับประทานผลไม้ เช่น ส้ม แอปเปิ้ล หรือน้ำผลไม้ แสดงว่าเรารับประทานกรดเข้าสู่ร่างกายแล้ว และขณะเดียวกันหากเราล้างห้องน้ำด้วยน้ำยาล้างห้องน้ำก็แสดงว่าเราใช้กรดในการทำความสะอาดเช่นเดียวกัน ผลิตภัณฑ์หลายอย่างมีกรดเป็นส่วนประกอบ กรด คืออะไร มีสมบัติอย่างไร และเกิดปฏิกิริยาอย่างไรจะได้เรียนรู้ในบทเรียนนี้

ภาพที่ 1 acid
ที่มา จาก https://pixabay.com/th/ , Clker-Free-Vector-Images
สมบัติของกรด
กรด คืออะไร เราจะทราบได้จากการทดสอบหรือการทำปฏิกิริยาเคมีซึ่งกรดเป็นสารประกอบที่มีสมบัติเฉพาะตัว คือ กรดเป็นสารที่มีรสเปรี้ยว ทำปฏิกิริยากับหินปูนหรือคาร์บอเนต สามารถเปลี่ยนสีกระดาษลิตมัสจากน้ำเงินเป็นแดง
กรด แบ่งได้ 2 ประเภทคือ กรดอินทรีย์ กรดอนินทรีย์
*กรด มี 2 ชื่อคือ กรดไฮโดร กับกรดออกซี่
Hydro = HCl* HBr HI HF HCN ฯลฯ กรดเหล่านี้ออกเสียง “ไฮโดร” นำหน้าแล้วตามด้วยสารที่ตามมา
*HCl = ก๊าซไฮโดรเจนคลอไรด์ หรือ กรดเกลือ
Oxy = HNO3 H2SO4 HClO3 H2CO3 * ฯลฯ กรดเหล่านี้ออกเสียง “อิก” ลงท้ายเสมอ * H2CO3 ไม่เสถียรจะแตกตัวให้ H2O, CO2
รสเปรี้ยว ถ้าเราเคยชิมวิตามินซี รสเปรี้ยวของกรดก็เป็นเช่นนั้น โดยวิตามีนซีมีองค์ประกอบหลักคือ กรดแอสคอร์บิก ส่วนผลไม้ตะกูลส้ม เช่น มะนาว ส้มโอ ส้มเขียวหวาน ก็มีความเป็นกรดเช่นเดียวกัน โดยมีกรดที่ชื่อว่ากรดซิตริก (Critic acid) ผสมอยู่ ในผลไม้อื่นๆ เช่น มะเขือเทศ เชอร์รี่ และแอปเปิลก็เป็นกรด น้ำส้มสายชูที่ใช้ปรุงอาหารก็ประกอบด้วยสารละลายกรดอะซิติกในน้ำ น้ำชาก็เช่นเดียวกันแม้กระทั่งนมบูด แต่การตรวจสอบความเป็นกรดของสารคงไม่ใช่การชิมเพื่อทดสอบรสชาติ แม้ว่าสารที่เป็นกรดมักมีรสเปรี้ยวแต่ก็ไม่ได้หมายความสารที่ไม่ได้มีรสเปรี้ยวไม่แสดงสมบัติความเป็นกรด
ปฏิกิริยากับโลหะ เมื่อเรานำโลหะมาทำปฏิกิริยากับกรดจะเกิดฟองแก๊สเกิดขึ้นซึ่งฟองที่เกิดขึ้นคือแก๊สไฮโดรเจน มีโลหะบางชนิดเท่านั้นที่ทำปฏิกิริยากับกรดได้ เช่น แมกนีเซียม สังกะสี และเหล็ก เป็นต้น ขณะที่เกิดปฏิกิริยาขึ้นโลหะก็จะละลายไปในสารละลาย การสังเกตนี้เป็นเหตุผลหนึ่งที่จัดกรดว่าเป็นสารกัดกร่อน (Corrosive) ซึ่งหมายถึงกรดสามารถ “กัด” วัสดุอื่น ๆ ได้ ตัวอย่างปฏิกิริยาเป็นดังนี้
Mg(s) + HCl(aq) ----------> MgCl2(aq) + H2(g)
ปฏิกิริยากับคาร์บอเนต กรดทำปฏิกิริยากับสารประกอบคาร์บอเนตในลักษณะเฉพาะตัว คาร์บอเนตไอออนประกอบด้วยอะตอมคาร์บอนและอะตอมออกซิเจนเชื่อมต่อกัน และมีประจุเป็นลบ เมื่อกรดทำปฏิกิริยากับสารประกอบคาร์บอเนตจะเกิดแก๊สเกิดขึ้น
นักธรณีวิทยาใช้ประโยชน์จากปฏิกิริยาระหว่างกรดกับสารประกอบคาร์บอเนตเพื่อระบุว่าหินชนิดใดเป็นหินปูน หินปูนเป็นหินที่มีแคลเซียมคาร์บอเนต(CaCO3) เป็นองค์ประกอบ เมื่อหยดสารละลายกรดไฮโดรคลอริก (HCl) ที่เจือจางลงบนหินปูน จะเกิดฟองแก๊สคาร์บอนไดออกไซด์ ขึ้นพิจารณาดังสมการแสดงดังปฏิกิริยา
2HCl(aq) + CaCO3(s) ----------> CaCl2(aq) + CO2(g) + H2O(g)
ปฏิกิริยานี้ใช้ระบุว่าหินชนิดใดเป็นหินปูน แนวประการรังเป็นรูปแบบหนึ่งของหินปูนที่พบในทะเล แนวโครงสร้างที่ใหญ่โตของปะการังเกิดจากการสร้างแคลเซียมคาร์บอเนตห่อหุ้มของสัตว์ทะเลตัวเล็กๆ ชอล์ก็เป็น หินปูนอีกชนิดหนึ่งซึ่งเกิดจากส่วนที่แข็งของสัตว์ทะเลขนาดจิ๋วที่ผ่านการทับถมเป็นชั้นหนาขึ้น เมื่อเวลาผ่านไปนานเข้าชั้นเหล่านี้ก็จะอัดแน่นจนแข็งตัวกลายเป็นชอล์ก
ปฏิกิริยากับอินดิเคเตอร์ ถ้าเราทำกิจกรรมใช้กระดาษลิตมัสทดสอบสารบางชนิด กระดาษลิตมัสเป็นตัวอย่างหนึ่งของตัวตรวจสอบกรด - เบส ซึ่งอินดิเคเตอร์ก็คือสารประกอบที่มีสมบัติเป็นกรดอ่อน ๆ จะเปลี่ยนสีเมื่อสัมผัสกับสารละลายกรด - เบส เช่น น้ำส้มสายชูและน้ำมะนาวจะเปลี่ยนสีกระดาษลิตมัสจากสีน้ำเงินเป็นแดง
>>>> สมบัติของอินดิเคเตอร์ >>>>>>
1. อินดิเคเตอร์แต่ละชนิดมีช่วง pH ของการเปลี่ยนสีจำกัด
2. อินดิเคเตอร์โดยทั่วไปจะมีสารที่ให้สีแตกต่างกัน
3. สีของอินดิเคเตอร์จะเปลี่ยนไปเมื่อค่า pH เปลี่ยนแปลง
เนื่องจากอินดิเคเตอร์แต่ละชนิดเปลี่ยนสีในช่วง pH จำกัดทำให้การตรวจหาค่า pH ของสารละลายไม่สะดวก จึงได้มีการนำอินดิเคเตอร์หลายชนิดที่มีช่วง pH ต่อเนื่องมาผสมกันในอัตราส่วนพอเหมาะ โดยสามารถเปลี่ยนสีในช่วง pH ของสารละลายได้กว้าง เรียกว่า ยูนิเวอร์ซัลอินดิเคเตอร์ (Universal indicator)
ตัวอย่างการเปลี่ยนสีของเมทิลเรด ซึ่งเป็นอินดิเคเตอร์ที่มีสมบัติเป็นกรดอ่อนเมื่ออยู่ในรูปโมเลกุล (HIn) ซึ่งเป็นรูปกรด (acid form) จะมีสีแดง และเมื่ออยู่ในรูปไอออน (In–) ซึ่งอยู่ในรูปเบส (base form) หรือเป็นคู่เบสจะมีสีเหลือง เมื่ออยู่ในสารละลายที่มีน้ำเป็นตัวทำละลายจึงมีภาวะสมดุล
ยูนิเวอร์ซัลอินดิเคเตอร์ คือ อินดิเคเตอร์ที่เกิดจากการนำอินดิเคเตอร์หลาย ๆ ชนิด ซึ่งเปลี่ยนสีในช่วง pH ต่าง ๆ กันมาผสมกัน อินดิเคเตอร์นี้สามารถเปลี่ยนสีได้ในสารละลายที่มี pH ต่างกันเกือบทุกค่า มีในรูปแบบกระดาษ เรียกว่ากระดาษ pH และนอกจากนั้นยังมีในรูปเป็นสารละลาย ดังนั้นจึงนิยมใช้ ยูนิเวอร์ซัลอินดิเคเตอร์หาค่า pH โดยการประมาณของสารละลายต่าง ๆ ได้โดยเติมอินดิเคเตอร์ชนิดนี้ลงในสารละลายที่ต้องการหาค่า pH แล้วเทียบสีที่ปรากฏกับแถบสีข้าง ๆ กล่อง จะทำให้ทราบค่า pH ของ สารนั้น ๆ ได้ ตัวอย่างยูนิเวอร์ซัลอินดิเคเตอร์ แสดงดังภาพ
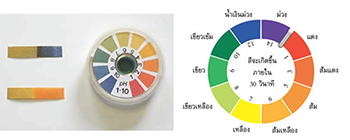
ภาพที่ 2 แสดงยูนิเวอร์แซลอินดิเคเตอร์
ที่มา: http://119.46.166.126/self_all/selfaccess11/m5/chemistry5_2/lesson4/lesson4_2.php
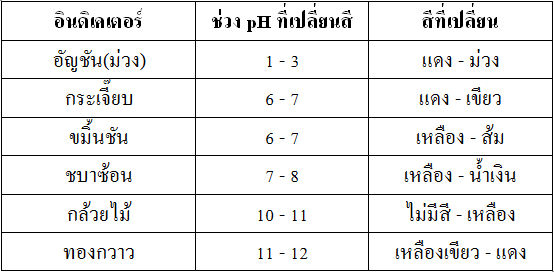
ภาพตารางแสดงตัวอย่างอินดิเคเตอร์ธรรมชาติบางชนิด
ที่มา: http://119.46.166.126/self_all/selfaccess11/m5/chemistry5_2/lesson4/lesson4_2.php
จากตารางจะเห็นว่าช่วงการเปลี่ยนสีของอินดิเคเตอร์แต่ละชนิดจะมีค่าแตกต่างกัน และสีที่เปลี่ยนก็จะแตกต่างกันไปตามชนิดของอินดิเคเตอร์ ช่วงการเปลี่ยนสีของอินดิเคเตอร์อธิบายได้ ดังนี้ เช่น
เมทิลออเรนจ์ มีช่วง pH การเปลี่ยนสีอยู่ระหว่าง 3.2 - 4.4 โดยสีที่เปลี่ยน คือ แดง – เหลือง หมายความว่า
- ถ้านำเมทิลออเรนจ์ไปทดสอบสารที่มี pH ต่ำกว่า 3.2 จะปรากฏสีแดง
- ถ้านำเมทิลออเรนจ์ไปทดสอบสารที่มี pH มากกว่า 4.4 จะปรากฏสีเหลือง
- ถ้านำเมทิลออเรนจ์ไปทดสอบสารที่มี pH อยู่ระหว่าง 3.2 – 4.4 จะปรากฏสีส้ม
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนเคมีพื้นฐานและเพิ่มเติม ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 3 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์ ปฏิกิริยาเคมี. กรุงเทพฯ:เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
กลับไปที่เนื้อหา
สมบัติของเบส
เบสเป็นกลุ่มของสารประกอบที่สามารถบ่งบอกได้ตามสมบัติที่ร่วมกันคือ เบสเป็นสารที่มีรสขม มีความลื่น และเปลี่ยนสีกระดาษลิตมัสสีแดงเป็นสีน้ำเงิน หรือกล่าวได้ว่า เบสเป็นสารที่มีสมบัติ “ตรงข้าม” กับกรด
รสขม ความขมอ่อนๆ ของน้ำโทนิคเกิดจากสารที่มีชื่อว่าควินิน (quinine) ซึ่งเป็นเบสชนิดหนึ่ง เบสเป็นสารที่มีรสขม ดังนั้น สบู่ แชมพู และน้ำยาทำความสะอาดล้วนมีรสขมทั้งนั้น แต่เราก็ไม่ควรทดสอบด้วยการชิมรสชาติของสาร แม้ว่าสารบางอย่างเราสามารถกินได้ก็ตาม
ความลื่น นักเรียนล้างมือโดยใช้สบู่ถูมือ ความลื่นที่นักเรียนรู้สึกเป็นลักษณะเฉพาะตัวที่สำคัญของสารที่เป็นเบส การทดสอบสารที่สงสัยด้วยการสัมผัสเป็นสิ่งที่ไม่ควรกระทำเหมือนดั่งที่นักเรียนไม่ควรทดสอบสารด้วยการชิม เพราะเบสแก่จะระเคยเคืองต่อผิวหรือแม้กระทั่งทำให้ผิวหนังไหม้ได้ ยังมีวิธีศึกษาสมบัติอื่นในการทดสอบเบสที่ปลอดภัยก่อน
เบสทำปฏิกิริยากับกรดจะได้เกลือและน้ำ ตัวอย่างเช่น สารละลายโซดาไฟ (โซเดียมไฮดรอกไซด์) ทำปฏิกิริยากับกรดเกลือ (กรดไฮโดรคอริก) จะได้เกลือโซเดียมคลอไรด์ นอกจากนี้สารละลายโซดาไฟสามารถทำปฏิกิริยากับกรดไขมันได้เกลือโซเดียมของกรดไขมัน หรือที่เราเรียกว่า สบู่ (Soap)
ปฏิกิริยากับอินดิเคเตอร์ เมื่อกระดาษลิตมัสสามารถทดสอบความเป็นกรดได้ ก็น่าจะใช้ทดสอบเบสได้เช่นกัน เบสจะเปลี่ยนสีกระดาษลิตมัสจากแดงเป็นน้ำเงิน เบสสามารถทำปฏิกิริยากับอินดิเคเตอร์อื่น ๆ ได้เช่นเดียวกับกรดแต่จากการใช้กระดาษลิตมัสจะให้ผลแน่นอนและปลอดภัย วิธีง่าย ๆ สำหรับจดจำการเปลี่ยนสีกระดาษลิตมัสของกรดหรือเบสคือจำว่า base ซึ่งเป็นการเรียกเบสในภาษาอังกฤษขึ้นต้นด้วยตัวอักษร b ดังนั้นจะเปลี่ยนสีกระดาษเป็นสีน้ำเงินหรือ blue นั่นเอง
ปฏิกิริยาของเบส ปฏิกิริยาของเบสแตกต่างจากรดคือ เบสไม่ทำปฏิกิริยากับโลหะหรือสารประกอบคาร์บอเนต ข้อมูลที่บอกว่าเบสไม่ทำปฏิกิริยากับสารประกอบสารบางประเภทนั้นไม่น่าจะมีประโยชน์ แต่การรู้ข้อมูลว่าสารประกอบชนิดหนึ่ง ๆ ไม่ทำปฏิกิริยากับอะไรบ้าง ก็ถือว่านักเรียนได้รู้สมบัติบางอย่างของสารชนิดนั้นแล้ว เช่น นักเรียนรู้ว่าสารนั้นไม่ใช่กรด สมบัติอีกอย่างหนึ่งที่สำคัญของเบสคือ เบสทำปฏิกิริยากับกรดได้

ภาพ base
ที่มา ดัดแปลงจาก https://pixabay.com/th/ , PublicDomainPictures
เบสในสารละลาย
ไอออนในสารละลายเบส
ในสารละลายเบสทุกชนิดจะมีไอออนที่เหมือนกันอยู่คือ ไฮดรอกไซด์ไอออน ( OH-) ซึ่งทำให้เบสมีสมบัติเหมือนกัน และมีสมบัติต่างไปจากกรด ตัวอย่างเช่น เมื่อ NaOH ละลายน้ำจะแตกตัวได้ OH- ดังนี้
NaOH (s) ----> Na+(aq) + OH- (aq)
KOH (s) ----> K+ (aq) + OH- (aq)
แต่ไม่ใช่ว่าเบสทุกตัวจะมีไฮดรอกไซด์ไอออนอยู่ในโมเลกุล ตัวอย่างเช่น แก๊สแอมโมเนีย (NH3) ไม่มีไฮดรอกไซด์เป็นองค์ประกอบ แต่เมื่ออยู่ในสารละลายแอมโมเนียจะทำปฏิกิริยากับน้ำแล้วเกิดไฮดรอกไซด์ไอออนขึ้น
NH3 (g) + H2O (l) ----> NH4+ (aq) + OH-(aq)
ถ้าสังเกตให้ดีจะเห็นว่า ปฏิกิริยาทั้งสองมีทั้งไอออนบวกและไฮดรอกไซด์ไอออนซึ่งเป็นไอออนลบ ตัวอย่างนี้จะทำให้สามารถให้คำจำกัดความหรือนิยามของสารละลายเบสอีกแบบหนึ่งได้ว่า เบสคือสารที่สามารถแตกตัวได้ไฮดรอกไซด์ไอออนเมื่ออยู่ในน้ำ ไฮดรอกไซด์ไอออนนี้เองทำให้เกิดรสขมและความรู้สึกลื่นของเบส และไฮดรอกไซด์ก็เป็นสิ่งที่ทำให้กระดาษลิตมัสจากสีแดงเป็นสีน้ำเงิน
ความแรงของเบส
การเปรียบเทียบความแรงของกรดและเบส อาจจะพิจารณาได้ดังนี้
1. ดูจากการแตกตัวของเบส
กรดที่มีการแตกตัวมาก มีความเป็นกรดมาก กรดและเบสที่แตกตัวได้ 100% จะเรียกว่ากรดแก่ และเบสแก่ ตามลำดับ ซึ่งสามารถนำไฟฟ้าได้ดี แต่ถ้ากรดและเบสนั้นแตกตัวได้เพียงบางส่วนก็จะเรียกว่า กรดอ่อน หรือเบสอ่อน ตามลำดับ ซึ่งการนำไฟฟ้าจะไม่ดี สำหรับการพิจารณาค่าการแตกตัวของกรดและเบสนั้น นอกจากจะคิดจากเปอร์เซ็นต์การแตกตัว หรืออาจจะดูได้จากค่าคงที่สมดุลของการแตกตัวของกรดหรือเบส (Ka หรือ Kb) เช่น ความแรงของเบส พิจารณาจากค่า Kb กล่าวคือ ถ้ามีค่า Kb มาก มีความเป็นเบสมากกว่า Kb น้อย เช่น
NH3 Kb = 1.76 x 10-5
N2H4 Kb = 9.5 x 10-7
C 6H5NH2 Kb = 4.3 x 10 -10
ความเป็นเบส NH3> N2H4 > C6H5NH2
2. ดูจากความสามารถในการให้และรับโปรตอน
เบสแก่ ได้แก่ เบสที่รับโปรตอนได้มาก
เบสอ่อน ได้แก่ เบสที่รับโปรตอนได้น้อย
โดยมีข้อสังเกตเกี่ยวกับคู่กรด- เบส ดังนี้
การแตกตัวของเบสแก่
เบสแก่ หมายถึงเบสที่เมื่อละลายน้ำแล้วสามารถแตกตัวเป็นไอออนได้ 100 %
ตัวอย่างเบสแก่ ได้แก่
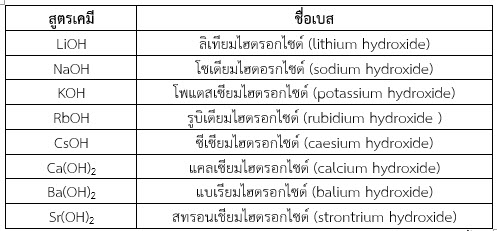
สารประกอบไฮดรอกไซด์ของธาตุหมู่ 1 ซึ่งมีสูตรทั่วไป XOH เมื่อละลายน้ำจะแตกตัวให้ไอออนบวกและไฮดรอกไซด์ไอออน โดยโมลหรือความเข้มข้นของไอออนบวก ไฮดรอกไซด์ไอออนและเบสจะเท่ากัน ดังสมการ
XOH(aq) ——> X+(aq) + OH–(aq)
ตัวอย่าง NaOH(aq) ——> Na+(aq) + OH–(aq)
KOH(aq) ——> K+(aq) + OH–(aq)
2 mol 2 mol 2 mol
0.5 mol/dm3 0.5 mol/dm3 0.5 mol/dm3
สรุป สำหรับเบสแก่ XOH
[OH–] = [XOH–]
สารประกอบไฮดรอกไซด์ของธาตุหมู่ 2 ซึ่งมีสูตรทั่วไป Y(OH)2 เมื่อละลายน้ำจะแตกตัวให้ไอออนบวกและไฮดรอกไซด์ไอออน โดยโมลหรือความเข้มข้นของไฮดรอกไซด์ไอออนจะเป็นสองเท่าของโมลหรือความเข้มข้นของไอออนบวกและเบส ดังสมการ
Y(OH)2(aq) ——> Y2+(aq) + 2OH–(aq)
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนเคมีพื้นฐานและเพิ่มเติม ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 3 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์ ปฏิกิริยาเคมี. กรุงเทพฯ:เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
กลับไปที่เนื้อหา
ในชีวิตประจำวันเราจะพบกับสารต่าง ๆ ซึ่งบางชนิดมีสมบัติเป็นกรด บางชนิดมีสมบัติเป็นเบส โดยสารละลายกรด - เบส มีทั้งประโยชน์และโทษต่อสิ่งมีชีวิตและสิ่งแวดล้อม ดังนั้นเราควรจะเลือกใช้สารต่าง ๆ อย่างระมัดระวังและเหมาะสม
กรดในชีวิตประจำวัน
กรดมีบทบาทสำคัญต่อปฏิกิริยาเคมีในร่างกายของสิ่งมีชีวิต มีการใช้กรดในการทำผลิตภัณฑ์ต่าง ๆมากมายที่ใช้ในบ้านในการเกษตรและอุตสาหกรรม
กรดที่พบในอาหาร วิตามินหลายชนิดพบในอาหารที่เรารับประทานเป็นประจำ เช่น ส้มและมะเขือเทศมีกรดแอสคอร์บิกหรือวิตามินซี ในผักใบเขียวจะมีกรดโฟลิกซึ่งจำเป็นอย่างยิ่งต่อการเจริญเติบโตของเซลล์
น้ำอัดลม ประกอบด้วยกรดคาร์บอนิก น้ำส้มและน้ำผลไม้ที่มีรสเปรี้ยวประกอบด้วยกรดซิตริกซึ่งมีอยู่ในส้ม มะนาว ส้มโอ กรดแอซีติก ซึ่งมีในน้ำส้มสายชู ใช้ในการปรุงแต่งรสอาหาร
กรดที่พบในร่างกาย กรดเป็นประโยชน์ต่อร่างกายและเป็นของเสียที่เกิดจากกระบวนการต่าง ๆ ของเซลล์ กรดในกระเพาะช่วยในการย่อยโปรตีน ในระหว่างการออกกำลังกายจะเกิดการสะสมกรดแลกติกขึ้นในกล้ามเนื้อที่ทำงานหนัก

ภาพประกอบบทเรียน กรด เบส ในชีวิตประจำวัน
ที่มา ดัดแปลงจาก https://pixabay.com/th/ , Viscious-Speed
กรดที่พบในบ้าน เราจะใช้สารละลายกรดไฮโดรคลอริกเจือจางสำหรับทำความสะอาดผิว ผนังหรือพื้นอิฐ โลหะ ซึ่งหาได้จากร้านขายอุปกรณ์ก่อสร้างในชื่อของกรดมิวเรียติก (muriatic) กรดในโรงงานอุตสาหกรรม เกษตรกรและผู้ผลิตในอุตสาหกรรมใช้ประโยชน์จากกรดมากมาย มีการนำกรดซัลฟิวริกไปใช้ในแบตเตอรี่รถยนต์ ใช้ในขั้นตอนขจัดสารปนเปื้อนในน้ำมันปิโตรเลียมและใช้ในกระบวนการผลิตเหล็กกล้า กรดไนตริกและกรดฟอสฟอริกใช้ทำเป็นปุ๋ยสำหรับการเพาะปลูกทั้งในบ้านและไร่นา
เบสในชีวิตประจำวัน
สารละลายเบสที่เราใช้ในชีวิตประจำวันมีมากมายหลายชนิด เช่น
- โซเดียมไบคาร์บอเนต ในปากของเรามีแบคทีเรียอาศัยอยู่แบคทีเรียเหล่านี้ใช้น้ำตาลเป็นอาหารโดยสลายน้ำตาลไปเป็นกรดที่เรียกว่า Plaque acid ซึ่งเป็นสาเหตุทำให้เกิดโรคฟันผุ ดังนั้นในยาสีฟันจึงผสมโซเดียมไบคาร์บอเนตหรือเบสที่ช่วยลดความเป็นกรด
- แมกนีเซียมไฮดรอกไซด์ ถ้าในกระเพาะอาหารมีกรดมากเกินไปทำให้อาหารไม่ย่อยและส่งผลให้เกิดอาการจุกเสียดหรือแน่นท้อง การรับประทานยาที่มีส่วนผสมของแมกนีเซียมไฮดรอกไซด์ หรือ Milk of magnesium จะช่วยลดความเป็นกรดในกระเพาะอาหารได้ เพราะมีฤทธิ์เป็นเบสอ่อน ๆ
- น้ำแอมโมเนียหรือแอมโมเนียไฮดรอกไซด์ ใช้ทำน้ำยาทำความสะอาดกระจก เป็นต้น
- ผงฟูหรือโซเดียมไบคาร์บอเนต ใช้ทำขนมต่าง ๆ
- สบู่ ใช้ทำความสะอาดร่างกาย มีหลายชนิดทั้งที่เป็นก้อนแข็ง เป็นของเหลว และเป็นครีม
- ยาสระผม ใช้ทำความสะอาดเส้นผม
- ผงซักฟอก ใช้ทำความสะอาดเสื้อผ้า
ผลกระทบของสารละลายกรด เบสในชีวิตประจำวัน
ฝนกรด (acid rain) เป็นปรากฏการณ์ธรรมชาติอันเกิดเนื่องมาจากมลภาวะทางอากาศ ซึ่งส่วนใหญ่เกิดมาจากกระบวนการผลิตไฟฟ้าและอุตสาหกรรมทั่วไปของมนุษย์ โดยฝนกรดก่อให้เกิดปัญหาต่าง ๆ ต่อสภาพแวดล้อมมากมาย
ฝนกรดเป็นผลมาจากก๊าซซัลเฟอร์ไดออกไซด์ (sulfur dioxide: SO2) และไนโตรเจนออกไซด์ (nitrogen oxide: NO) โดยก๊าซทั้งสองชนิดนี้มักจะเกิดจากการเผาผลาญเชื้อเพลิงฟอสซิล เช่น ถ่านหิน ก๊าซธรรมชาติ และน้ำมัน ก๊าซทั้งสองชนิดนี้จะทำปฏิกิริยากับน้ำ (water: H2O) และสารเคมีอื่น ๆ ในชั้นบรรยากาศเพื่อก่อให้เกิดกรดซัลฟิวริก (sulfuric acid: H2SO4) กรดไนตริก (nitric acid: HNO3) และสารมลพิษอื่น ๆ ก๊าซเหล่านี้มักจะทำปฏิกิริยากับสารเคมีจะส่งผลทำให้อากาศอบอ้าวอากาศร้อนชื้นทำให้เกิดมลพิษทางอากาศเมื่อไปโดนกับออกซิเจนอาจถูกกระแสลมพัดพาไปหลายร้อยกิโลเมตร และมักจะกลับสู่พื้นโลกโดยฝน หิมะ หมอก หรือแม้แต่ในรูปฝุ่นผงละออง
การเกิดฝนกรด
กระบวนการที่ก่อให้เกิดฝนกรดนั้น เริ่มต้นจากการเผาไหม้เชื้อเพลิงฟอสซิลต่าง ๆ การเผาไหม้คือปฏิกิริยาเคมีที่ออกซิเจน (oxygen: O2) ในอากาศรวมตัวกับคาร์บอน (carbon: C) ไนโตรเจน (nitrogen: N) ซัลเฟอร์ (sulfur: S) และสารอื่น ๆ ที่ประกอบอยู่ในสารที่เกิดการเผาไหม้ โดยผลิตภัณฑ์ที่เกิดขึ้นเป็นก๊าซนั้นเราเรียกว่าก๊าซออกไซด์ โดยเมื่อใดก็ตามสิ่งที่ถูกเผาไหม้นั้น มีไนโตรเจนหรือซัลเฟอร์เป็นส่วนประกอบด้วยแล้ว ก็จะเป็นผลทำให้สารออกไซด์เหล่านี้ก่อกำเนิดขึ้นมาได้ ในประเทศอเมริกา 70% ของซัลเฟอร์ไดออกไซด์เกิดมาจากโรงงานไฟฟ้า โดยเฉพาะอย่างยิ่งแหล่งที่ใช้ถ่านหินเป็นเชื้อเพลิง ในแคนาดา อุตสาหกรรมบางอย่าง เช่น การกลั่นน้ำมัน การหลอมโลหะ ก่อสารซัลเฟอร์ไดออกไซด์ในบรรยากาศสูงถึง 61% ส่วนไนโตรเจนออกไซด์นั้น เกิดได้จากมากมายหลายแหล่ง เนื่องจากสารอินทรีย์หลาย ๆ ชนิดมักจะมีไนโตรเจนประกอบอยู่ โดยควันพิษจากรถยนต์นั้นกินส่วนแบ่งเยอะที่สุด อย่างไรก็ตามแหล่งการเกิดไนโตรเจนออกไซด์ที่สำคัญอีกแหล่งก็คือ การเผาศพเมื่อก๊าซซัลเฟอร์ไดออกไซด์และไนโตรเจนออกไซด์เข้าสู่บรรยากาศแล้ว จะทำปฏิกิริยากับไอน้ำและสารเคมีอื่น ๆ ในบรรยากาศ ก่อให้เกิดกรดซัลฟูริก กรดไนตริกและสารผลพิษอื่น ๆ ประเภทไนเตรดและซัลเฟต โดยสารเหล่านี้อาจละลายตัวลงไปในฝน แล้วตกลงมาพร้อมกัน
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนเคมีพื้นฐานและเพิ่มเติม ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 3 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์ ปฏิกิริยาเคมี. กรุงเทพฯ:เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
กลับไปที่เนื้อหา



