อะตอมและพันธะเคมี
แนวคิดที่ว่าสิ่งต่าง ๆ ประกอบด้วยอนุภาคที่มีขนาดเล็กมาก ได้เริ่มขึ้นในสมัยกรีกโบราณดิโมคริตุสเป็นนักปราชญ์ชาวกรีกเป็นผู้หนึ่งที่ให้แนวคิดว่า ถ้าเราแบ่งวัตถุให้เล็กลงเรื่อย ๆ ในที่สุดจะได้หน่วยย่อยที่ไม่สามารถแบ่งให้เล็กลงไปได้อีกและเรียกหน่วยย่อยนี้ว่า อะตอม(atom) ซึ่งมาจากคำภาษากรีกว่า Atomos ซึ่งแปลว่า ไม่สามารถแบ่งได้อีก นักวิทยาศาสตร์ในยุคต่อมาได้ศึกษาค้นคว้าเพื่อให้ได้ข้อมูลเกี่ยวกับอะตอม สำหรับใช้ในการศึกษาเกี่ยวกับอะตอม ดังนี้
ภาพที่ 1 ภาพตัวอย่างอะตอม
ดัดแปลงจาก https://pixabay.com , Clker-Free-Vector-Images
วิวัฒนาการของแบบจำลองอะตอม
เนื่องจากอะตอมมีขนาดเล็กมาก ไม่สามารถมองเห็นด้วยตาเปล่า ความรู้เกี่ยวกับอะตอมจึงได้มาจากการแปลผลข้อมูลที่ได้จากการทดลอง และนำมาสร้างเป็นแบบจำลองซึ่งมีวิวัฒนาการดังนี้
ในปี พ.ศ. 2346 เซอร์ จอห์น ดอลตัน (Sir John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีเกี่ยวกับอะตอมว่าอะตอมมีขนาดเล็กแบ่งแยกและทำให้สูญหายไม่ได้อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกันแต่จะแตกต่างจากอะตอมของธาตุอื่น นอกจากนี้ดอลตันยังเสนอว่า สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อย ๆ

ภาพที่ 2 แสดงแบบจำลองอะตอมแบบดอลตัน
ที่มา http://www.rmutphysics.com/chemistry-glossary/index.php?option=com_content&task=view&id=1216&Itemid=149
ต่อมาได้มีการศึกษาเกี่ยวกับอะตอมเพิ่มขึ้นและค้นพบข้อมูลที่ไม่สอดคล้องกับแนวคิดของดอลตัน เช่น อะตอมสามารถแบ่งแยกได้ ทฤษฎีใหม่ของอะตอมจึงเริ่มมีการพัฒนาการขึ้น
ในปี พ.ศ. 2429 ออยเกน โกลด์ชไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมันได้ทำการทดลองศึกษาเกี่ยวกับอะตอมและได้ค้นพบอนุภาคที่มีประจุบวก ซึ่งเรียกว่า โปรตอน (Proton) และต่อมาในปี พ.ศ. 2440 เซอร์โจเซฟ จอห์น ทอมสัน (Sir Joseph John Thomson) นักวิทยาศาสตร์ชาวอังกฤษได้ทำการทดลองศึกษาเกี่ยวกับอะตอมเช่นเดียวกันและพบว่าอะตอมทุกชนิดประกอบด้วยอนุภาคที่มีประจุเป็นลบ และ เรียกอนุภาคนี้ว่า อิเล็กตรอน (electron) จากผลการทดลองดังกล่าวทำให้ทอมสันได้ข้อมูลมากขึ้น จึงเสนอแบบจำลองอะตอมเป็นรูปทรงกลมที่มีเนื้ออะตอมเป็นประจุบวกและมีอิเล็กตรอนซึ่งมีประจุเป็นลบกระจายอยู่ ทั่วไป
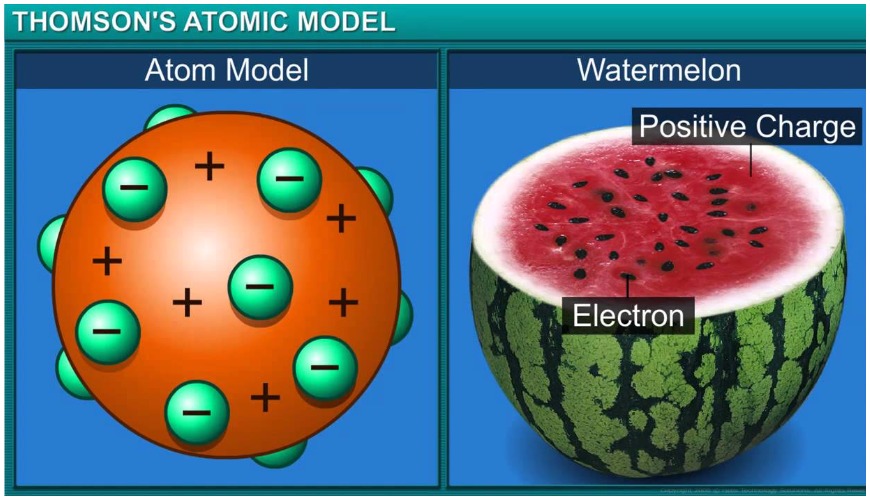
ภาพที่ 3 แสดงแบบจำลองอะตอมของทอมสันเปรียบกับผลแตงโม
ที่มา : http://www.justscience.in/articles/what-is-thomsons-atomic-model/2017/06/29
ในปี พ.ศ. 2454 ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด (Loard Ernest Rutherford) นักวิทยาศาสตร์ชาวอังกฤษและฮันส์ ไกเกอร์ (Hans Geiger) นักวิทยาศาสตร์ชาวเยอรมัน ได้ศึกษาและพิสูจน์แบบจำลองอะตอมของทอมสันโดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ พบว่า แบบจำลองอะตอมของทอมสันไม่สามารถอธิบายผลการทดลองได้ รัทเทอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมใหม่คือ อะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กมากอยู่ตรงกลางและมีประจุไฟฟ้าบวก โดยมีอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบวิ่งอยู่รอบ ๆ ดังรูป
ภาพที่ 4 แสดงแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ที่มา : http://thn2434555chemisty.blogspot.com/2016/08/blog-post_2.html
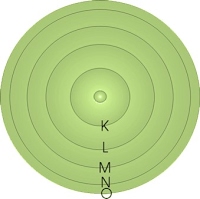
เนื่องจากแบบจำลองอะตอมของรัทเทอร์ฟอร์ด ไม่ได้อธิบายว่า อิเล็กตรอนรอบนิวเคลียส จัดตัวอยู่ในลักษณะใด นักวิทยาศาสตร์จึงได้ค้นคว้าข้อมูลต่อไป โดยทำการทดลองศึกษาสเปกตรัมของธาตุและสารประกอบ ผลการทดลองช่วยให้นีลส์ โบร์(Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก เสนอแบบจำลองระดับพลังงานของอะตอมที่มี 1 อิเล็กตรอน ว่า อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงมีระดับพลังงานเฉพาะตัว ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดจะมีพลังงานต่ำสุดเรียกว่าระดับ K และระดับพลังงานที่อยู่ถัดออกมาเรียกเป็น L M N หรือใช้สัญลักษณ์ n แทนตัวเลขระดับพลังงาน 1 2 3 ตามลำดับ ดังรูป
ภาพที่ 5 แบบจำลองอะตอมของโบห์ร
ที่มา : http://atomic-model.blogspot.com/2010/12/blog-post_6752.html
นักวิทยาศาสตร์ได้ศึกษาข้อมูลเพิ่มเติมและพบว่า อิเล็กตรอนมีสมบัติเป็นทั้งอนุภาคและคลื่น และเคลื่อนที่อย่างรวดเร็วตลอดเวลาทั่วทั้งอะตอม จึงไม่สามารถบอกตำแหน่งที่แน่นอนได้แต่มีโอกาสที่จะพบอิเล็กตรอนรอบนิวเคลียสบางบริเวณเท่านั้น ทำให้สร้างมโนภาพได้ว่าอะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่กลุ่มหมอกทึบแสดงว่ามีโอกาสที่จะพบอิเล็กตรอนได้มากกว่าบริเวณที่มีกลุ่มหมอกจาง
อนุภาคมูลฐานของอะตอม
จากการศึกษาวิวัฒนาการของแบบจำลองอะตอม ทำให้ทราบว่า อะตอมประกอบด้วย อิเล็กตรอนและโปรตอน แต่จากข้อมูลการทดลองที่ผ่านมา ทำให้นักวิทยาศาสตร์เชื่อว่าน่าจะมีอนุภาคที่มีมวลใกล้เคียงกับโปรตอนและเป็นกลางทางไฟฟ้าอยู่ในนิวเคลียสด้วย ซึ่งในปี พ.ศ. 2475 เซอร์เจมส์ แซดวิก (Sir James Chadwick) นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการทดลองยิงอนุภาคแอลฟาไปยังอะตอมของธาตุต่างๆและจากผลการทดลองทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าอยู่จริงและเรียกอนุภาคนี้ว่า นิวตรอน(neutron) จากการค้นพบนี้ ทำให้ทราบว่าอะตอมประกอบด้วยอนุภาคสามชนิด คือ อิเล็กตรอน โปรตอน และนิวตรอน ซึ่งเรียกว่า อนุภาคมูลฐานของอะตอม
เลขอะตอม เลขมวล และไอโซโทป
อะตอมประกอบด้วยโปรตอน นิวตรอน และอิเล็กตรอน แต่เนื่องจากจำนวนโปรตอนของอะตอมของธาตุแต่ละชนิดมีค่าเฉพาะตัวไม่ซ้ำกับธาตุอื่นๆดังนั้นการวิเคราะห์ชนิดของธาตุจึงพิจารณาจากจำนวนโปรตอน โดยตัวเลขที่แสดงจำนวนโปรตอน เรียกว่า เลขอะตอม (atomic number) ใช้สัญลักษณ์เป็น Z ส่วนผลรวมของจำนวนโปรตอนและนิวตรอนในนิวเคลียสเรียกว่า เลขมวล(atomic mass) ใช้สัญลักษณ์เป็น A ตัวอย่างเช่น ฮีเลียมมีจำนวนโปรตอน 2 จึงมีเลขอะตอมเท่ากับ 2 และมีจำนวนนิวตรอน 2 จึงมีเลขมวลเท่ากับ 4
อะตอมของธาตุบางชนิดอาจมีจำนวนนิวตรอนได้หลายค่าทำให้มีเลขมวลได้หลายค่าด้วยซึ่ง เฟรเดอริก ซอดดี (Frederick Soddy) นักเคมีชาวอังกฤษ เรียกว่าอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกัน ไอโซโทป(Isotope) ธาตุชนิดหนึ่งอาจมีได้หลายไอโซโทป บางไอโซโทปเกิดขึ้นในธรรมชาติและบางไอโซโทปได้จาการสังเคราะห์ เช่น ไฮโดรเจน มี 3 ไอโซโทป มีเลขมวล 1 2 และ 3 ไฮโดรเจนที่มีเลขมวล 2 และ 3 มีชื่อเฉพาะ ดิวทีเรียม และทริเทียม ตามลำดับ ไฮโดรเจนที่เกิดขึ้นในธรรมชาติมีปริมาณร้อยละ 99.99 ส่วนดิวเทอเรียม มีปริมาณน้อยมาก และทริเทียมเป็นไอโซโทปกัมมันตรังสี
แหล่งที่มา
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์ ปฏิกิริยาเคมี. กรุงเทพฯ: เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 3 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลาง
การศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
กลับไปที่เนื้อหา
พันธะเคมี หรือ Chemical Bond คือ แรงยึดเหนี่ยวที่เกิดขึ้นระหว่างอะตอมหรือกลุ่มของอะตอมเพื่อเกิดเป็นกลุ่มที่เสถียรและเป็นอิสระในระดับโมเลกุล ลักษณะเฉพาะที่สำคัญของพันธะเคมีในโมเลกุลคือจะปรากฏในบริเวณระหว่างนิวเคลียสของอะตอม ทำให้มีการเปลี่ยนแปลงพลังงานจลน์อยู่ในช่วงที่เหมาะสม ซึ่งอาจจะเกิดเป็นพันธะโคเวเลนต์ พันธะไอออนิก หรือพันธะโลหะ ได้ อนึ่ง การศึกษาเรื่องพันธะเคมีทำให้สามารถเข้าใจและทำนายสมบัติทางกายภาพและทางเคมีของสารได้ พันธะเคมีในสารชนิดต่าง ๆ จะส่งผลให้สารเหล่านั้นมีสมบัติบางประการแตกต่างกัน
ภาพที่ 1 ภาพตัวอย่างพันธะเคมี
ดัดแปลงจาก https://pixabay.com
พันธะโคเวเลนต์
นักวิทยาศาสตร์พบว่าแก๊สเฉื่อยสามารถอยู่เป็นอะตอมอิสระและมีสเถียรภาพสูง เมื่อพิจารณาเวเลนซ์อิเล็กตรอนของธาตุหมู่นี้พบว่ามีเวเลนต์อิเล็กตรอนเท่ากับ 8 ยกเว้นฮีเลียมมีเวเลนซ์อิเล็กตรอนเท่ากับ 2 แสดงว่าอะตอมที่มีจำนวนเวเลนต์อิเล็กตรอนเท่ากับ 8 เป็นสภาพที่สเถียรที่สุดในโมเลกุลลักษณะหนึ่ง พันธะโคเวเลนต์เกิดจากอะตอมสองอะตอมใช้เวเลนซ์อิเล็กตรอนหนึ่งคู่หรือมากกว่าร่วมกัน ทำให้เกิดแรงดึงดูดที่รวมอะตอมเป็นโมเลกุลขึ้น อะตอมมักสร้างพันธะโคเวเลนต์เพื่อเติมวงโคจรอิเล็กตรอนรอบนอกสุดให้เต็ม ดังนั้น อะตอมที่สร้างพันธะโคเวเลนต์จึงมักมีเวเลนซ์อิเล็กตรอนอยู่มาก เช่น ธาตุหมู่ VI และหมู่ VII เป็นต้น พันธะโคเวเลนต์แข็งแรงกว่าพันธะไฮโดรเจนและมีความแข็งแรงพอ ๆ กับพันธะไอออนิก
จากการศึกษาข้อมูลของนักวิทยาศาสตร์พบว่า เมื่ออะตอมของอโลหะเคลื่อนที่เข้ามาใกล้กันจะเกิดแรงดึงดูดระหว่างเวเลนซ์อิเล็กตรอนกับโปรตอนในนิวเคลียสของทั้งสองอะตอม นอกจากนี้ยังเกิดแรงผลักระหว่างโปรตอนกับโปรตอนและระหว่างอิเล็กตรอนกับอิเล็กตรอนของแต่ละอะตอมอีกด้วย เมื่ออะตอมทั้งสองเข้ามาใกล้กันในระยะที่เหมาะสม จะทำให้มีพลังงานต่ำสุดและอยู่ร่วมกันเป็นโมเลกุลได้โดยใช้เวเลนต์อิเล็กตรอนที่อยู่บริเวณระหว่างนิวเคลียสของอะตอมทั้งสองร่วมกัน แรงดึงดูดที่ทำให้อะตอมอยู่ร่วมกัน โมเลกุลของสารที่อะตอมยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่า โมเลกุลโคเวเลนต์ และสารที่ประกอบด้วยอะตอมที่สร้างพันธะโคเวเลนต์เรียกว่า สารโคเวเลนต์
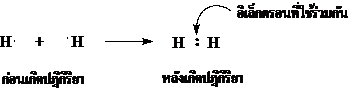
ภาพที่ 2 แสดงการเกิดพันธะของไฮโดรเจน (H2)
ที่มา : http://www.krubee.net/index.php?option=com_content&view=article&id=7&Itemid=113
1H มี 1 เวเลนต์อิเล็กตรอน เมื่อ H อะตอมรวมกันเป็นโมเลกุล จะมีการใช้เวเลนต์อิเล็กตรอนร่วมกัน 1 คู่ ดังที่ได้กล่าวไว้แล้วว่าพันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่า อะตอมคู่ร่วมพันธะ
◦ ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะเดี่ยว เช่น ในโมเลกุลของไฮโดรเจน
◦ ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะคู่ เช่น ในโมเลกุลของออกซิเจน
◦·ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะสามเช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ BeCl2 เป็นต้น
เทียนไขเกิจากการรวมตัวกันของคาร์บอนและไฮโดรเจน ส่วนน้ำตาลทรายเกิดจากการรวมตัวของอะตอมคาร์บอน ไฮโดรเจนและออกซิเจน ดังนั้นเทียนไขและน้ำตาลทรายจึงจัดเป็นสารโคเวเลนต์ เทียนไขไม่นำไฟฟ้า ส่วนน้ำตาลทรายเมื่อละลายน้ำสารละลายที่ได้ไม่นำไฟฟ้า เนื่องจากน้ำตาลทรายไม่มีการแตกตัวเป็นไอออนนั่นเอง
เมื่อพิจารณาแรงยึดเหนี่ยวที่มีอยู่ในสารโคเวเลนต์ส่วนใหญ่พบว่า นอกจากพันธะโคเวเลนต์ซึ่งเป็นแรงยึดเหนี่ยวระหว่างอะตอมภายในโมเลกุลโคเวเลนต์แล้ว ยังมีแรงยึดเหนี่ยวระหว่างโมเลกุลโคเวลนต์อีกด้วย ซึ่งเป็นแรงยึดเหนี่ยวอย่างอ่อนเมื่อเปรียบเทียบกับพันธะโคเวเลนต์ แรงยึดเหนี่ยวระหว่างโมเลกุลนี้จะแตกต่างกันไปตามชนิดของโมเลกุลโคเวเลนต์ จึงทำให้สารโคเวเลนต์มีสถานะเป็นแก๊ส ของเหลวหรือของแข็ง แรงยึดเหนี่ยวระหว่างโมเลกุลจะได้เรียนรู้ต่อไป
พันธะโลหะ
พันธะโลหะ (Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอมโลหะ ดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลว อะตอมของโลหะมีอิเล็กตรอนพิเศษเฉพาะในวงโคจรชั้นนอกของมันเทียบกับคาบ (period) หรือระดับพลังงานของพวกมัน อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้เปรียบได้กับทะเลอิเล็กตรอน(Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของไอออนบวก
พันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากในโลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้องในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ พันธะโลหะเขียนสูตรทางเคมีไม่ได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง อาจจะมีเป็นล้านๆ อะตอมก็ได้
พันธะโลหะเป็นแรงดึงดูดไฟฟ้าสถิต (electrostatic attraction) ระหว่างอะตอม หรือ ไอออนของโลหะ และ อิเล็กตรอนอิสระ(delocalized electrons) นี่คือเหตุว่าทำไมอะตอมหรือชั้นของมันยอมให้มีการเลื่อนไถลไปมาระหว่างกันและกันได้ เป็นผลให้โลหะมีคุณสมบัติที่สามารถตีเป็นแผ่นหรือดึงเป็นเส้นได้
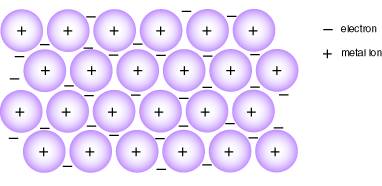
ภาพที่ 3 แสดงแบบจำลองอะตอมของพันธะโลหะ
ที่มา : http://www.neutron.rmutphysics.com/news/index.php?option=com_content&task=view&id=1979
พันธะไอออนิก
พันธะไอออนิก (ionic bonds) เป็นพันธะที่เกิดขึ้นจากแรงดึงดูดทางไฟฟ้าสถิตระหว่างไอออนบวกและไอออนลบ ซึ่งเกิดจากแรงยึดเหนี่ยวที่เกิดขึ้นในสารประกอบระหว่าง 2 อะตอม ที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก โดยหลักการแล้ว อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีน้อยจะให้อิเล็กตรอนแก่อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีมาก และทำให้อิเล็กตรอนที่อยู่รอบๆ อะตอมครบ 8 (octat rule ) กลายเป็นไอออนบวก และไอออนลบตามลำดับ ซึ่งอาจกล่าวได้ว่าแรงดังกล่าวทำให้เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น
พันธะไอออนิกเป็นพันธะที่เกิดขึ้นระหว่างโลหะและอโลหะ ซึ่งเกิดจากการถ่ายโอนอิเล็กตรอนจากโลหะให้แก่อโลหะ เนื่องจากโลหะมีค่าพลังงานไอออไนเซชัน(ionization energy)ต่ำ แต่อโลหะมีค่าสัมพรรคภาพอิเล็กตรอน(electron affinity) สูง ดังนั้นโลหะจึงมีแนวโน้มที่จะให้อิเล็กตรอน และอโลหะมีแนวโน้มที่จะรับอิเล็กตรอน โดยเมื่อโลหะเสียอิเล็กตรอนก็จะกลายเป็นไอออนบวก และอโลหะเมื่อรับอิเล็กตรอนก็จะกลายเป็นไอออนลบ
เมื่อสารไอออนิกมารวมกันจะเกิดเป็นสารประกอบโครงสร้างแลตทิซซึ่ง ประกอบด้วยไอออนบวกและไอออนลบจำนวนมากมาย โดยไอออนบวกจะถูกล้อมรอบด้วยไอออนลบ และไอออนลบจะถูกล้อมรอบด้วยไอออนบวกสารประกอบชนิดนี้เรียกว่า สารประกอบไอออนิก
สมบัติของสารประกอบไอออนิก
1. มีขั้ว
2. ไม่นำไฟฟ้าเมื่ออยู่ในสถานะของแข็ง แต่จะนำไฟฟ้าเมื่อใส่ลงในน้ำ
3. มีจุดหลอมเหลวสูง
4. มีจุดเดือดสูง
5. สารประกอบไอออนิกทำให้เกิดปฏิกิริยาระหว่างไอออนกับไอออนหรือเรียกว่าปฏิกิริยาไอออนิก
6. สมบัติไม่แสดงทิศทางของพันธะไอออนิก
7. เป็นผลึกแข็งที่เปราะบางแตกได้ง่าย
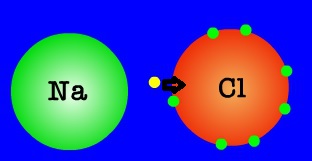
ภาพที่ 4 กระบวนการเกิดโมเลกุลของโซเดียมคลอไรด์ (NaCl)
ดัดแปลงจาก https://il.mahidol.ac.th/e-media/ap-chemistry1/chemical_bonding/ionic.htm
แหล่งที่มา
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์ ปฏิกิริยาเคมี. กรุงเทพฯ:เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 3 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
พันธะไอออนิก. สืบค้นเมื่อ 9 ธันวาคม 2562. จาก https://sansaneekwang.wordpress.com/พันธะไอออนิก/
พันธะไอออนิก (ionic bonds) . สืบค้นเมื่อ 9 ธันวาคม 2562. จาก https://il.mahidol.ac.th/e-media/ap-chemistry1/chemical_bonding/ionic.htm
กลับไปที่เนื้อหา
ประเภทของธาตุในตารางธาตุ
ธาตุโลหะ (metal) โลหะทรานซิชันเป็นต้นฉบับของโลหะ ธาตุโลหะเป็นธาตุที่มีสถานะเป็นของแข็ง (ยกเว้นปรอท ที่เป็นของเหลว) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง (ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na) เหล็ก (Fe) แคลเซียม (Ca) ปรอท (Hg) อะลูมิเนียม (Al) แมกนีเซียม (Mg) สังกะสี (Zn) ดีบุก (Sn) เป็นต้น
ธาตุอโลหะ (Non metal) มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน (C) ฟอสฟอรัส (P) กำมะถัน (S) โบรมีน (Br) ออกซิเจน (O2) คลอรีน (Cl2) ฟลูออรีน (F2) เป็นต้น
ธาตุกึ่งโลหะ (metalloid) เป็นธาตุกึ่งตัวนำ คือ มันจะสามารถนำไฟฟ้าได้เฉพาะในภาวะหนึ่งเท่านั้น ธาตุกึ่งโลหะเหล่านี้จะอยู่บริเวณเส้นขั้นบันได ได้แก่ โบรอน (B) ซิลิคอน (Si) เป็นต้น
ธาตุกัมมันตรังสี เป็นธาตุที่มีส่วนประกอบของ นิวตรอน กับโปรตอน ไม่เหมาะสม (>1.5) ธาตุที่ 83ขึ้นไปเป็นธาตุกัมมันตภาพรังสีทุกไอโซโทปมีครึ่งชีวิต
ภาพตารางธาตุ
ดัดแปลงจาก https://pixabay.com , ExplorersInternational
สมบัติของธาตุในแต่ละหมู่
ธาตุหมู่ I A หรือโลหะอัลคาไล (alkaline metal)
- โลหะอัลคาไล ได้แก่ ลิเทียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม
- เป็นโลหะอ่อน ใช้มีดตัดได้
- เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
- ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
- เมื่อเป็นไอออน จะมีประจุบวก
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- มีเวเลนซ์อิเล็กตรอน = 1
ธาตุหมู่ II A หรือโลหะอัลคาไลน์เอิร์ธ (alkaline earth)
- โลหะอัลคาไลน์เอิร์ธ ได้แก่ เบริลเลียม แมกนีเซียม แคลเซียม สตรอนเชียม แบเรียม เรเดียม
- มีความว่องไวต่อการเกิดปฏิกิริยามาก แต่น้อยกว่าโลหะอัลคาไล
- ทำปฏิกิริยากับน้ำได้สารละลายเบส สารประกอบโลหะอัลคาไลน์เอิร์ธพบมากในธรรมชาติ
- โลหะอัลคาไลน์เอิร์ธมีความว่องไวแต่ยังน้อยกว่าโลหะอัลคาไล
- โลหะอัลคาไลน์เอิร์ธมีเวเลนซ์อิเล็กตรอน = 2
ธาตุหมู่ III
- ธาตุหมู่ III ได้แก่ B Al Ga In Tl
- มีเวเลนซ์อิเล็กตรอน = 3
ธาตุหมู่ IV
- ธาตุหมู่ IV ได้แก่ C Si Ge Sn Pb
- มีเวเลนซ์อิเล็กตรอน = 4
ธาตุหมู่ V
- ธาตุหมู่ V ได้แก่ N P As Sb Bi
- มีเวเลนซ์อิเล็กตรอน = 5
ธาตุหมู่ VI
- ธาตุหมู่ VI ได้แก่ O S Se Te Po
- มีเวเลนซ์อิเล็กตรอน = 6
ธาตุหมู่ VII หรือหมู่แฮโลเจน (Halogen group)
- หมู่ธาตุแฮโลเจน ได้แก่ ฟลูออรีน คลอรีน โบรมีน ไอโอดีน และแอสทาทีน
- เป็นหมู่อโลหะที่ว่องไวต่อการเกิดปฏิกิริยามากที่สุด (F ว่องไวต่อการเกิดปฏิกิริยามากที่สุด)
- เป็นธาตุที่มีพิษทุกธาตุและมีกลิ่นแรง
- โมเลกุลของธาตุแฮโลเจนประกอบด้วย 2 อะตอม (Cl2 Br2 I2)
- แฮโลเจนไอออนมีประจุบลบหนึ่ง (F- Cl- Br- I- )
ธาตุหมู่ VIII หรือก๊าซเฉื่อย หรือก๊าซมีตระกูล (Inert gas )
- ก๊าซมีตระกูล ได้แก่ ฮีเลียม นีออน อาร์กอน คริปทอน ซีนอน และเรดอน
- มีเวเลนซ์อิเล็กตรอนเต็ม 8 อิเล็กตรอน จึงทำให้เป็นก๊าซที่ไม่ว่องไวต่อการเกิดปฏิกิริยา
- ก๊าซมีตระกูลอยู่เป็นอะตอมเดี่ยว แต่ยกเว้น Kr กับ Xe ที่สามารถสร้างพันธะได้
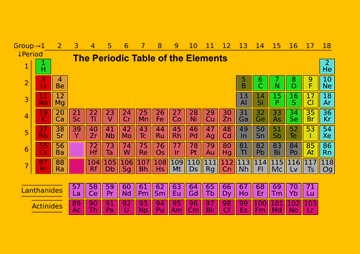
ตารางธาตุในปัจจุบัน
- จัดเรียงธาตุตามแนวนอน โดยเรียงเลขอะตอมเพิ่มขึ้นจากซ้ายไปขวา
- แถวตามแนวนอนเรียกว่า คาบ มีทั้งหมด 7 คาบ
- แถวตามแนวตั้ง เรียกว่า หมู่ แบ่งออกเป็นหมู่ย่อย A และ B โดยที่
- หมู่ย่อย A มี 8 หมู่ คือ หมู่ IA ถึง VIIIA
- หมู่ย่อย B มี 8 หมู่ คือ หมู่ IB ถึง VIIIB โดยเริ่มจากหมู่ IIIB ถึงหมู่ IIB เรียกหมู่นี้ว่า “ธาตุ
ทรานซิชั่น(Transition Elements)”
- ธาตุ 2 แถวล่าง ซึ่งแยกไว้ต่างหาก เรียกว่า “ธาตุทรานซิชั่นชั้นใน (Inner transition elements)”
- ธาตุแถวบนคือ ธาตุที่มีเลขอะตอมตั้งแต่ 58 ถึง 7 เรียกว่า “กลุ่มธาตุแลนทาไนด์”
- ธาตุแถวล่างคือ ธาตุที่มีเลขอะตอมตั้งแต่ 90 ถึง 103 เรียกว่า “กลุ่มธาตุแอกทิไนด์”
- ธาตุไฮโดรเจนมีสมบัติบางอย่างคล้ายธาตุหมู่ IA และมีสมบัติบางอย่างคล้ายธาตุหมู่ VIIA จึงแยกธาตุไฮโดรเจนไว้ต่างหาก
- ธาตุที่เป็นโลหะ และอโลหะถูกแยกออกจากกันด้วยเส้นขั้นบันได โดยทางซ้ายของเส้นขั้นบันไดเป็นโลหะ ทางขวาของเส้นขั้นบันไดเป็นอโลหะ ส่วนธาตุที่อยู่ชิดเส้นขั้นบันไดจะมีสมบัติก้ำกึ่งระหว่างโลหะกับอโลหะเรียกธาตุพวกนี้ว่า “ธาตุกึ่งโลหะ (Metalloid)”
การตั้งชื่อธาตุที่ค้นพบใหม่
จากตารางธาตุในรูป จะพบว่ามีธาตุอยู่ 106 ธาตุ ซึ่งยังมีการค้นพบธาตุใหม่ ๆ เพิ่มขึ้นอีกหลายธาตุ แต่ยังไม่ได้กำหนดสัญลักษณ์ที่แน่นอนไว้ในตารางธาตุ ธาตุบางธาตุถูกค้นพบโดยนักวิทยาศาสตร์หลายคณะ ทำให้มีชื่อเรียกและสัญลักษณ์ต่างกัน
เช่น ธาตุที่ 104 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะ คือ คณะของนักวิทยาศาสตร์สหรัฐอเมริกา ซึ่งเรียกชื่อว่า รัทเทอร์ฟอร์เดียม (Rutherfordium) และใช้สัญลักษณ์ Rf ในขณะที่คณะนักวิทยาศาสตร์สหภาพโซเวียตเรียกชื่อว่าเคอร์ซาโตเวียม (Kurchatovium) และใช้สัญลักษณ์ Ku
ธาตุที่ 105 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะเช่นเดียวกัน คือคณะนักวิทยาศาสตร์สหรัฐอเมริกาเรียกชื่อว่า ฮาห์เนียม (Hahnium) และใช้สัญลักษณ์ Ha ในขณะที่นักวิทยาศาสตร์สหภาพโซเวียตใช้ชื่อว่า นิลส์บอห์เรียม (Neilbohrium) และใช้สัญลักษณ์เป็น Ns
การที่คณะนักวิทยาศาสตร์ต่างคณะตั้งชื่อแตกต่างกัน ทำให้เกิดความสับสน International Union of Pure and Applied Chemistry (IUPAC) จึงได้กำหนดระบบการตั้งชื่อขึ้นใหม่ โดยใช้กับชื่อธาตุที่มีเลขอะตอมเกิน 100 ขึ้นไป ทั้งนี้ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็นภาษาละติน แล้วลงท้ายด้วย ium
ระบบการนับเลขในภาษาละตินเป็นดังนี้
0 = nil (นิล) 1 = un (อุน)
2 = bi (ไบ) 3 = tri (ไตร)
4 = quad (ควอด) 5 = pent (เพนท์)
6 = hex (เฮกซ์) 7 = sept (เซปท์)
8 = oct (ออกตฺ) 9 = enn (เอนน์)
เช่น
ธาตุที่ 104 ตามระบบ IUPAC อ่านว่า อุนนิลควอเดียม (Unnilquadium) สัญลักษณ์ Unq
ธาตุที่ 105 ตามระบบ IUPAC อ่านว่า อุนนิลเพนเทียม (Unnilpentium) สัญลักษณ์ Unp
การจัดตารางธาตุเป็นหมู่เป็นคาบ ทำให้ศึกษาสมบัติต่าง ๆ ของธาตุได้ง่ายขึ้น สามารถทำนายสมบัติบางประการของธาตุบางธาตุได้ กล่าวคือธาตุที่อยู่ในหมู่เดียวกันจะมีสมบัติต่าง ๆ คล้าย ๆ กัน และธาตุที่อยู่ในคาบเดียวกัน จะมีแนวโน้มของการเปลี่ยนแปลงสมบัติต่าง ๆ ต่อเนื่องกันไป ซึ่งจะกล่าวถึงรายละเอียดต่อไป
สำหรับที่มาของชื่อธาตุทั้ง 4 ตัว มีดังนี้
• ธาตุที่ 113 Nihonium มาจากคำว่า Nihon ที่แปลว่า "ญี่ปุ่น" เนื่องจากค้นพบโดยศูนย์วิจัย RIKEN Nishina Center for Accelerator-Based Science ของญี่ปุ่น
• ธาตุที่ 115 Moscovium ตามชื่อเมือง Moscow ที่ตั้งของสถาบัน Joint Institute for Nuclear Research, Dubna ในรัสเซีย ที่ค้นพบธาตุนี้
• ธาตุที่ 117 Tennessine ตามชื่อรัฐ Tennessee ที่ตั้งของห้องวิจัย Oak Ridge National Laboratory และมหาวิทยาลัย Vanderbilt University, กับ University of Tennessee at Knoxville ผู้ร่วมค้นพบธาตุนี้
• ธาตุที่ 118 Oganesson ตั้งชื่อตามศาสตราจารย์ Yuri Oganessian ชาวรัสเซีย แห่ง Joint Institute for Nuclear Research ผู้บุกเบิกการวิจัยเรื่องนี้ เสนอชื่อร่วมกันโดย Joint Institute for Nuclear Research ของรัสเซีย และ Lawrence Livermore National Laboratory ของสหรัฐอเมริกา
กระบวนการรับรองชื่อของ IUPAC จะให้ผู้ค้นพบธาตุมีสิทธิเสนอชื่อ และรับฟังความเห็นเป็นเวลา 5 เดือน โดยคำนึงถึงการออกเสียงชื่อธาตุ การแปลเป็นภาษาต่าง ๆ การเลือกตัวย่อที่มีความหมายและไม่ชนกับตัวย่ออื่น ๆ
แหล่งที่มา
แฟรงค์ เดวิด วี. (2547). ชุดสำรวจโลกวิทยาศาสตร์ ปฏิกิริยาเคมี. กรุงเทพฯ:เพียร์สัน เอ็ดดูเคชัน อินโดไชน่า.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 3 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
กลับไปที่เนื้อหา
-
11000 อะตอมและพันธะเคมี /lesson-chemistry/item/11000-2019-10-28-04-41-26เพิ่มในรายการโปรด