เซลล์ไฟฟ้าเคมี
ประโยชน์ของเซลล์กัลวานิก
เซลล์กัลวานิกในเชิงพาณิชย์ คือ เซลล์กัลวานิกที่ผลิตขึ้นมาเพื่อทำการค้าขายในเชิงพาณิชย์ จำแนกออกเป็น 2 ประเภทดังนี้
- เซลล์ปฐมภูมิ (Primary cell)
เซลล์ปฐมภูมิ คือ เซลล์ไฟฟ้าประเภทหนึ่งที่เมื่อสร้างเสร็จแล้วนำไปใช้เพื่อจ่ายกระแสไฟฟ้าออกได้ทันที เมื่อใช้ไปแล้วส่วนประกอบบางส่วนจะหมดเปลืองไปโดยไม่กลับคืนเป็นสภาพเดิมได้อีก หรือไม่สามารถนำกลับไปอัดไฟและนำกลับมาใช้ได้อีก เช่น เซลล์ดาเนียล เซลล์แห้ง เป็นต้น
- เซลล์ทุติยภูมิ (Secondary cell หรือ Reversible cell)
เซลล์ทุติยภูมิ คือ เซลล์ไฟฟ้าประเภทหนึ่งที่เมื่อสร้างเสร็จแล้วต้องนำไปอัดไฟเสียก่อนแล้วจึงจะนำไปใช้เพื่อจ่ายกระแสไฟฟ้าออกได้ เมื่อใช้ไปแล้วส่วนประกอบบางส่วนจะหมดเปลือง และแปรสภาพไป แต่อาจทำให้กลับคงสู่สภาพเดิมได้อีก โดยนำเซลล์ไฟฟ้าอัดไฟใหม่ เช่น เซลล์สะสมไฟฟ้าแบบตะกั่ว เซลล์นิกเกิล - แคดเมียม เป็นต้น
เซลล์แห้ง (Dry cell)
เซลล์แห้ง (Dry cell) คือ เซลล์กัลวานิกซึ่งประกอบด้วยสารที่ไม่ไหลหกออกนอกเซลล์ได้ สารเหล่านี้จะอยู่ในภาพของของแข็ง หรือกึ่งของเหลวที่ไม่สามารถไหลได้อย่างรวดเร็ว เซลล์แห้งสามารถอยู่ในภาพกรด หรือเบส ทั้งนี้ขึ้นอยู่กับชนิดของสารอิเล็กโทรไลต์
ตัวอย่างของเซลล์แห้ง
ก. ถ่านไฟฉาย
ถ่านไฟฉาย เป็นเซลล์ปฐมภูมิชนิดเซลล์แห้ง ชนิดกรด ถ่านไฟฉายมีศักย์ไฟฟ้าของเซลล์เริ่มต้น ประมาณ 1.5 โวลต์ แต่ถ้าใช้ไปนาน ๆ ศักย์ไฟฟ้าของเซลล์จะตกเหลือประมาณ 0.8 โวลต์ ขณะที่เกิดปฏิกิริยาจะเกิดสารผลิตภัณฑ์สะสมอยู่ภายในเซลล์ และถ้าเซลล์นี้ถูกทิ้งไม่ใช้เป็นวัน ๆ ศักย์ไฟฟ้าของเซลล์จะกลับเพิ่มขึ้นเป็น 1.3 โวลต์ ขณะนั้นสารผลิตภัณฑ์ที่เกิดจะกระจัดกระจายอยู่ทั่วไปในอิเล็กโทรไลต์นั้น

ภาพที่ 1 ถ่านไฟฉาย
ที่มา : https://commons.wikimedia.org/wiki/File:6_most_common_battery_types-1.jpg ,Lead holder
ส่วนประกอบของถ่านไฟฉาย
ถ่านไฟฉาย 1 เซลล์ ประกอบด้วย 2 ขั้ว คือ ภาชนะที่ทำด้วยสังกะสีเป็นขั้วแอโนด และใช้แกรไฟต์ (คาร์บอน) เป็นขั้วแคโทด เป็นแท่งอยู่ตรงกลาง และของผสมที่ชื้นของแอมโมเนียมคลอไรด์ (NH4Cl) แมงกานีส (IV) ออกไซด์ ซิงค์คลอไรด์ และสารเฉื่อยที่เป็นฉนวน ได้แก่ สารที่เป็นเศษขี้เลื่อย ของผสมนี้ถูกแยกออกจากกันด้วยกระดาษแผ่นรูพรุนแยกจากสังกะสีแอโนด โดยกระดาษแผ่นรูพรุนทำหน้าที่เหมือนสะพานไอออนในเซลล์กัลวานิก เมื่อเซลล์ขับกระแสไฟฟ้าออกมาจะพบว่าที่แอโนด สังกะสีถูกออกซิไดส์เกิดสังกะสีไอออนและอิเล็กตรอน และที่แคโทด แมงกานีส (IV) ออกไซด์ เกิดปฏิกิริยารีดักชัน โดยแมงกานีสเปลี่ยนเลขออกซิเดชันจาก +4 ใน MnO2 เป็น +3 ใน Mn2O3 ปฏิกิริยาที่เกิดในถ่านไฟฉายเป็นดังนี้
แอโนด(ขั้วลบ) หรือขั้ว Zn ;
Zn (s) ® Zn2+ (aq) + 2e- E0 = +0.763 V
แคโทด (ขั้วบวก) หรือขั้วแกร์ไฟต์ ;
MnO2 (s) + 2NH4+ (aq) + 2e- ® Mn2O3 (s) + 2NH3 (g) + H2O (l) E0 = +0.50 V
ปฏิกิริยาสุทธิของเซลล์ ;
Zn(s) + MnO2 (s) + 2NH4+ (aq)®Zn2+ (aq) + Mn2O3 (s) + 2NH3 (g) + H2O (l) ; = 1.26 V
ศักย์ไฟฟ้าของเซลล์ที่คำนวณได้ ทำที่ภาวะมาตรฐาน (250 C 1 atm) แต่ศักย์ไฟฟ้าของเซลล์ในถ่านไฟฉายกลับเป็น 1.5 ค่าทั้งสองนี้ต่างกันเล็กน้อย เพราะถ่านไฟฉายประกอบด้วยสารที่มีความเข้มข้นสูงกว่าความเข้มข้นที่ภาวะมาตรฐาน
ก๊าซแอมโมเนียที่เกิดขึ้นที่ขั้วแคโทด ทำปฏิกิริยากับสังกะสีไอออน เกิดสารเชิงซ้อน [ Zn(NH3)4]2+ ดังนี้
Zn2+ (aq) + 4NH3 (g) ® [ Zn(NH3)4]2+(aq)
ปฏิกิริยานี้ช่วยลดความเข้มข้นของสังกะสีไอออน ทำให้ศักย์ไฟฟ้าของเซลล์เกือบคงที่ และยังช่วยป้องกันไม่ให้โมเลกุลของก๊าซแอมโมเนีย ซึ่งเป็นฉนวนรวมตัวกันเป็นชั้นบาง ๆ ไปเกาะที่ผิวขั้วแคโทด เรียกว่า เกิด Polarization ซึ่งจะทำให้กระแสไฟฟ้าหยุดไหลหรือลดลงได้ นอกจากนั้นปฏิกิริยานี้ยังช่วยลดความดันที่เกิดจากก๊าซแอมโมเนีย ซึ่งอาจจะดันให้เซลล์แตกเสียหายได้
ข. เซลล์อัคคาไลน์ (Alkaline dry cells)
เซลล์อัลคาไลน์ เป็นเซลล์ปฐมภูมิชนิดหนึ่ง ซึ่งใช้หลักการเดียวกันกับถ่านไฟฉาย แต่สารละลายอิเล็กโตรไลต์จะใช้ สารละลายโพแทสเซียมไฮดรอกไซด์ แทนแอมโมเนียมคลอไรด์ ภาชนะที่ทำด้วยสังกะสีจึงไม่ผุกร่อนได้ง่ายใน OH- ที่ขั้วแอโนดถูกล้อมรอบด้วยสารผสมระหว่างสังกะสีกับโพแทสเซียมไฮดรอกไซด์มีลักษณะเป็นกาว (Paste) ส่วนที่ขั้วแคโทดมีสารละลายผสมระหว่างแมงกานีส (IV) ออกไซด์กับแกรไฟต์ล้อมรอบ เซลล์ชนิดนี้มีศักย์ไฟฟ้าของเซลล์เท่ากับ 1.54 โวลต์ เกือบคงที่ และมีอายุการใช้งานยาวนานกว่าถ่านไฟฉาย เมื่อเทียบราคาแล้วถูกกว่า ปฏิกิริยาที่เกิดขึ้นในเซลล์เป็นดังนี้
ที่แอโนด ; Zn(s) + 2OH- (aq) ® ZnO (s) + H2O (l) + 2e-
ที่แคโทด ; 2MnO2 (s) + H2O (l) + 2e- ® Mn2O3 (s) + 2OH- (aq)
ปฏิกิริยาสุทธิของเซลล์ คือ
Zn(s) + 2MnO2 (s) ® Zn(OH)2 (s) + Mn2O3 (s)
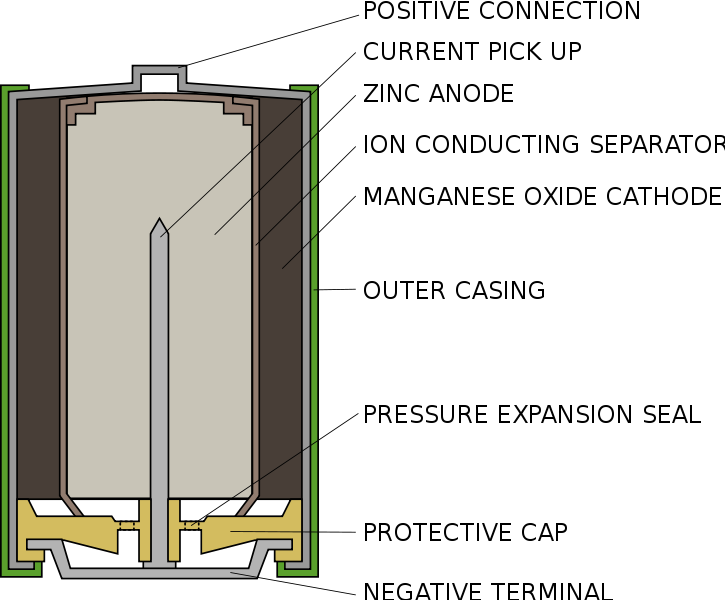
ภาพที่ 2 เซลล์อัลคาไลน์
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1226
ค. เซลล์ปรอท ( Mercury cell)
เซลล์ปรอท ( Mercury cell) หรือเซลล์รูบิน - มาลอรี (Rubin - mallory cell) เป็นเซลล์อัลคาไลน์ เช่นเดียวกับเซลล์อัลคาไลน์ และมีลักษณะคล้ายกัน เปลี่ยนเฉพาะสารอิเล็กโทรไลต์จาก MnO2 เป็น HgO (เมอคิวรี (II) ออกไซด์) เซลล์ชนิดนี้มีศักย์ไฟฟ้าของเซลล์ 1.35 โวลต์ ปฏิกิริยาที่เกิดขึ้นในเซลล์ดังนี้
แอโนด ; Zn (s) + 2OH- (aq) ® ZnO (s) + H2O (l) + 2e- , E0 = 1.25 V
แคโทด ; HgO (s) + H2O (l) + 2e- ® Hg (l) + 2OH- (aq) , E0 = 0.098 V
ปฏิกิริยาสุทธิ ; Zn (s) + HgO (s) ® ZnO (s) + Hg (l) , = 1.35 V
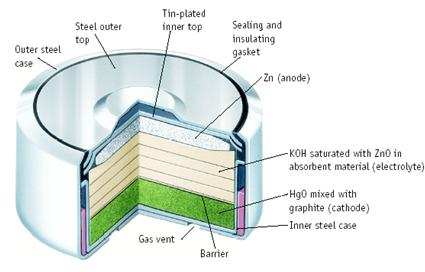
ภาพที่ 3 เซลล์ปรอท
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1226
ง. เซลล์เงิน (Zinc-silver oxide cell หรือ Button Battery)
เซลล์เงิน คือ เซลล์ปฐมภูมิเช่นเดียวกับเซลล์อัลคาไลน์ และใช้หลักการเดียวกัน เพียงแต่ใช้ AgO แทน MnO2 เท่านั้น เซลล์ชนิดนี้มีศักย์ไฟฟ้าของเซลล์ เท่ากับ 1.58 V ปฏิกิริยาที่เกิดขึ้นในเซลล์ดังนี้
ที่ขั้วแอโนด ; Zn (s) + 2OH- (aq) ® ZnO (s) + H2O (l) + 2e- , E0 = 1.25 V
ที่ขั้วแคโทด ; 2AgO (s) + H2O (l) + 2e- ® Ag2O (s) + 2OH- (aq) , E0 = 0.61 V
ปฏิกิริยาสุทธิ ; Zn (s) + 2AgO (s) ® ZnO (s) + Ag2O (s) , = 1.86 V
ภายหลังจากซิลเวอร์(II) ออกไซด์ถูกใช้ในการเกิดปฏิกิริยาสมบูรณ์ เซลล์นี้ก็ยังคงเกิดปฏิกิริยารีดักชันต่อไป โดยซิลเวอร์ (I) ออกไซด์ (Ag2O) เปลี่ยนไปเป็นโลหะเงิน (Ag) แต่จะให้ค่าศักย์ไฟฟ้าของเซลล์ต่ำลง ดังสมการของปฏิกิริยาต่อไปนี้
Zn (s) + Ag2O (s) + H2O (l) ® Zn(OH)2 (s) + 2Ag (s) , E0 = 1.58 V
เซลล์เงินมีอายุการใช้งานยาวกว่าเซลล์ปฐมภูมิอื่น ๆ แต่ราคาแพงกว่า เพราะเซลล์นี้ประกอบด้วยเงิน เซลล์เงินปัจจุบันพบว่าใช้ประโยชน์เป็นแหล่งให้พลังงานไฟฟ้า ในนาฬิกาข้อมือ เครื่องคิดเลขไฟฟ้า และกล้องถ่ายภาพอัตโนมัติ
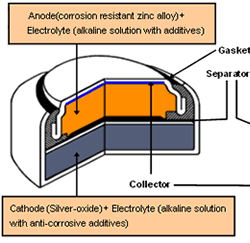
ภาพที่ 4 เซลล์เงิน
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1226
เซลล์ทุติยภูมิ (Secondary cell หรือ Reversible cell)
เซลล์ทุติยภูมิ เป็นเซลล์กัลวานิกชนิดหนึ่งที่สารตั้งต้นที่ถูกใช้ไปแล้วสามารถทำให้กลับคืนมาใหม่ได้ โดยการผ่านไฟฟ้ากระแสตรงลงไปในเซลล์ด้วยปริมาณที่พอเหมาะ ซึ่งเรียกกระบวนการนี้ว่า อัดไฟ (Charging หรือ Recharging) เซลล์ชนิดนี้ก่อนจะนำไปใช้ต้องนำไปอัดไฟเสียก่อน แล้วจึงนำไปใช้เพื่อจ่ายกระแสไฟฟ้าออกได้ และเมื่อใช้ไปนาน ๆ สารตั้งต้นจะถูกใช้หมดไป จึงต้องนำไปอัดไฟใหม่เพื่อให้สารผลิตภัณฑ์กลับมาเป็นสารตั้งต้นใหม่อีกครั้ง แล้วสามารถนำไปใช้จ่ายกระแสไฟฟ้าต่อได้ เช่น เซลล์สะสมไฟฟ้าแบบตะกั่ว เซลล์นิกเกิล-แคดเมียม
ก. เซลล์สะสมไฟฟ้าแบบตะกั่ว (Lead storage battery)
เซลล์สะสมไฟฟ้าแบบตะกั่ว เป็นเซลล์กัลวานิกชนิดเซลล์ทุติยภูมิ ที่สามารถอัดไฟนำกลับมาใช้ใหม่ได้ และเนื่องจากตะกั่วเป็นธาตุที่มีความหนาแน่นสูง จึงเป็นผลทำให้เซลล์ชนิดนี้ให้พลังงานต่อหนึ่งหน่วยมวลต่ำ (0.022 Kwh/kg) เมื่อนำเซลล์สะสมไฟฟ้าแบบตะกั่วต่อกันเป็นอนุกรม 6 เซลล์ มีศักย์ไฟฟ้าของเซลล์ประมาณ 12 โวลต์ แต่ละเซลล์ประกอบด้วยแอโนด เป็นตะกั่วอัด พื้นผิวขรุขระเป็นรูพรุน และแคโทดเป็นแผ่นตะกั่วเคลือบหุ้มด้วยเลด (IV) ออกไซด์ (PbO2) ขั้วทั้งสอง จุ่มในสารละลายกรดกำมะถันเข้มข้น 40% โดยมวล (ประมาณ 5.3 mol/dm3 ) มีความถ่วงจำเพาะ 1.3 และถ้าความถ่วงจำเพาะต่ำกว่า 1.1 จะต้องนำไปอัดไฟใหม่
ปฏิกิริยาที่เกิดขึ้นจากการจ่ายไฟของเซลล์สะสมไฟฟ้าแบบตะกั่ว เป็นดังนี้
ที่ขั้วแอโนด ; Pb (s) + SO42- (aq) ® PbSO4 (s) + 2e- , E0 = +0.356 V
ที่ขั้วแคโทด ; PbO2 (s) + 4H+ (aq) + SO42- (aq) + 2e- ® PbSO4 (s) + 2H2O (l) , E0 = +1.685 V
ปฏิกิริยาสุทธิเป็นดังนี้
Pb (s) + PbO2 (s) + 4H+ (aq) + 2SO42- (aq) ® 2PbSO4 (s) + 2H2O (l) , = +2.041 V
ขณะที่เกิดกระแสไฟฟ้าขึ้นในวงจรของเซลล์จะเกิดตะกอน PbSO4 ตกลงที่ก้นภาชนะ ความเข้มข้นของกรดกำมะถันลดลง และลดลงถึงจุดหนึ่งต้องนำไปอัดไฟใหม่
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 4 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลาง การศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
กลับไปที่เนื้อหา
ประโยชน์ของเซลล์อิเล็กโทรไลต์
เซลล์อิเล็กโทรไลต์เป็นเซลล์ที่เปลี่ยนพลังงานไฟฟ้าเป็นพลังงานเคมี ซึ่งสามารถอาศัยหลักการนี้มาประยุกต์ใช้ในอุตสาหกรรมต่าง ๆ ได้ เช่น การชุบโลหะ การทำโลหะให้บริสุทธิ์ การถลุงแยกแร่ การแยกสารละลายเกลือด้วยกระแสไฟฟ้า
การชุบโลหะด้วยไฟฟ้า (Electroplating)
การชุบโลหะด้วยไฟฟ้า คือ กระบวนการอิเล็กโทรลิซิสอย่างหนึ่งที่อาศัยพลังงานไฟฟ้าทำให้ไอออนของโลหะชนิดหนึ่ง กลายเป็นโลหะเคลือบ หรือ เกาะบนโลหะอีกชนิดหนึ่ง ซึ่งโดยหลักการนี้สามารถนำไปใช้ประโยชน์ในด้านต่าง ๆ เช่น การป้องกันการผุกร่อนของโลหะบางชนิด การทำให้โลหะมีความสวยงามและคงทน ฯลฯ
หลักทั่วไปในการชุบโลหะด้วยไฟฟ้า
-
จัดชิ้นงานที่จะชุบต่อเข้ากับขั้วแคโทด (ขั้วลบ)
-
ต้องการชุบด้วยโลหะใด ให้ใช้โลหะนั้นเป็นแอโนด (ขั้วบวก)
-
สารละลายอิเล็กโทรไลต์ต้องมีไอออนของโลหะที่ใช้เป็นขั้วแอโนด
-
ต้องใช้ไฟฟ้ากระแสตรง และการกำหนดศักย์ไฟฟ้าที่เหมาะสมก็จะทำให้ได้ผลิตภัณฑ์ที่สวยงาม
ตัวอย่างเช่น ต้องการชุบสร้อยเงินให้เป็นสร้อยทอง นำสร้อยเงินต่อเข้ากับขั้วแคโทด และใช้โลหะทองคำ ต่อเข้ากับขั้วแอโนด โดยใช้สารละลายที่มีไอออนของทอง เช่น Au+ , Au3+ เป็นสารละลายอิเล็กโทรไลต์ แล้วต่อเข้ากับแหล่งกำเนิดไฟฟ้ากระแสตรง โดยปรับค่าศักย์ไฟฟ้าให้เหมาะสม ก็จะได้สร้อยทองคำที่ทำจาก โลหะเงิน
ตัวอย่างการชุบชิ้นงานทองแดงโดยใช้ไฟฟ้ากระแสตรง
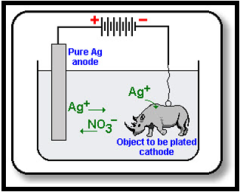
ภาพที่ 1 แสดงการชุบชิ้นงานด้วยทองแดงโดยใช้ไฟฟ้ากระแสตรง
ที่มา : https://sites.google.com/site/cartoon8821/
จากภาพอธิบายได้ว่า
-
ต่อโลหะเงิน (Ag ) เข้ากับขั้วแอโนด หรือขั้วบวก
-
ต่อชิ้นงานที่จะเคลือบเข้ากับขั้วแคโทด หรือขั้วลบของแบตเตอรี่่
-
ใช้สารละลาย Ag+ เป็นสารละลายอิเล็กโทรไลต์ เช่น AgNO3(aq)
-
ผ่านไฟฟ้ากระแสตรงที่มีศักย์ไฟฟ้าที่เหมาะสมลงไป
เมื่อผ่านไฟฟ้ากระแสตรงลงไปในเซลล์ดังภาพ จะพบว่า อิเล็กตรอนจากแบตเตอรี่่จะเคลื่อนลงไปสู่ขั้วแคโทด ทำให้ที่ขั้วนี้มีปริมาณของอิเล็กตรอนมาก และ Ag+ ซึ่งเป็นไอออนบวกก็จะเคลื่อนที่เข้ามารับอิเล็กตรอน เกิดปฏิกิริยารีดักชัน กลายเป็น โลหะเงิน เกาะ /เคลือบอยู่บนชิ้นงาน ขณะเดียวกันที่ขั้วแอโนดซึ่งมีโลหะเงินต่ออยู่ก็จะเกิดปฏิกิริยาออกซิเดชันได้ Ag+ ลงสู่สารละลายเพื่อชดเชยกับ Ag+ ที่ลดลง ทำให้ความเข้มข้นของสารละลายอิเล็กโทรไลต์คงที่ และอิเล็กตรอนที่ขั้วแอโนดไหลเข้าไปที่ขั้วบวก(แคโทด) ของแบตเตอรี่่ ทำให้กระแสไฟฟ้าครบวงจร ปฏิกิริยาที่เกิดขึ้นที่ขั้วแอโนด และแคโทด เป็นดังนี้
ที่ขั้วแอโนด ; Ag(s) ® Ag+ (aq) + e-
ที่ขั้วแคโทด ; Ag+ (aq) + e- ® Ag(s)
การชุบโลหะให้ผิวเรียบและสวยงามนั้นขึ้นอยู่กับปัจจัยต่อไปนี้
-
สารละลายอิเล็กโทรไลต์ต้องมีความเข้มข้นที่เหมาะสม
-
กระแสไฟฟ้าที่ใช้ต้องปรับค่าความต่างศักย์ให้มีความเหมาะสมตามชนิดและขนาดของชิ้นโลหะที่ต้องชุบ
-
โลหะที่ใช้เป็นแอโนดต้องบริสุทธิ์ และถ้าไม่บริสุทธิ์ต้องใช้สารบางชนิดเติมลงไปเพื่อทำปฏิกิริยากับสารที่เป็นมลทินไม่ให้มาเกาะบนผิวโลหะที่นำมาชุบ เช่น ในทางอุตสาหกรรมจะใส่สารประกอบไซยาไนด์เพื่อให้ทำปฏิกิริยากับโลหะที่เป็นมลทิน โดยจะ เกิดสารประกอบเชิงซ้อน จึงไม่มารบกวนหรือเกาะบนโลหะที่ต้องการชุบ
-
ไม่ควรชุบนานเกินไป ควรชุบเพียง 2 -3 นาทีเท่านั้น
จะพบว่าในกระบวนการชุบโลหะด้วยไฟฟ้า จะมี CN- อยู่ในสารละลายอิเล็กโทรไลต์ทั้งนี้เพื่อใช้ทำปฏิกิริยากับไอออนของโลหะเกิดเป็นสารประกอบเชิงซ้อน ทำให้ความเข้มข้นของโลหะไอออนลดลง เป็นการป้องกันไม่ให้ไอออนบวกของโลหะเกิดเป็นโลหะเคลือบผิวสารที่ต้องการเร็วเกินไป ซึ่งจะทำให้โลหะเคลือบได้หยาบไม่เรียบ หลุดง่าย
การทำโลหะให้บริสุทธิ์ด้วยไฟฟ้า (Electrorefining)
การทำโลหะให้บริสุทธิ์ เป็นขั้นตอนหนึ่งในกระบวนการถลุงแร่ โดยทั่วไป โลหะที่ถลุงได้จากแร่มักจะมีมลทินปนอยู่เล็กน้อย เพื่อทำให้โลหะนี้บริสุทธิ์มากขึ้นจะใช้กระบวนการอิเล็กโทรลิซิส ที่เรียกว่า Electrorefining ซึ่งมีหลักการดังนี้
-
นำโลหะที่จะทำให้บริสุทธิ์ต่อเข้ากับขั้วแอโนด (ขั้วบวก)
-
ใช้โลหะบริสุทธิ์อีกแท่งหนึ่งต่อเข้ากับขั้วแคโทด (ขั้วลบ)
-
ในสารละลายอิเล็กโตรไลต์ต้องมีไอออนบวกของโลหะที่ต้องการทำให้บริสุทธิ์ประกอบอยู่ด้วย
-
ต่อเข้ากับแหล่งกำเนิดไฟฟ้ากระแสตรง และจัดให้มีศักย์ไฟฟ้าของเซลล์ที่เหมาะสม
ตัวอย่างการทำโลหะทองแดงที่ได้จากการถลุงแร่คาลโคไพไรด์ (CuFeS2) ให้บริสุทธิ์ด้วยไฟฟ้า
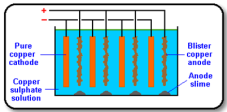
ภาพที่ 2 การทำโลหะทองแดงให้บริสุทธิ์ด้วยวิธีการอิเล็กโทรลิซิส
ที่มา : https://rawiwanmim.wordpress.com
การถลุงแร่ทองแดงชื่อว่า คาลโคไพไรด์ (CuFeS2) จะได้โลหะทองแดงที่บริสุทธิ์ 99 % เท่านั้น ถ้าต้องการทำให้บริสุทธิ์ขึ้นอีกต้องนำโลหะทองแดงที่ได้นี้ไปผ่านกระบวนการอิเล็กโทรลิซิส แยกมลทินในทองแดงออก
มลทินที่พบในโลหะทองแดงมี 2 ชนิด คือ
-
โลหะที่ถูกออกซิไดส์ง่าย (พวกนี้มีค่า E0 ต่ำ ) เช่น Zn , Fe
-
โลหะที่ถูกออกซิไดซ์ยาก (พวกนี้มีค่า E0 สูง ) เช่น Pt , Au , Ag
การจัดเครื่องมือดังภาพ ต่อ Cu ที่ไม่บริสุทธิ์เข้ากับขั้วแอโนด และ Cu บริสุทธิ์เข้ากับขั้วแคโทด จุ่มขั้วทั้งสองในสารละลายอิเล็กโทรไลต์ CuSO4 ผสมกับ H2SO4 แล้วต่อให้ครบวงจรกับแบตเตอรี่่ ผ่านไฟฟ้ากระแสตรงที่มีศักย์พอเหมาะลงไป จะพบว่าเกิดปฏิกิริยาขั้นที่ขั้วแอโนด และแคโทดดังนี้
ขั้วแคโทด ; Cu2+ (aq) + 2e- ® Cu (s)
ขั้วแอโนด ; เป็นขั้วที่ต่อกับ Cu ไม่บริสุทธิ์ จะเกิดปฏิกิริยาออกซิเดชันขึ้น โดยโลหะ Cu และพวกที่เป็นมลทิน เช่น Zn , Fe (มีค่า E0 ต่ำ ) จะให้อิเล็กตรอนและเกิดเป็นไอออนบวก คือ Cu2+ , Zn2+ , และ Fe2+ ส่วนพวกมลทินที่มี E0 สูง เช่น Ag , Pt , Au จะให้อิเล็กตรอนยาก จะตกเป็นตะกอนลงที่แอโนด เรียกตะกอนของโลหะพวกนี้ว่า Anode mud
Cu (s) ® Cu2+ (aq) + 2e-
Zn (s) ® Zn2+ (aq) + 2e-
Fe (s) ® Fe2+ (aq) + 2e-
ไอออนบวกของโลหะที่เกิดจากแอโนดในสารละลาย คือ Zn2+ (E0 = -0.76 V) , Fe2+ (E0 = -0.41 V)ซึ่งมีค่า E0 ต่ำกว่า Cu2+ (E0 = +0.34 V) ดังนั้นจึงพบว่า Cu2+ จะเข้าไปรับอิเล็กตรอนและเกิดปฏิกิริยารีดักชันเป็นโลหะ Cu ที่แคโทดได้ดีกว่า Zn2+ , และ Fe2+ ซึ่งรับอิเล็กตรอนยากกว่าและมีโอกาสเกิดเป็นโลหะที่แคโทดได้น้อย จึงทำให้โลหะทองแดงที่แยกได้ที่ขั้วแคโทด มีความบริสุทธิ์ 99.95 %
H2SO4 ที่เติมลงไปจะมีหน้าที่ไปกัดกร่อนให้ Cu , Zn และ Fe เสียอิเล็กตรอนเกิดเป็นไอออนเร็วและง่ายขึ้น
แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 4 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
กลับไปที่เนื้อหา
ศักย์ไฟฟ้าและปฏิกิริยาของเซลล์
ศักย์ไฟฟ้าของเซลล์
กระแสอิเล็กตรอน ที่เกิดจากเซลล์ไฟฟ้าเคมี เกิดจากแรงผลักอิเล็กตรอนออกจากขั้วแอโนด ผ่านวงจรภายนอกไปยังขั้วแคโทด เมื่อกระแสไฟฟ้าไหลผ่านจุดสองจุดที่มีศักย์ไฟฟ้าต่างกัน กระแสไฟฟ้าจะไหลจากศักย์ไฟฟ้าสูงไปสู่ศักย์ไฟฟ้าต่ำ ซึ่งมีทิศทางการไหลสวนทางกับการไหลของอิเล็กตรอน ความต่างศักย์จะวัดเป็นหน่วยโวลต์ เช่น แบตเตอรี่มีความต่างศักย์ 6 โวลต์ (V)
ศักย์ไฟฟ้าระหว่างขั้วของเซลล์ไฟฟ้าเคมี เรียกว่า ศักย์ไฟฟ้าของเซลล์ (E cell ) ศักย์ไฟฟ้าของเซลล์ขึ้นอยู่กับความเข้มข้นของไอออนในเซลล์ อุณหภูมิ และความดันย่อยของก๊าซที่เกี่ยวข้องกับปฏิกิริยาของเซลล์
ถ้าศักย์ไฟฟ้าระหว่างขั้วของเซลล์ไฟฟ้าเคมี (เซลล์กัลวานิก) หาได้จากการใช้แต่ละครึ่งเซลล์ที่มีความเข้มข้นของไอออนมนเซลล์เท่ากับ 1 โมลต่อลิตร ความดันย่อยของก๊าซที่เกี่ยวข้องเท่ากับ 1 บรรยากาศ และทำที่อุณหภูมิ 25 องศาสเซลเซียส ศักย์ไฟฟ้าของเซลล์นี้เรียกว่า ศักย์ไฟฟ้าของเซลล์มาตรฐาน ()
การอธิบายศักย์ไฟฟ้าของเซลล์
พลังงานที่เกิดขึ้นจากปฏิกิริยารีดอกซ์ ด้วยการเคลื่อนอิเล็กตรอนผ่านวงจรภายนอกจากขั้วหนึ่งไปยังอีกขั้วหนึ่งของเซลล์ไฟฟ้าเคมี ทำให้เกิดศักย์ไฟฟ้าของเซลล์ขึ้น และพลังงานนี้จะมากหรือน้อยขึ้นกับกำลังจากแรงผลักอิเล็กตรอนออกจากขั้วแอโนดและแรงดึงดูดอิเล็กตรอนเข้าขั้วแคโทด ในปฏิกิริยารีดอกซ์ถ้าเกิดปฏิกิริยาออกซิเดชันให้อิเล็กตรอนอย่างรวดเร็ว และเกิดปฏิกิริยารีดักชัน รับอิเล็กตรอนง่ายและรวดเร็ว ก็จะพบว่าเกิดการถ่ายโอนอิเล็กตรอนอย่างรุนแรง ปฏิกิริยารีดอกซ์นี้ก็จะเกิดพลังงานปริมาณมาก ศักย์ไฟฟ้าของเซลล์ก็จะมากขึ้นด้วย (กำลังในการผลักและดูดอิเล็กตรอนของปฏิกิริยาในเซลล์ถูกวัดในภาพศักย์ไฟฟ้าของเซลล์ (E) เรียกอีกอย่างหนึ่งว่า แรงเคลื่อนไฟฟ้า )
ศักย์ไฟฟ้าของครึ่งเซลล์
เมื่อนำครึ่งเซลล์ Zn (s) / Zn2+ (aq) , ครึ่งเซลล์ Cu (s) / Cu2+ (aq) และครึ่งเซลล์ Mg (s) / Mg2+ (aq) มาต่อเป็นเซลล์กัลวานิกแบบต่าง ๆ และต่อกับแกลวานอมิเตอร์เข้าไปในวงจร และอ่านค่าศักย์ไฟฟ้าของเซลล์ได้ดังตารางดังนี้
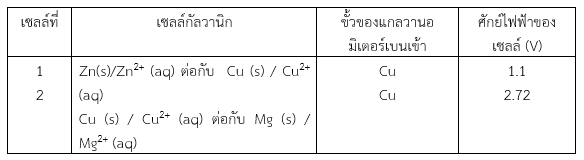
จากการทดลองจะเห็นได้ว่าเมื่อใช้ครึ่งเซลล์ต่างกัน ค่าศักย์ไฟฟ้าของเซลล์จะไม่เท่ากัน แสดงว่าค่าศักย์ไฟฟ้าของแต่ละครึ่งเซลล์มีค่าไม่เท่ากัน การวัดค่าศักย์ไฟฟ้าของครึ่งเซลล์ เพื่อหาค่าศักย์ไฟฟ้า จะกระทำโดยตรงไม่ได้ เนื่องจากครึ่งเซลล์ไม่ครบวงจร แต่ถ้านำครึ่งเซลล์ 2 ครึ่งเซลล์มาต่อกันให้ครบวงจรไฟฟ้าก็จะได้ค่าศักย์ไฟฟ้าของเซลล์ ซึ่งก็ยังไม่สามารถทราบได้ว่าแต่ละครึ่งเซลล์มีค่าศักย์ไฟฟ้าเท่าใด ดังนั้นในทางปฏิบัติ จึงหาค่าศักย์ไฟฟ้าของครึ่งเซลล์ได้โดยการเปรียบเทียบ กล่าวคือ ต้องกำหนดให้ครึ่งเซลล์ใดครึ่งเซลล์หนึ่งเป็นครึ่งเซลล์มาตรฐานซึ่งทราบค่าศักย์ไฟฟ้าแน่นอน แล้วจึงนำไปต่อกับครึ่งเซลล์อื่นที่ต้องการหาค่าศักย์ไฟฟ้า (รายละเอียดได้กล่าวไว้ในหัวข้อ การหาค่าศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์ แล้ว)
การใช้ครึ่งเซลล์มาตรฐานแตกต่างกัน ก็จะทำให้ได้ค่าศักย์ไฟฟ้าที่แตกต่างกันไปด้วย ดังนั้น เพื่อไม่ให้เกิดความสับสนนักเคมีจึงได้กำหนดให้ใช้เซลล์ไฮโดรเจนมาตรฐานเป็นสากลในการเปรียบเทียบ
ครึ่งเซลล์ไฮโดรเจนมาตรฐาน (Standard Hydrogen Electrode)
ครึ่งเซลล์ไฮโดรเจนมาตรฐาน (Standard Hydrogen Electrode , SHE) เป็นครึ่งเซลล์มาตรฐานสากลที่ใช้เปรียบเทียบหาค่าศักย์ไฟฟ้าของครึ่งเซลล์ที่ต้องการ ครึ่งเซลล์ไฮโดรเจนมาตรฐานประกอบด้วยขั้วไฟฟ้าที่ทำด้วยแพลทินัมแบล็ก (Platinum back) จุ่มในสารละลายกรด HCl เข้มข้น 1 โมล/ลิตร มีก๊าซ H2 ผ่านลงในสารละลายตลอดเวลา ก๊าซที่ใช้นี้มีความดัน 1 บรรยากาศ (atm) และแพลทินัมแบล็กที่ใช้เป็นขั้วไฟฟ้าต้องทำให้มีพื้นที่ผิวมาก มีรูพรุน เพื่อให้เกิดปฏิกิริยาได้รวดเร็วขึ้น และรักษาสมดุลระหว่าง H2 และ H+ ในสารละลายดังสมการ (อุณหภูมิ 25 0C)

เนื่องจากครึ่งเซลล์ไฮโดรเจนมาตรฐานใช้เป็นสากลในการเปรียบเทียบ จึงกำหนดค่า ศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์ (E0 ) เท่ากับ 0.00 โวลต์ และเขียนแผนภาพของครึ่งเซลล์เป็น Pt (s) / H2 (1 atm) / H+ ( 1 mol / dm3 ) ครึ่งเซลล์ไฮโดรเจนมาตรฐาน อาจจะเกิดปฏิกิริยาออกซิเดชัน หรือรีดักชัน ทั้งนี้ขึ้นอยู่กับครึ่งเซลล์ที่นำมาต่อด้วยปฏิกิริยาที่เกิดขึ้น และค่าศักย์ไฟฟ้าแสดงได้ดังนี้
ก. ศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์
เมื่อนำครึ่งเซลล์ที่ต้องการทราบค่าศักย์ไฟฟ้าของครึ่งเซลล์มาต่อเข้ากับครึ่งเซลล์ไฮโดรเจนมาตรฐาน ค่าศักย์ไฟฟ้าที่หาได้นั้น จะเรียกว่า ศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์ (กำหนดสัญลักษณ์ คือ E 0 ) ถ้าทดลองโดยใช้ครึ่งเซลล์ที่ประกอบด้วยสารละลายเข้มข้น 1 โมลต่อลิตร และถ้ามีก๊าซเกี่ยวข้องด้วยต้องมีความดัน 1 บรรยากาศ (atm) ที่อุณหภูมิ 25 องศาเซลเซียส
ข. การหาค่าศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์ (E 0 )
การหาค่าศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์ในทางปฏิบัติสามารถทำได้ดังนี้
-
นำครึ่งเซลล์ที่ต้องการหาค่า E 0 นั้นมาต่อเป็นเซลล์กัลวานิกกับครึ่งเซลล์ไฮโดรเจนมาตรฐานให้ครบวงจรโดยมีโวลต์มิเตอร์ต่ออยู่ด้วย แล้วอ่านค่าศักย์ไฟฟ้ามาตรฐานของเซลล์
-
สังเกตการณ์เบนของเข็มโวลต์มิเตอร์ ขั้วที่เข็มเบนออกจะเป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน (ขั้วลบ) ซึ่งเรียกว่าขั้วแอโนด และขั้วที่เข็มเบนเข้าหา จะเป็นขั้วที่เกิดปฏิกิริยารีดักชัน (ขั้วบวก) ซึ่งเรียกว่าขั้วแคโทด)
-
กำหนดให้ค่าครึ่งเซลล์ไฮโดรเจนมาตรฐานมีค่า E 0 = 0.00 โวลต์
-
นำค่าศักย์ไฟฟ้ามาตรฐานของเซลล์ที่อ่านได้ มาคำนวณหาศักย์ไฟฟ้ามาตรฐานของครึ่งเซลล์ได้จากสูตร

แหล่งที่มา
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.). (2551).หนังสือเรียนรายวิชาพื้นฐาน เคมี ชั้นมัธยมศึกษาปีที่ 4-6 เล่ม 4 กลุ่มสาระการเรียนรู้วิทยาศาสตร์ ตามหลักสูตรแกนกลางการศึกษาขั้นพื้นฐาน พ.ศ. 2551. กรุงเทพฯ : คุรุสภาลาดพร้าว.
กลับไปที่เนื้อหา



