atomic structure
- 1. การแนะนำ
- 2. บทเรียนที่ 2 การทดลองของทอมสัน
- 3. บทเรียนที่ 3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
- 4. บทเรียนที่ 4 อนุภาคมูลฐานของอะตอม
- 5. บทเรียนที่ 5 การเกิดสเปกตรัมและแบบจำลองอะตอมของโบร์
- 6. บทเรียนที่ 6 แบบจำลองอะตอมแบบกลุ่มหมอก
- 7. บทเรียนที่ 7 การจัดเรียงอิเล็กตรอนในอะตอม
- 8. บทเรียนที่ 8 ออร์บิทัล
- - ทุกหน้า -
บทเรียนที่ 1 จอห์น ดาลตัน (John Dalton) นักวิทยาศาสตร์ สาขาเคมี
จอห์น ดาลตัน : John Dalton
เกิดวันที่ 6 กันยายน ค.ศ. 1766 ที่เมืองคอกเกอร์เมาท์ ประเทศอังกฤษ (England)
เสียชีวิต วันที่ 27 กรกฎาคม ค.ศ. 1844 ที่เมืองแมนเชสเตอร์ (Manchester) ประเทศอังกฤษ
ผลงาน - ทฤษฎีอะตอม (Atomic Theory)
- ค้นพบกฎความดันย่อย
- อธิบายสาเหตุของตาบอดสี จอห์น ดาลตันเป็นนักฟิสิกส์ และนักเคมีชาวอังกฤษผู้ค้นพบทฤษฎีอะตอม ซึ่งทำให้เขามีชื่อเสียงเป็นที่รู้จักในวงการวิทยาศาสตร์มากขึ้น

จอห์น ดาลตัน เกิดเมื่อวันที่ 6 กันยายน ค.ศ. 1766 ที่เมืองคอกเกอร์เมาท์ ประเทศอังกฤษ ในครอบครัวที่ยากจน บิดาของเขาชื่อโจเซฟ จอห์น จอห์น จอห์น ดาลตัน (Joseph Dalton) มีอาชีพเป็นช่างทอผ้า เขามีความสนใจเกี่ยวกับวิทยาศาสตร์มาตั้งแต่เด็กและตั้งใจว่าเมื่อโตขึ้นจะต้องเป็นนักวิทยาศาสตร์ให้ได้ แล้วความตั้งใจของเขาก็เป็นจริง จอห์น ดาลตันเข้ารับการศึกษาขั้นต้นที่โรงเรียนของจอห์นเฟลทเชอร์ (John Fletcher) ซึ่งใช้โรงสวดที่ทำพิธีกรรมทางศาสนา เป็นสถานที่ทำการเรียนการสอนและเมื่อมีผู้ต้องการใช้โรงสวดนี้ประกอบพิธีกรรม โรงเรียนก็ต้องปิดทำการเมื่อโรงเรียนหยดจอห์น ดาลตันมักใช้เวลาไปกับการหาความรู้เพิ่มเติมในเรื่องวิทยาศาสตร์อยู่เสมอไม่เหมือนกับเด็กคนอื่นเมื่อโรงเรียนหยุดก็มักจะพากันเที่ยวเล่นอย่างสนุกสนาน
ต่อมาในปี ค.ศ. 1778 โรงเรียนแห่งนี้ต้องหยุดกิจการลง ดังนั้นจอห์น ดาลตันจึงมีความคิดที่จะเปิดโรงเรียนขึ้นบ้าง โดยใช้โรงนาเป็นสถานที่เรียนจอห์น ดาลตันเก็บค่าเรียนเป็นรายคน โดยเก็บคนละ 6 เพนนี (Penny) ต่อสัปดาห์ แต่ต่อมาไม่นานโรงเรียนของจอห์น ดาลตันก็ต้องปิดกิจการลง เนื่องจากชาวบ้านต้องการใช้สถานที่สำหรับประกอบพิธีทางศาสนา ภายหลังจากที่โรงเรียนปิดจอห์น ดาลตันได้นำเงินที่เกิดสะสมไว้เปิดร้านจำหน่ายหนังสือ และออกวารสาร ต่อมาในปี ค.ศ. 1781 จอห์น ดาลตันได้เข้าทำงานเป็นครูอีกครั้งหนึ่งที่โรงเรียน ของพี่ชายเขาเองที่เมืองเคนดอล
วิทยาศาสตร์แขนงที่จอห์น ดาลตันให้ความสนใจมากที่สุด คือ อุตุนิยมวิทยา (Meteorology) จอห์น ดาลตันได้สร้างเครื่องมือเพื่อช่วยในการทดลองครั้งนี้ด้วย ได้แก่ บารอริเตอร์ (Barometer) ใช้สำหรับวัดความดันอากาศ เทอร์มอมิเตอร์ (Thermometer1) ใช้สำหรับวัดอุณหภูมิ และไฮโกรมิเตอร์(Hygrometer) ใช้สำหรับวัดความชื้นในอากาศ จอห์น ดาลตันใช้เครื่องมือทั้ง 3 ชนิดนี้วัดสภาพความเปลี่ยนแปลงของดินฟ้าอากาศ และจดบันทึกไว้อย่างละเอียดเป็นประจำทุกวัน จนกระทั่วเขาเสียชีวิต รายงานเรื่องนี้ของจอห์น ดาลตันมีมากมาย เขาได้รวบรวมข้อมูลทั้งหมดลงในหนังสือชื่อว่า การสังเกตการณ์ทางอุตุนิยมวิทยา ซึ่งออกตีพิมพ์เผยแพร่ในปี ค.ศ. 1783
ในปี ค.ศ. 1792 จอห์น ดาลตันได้ให้ความสนใจเกี่ยวกับธรรมชาติวิทยา เขาศึกษาจนมีความชำนาญด้านนี้เป็นอย่างดี และได้ตีพิมพ์หนังสือออกมาเล่มหนึ่งชื่อว่า ออร์ทัส ซิคคัส ซึ่งเป็นเรื่องเกี่ยวกับพันธุ์พืชและสัตว์ มีจำนวน ถึง 11 เล่ม จากผลงานชิ้นดังกล่าวจอห์น ดาลตันได้รับเชิญจากวิทยาลัยนิวคอลเลจ แมนเชสเตอร์ ให้ดำรงตำแหน่งศาสตราจารย์สอนวิชาปรัชญาธรรมชาติและคณิตศาสตร์
ต่อมาจอห์น ดาลตันได้ย้านไปอยู่ที่เมืองยอร์ค ที่นี่เขาได้ทำงานเป็นครูพิเศษสอนวิชาคณิตศาสตร์โดยเก็บค่าสอนเป็นรายชั่วโมงและในระหว่างนี้เขาได้ทำการทอลงเกี่ยวกับเคมี และในปี ค.ศ. 1808 จอห์น ดาลตันได้ตีพิมพ์หนังสือเล่มหนึ่งมีชื่อว่า A New System of ChemicalPhilosophy เล่มที่ 1 เป็นเรื่องเกี่ยวกับทฤษฎีอะตอม (Atomic Theory) โดยจอห์น ดาลตันเป็นคนแรกที่ค้นพบทฤษฎีนี้ในระหว่างปี ค.ศ. 1801 - 1803 ต่อมาในปี ค.ศ. 1810 จอห์น ดาลตันได้พิมพ์หนังสือเล่มที่ 2 ชื่อว่า A New System of Chemical Philosophy จากหนังสือทั้ง 2 เล่มนี้ สามารถอธิบายสมบัติของอะตอมได้ชัดเจนที่สุด จอห์น ดาลตันสรุปเกี่ยวกับทฤษฎีอะตอมไว้ดังนี้
1. ธาตุต่าง ๆ ประกอบไปด้วยอนุภาคเล็ก ๆ จำนวนมาก และอนุภาคเล็ก ๆ เหล่านี้ เรียกว่า "อะตอม (Atoms)"
2. อะตอมของธาตุต่าง ๆ ก็มีลักษณะ และน้ำหนักประจำเฉพาะของธาตุนั้น
3. สารประกอบเกิดจากการรวมตัวของสสารตั้งแต่ 2 ชนิดขึ้นไป และต้องเป็นไปในอัตราส่วนที่เลขลงตัวเสมอ เช่น อัตราส่วนเป็น 4 : 1 เสมอ จะไม่เป็น 4.1 : 1 เด็ดขาด
4. อะตอมไม่สามารถสร้างขึ้นใหม่ หรือทำลายให้สิ้นสูญไปได้
5. อะตอมเป็นหน่วยที่เล็กที่สุด ในส่วนประกอบที่เล็กที่สุดของธาตุ ซึ่งไม่สามารถแยกออกไปได้อีก
นอกจากนี้เขายังใช้สัญลักษณ์แทนอะตอมของธาตุ และสารประกอบด้วย เช่น แทน ไฮโดรเจน, แทนออกซิเจน, แทน คาร์บอน, แทน คาร์บอนไดออกไซด์, แทน คาร์บอนมอนอกไซด์ จากการค้นพบดังกล่าว จึงถือได้ว่าจอห์น ดาลตันเป็นนักวิทยาศาสตร์คนแรกที่ค้นพบสมบัติของอะตอม และกำหนดรายละเอียดต่าง ๆ เกี่ยวกับอะตอม
หลังจากนั้นจอห์น ดาลตันได้ทดลองเรื่องความดันของก๊าซ จอห์น ดาลตันได้ตั้งกฎว่าด้วยความดันย่อย (Dalton's Low of Partial Pressures)โดยมีใจความสำคัญว่า เมื่อธาตุถูกกดดันมาก ๆ จะเกิดการเสียดสีกันของโมเลกุลทำให้เกิดความร้อน ต่อจากนั้นเขาได้ตั้งกฎเกี่ยวกับการระเหยของของเหลว (Evaporation of Liquids) ภายหลังจากการทดลอง จอห์น ดาลตันพบว่า "ของเหลวจะระเหยกลายเป็นไอได้มากหรือน้อย มีอุณหภูมิเป็นตัวแปรสำคัญเพียงอย่างเดียวเท่านั้น"
นอกจากนี้เขายังค้นคว้าเกี่ยวกับสาเหตุที่ทำให้ตาบอดสี (Color - Blindness) เขาได้อธิบายสาเหตุของตาบอดสีว่าเกิดจากความผิดปกติของสารที่ทำหน้าที่แปรผลของสี การที่จอห์น ดาลตันค้นคว้าเรื่องนี้ เนื่องจากน้องชายของเขาตาบอดสีนั่นเอง
จอห์น ดาลตันเสียชีวิตเมื่อวันที่ 27 กรกฎาคม ค.ศ. 1844 ที่เมืองแมนเชสเตอร์ (Manchester) ประเทศอังกฤษ
กลับไปที่เนื้อหา
บทเรียนที่ 2 การทดลองของทอมสัน
แบบจำลองอะตอมของทอมสัน



Joseph John Thomson
รางวัลโนเบล (Nobel Prize) สาขาฟิสิกส์ ในปีค.ศ. 1906
United Kingdom
University of Cambridge
Cambridge, United Kingdom
มีชีวิตอยู่ระหว่างปี 1856 - 1940

ปรากฏการณ์ที่เกิดขึ้นในหลอดรังสีแคโทด

รังสีแคโทดเดินทางเป็นเส้นตรงจากขั้วแคโทดไปยังขั้วแอโนด

รังสีแคโทดบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า
เซอร์ โจเซฟ จอห์น ทอมสัน (J.J Thomson) นักวิทยาศาสตร์ชาวอังกฤษได้สนใจปรากฏการณ์ที่เกิดขึ้นในหลอดรังสีแคโทด จึงทำการทดลองเกียวกับการนำไฟฟ้าของแก๊สขึ้นในปี พ.ศ. 2440 (ค.ศ. 1897) และได้สรุปสมบัติของรังสีไว้หลายประการ ดังนี้
1. รังสีแคโทดเดินทางเป็นเส้นตรงจากขั้วแคโทดไปยังขั้วแอโนด เนื่องจากรังสีแคโทดทำให้เกิดเงาดำของวัตถุได้ ถ้านำวัตถุไปขวางทางเดินของรังสี
2. รังสีแคโทดเป็นอนุภาคที่มีมวล เนื่องจากรังสีทำให้ใบพัดที่ขวางทางเดินของรังสีหมุนได้เหมือนถูกลมพัด
3. รังสีแคโทดประกอบด้วยอนุภาคที่มีประจุลบ เนื่องจากเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า
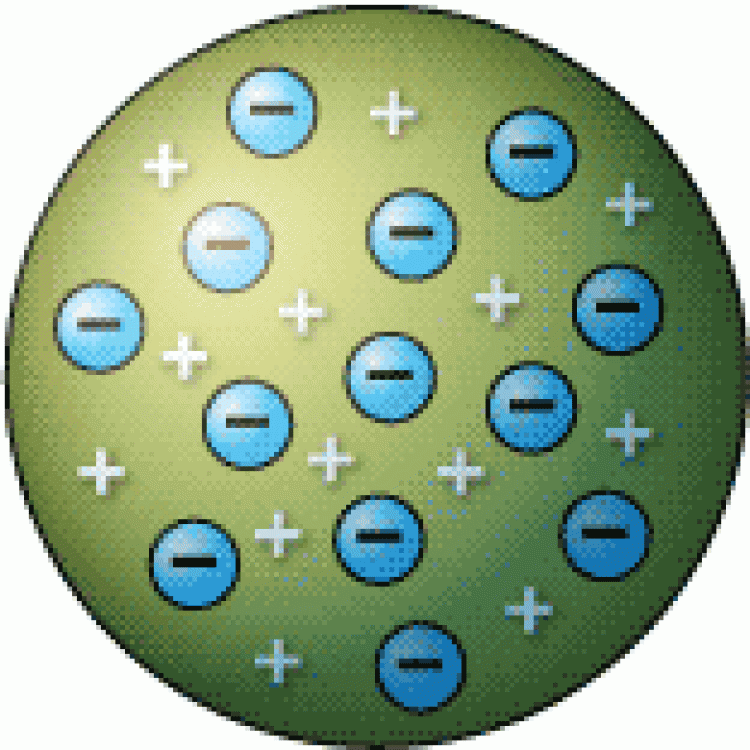
จากผลการทดลองนี้ ทอมสันอธิบายได้ว่า อะตอมของโลหะที่ขั้วแคโทดเมื่อได้รับกระแสไฟฟ้าที่มีความต่างศักย์สูงจะปล่อยอิเล็กตรอนออกมาจากอะตอม อิเล็กตรอนมีพลังงานสูง และเคลื่อนที่ภายในหลอด ถ้าเคลื่อนที่ชนอะตอมของแก๊สจะทำให้อิเล็กตรอนในอะตอมของแก๊สหลุดออกจากอะตอม อิเล็กตรอนจากขั้วแคโทดและจากแก๊สซึ่งเป็นประจุลบจะเคลื่อนที่ไปยังขั้วแอโนด ขณะเคลื่อนที่ถ้ากระทบฉากที่ฉาบสารเรืองแสง เช่น ZnS ทำให้ฉากเกิดการเรืองแสง ซึ่งทอมสันสรุปว่ารังสีแคโทดประกอบด้วยอนุภาคที่มีประจุลบเรียกว่า “อิเล็กตรอน” และยังได้หาค่าอัตราส่วนประจุต่อมวล (e/m) ของอิเล็กตรอนโดยใช้สยามแม่เหล็กและสนามไฟฟ้าช่วยในการหา ซึ่งได้ค่าประจุต่อมวลของอิเล็กตรอนเท่ากับ 1.76 x 108 C/g ค่าอัตราส่วน e/m นี้จะมีค่าคงที่ ไม่ขึ้นอยู่กับชนิดของโลหะที่เป็นขั้วแคโทด และไม่ขึ้นอยู่กับชนิดของแก๊สที่บรรจุอยู่ในหลอดรังสีแคโทด แสดงว่าในรังสีแคโทดประกอบด้วยอนุภาคไฟฟ้าที่มีประจุลบเหมือนกันหมดคือ อิเล็กตรอน นั่นเอง ทอมสันจึงสรุปว่า
|
“อิเล็กตรอนเป็นส่วนประกอบส่วนหนึ่งของอะตอม และอิเล็กตรอนของทุกอะตอมจะมีสมบัติเหมือนกัน” |
กลับไปที่เนื้อหา
บทเรียนที่ 3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
เออร์เนสท์ รัทเทอร์ฟอร์ด (Ernest Rutherford 1871 - 1937 : New Zealand)
หลังจากนักวิทยาศาสตร์ชาวฝรั่งเศส ชื่อ เบเคอเรล ได้พบสารกัมมันตรังสี และเรินต์เกน ค้นพบรังสีเอ็กซ์ (X-ray)รัทเทอร์ฟอร์ดได้ทำการศึกษาธรรมชาติของรังสีที่เกิดจากสารกัมมันตรังสีที่เกิดจากการสลายตัวของสารกัมมันตรังสีมีอยู่ 3 ชนิด คือ รังสีแอลฟา (a) รังสีเบตา (b) รังสีแกมมา (g )
1. รังสีแอลฟาหรืออนุภาคแอลฟา ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก (+2) เป็นนิวเคลียสของอะตอมของธาตุฮีเลียม คือประกอบด้วยโปรตอน 2 ตัวและนิวตรอน 2 ตัว มีอำนาจผ่านทะลุวัตถุได้น้อยมาก ถูกกั้นด้วยกระดาษเพียงแผ่นเดียวหรือสองแผ่น
2.รังสีเบตาหรืออนุภาคเบตา ประกอบด้วยอิเลคตรอนที่มีพลังงานสูง มีอำนาจการผ่านทะลุสูงกว่ารังสีแอลฟา ถูกกั้นด้วยแผ่นโลหะบางๆ 3.รังสีแกมมา แสดงสมบัติเป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก คล้ายรังสีเอ็กซ์ รังสีแกมมาไม่มีมวล ไม่มีประจุ มีอำนาจผ่านทะลุสูงมาก ถูกกั้นโดยแผ่นตะกั่วหนา
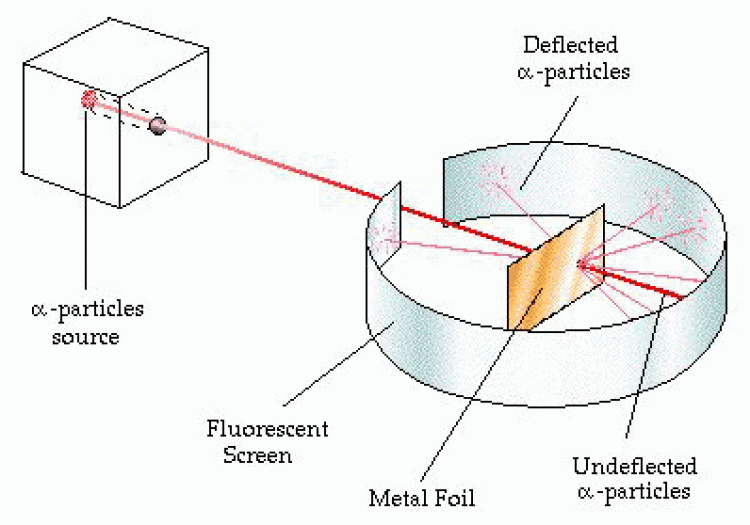
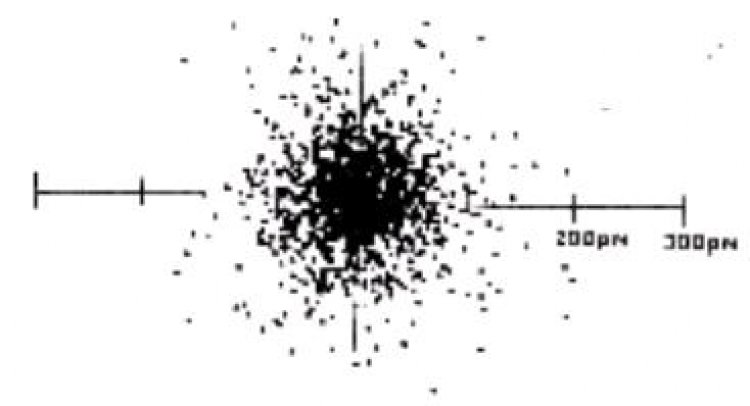
ลอร์ด เออร์เนสท์ รัทเทอร์ฟอร์ด (Lord Ernest Rutherford) นักวิทยาศาสตร์ชาวนิวซีแลนด์ ทดลองใช้อนุภาคแอลฟายิงไปยังแผ่นโลหะทองคำบางๆ และใช้ฉากเรืองแสงซึ่งฉาบด้วยซิงค์ซัลไฟด์เป็นฉากรับอนุภาคแอลฟาเพื่อตรวจสอบว่าอนุภาคแอลฟาวิ่งไปในทิศทางใดบ้าง จากการทดลองพบว่า อนุภาคแอลฟาส่วนใหญ่เดินทางเป็นเส้นตรงผ่านทะลุแผ่นทองคำไปได้ มีบางอนุภาคที่เฉออกจากเส้นทางเดิม และบางอนุภาคซึ่งน้อยมากสะท้อนกลับจากเส้นทางเดิมเมื่อกระทบแผ่นทองคำ ทราบได้เพราะอนุภาคแอลฟากระทบฉากเรืองแสง ทำให้สรุปแบบจำลองได้ดังนี้
กลับไปที่เนื้อหา
บทเรียนที่ 4 อนุภาคมูลฐานของอะตอม
|
อนุภาค |
สัญลักษณ์ |
มวล (Kg) |
เปรียบเทียบมอลกับ e- |
ประจุ |
ชนิดของประจุ |
|
อิเลคตรอน |
e |
9.109 x 10-31 |
1 |
1.602 x 10-19 |
-1 |
|
โปรตรอน |
p |
1.672 x 10-24 |
1836 |
1.602 x 10-19 |
+1 |
|
นิวตรอน |
n |
1.674 x 10-24 |
1839 |
- |
0 |
กลับไปที่เนื้อหา
บทเรียนที่ 5 การเกิดสเปกตรัมและแบบจำลองอะตอมของโบร์
นีลส์ โบร์ นักฟิสิกส์ชาวเดนมาร์กได้เสนอข้อสันนิษฐานเกี่ยวกับการเกิดเส้นสเปกตรัมว่า อิเล็กตรอนจะมีพลังงานเฉพาะค่าๆ หนึ่งเท่านั้นในอะตอม ซึ่งเรียกว่า ระดับพลังงาน(Energy level) ของอิเล็กตรอน โดยที่อิเล็กตรอนที่อยู่ในระดับพลังงานจะไม่มีการดูดหรือคายพลังงาน การดูดหรือคายพลังงานของอิเล็กตรอนจะเกิดขึ้นก็ต่อเมื่ออิเล็กตรอนมีการเปลี่ยนแปลงระดับพลังงานเท่านั้น
โดยการเคลื่อนย้ายจากระดับพลังงานหนึ่งไปยังอีกระดับพลังงานหนึ่ง ซึ่งสามารถใช้อธิบายการเปล่งแสงของอะตอมออกมาเป็นเส้นสเปกตรัมดังนี้
อิเล็กตรอนที่วิ่งวนอยู่รอบๆ นิวเคลียสจะมี 2 พลังงานคือ พลังงานศักย์ ซึ่งเป็นพลังงานที่เกิดจากแรงดึงดูดระหว่างอิเล็กตรอนกับโปรตอนในนิวเคลียส และพลังงานจลน์ที่อิเล็กตรอนวิ่งวนอยู่รอบนิวเคลียส รวมเรียกว่า พลังงานรวมของอิเล็กตรอน พลังงานรวมของอิเล็กตรอนที่มีค่าต่ำสุด อะตอมจะเสถียร เรียกพลังงานรวมของอิเล็กตรอนที่ค่าต่ำสุดนี้ว่า พลังงานในสถานะพื้น หรือ เรียกว่า สถานะพื้น (ground state) เมื่ออิเล็กตรอนได้รับพลังงานเพิ่มขึ้น อิเล็กตรอนจะดูดกลืนพลังงานไว้ ทำให้อิเล็กตรอนถูกกระตุ้นและเคลื่อนย้ายไปสู่ระดับพลังงานที่สูงกว่า เรียกว่า สถานะกระตุ้น (excited state) ที่สถานะกระตุ้นนี้อิเล็กตรอนจะไม่เสถียรเนื่องจากมีพลังงานสูง อิเล็กตรอนพยายามปรับตัวกลับคืนสู่สถานะพื้น โดยการคายพลังงานออกมาส่วนหนึ่งเพื่อลดพลังงานลง แล้วกลับสู่ระดับพลังงานที่ต่ำกว่า (สถานะพื้น) พลังงานส่วนใหญ่ที่คายออกมาจะปรากฏในรูปพลังงานแสง ดังรูปที่ 1
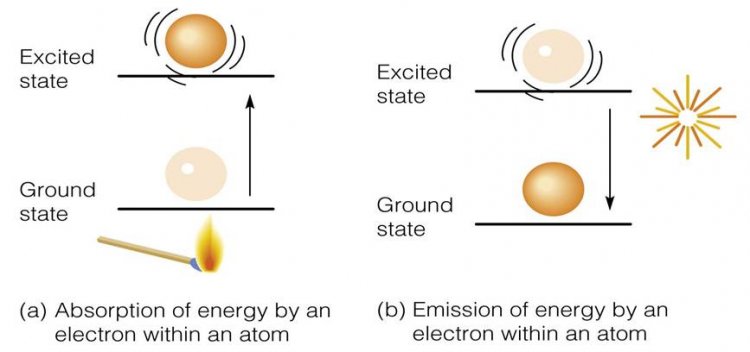
รูปที่ 1 แสดงการดูดกลืนและการคายพลังงานของอิเล็กตรอน
การแปลความหมายสเปกตรัมของไฮโดรเจน
นีลส์ โบร์ ได้ทำการทดลองศึกษาเส้นสเปกตรัมของไฮโดรเจน พบว่าเมื่อให้พลังงานกับแก๊สไฮโดรเจน ไฮโดรเจนจะให้สเปกตรัมออกมาจำนวนมาก มีทั้งที่อยู่ในช่วงความยาวคลื่นที่มองเห็นได้และไม่ได้ สำหรับเส้นสเปกตรัมที่มองเห็นได้มี 4 เส้น ประกอบด้วยเส้นสีม่วง สีน้ำเงิน สีน้ำทะเล และสีแดง ซึ่งมีความยาวคลื่น 410 434 486 และ 656 นาโนเมตร ตามลำดับ ดังตาราง
ตารางที่ 1 ความยาวคลื่นและพลังงานของเส้นสเปกตรัมของไฮโดรเจน
|
สีของสเปกตรัม |
ความยาวคลื่น (nm) |
พลังงาน (kJ) |
|
สีม่วง สีน้ำเงิน สีน้ำทะเล สีแดง |
410 434 486 656 |
4.84 x 10-22 4.57 x 10-22 4.08 x 10-22 3.02x 10-22 |
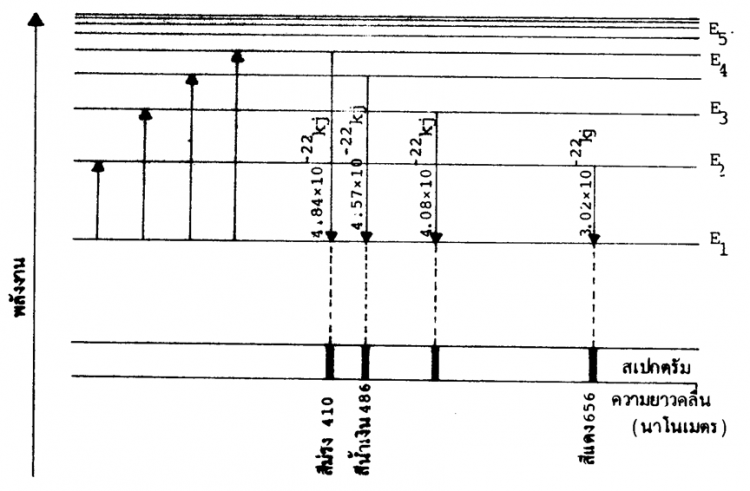
รูปที่ 3 แผนผังการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนของไฮโดรเจน
สรุปการเกิดสเปกตรัมของธาตุ
1.เมื่ออิเล็กตรอนได้รับพลังงานจะถูกกระตุ้นให้ขึ้นไปอยู่ระดับพลังงานที่สูงขึ้นซึ่งจะขึ้นไปอยู่ระดับใดย่อมขึ้นกับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอนขึ้นไปอยู่ในระดับพลังงานที่สูงขึ้นนี้ทำให้อะตอมไม่เสถียร อิเล็กตรอนจึงพยายามกลับมาสู่ระดับพลังงานเดิมโดยการคายพลังงานออกมาค่าหนึ่งซึ่งเท่ากับพลังงานที่ได้รับเข้าไป พลังงานส่วนใหญ่ที่คายออกมาจะอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้า ซึ่งปรากฎเป็นเส้นสเปกตรัมที่มีสีต่าง ๆ กันในสเปกโตรสโคป
2.การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำเป็นจะต้องเกิดระหว่างระดับพลังงานที่อยู่ถัดกัน แต่อาจจะมีการเปลี่ยนข้ามขั้นได้ จึงเป็นเป็นเหตุให้มีเส้นสเปกตรัมเกิดขึ้นได้หลายเส้น
3.ภายในอะตอมซึ่งแบ่งพลังงานเป็นชั้น ๆ ระดับพลังงานที่อยู่ใกล้นิวเคลียสจะต่ำที่สุด และระดับพลังงานที่อยู่ห่างจากนิวเคลียสมากที่สุดจะมีค่าสูงสุด ดังนั้นอิเล็กตรอนในระดับพลังงานต่ำจึงอยู่ใกล้นิวเคลียสมากกว่าอิเล็กตรอนในระดับพลังงานสูง
4.ระดับพลังงานต่ำ ๆ จะอยู่ห่างกัน และเมื่อสูงขึ้นจะอยู่ชิดกันมากขึ้น กล่าวคือ ยิ่งระดับพลังงานสูงขึ้นจะยิ่งอยู่ชิดกันมากขึ้น
5.เส้นสเปกตรัมของธาตุ แสดงให้เห็นถึงพลังงานที่อิเล็กตรอนคายออกมาเมื่อเปลี่ยนจากระดับพลังงานสูงมาสู่ระดับพลังงานที่ต่ำกว่า
เอกสารอ้างอิง
นิพนธ์ ตังคณานุรักษ์และคณิตา ตังคณานุรักษ์.(2549).คู่มือเคมีพื้นฐานและเพิ่มเติม ม.4 เล่ม 1.กรุงเทพฯ:แม็ค.
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี.(2548).หนังสือเรียนเคมี พื้นฐานและเพิ่มเติม เล่ม 1 ชั้นมัธยมศึกษาปีที่ 4.กรุงเทพฯ:โรงพิมพ์คุรุสภาลาดพร้าว.
Raymond Chang.(2002). Chemistry 1. Williams College : McGraw-Hill Higher Education.
กลับไปที่เนื้อหา
บทเรียนที่ 6 แบบจำลองอะตอมแบบกลุ่มหมอก
| แบบจำลองอะตอมกลุ่มหมอก | |||
|
แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติมทางกลศาสตร์ควอนตัม แล้วสร้างสมการสำหรับใช้คำนวณ โอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่าง ๆ ขึ้นมา จนได้แบบจำลองใหม่ ที่เรียกว่าแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีรายละเอียดดังนี้
|
กลับไปที่เนื้อหา
บทเรียนที่ 7 การจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอนในอะตอม
1. อิเล็กตรอนที่วิ่งอยู่รอบ ๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด (ชั้น K)จะมีพลังงานต่ำที่สุด และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขี้นๆตามลำดับ
พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < L < M < N < O < P < Q
หรือชั้นที่ 1< 2 < 3 <4 < 5 < 6 < 7
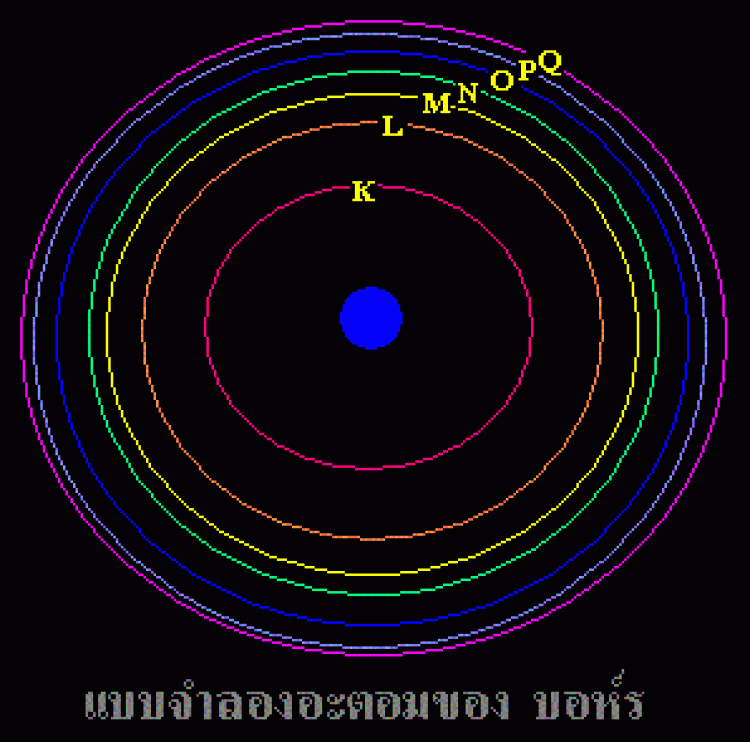
2. ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n2 เมื่อ n = เลขชั้น
เลขชั้นของชั้น K=1,L=2,M=3,N=4,O=5,P=6 และ Q=7
ตัวอย่าง จำนวน e- ในระดับพลังงานชั้น K มีได้ ไม่เกิน 2n2 = 2 x 12 = 2x1 = 2
จำนวน e-ในระดับพลังงานชั้น N มีได้ ไม่เกิน 2n2 = 2 x 42 = 2x16 = 32
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ในแต่ละชั้นย่อย จะมีจำนวน e-ได้ ไม่เกิน ดังนี้
ระดับพลังงานชั้นย่อย s มี e- ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e- ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e-ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e-ได้ ไม่เกิน 14 ตัว
เขียนเป็น s2 p6 d10 f14

กลับไปที่เนื้อหา
บทเรียนที่ 8 ออร์บิทัล
ออร์บิทัล เป็นฟังก์ชันทางคณิตศาสตร์ที่อธิบายคลื่นเหมือนพฤติกรรมของทั้ง อิเล็กตรอนหนึ่งหรือคู่ของอิเล็กตรอนในอะตอม ฟังก์ชันนี้สามารถใช้เพื่อคำนวณโอกาสในการหาอิเล็กตรอนของอะตอมใดๆ ในที่ เฉพาะพื้นที่รอบนิวเคลียสอะตอมของ. หน้าที่เหล่านี้อาจเป็นกราฟสามมิติของสถานที่ ที่น่าจะพบอิเล็กตรอน ระยะจึงอาจดูได้โดยตรงที่พื้นที่ทางกายภาพกำหนดโดยฟังก์ชันที่อิเล็กตรอนน่า โดยที่ orbitals atomic เป็นควอนตัมเป็นไปได้ของอิเล็กตรอนแต่ละบุคคลในกลุ่มอิเล็กตรอนรอบอะตอม เดียวตามที่อธิบายโดยฟังก์ชันโคจร.
แม้จะมีการเปรียบเทียบอย่างเห็นได้ชัดในดาวเคราะห์ซึ่งโคจรรอบดวงอาทิตย์ ซึ่งอิเล็กตรอนไม่สามารถอธิบายอนุภาคของแข็งและ orbitals ปรมาณูเพื่อไม่ค่อยหากเคยคล้ายรูปไข่เส้นทางของดาวเคราะห์. การเปรียบเทียบความแม่นยำมากขึ้นอาจจะมีของขนาดใหญ่และมักจะผิดปรกติ บรรยากาศรูป (อิเล็กตรอน) กระจายทั่วดาวเคราะห์ค่อนข้างเล็ก (นิวเคลียสอะตอม). Orbitals อะตอมตรงอธิบายรูปบรรยากาศเฉพาะเมื่อมีอิเล็กตรอนเดียวอยู่ในอะตอมนี้. เมื่ออิเล็กตรอนมากขึ้นจะเพิ่มอะตอมเดียวอิเล็กตรอนเพิ่มเติมมักจะเท่าเทียม กันกรอกปริมาณพื้นที่รอบนิวเคลียสเพื่อให้เก็บผล (บางครั้ง termed เมฆอิเล็กตรอนของอะตอม "") มีแนวโน้มไปโซนทรงกลมทั่วไปของความน่าจะอธิบายที่อิเล็กตรอนของอะตอมจะพบ.
นีลส์ บอร์เป็นผู้เสนอความคิดที่ว่าอิเล็กตรอนหมุนรอบนิวเคลียสที่อัดแน่นด้วยโมเมนตัมเชิงมุมที่มีค่าแน่นอนในปี ค.ศ. 1913 ขณะที่นักฟิสิกส์ชาวญี่ปุ่น Hantaro Nagaoka เคยเผยแพร่สมมติฐานเกี่ยวกับวงโคจรที่อธิบายพฤติกรรมของอิเล็กตรอนมาก่อนหน้านี้แล้วตั้งแต่ปี ค.ศ. 1904 อย่างไรก็ตามต้องรอจนถึงปี 1926 จึงได้ข้อสรุปจากสมการของชเรอดิงเงอร์ ว่าด้วยลักษณะความเป็นคลื่นของอิเล็กตรอนในอะตอม ซึ่งเป็นหลักการการโคจรของอิเล็กตรอนแบบสมัยใหม่
การโคจรในที่นี้แตกต่างไปจากกลศาสตร์ดั้งเดิม ดังนั้นการโคจรของอิเล็กตรอนในอะตอมจึงเรียกด้วยคำเฉพาะว่า ออร์บิทัล ซึ่งกำหนดขึ้นครั้งแรกโดยนักเคมีชื่อว่า Robert Mulliken ในปี 1932 ใน. orbitals อะตอมอธิบายมักจะเป็น" ไฮโดรเจน - เช่น "(หมายถึงหนึ่งอิเล็กตรอน) ฟังก์ชันคลื่นมากกว่าพื้นที่, ประเภทโดย n, l และตัวเลขควอนตัม m ซึ่งตรงกับคู่ของพลังงานอิเล็กตรอน 'angular โมเมนตัมและทิศทางโมเมนตัม angular ตามลำดับ. แต่ละโคจร (กำหนดโดยกำหนดที่แตกต่างของตัวเลขควอนตัม) และที่มีสูงสุดสองอิเล็กตรอนให้เป็นที่รู้จักกันโดยชื่อคลาสสิกที่ใช้ในการ กำหนดค่าอิเล็กตรอนปรากฏบนขวา. ชื่อเหล่านี้โคจรคลาสสิค (s, p, d, f) จะได้มาจากลักษณะของสาย spectroscopic พวกเขาคมแพร่หลัก, และพื้นฐานที่เหลือถูกตั้งชื่อตามลำดับตัวอักษร. (โคจรห้าเรียกว่าตอนนี้ g เป็นเรียกเดิม t ยืนสำหรับหนา.)
จากประมาณ 1,920 แม้ก่อนที่แอดเวนต์ของกลศาสตร์ควอนตัมสมัยใหม่ที่หลักการ aufbau หลักการก่อสร้าง () ที่ atoms ถูกสร้างขึ้นของคู่อิเล็กตรอน, จัดในรูปแบบซ้ำง่ายของการเพิ่มจำนวนคี่ (1,3,5,7 ..) , เคยถูกใช้โดย นีลส์ บอร์ และอื่นๆเพื่อสรุปสถานะของสิ่งที่ต้องการ orbitals atomic ภายในกำหนดค่าอิเล็กตรอนรวม atoms ซับซ้อน. ในคณิตศาสตร์ของฟิสิกส์อะตอมก็ยังมักจะอำนวยความสะดวกเพื่อลดการทำงาน อิเล็กตรอนของระบบที่ซับซ้อนเป็นชุดของ orbitals atomic ง่าย. แม้ว่าอิเล็กตรอนแต่ละ multi-อะตอมอิเล็กตรอนไม่แคบไปหนึ่งหนึ่ง "หรือสองอิเล็กตรอน orbitals atomic" ในภาพ idealized ข้างต้นยังคลื่นอิเล็กตรอนแบบการทำงานอาจจะแตกลงชุดซึ่งยังคงแบกสำนักพิมพ์ ของ atomic orbitals; ประหนึ่งว่าในความรู้สึกบางเมฆอิเล็กตรอนของอะตอมหลายอิเล็กตรอนคือบางส่วน ยังคง "ประกอบด้วย" ของ orbitals atomic แต่ละที่มีเพียงหนึ่งหรือสองอิเล็กตรอน. Physicality ของมุมมองนี้จะแสดงที่ดีที่สุดในลักษณะซ้ำของสารเคมีและการทำงานทางกายภาพ ขององค์ประกอบผลซึ่งในธรรมชาติสั่งเรียกจากศตวรรษที่ 19 เป็นตารางธาตุของธาตุ. ในการสั่งซื้อช่วงซ้ำ 2, 6, 10 และ 14 ธาตุในตารางธาตุตรงกับจำนวนของอิเล็กตรอนที่ครอบครองชุดสมบูรณ์ s, p, d และ f orbitals atomic ตามลำดับ
กลับไปที่เนื้อหา
-
7075 atomic structure /lesson-chemistry/item/7075-atomic-structureเพิ่มในรายการโปรด