แก๊ส ของแข็ง ของเหลว

บทเรียนที่ 1 บทนำ
สสารทั้งหลาย มี สถานะสำคัญอยู่ 3 สถานะคือของแข็ง (solid) ของเหลว (liquid) หรือแก๊ส(gas) หรือบางทีอาจจะนับ พลาสมา (แก๊สในสภาพที่มีประจุ) ผลึกเหลว (liquid crystal) และเกลือหลอมเหลว (molten salt state) เป็นสถานะเพิ่มเติมด้วยในบทนี้เราจะกล่าวถึงเฉพาะสสารที่อยู่ในสถานะแก๊ส แก๊สมีสมบัติทางกายภาพที่สำคัญอะไรบ้าง เพื่อที่จะเข้าใจ ปรากฏการณ์บางอย่างที่เกิดขึ้นในชีวิตประจำวัน รวมถึงการนำเอาความรู้เรื่องแก๊สไปใช้ประโยชน์ต่อไป
ถ้ากล่าวถึง ความแตกต่างระหว่าง ของแข็ง ของเหลวและแก๊ส ก็พอจะจำแนกได้ง่ายๆ ดังนี้สารที่อยู่ในสถานะของแข็งมีการจัดเรียงตัวของอนุภาคองค์ประกอบใกล้ชิดกัน และอนุภาคของแข็งเคลื่อนที่ไม่ได้ แต่ก็สั่นไปมาได้เล็กน้อยเนื่องจากมีช่องว่างระหว่างโมเลกุลน้อยมากส่วนของเหลวสามารถเคลื่อนไหวได้ แต่ก็เคลื่อนที่ได้น้อยกว่าสารที่อยู่ในสถานะแก๊สซึ่งเคลื่อนที่ได้อย่างอิสระ แก๊สเป็นสสารที่มีความหนาแน่นน้อยมาก ซึ่งไม่มีรูปร่างที่แน่นอนเหมือนของแข็ง ไม่มีปริมาตรที่แน่นอนเหมือนของเหลวและของแข็ง แต่แก๊สจะบรรจุอยู่เต็มภาชนะที่บรรจุ คือโมเลกุลของแก๊สเมื่อเข้าไปอยู่ในภาชนะใดๆ แม้จะมีหนึ่งอะตอม สองอะตอม หนึ่งโมเลกุล สองโมเลกุล หรือหลายๆ โมเลกุล แก๊สก็จะเคลื่อนที่ไปมาตลอด
บริเวณที่แก๊สเคลื่อนที่ได้ก็คือปริมาตรของภาชนะที่บรรจุอยู่ เพราะว่าแก๊สมีการเคลื่อนที่ตลอดเวลา ภายใต้การเคลื่อนที่ไปมาย่อมเกิดการชนกันระหว่างโมเลกุลและชนกับผนังภาชนะ การชนกันเหล่านี้ทำให้แก๊สเกิดมีความดันเมื่อเราต้องการจะเข้าใจธรรมชาติของแก๊สที่มีอยู่ เพื่อจะสามารถค้นหาอะไรบางอย่างจากธรรมชาติของแก๊สต่างๆ เราจะต้องเข้าใจธรรมชาติของแก๊สเหล่านั้น เมื่อเป็นความพยายามที่อยากจะเข้าใจธรรมชาติ ก็ต้องหาหนทางมาอธิบายรวมทั้งหลักฐานต่างๆ มายืนยันสิ่งที่เกิดขึ้นนั้น ใครทำนายได้ถูกต้องแม่นยำที่สุดด้วยหลักการและหลักฐานอะไรก็แล้วแต่ ก็จะได้รับการยอมรับจากคนอื่นๆ ในที่สุด สำหรับเรื่องของแก๊สก็เช่นเดียวกันมีความน่าสนใจอย่างไรก็ลองติดตามอ่านดูนะครับ..........
กลับไปที่เนื้อหา
บทเรียนที่ 2 แก๊ส (หน่วยที่เกี่ยวข้อง)
ปริมาตรของก๊าซ
เนื่องจากก๊าซมีสมบัติฟุ้งกระจายและเคลื่อนที่ตลอดเวลา ปริมาตรของก๊าซจึงมีค่าเท่ากับปริมาตรของภาชนะที่บรรจุก๊าซนั้นหน่วยของปริมาตรคือ ลิตรหรือลูกบาศก์เดซิเมตร มิลลิเมตรหรือลูกบาศก์เซนติเมตร และลูกบาศก์เมตร
อุณหภูมิของก๊าซ นิยมวัดเป็นองศาเซลเซียส (oC) องศาฟาเรนไฮต์ (oF) องศาโรเมอร์(oR)
และเคลวิน (K) หน่วยที่ใช้มากที่สุดในเรื่องการคำนวณของก๊าซ คือ เคลวิน (K) ซึ่งสัมพันธ์กับองศาเซลเซียส
คือ K = 273 +oC ค่าที่ละเอียดคือ 273.15
ความดันของก๊าซ หมายถึง แรงกระทำต่อหนึ่งหน่วยพื้นที่ที่ตั้งฉากกัน ในกรณีที่ก๊าซบรรจุอยู่ในภาชนะ ความดันของก๊าซเกิดจากการชนกันระหว่างโมเลกุลของก๊าซกับภาชนะ
หน่วยของความดันคือ บรรยากาศ (atm) มิลลิเมตรของปรอท (mmHg) นิวตันต่อตารางเมตร ปอนด์ต่อตารางนิ้ว โดย 1 atm = 760 mmHg
STP คือ อุณหภูมิและความดันมาตรฐานมีค่าเท่ากับ 0 องศาเซลเซียส หรือ 273.15 เคลวิน และ1 บรรยากาศ หรือ 760 มิลลิเมตรของปรอท ในวิชาเคมีนิยมใช้บรรยากาศ (atm)
กลับไปที่เนื้อหา
บทเรียนที่ 3 ทฤษฎีจลน์ของแก๊ส
ทฤษฎีจลน์ของแก๊ส (The kinetic theory of gases)
ทฤษฎีจลน์ของแก๊สเป็นทฤษฎีที่ใช้อธิบายสมบัติทางฟิสิกส์ของแก๊ส นักวิทยาศาสตร์ที่ได้เสนอทฤษฎีนี้คือ Deniel Bernoulli และทฤษฎีนี้ได้ถูกปรับปรุงโดยนักวิทยาศาสตร์คนอื่น ๆ เพื่อให้มีความสมบูรณ์และถูกต้องยิ่งขึ้น จนได้ทฤษฎีจลน์ของแก๊สในปัจจุบัน ซึ่งมีข้อความดังนี้
1. แก๊สต่างๆประกอบด้วยอนุภาคที่มีขนาดเล็กมากเรียกว่า โมเลกุล
2. โมเลกุลของแก๊สอยู่ห่างกันไม่มีแรงยึดเหนี่ยวระหว่างกันและกัน แต่ละโมเลกุลมีอิสระในการเคลื่อนที่
3. โมเลกุลของแก๊สมีมวลแต่มีขนาดเล็กมากจนถือได้ว่ามีปริมาตรเป็นศูนย์
4. โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่เป็นเส้นตรงอย่างไม่เป็นระเบียบตลอดเวลาด้วย อัตราเร็วคงที่(แต่ไม่จำเป็นต้องเท่ากัน)จนปะทะโมเลกุลอื่นหรือผนังภาชนะจึงจะเปลี่ยนทิศทางอาจเปลี่ยนอัตราเร็วด้วย
5. การชนกันของโมเลกุลเป็นแบบยึดหยุ่นสมบูรณ์คือ เมื่อชนกันแล้วจะไม่มีการสูญเสียพลังงานรวม แต่อาจจะมีการถ่ายเทพลังงานระหว่างโมเลกุลได้
6. ที่อุณหภูมิคงที่ อัตราเร็วเฉลี่ยของแก๊สชนิดหนึ่ง ๆ จะมีค่าคงที่
7. โมเลกุลของแก๊สใด ๆ จะมีพลังงานจลน์เฉลี่ยค่าหนึ่งค่าหนึ่งซึ่งเท่ากับ ? mv2 (เมื่อ m คือมวลโมเลกุลของแก๊ส และv คือความเร็วในการเคลื่อนที่ของโมเลกุลของแก๊ส)
8. ที่อุณหภูมิเดียวกัน แก๊สทุกชนิดจะมีค่าพลังงานจลน์เฉลี่ยเท่ากัน และพลังงานจลน์เฉลี่ย ของแก๊สแปรผันตรงกับอุณหภูมิเคลวิน
หมายเหตุ โมเลกุลของแก๊สที่มีสมบัติเป็นไปตามทฤษฎีจลน์ของแก๊สครบทุกข้อ คือแก๊สในอุดมคติหรือแก๊สสมบัติ ส่วนแก๊สจริงจะมีพฤติกรรมใกล้เคียงแก๊สในอุดมคติ ก็ต่อเมื่ออยู่ในภาวะอุณหภูมิสูงและความดันต่ำ ตัวอย่างเช่น ทฤษฎีของแก๊สข้อ 2) ที่ว่าโมเลกุลไม่มีแรงยึดเหนี่ยวระหว่างกันและกัน สำหรับแก๊สจริงย่อมมีแรงยึดเหนี่ยวอย่างแน่นอน แต่แรงยึดเหนี่ยวนั้นจะมีค่ามากหรือน้อยขึ้นอยู่กับชนิดของแก๊ส แต่อย่างไรก็ตามที่อุณหภูมิสูงโมเลกุลของแก๊สจะมีพลังงานจลน์สูงขึ้น ประกอบกับความดันต่ำด้วย โมเลกุลจึงเคลื่อนที่ออกจากวันมากขึ้นทำให้ระยะห่างระหว่างโมเลกุลมากขึ้น แรงยึดเหนี่ยวระหว่างโมเลกุลจึงลดน้อยลงหรืออาจน้อยมากจนไม่มีเลย แสดงว่าโมเลกุลของแก๊สดังกล่าวกำลังมีพฤติกรรมคล้ายกับแก๊สสมมติ
คำอธิบายเพิ่มเติมทฤษฎีจลน์ของแก๊ส
1. จากทฤษฎีของแก๊สข้อ 5) เมื่อโมเลกุลชนกันเอง อาจมีการถ่ายเทพลังงานแต่ไม่มีการสูญเสียพลังงานรวมนั้น หมายความว่า พลังงานรวมทั้งหมดของระบบไม่เปลี่ยน หรือพลังงานรวมของโมเลกุลของแก๊สทั้งสองโมเลกุลที่ชนกันไม่เปลี่ยน แต่เมื่อโมเลกุลสองโมเลกุลชนกันถ้ามีการถ่ายเทพลังงาน โมเลกุลหนึ่งสูญเสียพลังงานไปเท่าใด อีกโมเลกุลหนึ่งก็จะรับพลังงานเพิ่มขึ้นเท่านั้น
2. จากทฤษฎีจลน์ของแก๊สข้อ 7) และ 8) พลังงานจลน์เฉลี่ยของโมเลกุลของแก๊ส (E) ซึ่งมีค่าเท่ากับ ? mv2 นั้น เป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน หมายความว่าเมื่ออุณหภูมิ เพิ่มขึ้นแก๊สก็จะมีพลังงานจลน์เฉลี่ยเพิ่มขึ้น แต่ถ้าอุณหภูมิลดลงแก๊สก็จะมีพลังงานจลน์เฉลี่ยลดลงด้วย (E ? T) และเหตุที่พลังจลน์เฉลี่ยของโมเลกุลของแก๊สเป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน เพราะว่าความเร็วเฉลี่ยของโมเลกุลของแก๊ส (v) เป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน (อุณหภูมิสูงแก๊สจะมีความเร็วเฉลี่ยสูง อุณหภูมิต่ำแก๊สจะมีความเร็วเฉลี่ยต่ำ)
E = mv2
จากสูตร ค่าพลังงานจลน์ เฉลี่ยของโมเลกุลของแก๊ส (E) เป็นสัดส่วนโดยตรงกับความเร็วเฉลี่ย (v) กล่าวคือ ถ้า V มีค่ามาก E ก็จะมีค่ามากด้วย แต่ถ้า v มีค่าน้อย E ก็จะมีค่าน้อยด้วย เนื่องจากค่า v เป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน ดังนั้น ค่า E จึงเป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวินด้วย
การใช้ทฤษฎีจลน์อธิบายสมบัติของแก๊ส
ทฤษฎีจลน์ของแก๊สสามารถใช้อธิบายสมบัติของแก๊สในเรื่องที่เกี่ยวข้องกับอุณหภูมิ ความดัน ปริมาตร และจำนวนโมเลกุล (หรือ โมล) ของแก๊สได้
1. ใช้อธิบายว่าทำไมแก๊สจึงมีรูปร่างและปริมาตรไม่แน่นอนขึ้นอยู่กับภาชนะที่บรรจุ
ตามทฤษฎีจลน์ของแก๊สทราบว่าโมเลกุลของแก๊สมีขนาดเล็กมากและไม่มีแรงยึดเหนี่ยวระหว่างกันและกัน ดังนั้นไม่ว่าจะบรรจุแก๊สไว้ในภาชนะชนิดใดก็ตาม โมเลกุลของแก๊สก็จะเคลื่อนที่แพร่กระจายเต็มพื้นที่ภาชนะที่บรรจุ จึงทำให้แก๊สนั้นมีรูปร่างเหมือนภาชนะที่บรรจุ และแก๊สนั้นจะมีปริมาตรเท่าภาชนะที่บรรจุด้วย เช่น เมื่อบรรจุแก๊สX จำนวนหนึ่งในถังสี่เหลี่ยม ซึ่งมีปริมาตร 20 dm3 แก๊สX ก็จะมีรูปร่างเป็นรูปสี่เหลี่ยม และมีปริมาตรเท่ากับ 20 dm3 ด้วย
2.ใช้อธิบายว่าทำไมแก๊สจึงมีความดัน
ตามทฤษฎีจลน์ของแก๊สกล่าวว่า โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่เป็นเส้นตรงอยู่ตลอดเวลา ด้วยอัตราเร็วคงที่ เกิดการชนกันเอง และชนผนังภาชนะอยู่ตลอดเวลา การที่โมเลกุลของแก๊สเคลื่อนที่ชนผนังภาชนะตลอดเวลา ทำให้เกิดแรงดัน และผลรวมของแรงดันทั้งหมดที่มีต่อหนึ่งหน่วยพื้นที่เรียกว่า ความดันของแก๊ส
3. ใช้อธิบายว่าทำไมปริมาตรของแก๊สจึงแปรผกผันกับความดัน เมื่ออุณหภูมิและจำนวนโมลคงที่ (กฎของบอยล์ )
ปัญหาข้อนี้จะใช้ทฤษฎีจลน์ของแก๊สที่กล่าวว่า ที่อุณหภูมิคงที่ อัตราเร็วเฉลี่ยของแก๊สชนิดเดียวกันจะมีค่าคงที่ และที่อุณหภูมิคงที่แก๊สทุกชนิดมีพลังงานจลน์เฉลี่ยเท่ากันมาอธิบาย ดังนั้นจากความสัมพันธ์ที่ว่า เมื่ออุณหภูมิคงที่ปริมาตรของแก๊สแปรผกผันกับความดัน คือ เมื่อปริมาตรของแก๊สลดลง ความดันของแก๊สจะเพิ่มขึ้น และเมื่อปริมาตรของแก๊สเพิ่มขึ้น ความดันของแก๊สก็จะลดลง ใช้ทฤษฎีจลน์อธิบายได้ดังนี้
การลดปริมาตรแล้วทำให้ความดันเพิ่มขึ้น เพราะการลดปริมาตรโดยอุณหภูมิคงที่ ถึงแม้ว่าโมเลกุลของแก๊สจะมีความเร็วเฉลี่ยและพลังงานจลน์เฉลี่ยคงที่แต่โมเลกุลของแก๊สคงที่ แต่โมเลกุลของแก๊สจะชนผนังภาชนะบ่อยครั้งขึ้นจึงเกิดแรงดันมากขึ้น ทำให้ความดันของแก๊สเพิ่มขึ้น ในทางตรงกันข้ามถ้าเพิ่มปริมาตรทำให้ความดันลดลง เพราะการเพิ่มปริมาตรทำให้โมเลกุลของแก๊สชนผนังภาชนะด้วยความถี่ลดลง แรงดันของแก๊สจึงลดลงด้วย
4. ใช้อธิบายว่าทำไมความดันของแก๊สจึงแปรผันตรงกับจำนวนโมล หรือจำนวนโมเลกุลของแก๊ส เมื่ออุณหภูมิและปริมาตรคงที่
สำหรับปัญหาข้อนี้อธิบายโดยใช้ทฤษฎีจลน์ได้ดังนี้ เนื่องจากโมเลกุลของแก๊สแต่ละโมเลกุลมีการเคลื่อนที่เป็นเส้นตรงอยู่ตลอดเวลาในอัตราเร็วเฉลี่ยคงที่เมื่ออุณหภูมิคงที่ ดังนั้นเมื่อเพิ่มจำนวนโมเลกุล จะทำให้โมเลกุลของแก๊สเคลื่อนที่ชนผนังภาชนะบ่อยครั้งขึ้น เป็นเหตุให้เกิดแรงดันมากขึ้น นั่นคือความดันของแก๊สเพิ่มขึ้น ในทางตรงกันข้ามถ้าลดจำนวนโมเลกุลของแก๊ส จะทำให้โมเลกุลของแก๊สเคลื่อนที่ชนผนังภาชนะด้วยความถี่ลดลง ทำให้แรงดันลดลง นั่นคือความดันของแก๊สลดลง
5. ใช้อธิบายว่าทำไมปริมาตรของแก๊สจึงแปรผันตรงกับโมลหรือจำนวนโมเลกุลของแก๊สเมื่ออุณหภูมิและความดันคงที่ (กฎของอาโวกาโดร)
สำหรับปัญหาข้อนี้อธิบายได้ดังนี้ เมื่อแก๊สมีจำนวนโมเลกุลมากขึ้น โมเลกุลของแก๊สจะชนผนังภาชนะที่บรรจุด้วยความถี่สูงขึ้น ทำให้เกิดแรงดันมากขึ้น นั่นคือแก๊สมีความดันสูงขึ้น และมีค่ามากกว่าความดันภายนอก ถ้าบรรจุแก๊สในกระบอกสูบที่ลูกสูบเคลื่อนที่ได้โดยไม่มีแรงเสียดทานหรือมีน้อย เมื่อแก๊สมีความดันมากขึ้น ก็จะดันให้ลูกสูบเคลื่อนที่ขึ้น ทำให้ปริมาตรของแก๊สเพิ่มขึ้น ทั้งนี้เพื่อให้ความดันมีค่าคงที่นั่นเอง ในทางตรงกันข้าม ถ้าแก๊สมีจำนวนโมเลกุลน้อย ก็จะชนผนังภาชนะที่บรรจุในอัตราความถี่ต่ำลงทำให้เกิดแรงดันน้อย นั่นคือแก๊สมีความดันต่ำลง และต่ำกว่าความดันภายนอกเพื่อรักษาความดันให้คงที่ ลูกสูบก็จะเคลื่อนที่ลง ทำให้ปริมาตรลดลง
6. ใช้อธิบายว่าทำไมปริมาตรของแก๊สจึงแปรผันกับอุณหภูมิเมื่อความดันและจำนวนโมเลกุลของแก๊สคงที่ (กฎของชาร์ล)
จากทฤษฎี พลังงานจลน์เฉลี่ยของแก๊สเป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน นั่นคือเมื่ออุณหภูมิสูงแก๊สจะมีพลังงานจลน์เฉลี่ยสูง เมื่ออุณหภูมิต่ำแก๊สจะมีพลังงานจลน์เฉลี่ยต่ำ ดังนั้นถ้าบรรจุแก๊สในกระบอกสูบที่ลูกสูบเคลื่อนที่ขึ้นลงได้สะดวก เมื่ออุณหภูมิ เพิ่มขึ้นโมเลกุลของแก๊สจะมีพลังงานจลน์เฉลี่ยเพิ่มขึ้น จึงเคลื่อนที่ชนผนังภาชนะที่บรรจุได้แรงและบ่อยครั้งขึ้นทำให้แก๊สภายในกระบอกสูบมีความดันมากกขึ้น และมากกว่าความดันภายนอก ก็จะดันให้ลูกสูบเคลื่อนที่ขึ้นเพื่อรักษาความดันให้คงที่ แก๊สภายในกระบอกสูบจึงมีปริมาตรเพิ่มขึ้น ในทางตรงกันข้ามถ้าอุณหภูมิลดลง โมเลกุลของแก๊สจะมีพลังงานจลน์เฉลี่ยลดลงจึงเคลื่อนที่ชนผนังภาชนะที่บรรจุเบาลง และชนด้วยความถี่ต่ำลง ทำให้แก๊สภายในกระบอกสูบมีความดันลดลง และต่ำกว่าความดันภายนอก ทำให้ลูกสูบเคลื่อนที่ลงเพื่อรักษาความดันให้คงที่ แก๊สภายในกระบอกสูบจึงมีปริมาตรลดลง
กลับไปที่เนื้อหา
บทเรียนที่ 4 กฏของบอยล์

ความสัมพันธ์ระหว่างปริมาตร ความดัน และอุณหภูมิของแก๊ส
กฎของบอยล์ (Boyle’s Law)
เมื่อทดลองโดยใช้กระบอกฉีดยาและปิดปลายกระบอกฉีดยา เมื่อกดก้านกระบอกฉีดยาทำให้ปริมาตรของแก๊สในกระบอกฉีดยาลดลง และเมื่อปล่อยมือก้านกระบอกฉีดยาจะเลื่อนกลับสู่ตำแหน่งเดิม ในทำนองเดียวกันเมื่อดึงก้านกระบอกฉีดยาขึ้น ทำให้ปริมาตรของแก๊สในกระบอกฉีดเพิ่มขึ้น และเมื่อปล่อยมือก้านกระบอกฉีดยาจะเลื่อนกลับสู่ตำแหน่งเดิม สามารถใช้ทฤษฎีจลน์ของแก๊สอธิบายได้ว่า เมื่อปริมาตรของแก๊สในกระบอกฉีดยาลดลง ทำให้โมเลกุลของแก๊สอยู่ใกล้กันมากขึ้น จึงเกิดการชนกันเองและชนผนังภาชนะมากขึ้น เป็นผลให้ความดันของแก๊สในกระบอกฉีดยาเพิ่มขึ้นเมื่อเทียบกับตอนเริ่มต้น ในทางตรงกันข้ามการเพิ่มปริมาตรของแก๊สในกระบอกฉีดยาทำให้โมเลกุลของแก๊สอยู่ห่างกัน การชนกันเองของโมเลกุลของแก๊สและการชนผนังภาชนะน้อยลง ความดันของแก๊สในกระบอกฉีดยาจึงลดลง
นักวิทยาศาสตร์ได้ทำการทดลองเพื่อศึกษาความสัมพันธ์ระหว่างปริมาตรกับความดันของแก๊ส โดยควบคุมให้อุณหภูมิคงที่ ได้ผลดังตารางต่อไปนี้
|
การทดลอง |
ปริมาตร |
ความดัน |
PV |
|
1 |
5.00 |
760 |
3.80 x 103 |
|
2 |
10.00 |
380 |
3.80 x 103 |
|
3 |
15.00 |
253 |
3.80 x 103 |
|
4 |
20.00 |
191 |
3.82 x 103 |
|
5 |
25.00 |
151 |
3.78 x 103 |
|
6 |
30.00 |
127 |
3.81 x 103 |
|
7 |
35.00 |
109 |
3.82 x 103 |
|
8 |
40.00 |
95 |
3.80 x 103 |
|
9 |
45.00 |
84 |
3.78 x 103 |
จากผลการทดลองในตารางพบว่า ผลคูณของความดันกับปริมาตร (PV) ของแก๊สในการทดลองแต่ละครั้งมีค่าค่อนข้างคงที่ และเมื่อเขียนกราฟแสดงความสัมพันธ์ระหว่างความดันกับปริมาตรของแก๊สจะได้ดังรูปต่อไปนี้
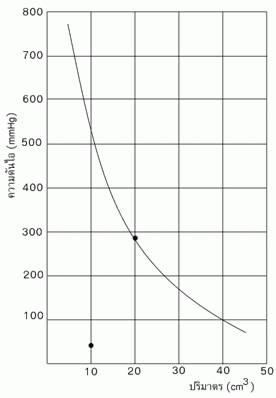
จากข้อมูลในตารางและจากกราฟพบว่าขณะที่อุณหภูมิคงที่ ถ้าปริมาตรของแก๊สเพิ่มขึ้นจะทำให้ความดันของแก๊สลดลง และเมื่อปริมาตรของแก๊สลดลง ความดันของแก๊สจะเพิ่มขึ้น
รอเบิร์ต บอยล์ (Robert Bolye) นักเคมีชาวอังกฤษ ได้ศึกษาเกี่ยวกับการเปลี่ยนปริมาตรของแก๊สในปี ค.ศ. 1662 (พ.ศ. 2205) และสรุปเป็นกฎเรียกว่า “กฎของบอยล์” ซึ่งมีสาระสำคัญดังนี้
เมื่ออุณหภูมิและมวลของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผกผันกับความดัน

REF :http://www.chem.iastate.edu/group/Greenbowe/sections/projectfolder/flashfiles/gaslaw/boyles_law.swf
ถ้าให้Pแทนความดันของแก๊สVแทนปริมาตรของแก๊ส ความสัมพันธ์ตามกฎของบอยล์เขียนแสดงความสัมพันธ์ได้ดังนี้
Va
PV = k
ค่าคงที่kในสมการนี้ขึ้นอยู่กับอุณหภูมิ ปริมาตร มวลของแก๊ส และลักษณะเฉพาะของแก๊สแต่ละชนิด และจากผลการทดลองพบว่าผลคูณระหว่างปริมาตและความดันของแก๊สมีค่าคงที่เสมอ ดังนั้นถ้าให้P1และV1เป็นความดันและปริมาตรที่สภาวะที่ 1 จะได้ว่า
P1V1 = k ………. (1)
และถ้าให้P1และV1เป็นความดันและปริมาตรที่สภาวะที่ 1 จะได้ว่า
P2V2 = k ………. (2)
(1) = (2) P1V1 = P2V2
ผลที่ได้จากกฎของบอยล์เมื่อนำมาเขียนกราฟโดยให้ความดันเป็นแกนตั้ง และปริมาตรเป็นแกนนอน จะได้กราฟ
จากกราฟถ้าอุณหภูมิเปลี่ยนไปจะได้กราฟที่มีลักษณะไฮเปอร์โบลา และพบว่าอุณหภูมิยิ่งสูงขึ้น ลักษณะของเส้นกราฟเกือบจะเป็นเส้นตรง
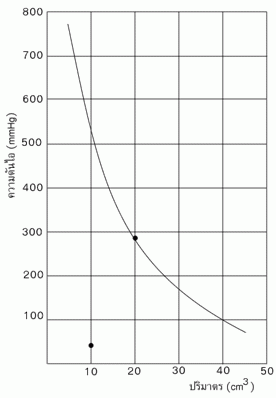
จากกราฟนี้ กราฟแต่ละเส้นแสดงความสัมพันธ์ระหว่างความดันกับปริมาตรที่ต่างกัน และได้กราฟที่มีลักษณะเป็นเส้นโค้ง ซึ่งไม่สามารถบอกได้ชัดเจนว่าเป็นไปตามกฎของบอยล์หรือไม่ แต่ถ้าเขียนกราฟระหว่างความดันกับส่วนกลับของปริมาตรจะได้กราฟที่เป็นเส้นตรง ซึ่งถ้าหากมีการเบี่ยงเบนเกิดขึ้น เส้นจะเฉออกจากแนวเส้นตรงอย่างเห็นได้ชัด
ตัวอย่างที่1 แก๊สจำนวน 15gมีปริมาตร 10 ลิตร ที่ความดัน 150mmHgเมื่ออุณหภูมิคงที่ ถ้าเปลี่ยนความดันเป็น 50mmHg แก๊สจะมีปริมาตรเท่าใด
วิธีทำ P1 = 150 mmHg
P2 = 50 mmHg
V1 = 10 ลิตร
V2 = ?
จากสูตร P1V1 = P2V2
150 x 10 = 50 x V2
V2 =
= 30ลิตร
ตัวอย่างที่2 แก๊สชนิดหนึ่งมีความดันเริ่มต้นเท่ากับ 200mmHgแก๊สชนิดนี้จะมีความดันสุดท้ายเป็นเท่าใดถ้าทำให้แก๊สมีปริมาตรลดลงเป็นครึ่งหนึ่งของปริมาตรเดิมเมื่ออุณหภูมิคงที่
วิธีทำ P1 = 200 mmHg
P2 = ? mmHg
V1 = V1
V2 =
จากสูตร P1V1 = P2V2
200 x V1 = P2x
P2 =
= 400 mmHg
กลับไปที่เนื้อหา
บทเรียนที่ 5 กฏของชาร์ล
กฎของชาร์ล(Charle’s Law)
ในการทดลองจุ่มกระบอกฉีดยาซึ่งบรรจุน้ำจำนวนหนึ่งลงในน้ำร้อน น้ำในกระบอกฉีดยาจะถูกดันออก ในทางตรงกันข้าม ถ้าจุ่มกระบอกฉีดยาลงในน้ำเย็น น้ำจากภายนอกจะเข้าไปแทนที่อากาศในกระบอกฉีดยา นั่นคือ การเพิ่มอุณหภูมิมีผลให้ปริมาตรของแก๊สเพิ่มขึ้น และการลดอุณหภูมิมีผลให้ปริมาตรของแก๊สลดลงด้วย แสดงว่าอุณหภูมิมีผลต่อการเปลี่ยนแปลงปิมาตรของแก๊ส
การเปลี่ยนแปลงนี้ใช้ทฤษฎีจลน์ของแก๊สอธิบายได้ว่า
การเพิ่มอุณหภูมิมีผลทำให้พลังงานจลน์เฉลี่ยของแก๊สเพิ่มขึ้น โมเลกุลของแก๊สจึงเคลื่อนที่เร็วขึ้น ทำให้โมเลกุลชนกันเองและชนผนังภาชนะมากขึ้น รวมทั้งพลังงานในการชนกันสูงขึ้นด้วย เป็นผลให้ความดันของแก๊สในกระบอกฉีดยาสูงขึ้นด้วย จึงดันน้ำออกจากกระบอกฉีดยาจนความดันของแก๊สภายในเท่ากับภายนอก จึงสังเกตเห็นว่าแก๊สในกระบอกฉีดยามีปริมาตรเพิ่มขึ้น ในกลับกันเมื่อลดอุณหภูมิ พลังงานจลน์เฉลี่ยของแก๊สในกระบอกฉีดยาจะลดลง ทำให้การชนกันเองระหว่างโมเลกุลของแก๊สและการชนผนังภาชนะน้อยลง รวมทั้งพลังงานในการชนลดลง ความดันของแก๊สในกระบอกฉีดยาจึงต่ำ อากาศภายนอกซึ่งมีความดันสูงกว่าจึงดันน้ำให้เข้าไปในกระบอกฉีดยา ความดันภายในจึงเพิ่มขึ้นจนเท่ากับความดันภายนอก จึงสังเกตเห็นว่าปริมาตรของแก๊สในกระบอกฉีดยาลดลงจนกระทั่งคงที่ จึงสรุปได้ว่าอุณหภูมิเป็นอีกปัจจัยหนึ่งที่มีผลต่อการเปลี่ยนปริมาตรของแก๊ส

Jacques Charles
จากผลการทดลองพบว่าเมื่อนำข้อมูลมาเขียนกราฟ จะได้กราฟเส้นตรงที่มีความชันคงที่ และทำให้คาดคะเนได้ว่า ถ้าลดอุณหภูมิของแก๊สลงเรื่อย ๆ แก๊สจะไม่มีปริมาตร หรือมีปริมาตรเป็นศูนย์ที่อุณหภูมิ –273OC แต่โดยความเป็นจริงแก๊สจะไม่สามารถมีปริมาตรเป็นศูนย์ได้ เนื่องจากเมื่อลดอุณหภูมิลงเรื่อย ๆ แก๊สจะเปลี่ยนสถานะเป็นของเหลวก่อนที่อุณหภูมิจะถึง –273OC ซึ่งนักวิทยาศาสตร์ได้กำหนดให้อุณหภูมิ –273OC มีค่าเท่ากับ 0 เคลวิน (K) โดยมีความสัมพันธ์ดังนี้
|
T = 273 + tOC |
เมื่อทดลองศึกษาการเปลี่ยนปริมาตรของแก๊สเมื่อเปลี่ยนอุณหภูมิ พบความสัมพันธ์ระหว่างปริมาตรแก๊สกับอุณหภูมิในหน่วยองศาเซลเซียสและในหน่วยเคลวิน ดังตาราง
|
การทดลองครั้งที่ |
T (OC ) |
T ( K ) |
V (cm3) |
V/T (cm3/K) |
|
1 |
10 |
283 |
100 |
0.35 |
|
2 |
50 |
323 |
114 |
0.35 |
|
3 |
100 |
373 |
132 |
0.35 |
|
4 |
200 |
473 |
167 |
0.35 |
จากตารางจะเห็นว่า เมื่อเปลี่ยนอุณหภูมิในหน่วยเซลเซียสเป็นหน่วยเคลวิน อัตราส่วนระหว่างปริมาตรกับอุณหภูมิเคลวินจะมีค่าคงที่จ๊าก–อาเล็กซองเดร์–เซซา ชาร์ล (Jacqes A.C. Charles) นักวิทยาศาสตร์ชาวฝรั่งเศส ได้ศึกษาความสัมพันธ์ระหว่างอุณหภูมิกับปริมาตรแก๊ส ในปี ค.ศ.1778 (พ.ศ.2321) และสรุปความ สัมพันธ์เป็นกฎ เรียกว่ากฎของชาร์ล ซึ่งมีใจความดังนี้
|
“เมื่อมวลและความดันของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผันตรงกับอุณหภูมิเคลวิน” |
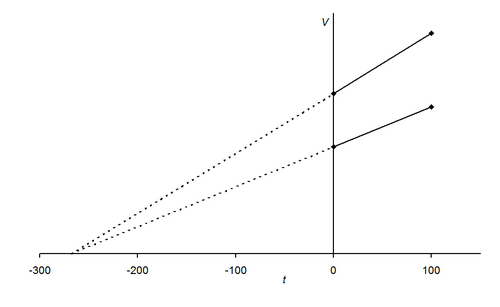
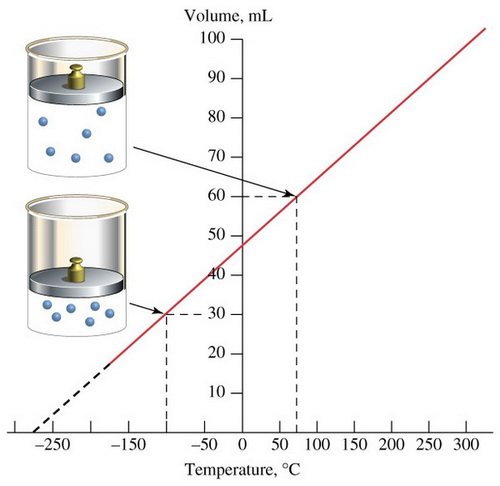

REF : http://www.chem.iastate.edu/group/Greenbowe/sections/projectfolder/flashfiles/gaslaw/charles_law.swf
จากกฎของชาร์ล สามารถเขียนเป็นความสัมพันธ์ได้ดังนี้
V a T
V = kT
= k
ถ้าให้ V1 เป็นปริมาตรของแก๊สที่อุณหภูมิ T1
V2 เป็นปริมาตรของแก๊สที่อุณหภูมิ T2
เนื่องจากอัตราส่วนระหว่าง V กับ T คงที่ ดังนั้น
V1/T1 = V2/T2
ตัวอย่างที่ 3 แก๊สชนิดหนึ่งมีปริมาตร 80 cm3 ที่อุณหภูมิ 45OC แก๊สนี้จะมีปริมาตรเท่าใดที่อุณหภูมิ 0OC ถ้าความดันคงที่
วิธีทำ V1 = 80 cm3
V2 = ?
T1 = 273 + 45 = 318 K
T2 = 273 + 0 = 273 K
V1/T1 = V2/T2
= 68.68 cm3
ตัวอย่างที่4 แก๊สชนิดหนึ่งมีปริมาตร 30 ลิตร ที่อุณหภูมิ 25OC ถ้าความดันคงที่ แก๊สนี้จะมีปริมาตรเท่าใดเมื่ออุณหภูมิเปลี่ยนไปเป็น 100OC
วิธีทำ V1 = 30 ลิตร
V2 = ?
T1 = 273 + 25 = 298 K
T2 = 273 + 100 = 373 K
= 30.55 ลิตร
เกย์–ลูสแซกได้ทำการทดลองเพิ่มเติมต่อไป โดยให้ปริมาตรของแก๊สคงที่ เพื่อที่จะหาความสัมพันธ์ระหว่างความดันกับอุณหภูมิ ผลที่ได้คือความดันของแก๊สใด ๆ จะแปรผันตรงกับอุณหภูมิเมื่อปริมาตรคงที่ดังนั้น
P a T
P = kT
= k
และ = =
ตัวอย่างที่5 ถังใบหนึ่งถ้ามีแก๊สบรรจุอยู่จำนวนหนึ่ง มีความดัน 135 บรรยากาศ ที่อุณหภูมิ 20OC ถ้าให้แก๊สภายในถังร้อนขึ้นเป็น 85OC จะมีความดันเท่าใดเมื่อปริมาตรคงที่
วิธีทำ =
=
P2 =
= 164.9 บรรยากาศ
กลับไปที่เนื้อหา
บทเรียนที่ 6 กฏของอาโวกาโดร
อาเมเดโอ อาโวกาโดร
(Lorenzo Romano Amedeo Carlo Avogadro ค.ศ.1776 - 1856)
นักวิทยาศาสตร์ชาวอิตาลีชื่อ อาเมเดโอ อาโวกาโดร ได้ศึกษาความสัมพันธ์ระหว่างปริมาตรกับปริมาณของแก๊ส โดยเขาได้เสนอสมมติฐานไว้ในปี ค.ศ. 1811 ว่า "ที่อุณหภูมิและความดันเดียวกัน แก๊สต่างชนิดกันที่มีปริมาตรเท่ากันจะมีจำนวนโมเลกุลเท่ากัน" ซึ่งหมายความว่า แก๊สทุกชนิดจะมีปริมาตรเพิ่มขึ้นเรื่อยๆ เมื่อจำนวนโมเลกุลของแก๊สเพิ่มขึ้นเรื่อยๆ เช่นกัน
แต่ข้อสมมติฐานของเขาไม่ได้รับการยอมรับจากวงการวิทยาศาสตร์ในสมัยนั้นเป็นเวลาเกือบ 50 ปี และต่อมาเมื่อ สตานิซาโล คานนิซาโร (Stanisalo Cannizaro) ได้ทดลองพิสูจน์และได้นำเสนอในที่ประชุมวิทยาศาสตร์เมื่อปี ค.ศ. 1860 สมมติฐานของอาโวกาโดรจึงได้รับการยอมรับในที่สุด
และเพื่อเป็นเกียรติแก่อาโวการโดร ตัวเลข 1 โมลซึ่งเท่ากับ 6.02 x 1023จึงเรียกว่า เลขอาโวกาโดร (Avogadro Number) จากข้อสมมติฐานของอาโวกาโดรเมื่อได้ทดลองซ้ำต่อมาหลายๆ ครั้งก็ยืนยันความสัมพันธ์ที่เป็นไปตามสมมติฐานอาโวกาโดร จึงตั้งเป็นกฏของอาโวกาโดรขึ้นมา ซึ่งกล่าวว่า "ที่ความดันและอุณหภูมิของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผันตรงกับจำนวนโมเลกุลหรือจำนวนโมลของแก๊สนั้น" ดังแผนภาพด้านล่าง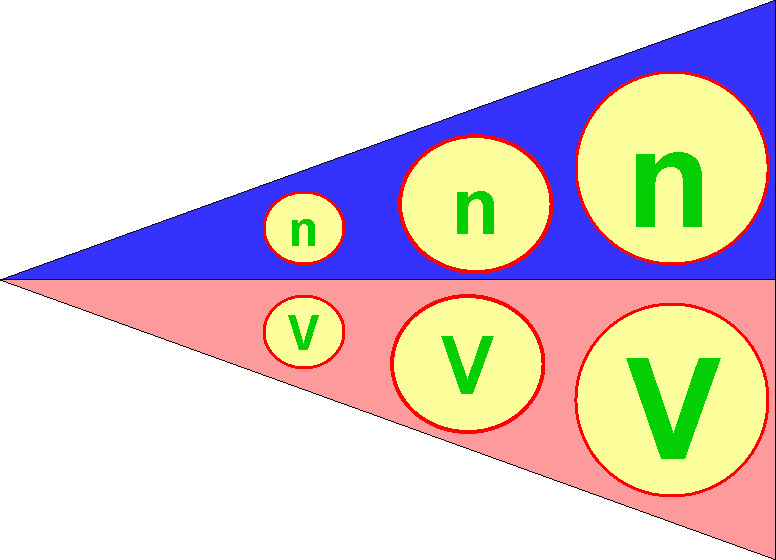
เมื่อ n คือจำนวนโมล และ V คือปริมาตรของแก๊ส
จากแผนภาพ เมื่อ n มีจำนวนน้อย V ก็จะน้อยด้วย แต่เมื่อ n มีจำนวนมากขึ้น V ก็จะมากขึ้นตามไปด้วย จากสมมติฐานของอาโวกาโดรเขียนเป็นความสัมพันธ์ทางคณิตศาสตร์ได้ว่า ปริมาตรของแก๊ส แปรผันตรงกับจำนวนโมลของแก๊ส![]()
![]()
![]()
กลับไปที่เนื้อหา
บทเรียนที่ 7 ของแข็ง (1)
ชนิดของผลึก

ของแข็งที่อยู่ในรูปผลึกมีลักษณะที่สำคัญคือมีการจัดเรียงอนุภาคภายในอย่างมีระเบียบในสามมิติ แต่ละอนุภาคยึดเหนี่ยวด้วยแรงชนิดต่าง ๆ มีโครงสร้างทางเรขาคณิตที่แน่นอน ของแข็งบริสุทธิ์มีจุดหลอมเหลวที่ชัดเจนและคงที่ นั่นคือเมื่ออุณหภูมิถึงจุดหลอมเหลวสารประเภทนี้จะเปลี่ยนสถานะเป็นของเหลวทันที
ถ้าใช้แรงยึดเหนี่ยวระหว่างอนุภาคภายในผลึกเป็นเกณฑ์ สามารถแบ่งของแข็งในรูปผลึกได้ 4 ประเภท ดังนี้
1. ผลึกโมเลกุล (Molecular crystal)
ผลึกโมเลกุล (Molecular crystal)
ประกอบด้วยโมเลกุลที่ยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์ และหรือพันธะไฮโดรเจนถ้าเป็นผลึกของโมเลกุลที่ไม่มีขั้ว แรงยึดเหนี่ยวระหว่างโมเลกุลจะเป็นแรงแวนเดอร์วาลส์ประเภทแรงลอนดอน เช่น แนฟทาลีน น้ำแข็งแห้ง ถ้าเป็นของแข็งที่โมเลกุลมีขั้วจะยึดเหนี่ยวด้วยแรงดึงดูดระหว่างขั้ว หรือพันธะไฮโดรเจน เช่น นำแข็ง แอมโมเนียแข็ง ซึ่งโมเลกุลจะยึดเหนี่ยวกันด้วยพันธะไฮโดรเจน ของแข็งที่เป็นผลึกโมเลกุลส่วนใหญ่จะมีลักษณะค่อนข้างอ่อนหรือแข็งปานกลาง มีจุดหลอมเหลวต่ำ ไม่นำไฟฟ้า สำหรับผลึกของโมเลกุลไม่มีขั้วบางชนิดระเหิดได้ง่าย เช่น แนฟทาลีน
ผลึกโคเวเลนต์ร่างตาข่าย(Network covalent crystal)
ประกอบด้วยอะตอมที่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เช่น แกรไฟต์ เพชร ซึ่งมีอะตอมของคาร์บอนสร้างพันธะโคเวเลนต์กับอะตอมของคาร์บอนอื่นอีก 3 อะตอม และ 4 อะตอมตามลำดับ เกิดเป็นสารที่มีโครงผลึกร่างตาข่าย ของแข็งประเภทนี้มีจุดหลอมเหลวสูง มีความแข็ง แต่ความแข็งจะมากหรือน้อยขึ้นอยู่กับการจัดเรียงอะตอมในโครงผลึกร่างตาข่าย

กลับไปที่เนื้อหา
บทเรียนที่ 8 ของแข็ง(2)
ผลึกโลหะ (Metalic crystal)
ประกอบด้วยอะตอมที่ยึดเหนี่ยวกันด้วยพันธะโลหะที่แข็งแรงมาก ของแข็งประเภทนี้ส่วนใหญ่มีความแข็งและเหนียว สามารถตีเป็นแผ่น บิดงอได้ เป็นตัวนำความร้อนและไฟฟ้าที่ดี แต่อย่างไรก็ตามผลึกโลหะทั้งหมดอาจมีสมบัติไม่สอดคล้องตามที่กล่าวแล้ว เช่น ตะกั่ว ซึ่งนำไฟฟ้าได้ไม่ดี สำหรับจุดเดือดจุดหลอมเหลวของของแข็งประเภทนี้ค่อนข้างสูงและแตกต่างกันไปตามความแข็งแรงของพันธะโลหะ แต่มีผลึกโลหะบางชนิดที่มีลักษณะค่อนข้างอ่อน มีจุดเดือดและจุดหลอมเหลวต่ำ เช่น โพแทสเซียม (K) โซเดียม (Na)

ผลึกไอออนิก (Ionic crystal)
ประกอบด้วยไอออนบวกและไอออนลบที่มีขนาดไอออนแตกต่างกัน และยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้า ของแข็งประเภทนี้จึงมีลักษณะแข็งและเปราะ มีจุดหลอมเหลวและจุดเดือดสูง เมือเป็นของแข็งไม่นำไฟฟ้า แต่จะนำไฟฟ้าได้เมื่อเป็นของเหลวหรือเป็นสารละลายในน้ำ

กลับไปที่เนื้อหา



