สมดุลกรด-เบส
- 1. การแนะนำ
- 2. บทเรียนที่ 2 ไอออนในสารละลายกรด และสารละลายเบส
- 3. บทเรียนที่ 3 ทฤษฎีกรด-เบส(ตอนที่ 1)
- 4. บทเรียนที่ 4 ทฤษฎีกรด-เบส (ตอนที่ 2)
- 5. บทเรียนที่ 5 คู่กรดเบสและความแรงของกรดและเบส
- 6. บทเรียนที่ 6 การแตกตัวของกรดแก่ และเบสแก่
- 7. บทเรียนที่ 7 การแตกตัวของกรดอ่อน
- 8. บทเรียนที่ 8 การแตกตัวของเบสอ่อน
- 9. บทเรียนที่ 9 การแตกตัวของน้ำ
- 10. บทเรียนที่ 10 PH ของสารละลาย
- 11. บทเรียนที่ 11 อินดิเคเตอร์
- 12. บทเรียนที่ 12 สารละลายกรด-เบสในชีวิตประจำวัน
- 13. บทเรียนที่ 13 ปฏิกิริยาระหว่างกรด-เบส
- 14. บทเรียนที่ 14 ปฏิกิริยาระหว่างกรด-เบส (2)
- 15. บทเรียนที่ 15 การไทเทรตกรด-เบส
- - ทุกหน้า -
บทเรียนที่ 1 สารละลายอิเล็กโทรไลต์
สารละลายอิเล็กโทรไลต์ คืออะไร
อิเล็กโทรไลต์ (Electrolyte) หมายถึง สารที่เมื่อละลายในน้ำจะนำไฟฟ้าได้ เนื่องจากมีไอออนซึ่งอาจจะเป็นไอออนบวก หรือไอออนลบเคลื่อนที่อยู่ในสารละลาย สารละลายอิเล็กโทรไลต์นี้อาจเป็นสารละลายกรด เบส หรือเกลือก็ได้ ตัวอย่างเช่น สารละลายกรดเกลือ (HCl) สารละลายโซเดียมไฮดรอกไซด์ (NaOH) และสารละลายของเกลือ KNO3เป็นต้น โดยในสารละลายดังกล่าวประกอบด้วยไอออน H+, Cl-, OH-, K+
และ NO3- ตามลำดับ
นอนอิเล็กโทรไลต์ (Non-electrolyte) หมายถึง สารที่ไม่สามารถนำไฟฟ้าได้เมื่อละลายน้ำ ทั้งนี้เนื่องจาก สารพวกนอนอิเล็กโทรไลต์ จะไม่สามารถแตกตัวเป็นไอออนได้ เช่น น้ำบริสุทธิ์ น้ำตาล แอลกอฮอล์ เป็นต้น ความแตกต่างของสารอิเล็กโทรไลต์และนอน- อิเล็กโทรไลต์ พิจารณาจากสาร 2 ชนิด เมื่อละลายน้ำจะรวมกับน้ำเกิดการเปลี่ยนแปลงดังนี้
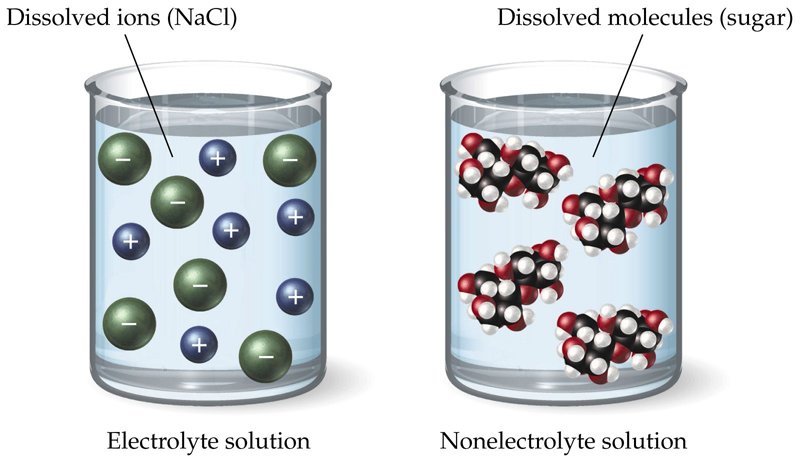
อิเล็กโทรไลต์แก่และอิเล็กโทรไลต์อ่อน
สารละลายอิเล็กโทรไลต์ต่างๆ นำไฟฟ้าได้ไม่เท่ากัน เนื่องจากการแตกตัวเป็นไอออนของอิเล็กโทรไลต์ไม่เท่ากัน อิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้มากกว่า ก็จะนำไฟฟ้าได้ดีกว่าอิเล็กโทรไลต์ที่แตกตัวเป็นไอออนได้น้อยกว่า อิเล็กโทรไลต์แบ่งออกได้เป็น 2 ประเภท ดังนี้
1. อิเล็กโทรไลต์แก่ (strong electrolyte) หมายถึง สารที่ละลายน้ำแล้วแตกตัวเป็นไอออนได้มาก อาจจะแตกตัวได้ 100% และนำไฟฟ้าได้ดีมาก เช่น กรดแก่ และเบสแก่ และเกลือส่วนใหญ่จะแตกตัวได้ 100% เป็นต้น
2. อิเล็กโทรไลต์อ่อน (weak electrolyte) หมายถึง สารที่ละลายน้ำแล้วแตกตัวได้บางส่วน นำไฟฟ้าได้น้อย
ตารางตัวอย่างของอิเล็กโทรไลต์แก่ และอิเล็กโทรไลต์อ่อนบางชนิด
|
อิเล็กโทรไลต์แก่ |
อิเล็กโทรไลต์อ่อน (นำไฟฟ้าได้ไม่้ดี) |
|
เกลือที่ละลายนำ้ทั้งหมด |
CH3COOH |
เราจะรู้ได้อย่างไรว่าสารละลายของเราเป็นสารละลายอิเล็กโทรไลต์หรือเปล่า?
การทดสอบว่าสารละลายเป็นสารละลายอิเล็กโทรไลต์ หรือไม่ก็ต้องดูการนำไฟฟ้าของสารละลาย เราอาจทดสอบโดยใช้เครื่องมือง่ายๆ ดังนี้
สารละลายที่นำไฟฟ้า ได้แก่ สารละลายของกรด เบส และเกลือ อุปกรณ์ที่ใช้ในการทดลอง ประกอบด้วยขั้วไฟฟ้า 2 ขั้ว ต่อเข้ากับแหล่งให้พลังงานไฟฟ้า
( ให้ศักย์ไฟฟ้า) หลอดไฟ และสวิตซ์ให้ครบวงจรดังภาพ
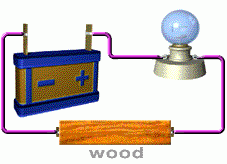

ภาพอุปกรณ์การวัดการนำไฟฟ้าของสารละลายอิเล็กโทรไลต์
ที่มา http://ssga.ru
ตัวอย่างผลการทดลองการทดสอบการนำไฟฟ้า
|
สารที่ใช้ทดสอบ |
ผลการทดสอบ |
| น้ำบริสุทธิ์ น้ำที่มีน้ำตาลละลายอยู่ ยูเรีย CO(NH2)2 สารละลายเกลือ NaCl สารละลายเกลือ K2SO4 สารละลายกรด HCI สารละลายกรดแอซิติก CH3COOH สารละลายเบส NaOH สารละลายเบส Na4OH |
ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง) ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง) ไม่นำไฟฟ้า (หลอดไฟไม่สว่าง) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้าน้อย (หลอดไฟสว่าง) นำไฟฟ้า (หลอดไฟสว่าง) นำไฟฟ้า (หลอดไฟสว่าง) |
ผลที่ได้อธิบายได้ว่า สารละลายที่ไม่มีไอออนอยู่ เช่น น้ำ หรือน้ำตาลทรายที่ละลายอยู่ในน้ำมัน จะมีพันธะแบบโคเวเลนต์ ไม่สามารถแตกตัวเป็นไอออนได้ จึงไม่นำไฟฟ้า แต่ NaCl HCl เมื่ออยู่ในน้ำจะแตกตัวเป็น Na+, Cl-หรือ H+, Cl-ซึ่งเป็นไอออนที่เคลื่อนที่ในสารละลายทำให้เกิดการนำไฟฟ้าขึ้นได้
|
||||
กลับไปที่เนื้อหา
บทเรียนที่ 2 ไอออนในสารละลายกรด และสารละลายเบส
จากการศึกษาสมบัติของสารละลาย พบว่า สารละลายกรดและสารละลายเบส เป็นสารละลายอิเล็กโทรไลต์ นำไฟฟ้าได้ เปลี่ยนสีกระดาษลิตมัส ทำปฏิกิริยากับโลหะและเกลือ กรดและเบสสามารถแตกตัวเป็นไอออน เมื่อเป็นสารละลาย เราจะศึกษาต่อไปถึงไอออนในสารละลายกรดและเบส ซึ่งทำให้สารละลายแสดงสมบัติเฉพาะตัวดังกล่าว
ไอออนในสารละลายกรด
ในสารละลายกรดทุกชนิด จะมีไอออนที่เหมือนกันอยู่ส่วนหนึ่งคือ H+หรือ เมื่อรวมกับน้ำได้เป็น H3O+( ไฮโดรเนียมไอออน) ทำให้กรดมีสมบัติเหมือนกัน ตัวอย่างเช่น สารละลายกรดไฮโดรคลอริก (HCl) ซึ่งเกิดจากกรด HCl ละลายในน้ำ โมเลกุลของ HCl และ น้ำต่างก็เป็นโมเลกุลโคเวเลนต์มีขั้ว ทำให้เกิดแรงดึงดูดระหว่างขั้วของ HCl และน้ำ โดยที่โปรตอน (H+) ของ HCl ถูกดึงดูดโดยโมเลกุลของน้ำเกิดเป็นไฮโดรเนียมไอออน (H++ H2O![]() H3O+) ในบางครั้งเขียนแทน H3O+ด้วย H+โดยเป็นที่เข้าใจว่า H+นั้นจะอยู่รวมกับโมเลกุลของน้ำในรูป H3O+เสมอ
H3O+) ในบางครั้งเขียนแทน H3O+ด้วย H+โดยเป็นที่เข้าใจว่า H+นั้นจะอยู่รวมกับโมเลกุลของน้ำในรูป H3O+เสมอ
HCl (g) + H2O (l)![]() H3O+(aq) + Cl-(aq)
H3O+(aq) + Cl-(aq)
ไฮโดรเนียมไอออนในน้ำไม่ได้อยู่เป็นไอออนเดียว แต่จะมีน้ำหลายโมเลกุลมาล้อมรอบอยู่ด้วย เช่น อาจอยู่ในรูปของ H5O2+, H7O3+, H9O4+เป็นต้น
ไอออนในสารละลายเบส
ในสารละลายเบสทุกชนิดจะมีไอออนที่ี่เหมือนกันอยู่คือ ไฮดรอกไซด์ไอออน ( OH-) ซึ่งทำให้เบสมีสมบัติเหมือนกัน และมีสมบัติต่างไปจากกรด ตัวอย่างเช่น เมื่อ NaOH ละลายน้ำจะแตกตัวได้ OH-ดังนี้
NaOH (s)![]() Na+(aq) + OH-(aq)
Na+(aq) + OH-(aq)
KOH (s)![]() K+(aq) + OH-(aq)
K+(aq) + OH-(aq)
NH3(g) + H2O (l)![]() NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)
ประโยชน์ของสารละลายกรดและเบสในชีวิตประจำวัน
สารละลายกรดและเบสมีบทบาทที่สำคัญในชีวิตประจำวัน ทั้งมีอยู่ในธรรมชาติและที่สังเคราะห์ขึ้นใช้ประโยชน์ในด้านต่างๆ เช่น ในด้านอาหาร อุตสาหกรรม การแพทย์ ตัวอย่างเช่น น้ำส้มสายชู น้ำส้ม น้ำมะนาว เหล่านี้ล้วนเป็นสารละลายกรด น้ำส้มสายชู ประกอบด้วยกรดแอซิติก น้ำส้มและน้ำมะนาวประกอบด้วยกรดซิตริก นอกจากนั้น ก็มีกรดคาร์บอนิกในน้ำโซดา กรดซัลฟิวริกในสารละลายที่อยู่ในแบตเตอรี่ สารละลายเบสที่คุ้นเคยในชีวิตประจำวันได้แก่ โซดาทำขนม (NaHCO3), หรือโซดาแอส (NaCO3), โซเดียมไฮดรอกไซด์ (NaOH) หรือโซดาไฟ
กลับไปที่เนื้อหา
บทเรียนที่ 3 ทฤษฎีกรด-เบส(ตอนที่ 1)
ทฤษฎีกรด - เบส
ในการที่จะให้นิยามของกรด- เบส และในการจำแนกสารต่างๆ ว่าเป็นกรดหรือเบสนั้นได้มีนักวิทยาศาสตร์ ได้ศึกษาและตั้งทฤษฎีกรด- เบส ขึ้นหลายทฤษฎีด้วยกัน ทฤษฎีกรด- เบสที่สำคัญมีดังนี้
ทฤษฎีกรด- เบสของอาร์เรเนียส
อาร์เรเนียส เป็นนักวิทยาศาสตร์ชาวสวีเดน ได้ตั้งทฤษฎีกรด- เบส ในปี ค. ศ. 1887 ( พ. ศ. 2430) อาร์เรเนียสศึกษาสารที่ละลายน้ำ (Aqueous solution) และการนำไฟฟ้าของสารละลายนั้น เขาพบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน เมื่อละลายอยู่ในน้ำและให้นิยามกรดไว้ว่า
“ กรด คือ สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน” เช่น
HCl (g)![]() H+(aq) + Cl-(aq)
H+(aq) + Cl-(aq)
HClO4(l)![]() H+(aq) + ClO4-(aq)
H+(aq) + ClO4-(aq)
CH3COOH (l)![]() H+(aq) + CH3COO-(aq)
H+(aq) + CH3COO-(aq)
H2SO4(l)![]() H+(aq) + SO22-(aq)
H+(aq) + SO22-(aq)
H2CO3(l)![]() H+(aq) + HCO3-(aq)
H+(aq) + HCO3-(aq)
“เบสคือสารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน” เช่น
NaOH (s)![]() Na+(aq) + OH-(aq)
Na+(aq) + OH-(aq)
Ca(OH)2(s)![]() Ca2+(aq) + 2OH-(aq)
Ca2+(aq) + 2OH-(aq)
KOH (s)![]() K+(aq) + OH-(aq)
K+(aq) + OH-(aq)
NH4OH (l)![]() NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)
ทฤษฎีกรด- เบส อาร์เรเนียส จะเน้นเฉพาะการแตกตัวในน้ำ ให้เป็น H+และ OH-ไม่รวมถึงตัวทำละลายอื่นๆ ทำให้อธิบายความเป็นกรด- เบสได้จำกัด
- สารที่จะเป็นกรดได้ต้องมี H+อยู่ในโมเลกุล และสารที่ี่จะเป็นเบสได้ก็ต้องมี OH-อยู่ในโมเลกุล
กลับไปที่เนื้อหา
บทเรียนที่ 4 ทฤษฎีกรด-เบส (ตอนที่ 2)
ทฤษฎีกรด- เบส ของเบรินสเตต- เลารี
โจฮันส์ นิโคลัส เบรินสเตต นักเคมีชาวเดนมาร์ก และ โทมัส มาร์ติน ลาวรี นักเคมีชาวอังกฤษ ได้ศึกษาการให้และรับโปรตอนของสาร เพื่อใช้ในการอธิบายและจำแนกกรด- เบสได้กว้างขึ้น และได้ตั้งทฤษฎีกรด- เบสขึ้นในปี ค. ศ.1923 ( พ. ศ.2466)
กรด คือสารที่สามารถให้โปรตอนกับสารอื่นๆ ได้ (Proton donor)
เบส คือสารที่สามารถรับโปรตอนจากสารอื่นได้ (Proton acceptor)
พิจารณาตัวอย่างต่อไปนี้
1.
 |
HCl เป็นสารที่ให้โปรตอน (H+) ดังนั้น HCl จึงเป็นกรด
H2O เป็นสารที่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
2.
 |
NH4+เป็นสารที่ให้โปรตอน (H+) ดังนั้น NH4+จึงเป็นกรด
H2Oเป็นสารที่รับโปรตอน (H+) ดังนั้น H2Oจึงเป็นเบส
3.
 |
H2Oเป็นสารที่ให้โปรตอน (H+) ดังนั้น H2Oจึงเป็นกรด
NH3เป็นสารที่รับโปรตอน (H+) ดังนั้น NH3จึงเป็นเบส
จากปฏิกิริยาทั้ง 3 ปฏิกิริยา จะมีสารที่ให้และรับโปรตอนในแต่ละปฏิกิริยา และมี H3O+และ OH-เกิดขึ้น
ทฤษฎีกรด- เบสของเบรินสเตต- ลาวรี ใช้อธิบายสมบัติของกรด- เบส ได้กว้างกว่าทฤษฎีของอาร์เรเนียส แต่ยังมีข้อจำกัดคือ สารที่จะทำหน้าที่เป็นกรดจะต้องมีโปรตอนอยู่ในสารนั้น
สารบางตัวทำหน้าที่เป็นทั้งกรด เมื่อทำปฏิกิริยากับสารตัวหนึ่ง และทำหน้าที่เป็นเบส เมื่อทำปฏิกิริยากับอีกสารหนึ่ง นั่นคือเป็นได้ทั้งกรดและเบส สารที่มีลักษณะนี้เรียกว่า สารเอมโพเทอริก(Amphoteric) เช่น H2O , HCO3-เป็นต้น
กรณีของ H2O
 |
ในกรณีนี้ H2O เป็นกรดเมื่อทำปฏิกิริยากับ NH3และเป็นเบสเมื่อทำปฏิกิริยากับNH4+
กรณีของ HCO3-
 |
ในกรณีนี้ HCO3-เป็นเบสเมื่อทำปฏิกิริยากับ HCl และเป็นกรดเมื่อทำปฏิกิริยากับ OH-
ดังนั้นอาจจะสรุปได้ว่า สารที่เป็นเอมโฟเทอริก ถ้าทำปฏิกิริยากับสารที่ให้โปรตอนได้ดีกว่า ตัวมันเองจะรับโปรตอน ( ทำหน้าที่เป็นเบส) แต่ถ้าไปทำปฏิกิริยากับสารที่ให้โปรตอนได้ไม่ดี ตัวมันเองจะเป็นตัวให้โปรตอนกับสารนั้น ( ทำหน้าเป็นกรด)
ในปี ค. ศ. 1923 ( พ. ศ. 2466) ลิวอีสไดเสนอนิยามของกรดและเบสดังนี้
กรด คือสารที่สามารถรับอิเล็กตรอนคู่ จากเบส แล้วเกิดพันธะโคเวเลนต์
เบส คือสารที่สามารถให้อิเล็กตรอนคู่ในการเกิดพันธะโคเวเลนต์
ปฏิกิริยาระหว่างกรด- เบส ตามทฤษฎีนี้ อธิบายในเทอมที่มีการใช้อิเล็กตรอนคู่ร่วมกัน กรดรับอิเล็กตรอนเรียกว่าเป็น Electrophile และเบสให้อิเล็กตรอนเรียกว่าเป็น Nucleophile และตามทฤษฎีนี้สารที่เป็นเบสต้องมีอิเล็กตรอนคู่อิสระ เช่น
 |
ในกรณีนี้ NH3เป็นเบส มีอิเล็กตรอนคู่ 1 คู่ จะให้อิเล็กตรอนคู่กับกรดในการเกิดพันธะโคเวเลนต์ และ BF3รับอิเล็กตรอนจาก NH3BF3จึงเป็นกรด
ทฤษฎีของลิวอิสนี้มีข้อดีคือ สามารถจำแนกกรด- เบส ที่ไม่มีทั้ง H หรือ OH-ในสารนั้น และแม้ว่าสารนั้นไม่ได้อยู่ในรูปสารละลาย แต่อยู่ในสถานะแก๊สก็สามารถใช้ทฤษฎีลิวอิสอธิบายความเป็นกรดเบสได้
ตัวอย่างอื่นๆ เช่น
 |
ตัวอย่างที่ 4ปฏิกิริยาต่อไปนี้ สารตั้งต้นใดทำหน้าที่เป็นกรด สารใดทำหน้าที่เป็นเบสตามทฤษฎีของอาร์เรเนียส
ก. HSO4-(aq) + H2O (l)![]() SO42-+ H3O + H2O
SO42-+ H3O + H2O
ข. LiOH (s)![]() Li2++ OH-
Li2++ OH-
ค. H2O + H2O![]() H3O + + OH-
H3O + + OH-
วิธีทำ
ก. HSO4-(aq) + H2O (l)![]() SO42-+ H3O+
SO42-+ H3O+
HSO4-ให้ H+ในน้ำ HSO4--ทำหน้าที่เป็นกรด
ข. LiOH (s) เป็นเบสเพราะ แตกตัวให้ OH-ในน้ำ
ค. H2Oเป็นทั้งกรดและเบส โมเลกุลหนึ่งให้ H3O+( เป็นกรด) อีกโมเลกุลหนึ่งแตกตัวให้ OH-( เป็นเบส)
ตัวอย่างที่ 5ในปฏิกิริยาต่อไปนี้ HCO3-ไอออนทำหน้าที่เป็นกรดในปฏิกิริยาใด
ก. HCO3-(aq) + H2O (l)![]() H2CO3(aq) + OH-(aq)
H2CO3(aq) + OH-(aq)
ข. HCO3-(aq) + OH-(aq)![]() H2O (l) + CO32-(aq)
H2O (l) + CO32-(aq)
ค. HCO3-(aq) + HSO4-(aq)![]() H2CO3(aq) + SO42-(aq)
H2CO3(aq) + SO42-(aq)
ง. HCO3-(aq) + CH3COOH (aq)![]() H2O (l) + CO2(g) + CH3COO-(aq)
H2O (l) + CO2(g) + CH3COO-(aq)
วิธีทำ
ก. HCO3-(aq) ไม่ใช่กรด แต่เป็นเบสเพราะรับ H+
ข. HCO3-(aq) เป็นกรด เพราะให้ H+กับ OH-
ค. HCO3-(aq) เป็นเบส เพราะรับ H+
ง. HCO3-(aq) เป็นเบส เพราะรับH+จาก CH3COOH (aq) ได้ H2O (l) + CO2(g)
ตัวอย่างที่ 6สารต่อไปนี้ ข้อใดทำหน้าที่ได้ทั้งกรดและเบส
ก. HC2O42-
ข. CO32-
ค. CN-
ง. HSO4-
เฉลย
ข้อ ก และ ง เป็นได้ทั้งกรดและเบส เพราะสามารถให้ และรับ H+ได้
ข้อ ข และ ค. เป็นเบสได้เพียงอย่างเดียว เพราะให้โปรตอนไม่ได้เนื่องจากไม่มี H แต่สามารถรับโปรตอนได้ กลายเป็น HCO3-และ HCN ตามลำดับ
กลับไปที่เนื้อหา
บทเรียนที่ 5 คู่กรดเบสและความแรงของกรดและเบส
ไหมว่ากรด-เบส นี้มีคู่ด้วยนะเรียกว่า คู่กรด-เบส จะเป็นอย่างไรนั้นเดี๋ยวจะอธิบายต่อไป
จากปฏิกิริยาของกรดกับเบสที่กล่าวถึงแล้ว ตามทฤษฎีของเบรินสเตต- ลาวรี จะเห็นว่าในปฏิกิริยาหนึ่งๆ อาจจะจัดคู่กรด- เบสได้ 2 คู่ด้วยกัน ตัวอย่างเช่น

ปฏิกิริยาตัวอย่างนี้ ปฏิกิริยาไปข้างหน้า NH4+ทำหน้าที่เป็นกรด เพราะให้ H+กับ H2O แล้วได้เป็น NH3และ H2O รับ
H+ทำหน้าที่เป็นเบส ส่วนปฏิกิริยาย้อนกลับ H3O+เป็นกรด เพราะให้ H+กับ NH3ซึ่งเป็นเบส แล้วได้ H2O และ NH4+ตามลำดับ
เรียก NH4+ว่าคู่กรดของ NH3( เบส)
H2O ว่าคู่เบสของ H3O+( กรด)
NH3ว่าคู่เบสของ NH4+(กรด)
H3O+ว่าคู่กรดของ H2O ( กรด)
จะเห็นได้ว่า คู่กรด- เบสนั้นจะมีจำนวนโปรตอน (H) ต่างกัน 1 ตัว หรืออาจกล่าวได้ว่า จำนวนโปรตอนของคู่กรด จะมากกว่าโปรตอนคู่เบสอยู่ 1 ตัวเสมอ
ตัวอย่าง คู่กรด - เบส

การเปรียบเทียบความแรงของกรดและเบส อาจจะพิจารณาได้ดังนี้
1. ดูจากการแตกตัวของกรด
กรดที่มีการแตกตัวมาก มีความเป็นกรดมาก กรดและเบสที่แตกตัวได้ 100% จะเรียกว่ากรดแก่ และเบสแก่ ตามลำดับ ซึ่งสามารถนำไฟฟ้าได้ดี แต่ถ้ากรดและเบสนั้นแตกตัวได้เพียงบางส่วนก็จะเรียกว่า กรดอ่อน หรือเบสอ่อน ตามลำดับ ซึ่งการนำไฟฟ้าจะไม่ดี
สำหรับการพิจารณาค่าการแตกตัวของกรดและเบสนั้น นอกจากจะคิดจากเปอร์เซ็นต์การแตกตัว หรืออาจจะดูได้จากค่าคงที่สมดุลของการแตกตัวของกรดหรือเบส (Kaหรือ Kb) เช่น
ความแรงของเบส พิจารณาจากค่า Kbกล่าวคือ ถ้ามีค่า Kbมาก มีความเป็นเบสมากกว่า Kbน้อย เช่น
NH3Kb= 1.76 x 10-5
N2H4Kb= 9.5 x 10-7
C6H5NH2Kb= 4.3 x 10-10
ความเป็นเบส NH3> N2H4> C6H5NH2
2. ดูจากความสามารถในการให้และรับโปรตอน
กรดแก่ ได้แก่ กรดที่ให้โปรตอนได้มาก
กรดอ่อน ได้แก่ กรดที่ให้โปรตอนได้น้อย
เบสแก่ ได้แก่ เบสที่รับโปรตอนได้มาก
เบสอ่อน ได้แก่ เบสที่รับโปรตอนได้น้อย
โดยมีข้อสังเกตเกี่ยวกับคู่กรด- เบส ดังนี้
- ถ้ากรดเป็นกรดแก่ คู่เบสจะเป็นเบสอ่อน เช่น
HCl (aq) + H2O![]() H3O+(aq) + Cl-(aq)
H3O+(aq) + Cl-(aq)
กรดแก่ เบสอ่อน
- ถ้ากรดเป็นกรดอ่อน คู่เบสจะเป็นเบสแก่ เช่น
HS-(aq) + H2O![]() H3O++ S2-(aq)
H3O++ S2-(aq)
กรดอ่อน เบสแก่
- ถ้าเบสเป็นเบสแก่ คู่กรดจะเป็น กรดอ่อน เช่น
H3O++ S2-(aq)![]() HS-(aq) + H2O
HS-(aq) + H2O
เบสแก่ กรดอ่อน
- ถ้าเบสเป็นเบสอ่อน คู่กรดจะเป็น กรดแก่ เช่น
Cl-(aq) + H3O+![]() HCl + H2O
HCl + H2O
เบสอ่อน กรดแก่
ตารางลำดับความแรงของกรดและเบสตัวอย่างตามทฤษฎีของเบรินสเตต- ลาวรี

3. ดูจากการเรียงลำดับในตารางธาตุ
การพิจารณาความแรงของกรดและเบสดูจากการเรียงลำดับของธาตุที่อยู่ในกรดนั้้้น ตามตารางธาตุ ซึ่งแบ่งออกได้เป็น
3.1 กรดออกซีหมายถึง กรดที่ประกอบด้วย H, O และธาตุอื่นอีก เช่น HNO3,H3PO4,H3AsO4,HClO4ถ้าจำนวนอะตอมออกซิเจนเท่ากัน ความแรงของกรดเรียงลำดับดังนี้

ดังนั้น H2SO4> H2SeO4, H3PO4> H3AsO4
3.2 กรดที่ไม่มีออกซิเจนเช่น HCl, HBr, HF, และ HI ความแรงของกรดแรงลำดับดังนี้
HI > HBr > HCl > HF
H2S > H2O
กลับไปที่เนื้อหา
บทเรียนที่ 6 การแตกตัวของกรดแก่ และเบสแก่
การแตกตัวของกรดแก่และเบสแก่ จะแตกตัวได้หมด 100% หมายถึง การแตกตัวของกรดแก่และเบสแก่ เป็นไอออนได้หมดในตัวทำละลายซึ่งส่วนใหญ่เป็นน้ำ เช่น การแตกตัวของกรด HCl จะได้ H+หรือ H3O+และ Cl-ไม่มี HCl เหลืออยู่ หรือการแตกตัวของเบส เช่น NaOH ได้ Na+และ OH-ไม่มี NaOH เหลืออยู่
การแตกตัวของกรดแก่และเบสแก่เขียนแทนด้วยลูกศร ซึ่งแสดงการเปลี่ี่ยนแปลงไปข้างหน้าเพียงอย่างเดียว เช่น

การคำนวณเกี่ยวกับการแตกตัวของกรดแก่และเบสแก่
ตัวอย่างที่ 1จงคำนวณหา [H3O+] , [NO3-] ในสารละลาย 0.015 M HNO3
วิธีทำ
HNO3+H2O![]() H3O++ NO3-
H3O++ NO3-
0.015
เพราะฉะนั้น [H3O+] = [NO3-] = 0.015 โมล/ ลิตร
ตัวอย่างที่ 2ถ้า KOH 0.1 โมล ละลายน้ำและสารละลายมีปริมาตร 2 ลิตร ในสารละลายจะมีไอออนใดบ้างอย่างละกี่ี่โมลต่อลิตร
วิธีทำ
KOH (s)![]() K+(aq) + OH-(aq)
K+(aq) + OH-(aq)
0.1โมล/ 2 ลิตร
สารละลาย KOH 2 ลิตร มี KOH 0.1 โมล
สารละลาย KOH 1 ลิตร มี KOH![]() = 0.05 โมล/ ลิตร
= 0.05 โมล/ ลิตร
ดังนั้น KOH จะแตกตัวให้ K+และ OH-อย่างละ 0.05 โมล/ ลิตร
ตัวอย่างที่ 3สารละลายกรดแก่ (HA) 250 ลูกบาศก์เซนติเมตร มีปริมาณ H3O+ไอออน 0.05 โมล สารละลายนี้ี้มีความเข้มข้นเท่าใด ถ้าเติมกรดนี้ี้ลงไปอีก 0.2 โมล โดยที่ี่สารละลายมีปริมาตรคงเดิม สารละลายที่ี่ได้จะมีความเข้มข้นเท่าใด
วิธีทำ
HA![]() H3O+(aq) + A-(aq)
H3O+(aq) + A-(aq)
0.05 โมล/ 250 cm3
สารละลาย HA 250 cm3มี HA 0.05 โมล
สารละลาย HA 1000 cm3มี HA =![]() = 0.20 โมล
= 0.20 โมล
เพราะฉะนั้นสารละลายที่ได้มีความเข้มข้น 0.20 โมล/ ลิตร
ถ้าเติมกรดอีก 0.2 โมล
สารละลายมี HA รวมทั้งหมด = 0.05 + 0.2 = 0.25 โมล
สารละลาย HA 250 cm3มี HA 0.25 โมล
สารละลาย HA 1000 cm3มี HA =![]() = 1.00 โมล
= 1.00 โมล
เพราะฉะนั้นสารละลายที่ได้มีความเข้มข้น 1.00 โมล/ ลิตร
ตัวอย่างที่ 4จงหาความเข้มข้นของ OH-ที่ี่เกิดจากการเอา NaOH 10.0 กรัม ละลายในน้ำทำเป็นสารละลาย 0.2 dm3(Na = 23, O = 16, H = 1)
วิธีทำ
จำนวนโมลของ NaOH =![]() = 0.25 mol
= 0.25 mol
สารละลาย 0.2 dm3มีเนื้อของ NaOH = 0.25 โมล
สารละลาย 1 dm3มี NaOH =![]() = 1.25 โมล/ ลิตร
= 1.25 โมล/ ลิตร
เพราะฉะนั้นสารละลายมีความเข้มข้น 1.25 โมล/ ลิตร
และปฏิกิริยาการแตกตัวของ NaOH เป็นดังนี้
NaOH (aq)![]() Na+(aq) + OH-(aq)
Na+(aq) + OH-(aq)
1.25 โมล 1.25 โมล 1.25 โมล
เพราะฉะนั้นความเข้มข้นของ OH-= 1.25 โมล/ ลิตร
กลับไปที่เนื้อหา
บทเรียนที่ 7 การแตกตัวของกรดอ่อน
สารละลายกรดอ่อน เช่น กรดแอซิติก (CH3COOH) เมื่อละลายน้ำ จะนำไฟฟ้าได้ไม่ดี ทั้งนี้ เพราะกรดแอซิติกแตกตัวเป็นไอออนได้เพียงบางส่วน เขียนแทนโดยสมการจะใช้ลูกศร![]() เพื่อชี้ว่าปฏิกิริยาเกิดขึ้นทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ และอยู่ในภาวะสมดุลกัน เช่น
เพื่อชี้ว่าปฏิกิริยาเกิดขึ้นทั้งปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ และอยู่ในภาวะสมดุลกัน เช่น
CH3COOH (aq) + H2O (l)![]() H3O+(aq) + CH3COO-(aq)
H3O+(aq) + CH3COO-(aq)
ปริมาณการแตกตัวของกรดอ่อน นิยมบอกเป็นร้อยละ เช่น กรด HA แตกตัวได้ร้อยละ 10 ในน้ำ หมายความว่า กรด HA 1 โมล เมื่อละลายน้ำ จะแตกตัวให้ H+
เพียง 0.10 โมล

การแตกตัวของกรดของกรดอ่อนชนิดเดียวกัน จะเพิ่มขึ้นเมื่อสารละลายมีความเจือจางมากขึ้น เช่น กรดแอซิติก CH3COOH ความเข้มข้นต่างกันจะมีเปอร์เซ็นต์การแตกตัวต่างกัน ดังนี้
CH3COOH 1.0 M แตกตัวได้ 0.42 %
CH3COOH 0.10 M แตกตัวได้ 1.30 %
CH3COOH 0.010 M แตกตัวได้ 4.20 %
การแตกตัวของกรดมอนอโปรติก (monoprotic acid dissociation)
กรดมอนอโปรติก คือกรดที่แตกตัวให้ H+ได้เพียง 1 ตัว เช่น HCOOH และ CH3COOH
HCOOH (aq)![]() H+(aq) + HCOO-(aq)
H+(aq) + HCOO-(aq)
CH3COOH (aq)![]() H+(aq) + CH3COO-(aq)
H+(aq) + CH3COO-(aq)
การแตกตัวของกรดพอลิโปรติก (polyprotic acid dissociation)
กรดพอลิโปรติก หมายถึงกรดที่มีโปรตอนมากกว่า 1 ตัว และสามารถแตกตัวให้ H+ได้มากกว่า 1 ตัว ถ้าแตกตัวได้ H+
2 ตัว เรียกว่า กรดไดโปรติก เช่น H2CO3, H2S , H2C2O4เป็นต้น
H2S![]() H++ HS-
H++ HS-
HS-![]() H++ S2-
H++ S2-
H2CO3![]() H++ HCO3-
H++ HCO3-
HCO3-![]() H++ CO32-
H++ CO32-
กรดที่ี่แตกตัวให้ H+ได้ 3 ตัว เรียกว่า กรดไตรโปรติก เช่น H3PO4, H3PO3
H3PO3![]() H++ H2PO4-
H++ H2PO4-
H2PO4-![]() H++ HPO42-
H++ HPO42-
HPO42-![]() H++ PO43-
H++ PO43-
กรดอ่อนแตกตัวได้เพียงบางส่วน ปฏิกิริยาการแตกตัวไปข้างหน้า และปฏิกิริยาย้อนกลับเกิดขึ้นได้พร้อมกัน และปฏิกิริยาการแตกตัวของกรดอ่อนนี้ี้จะอยู่ในภาวะสมดุล ค่าคงที่สมดุลนี้ี้จะหาได้ดังนี้

ค่าคงที่ี่สมดุลของกรดนี้ใช้เปรียบเทียบความแรงของกรดได้ ถ้าค่า Kaมีค่ามากแสดงว่ากรดมีความแรงมาก แตกตัวได้ดี ถ้าค่า Kaน้อยแสดงว่ากรดแตกตัวได้น้อย มีความแรงน้อย สำหรับกรดที่ี่แตกตัวได้ 100% จะไม่มีค่า Ka
ตัวอย่างค่า Ka

ถ้าเปรียบเทียบความแรงของกรดโดยใช้ Ka
Ka(HF) > Ka(CH3COOH) > Ka(HCN)
เพราะฉะนั้นความแรงของกรด HF > CH3COOH > HCN
- กรณีกรดไดโปรติก

- กรณีกรดไตรโปรติก
 |
ตัวอย่างที่ 5จงคำนวณเปอร์เซ็นต์การแตกตัวของกรด HA 1 โมล/ ลิตร ซึ่งมี H3O+0.05 โมล/ ลิตร
วิธีทำHA (aq) + H2O (l)![]() H3O++ A-(aq)
H3O++ A-(aq)
เริ่มต้น 1โมล/ ลิตร 0 0
ภาวะสมดุล 1 - 0.05 0.05 0.05 โมล/ ลิตร
 |
ตัวอย่างที่ 6สารละลายกรด HA มีค่า Kaเป็น 6.8 x 10-4สารละลายกรดนี้มีความเข้มข้น 1 โมล/ ลิตร สารละลายกรดนี้จะมีความเข้มข้นของ H3O+เท่าใด
วิธีทำHA (aq) + H2O (l)![]() H3O++ A-(aq)
H3O++ A-(aq)
เริ่มต้น 1 0 0
ภาวะสมดุล 1 - x x x
 |
ตัวอย่างที่ 7ที่ 250C กรดแอซิติก (CH3COOH) เข้มข้น 0.1 โมล/ ลิตร แตกตัวได้ 1.34 % จงคำนวณหาความเข้มข้นของไฮโดรเนียมไอออน แอซิเตตไอออน และ Ka
วิธีทำ
0.1 mol/dm3CH3COOH แตกตัวได้ 1.34 % หมายความว่า
CH3COOH 100 mol/dm3แตกตัวได้ = 1.34 mol/dm3
CH3COOH 0.1 mol/dm3แตกตัวได้ =![]() = 0.00134 mol/dm3
= 0.00134 mol/dm3
CH3COOH + H3O![]() H3O++ CH3COO-
H3O++ CH3COO-
เริ่มต้น 0.1 0 0
ภาวะสมดุล 0.1- 0.00134 0.00134 0.00134
 |
ตัวอย่างที่ 8จงคำนวณหาความเข้มข้นของ H+, SO42-, และ HSO4-ของสารละลายกรด H2SO4เข้มข้น 0.05 โมล/ ลิตร กำหนดค่า
Ka2= 1.26 x 102-
วิธีทำ
กรด H2SO4เป็นกรดแก่แตกตัวได้ 100 % ในขั้นที่ 1
H2SO4(aq)![]() H+(aq) + HSO4-(aq)
H+(aq) + HSO4-(aq)
0.50 โมล/ ลิตร
ขั้นที่ 2 HSO4-(aq) แตกตัวให้ H+และ SO42-(aq) ดังนี้
HSO4-(aq)![]() H+(aq) + SO42-(aq)
H+(aq) + SO42-(aq)
เริ่มต้น 0.50 0.50 0 ( ความเข้มข้นของ HSO4-และ H+ได้จากการแตกตัวขั้นที่ี่1)
ภาวะสมดุล 0.50-x 0.50+x x
 |
กลับไปที่เนื้อหา
บทเรียนที่ 8 การแตกตัวของเบสอ่อน
การแตกตัวของเบสอ่อน
เบสอ่อนเมื่อละลายน้ำจะแตกตัวเป็นไอออนเพียงบางส่วน และปฏิกิริยาการแตกตัวของเบสอ่อน เป็นปฏิกิริยาที่ผันกลับได้ เช่น แอมโมเนีย เมื่อละลายน้ำจะมีภาวะสมดุลเกิดขึ้น ดังสมการ
NH3(aq) + H2O (l)![]() NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)
 |
Kbคือ ค่าคงที่สมดุลของเบส ค่า Kbนี้เป็นค่าคงที่และใช้เปรียบเทียบความแรงของเบสได้ เช่นเดียวกับค่า Ka
- โมโนโปรติกเบส (monoprotic base) จะรับ H+ได้ 1 ตัว และมีค่า Kbเพียงค่าเดียว เช่น NH3
- โพลิโปรติกเบส (polyprotic base) จะรับ H+ได้มากกว่า 1 ตัว และมีค่า Kbได้หลายค่า เช่น ไฮดราซีน H2NNH2
H2NNH2+ H2O![]() H2NNH3++ OH-; Kb1 = 9.1 x 10-7
H2NNH3++ OH-; Kb1 = 9.1 x 10-7
H2NNH3++ H2O![]() H3NNH3++ OH-; Kb2 = 1.0 x 10-15
H3NNH3++ OH-; Kb2 = 1.0 x 10-15
ตารางที่ 1ค่าคงที่สมดุลของเบสอ่อนบางตัว
 |
นอกจาก การบอกปริมาณการแตกตัวของเบสอ่อน ในลักษณะของค่า Kbแล้วก็ยังสามารถบอกปริมาณการแตกตัวของเบสอ่อนได้ในลักษณะของเปอร์เซ็นต์ของการแตกตัว ดังนี้
 |
ตัวอย่างการคำนวณ
ตัวอย่างที่ 9จงเขียนค่าคงที่สมดุลของเบสอ่อนต่อไปนี้ C6H5NH2, N2H2
วิธีทำ
 |
ตัวอย่างที่ 10จงคำนวณหาความเข้มข้นของ OH - ในสารละลายแอมโมเนียเข้มข้น 0.200 โมล/ ลิตร กำหนดค่า K b = 1.77 x 10-5
วิธีทำ
 |
ตัวอย่างที่ 11เมื่อแอมโมเนียละลายน้ำจะแตกตัวให้ NH4+และ OH-ถ้าแอมโมเนียจำนวน 0.106 โมล ละลายในน้ำ 1 ลิตร ที่ภาวะสมดุลแตกตัวให้ NH4+และ OH-เท่ากัน คือ 1.38 x 10-3โมล จงหาค่าคงที่ี่ของการแตกตัวของ NH3
วิธีทำ
 |
ตัวอย่างที่ 12สารละลาย NH30.10 โมล/ ลิตร แตกตัวให้ NH4+และ OH-= 1.88 x 10-3โมล/ ลิตร จะแตกตัวได้กี่ี่เปอร์เซ็นต์ และถ้าสารละลายเบสเข้มข้น 0.20 โมล/ ลิตร จะแตกตัวได้กี่ี่เปอร์เซ็นต์
วิธีทำ
 |
กรณีสารละลายเบสเข้มข้น 0.2 โมล/ ลิตร
 |
กลับไปที่เนื้อหา
บทเรียนที่ 9 การแตกตัวของน้ำ
การแตกตัวของน้ำบริสุทธิ์เป็นอย่างไร
น้ำเป็นอิเล็กโทรไลต์ที่อ่อนมาก แตกตัวได้น้อยมาก ดังนั้น การนำไฟฟ้าของน้ำจะน้อย จนไม่สามารถตรวจสอบได้ด้วยการนำไฟฟ้าผ่านหลอดไฟ แต่ตรวจได้ด้วยเครื่องวัดกระแส (เป็นแอมมิเตอร์) อาจอนุโลมได้ว่าน้ำบริสุทธิ์เป็นสารนอนอิเล็กโทรไลต์
ตัวอย่างการวัดการนำไฟฟ้าของน้ำชนิดต่างๆ ได้แก่ น้ำกลั่นที่ี่อุณหภูมิห้อง น้ำกลั่นที่ี่อุณหภูมิ 60 - 70 องศาเซลเซียส น้ำคลอง น้ำประปา และน้ำฝน จะได้ผลดังตาราง
ตารางตัวอย่างการนำไฟฟ้าของน้ำชนิดต่างๆ
| น้ำชนิดต่าง ๆ | เครื่องตรวจการนำไฟฟ้า | วัดด้วยแอมมิเตอร์ |
| น้ำกลั่นที่อุณหภูมิห้อง น้ำกลั่นที่อุณหภูมิ 60-700C น้ำคลอง น้ำประปา น้ำฝน |
หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง หลอดไฟไม่สว่าง |
40 80 90 85 80 |
ตามทฤษฎีของเบรินสเตตและลาวรี น้ำทำหน้าที่ี่เป็นทั้งกรดและเบส ไอออนที่เกิดขึ้นจากการแตกตัวของน้ำ และมีการถ่ายเทโปรตอนกันเองได้ ( ออโตไอออนไนเซชัน)
 |
โมเลกุลของน้ำที่เสีย H+จะเปลี่ยนเป็น OH-ซึ่งมีประจุลบและโมเลกุลของน้ำที่ได้รับ H+จะเปลี่ยนเป็น H3O+ซึ่งมีประจุบวก เราอาจเขียนสมการกรด- เบส ได้ง่ายๆ ดังนี้
H2O (l) + H2O (l)![]() H3O+(aq) + OH-(aq)
H3O+(aq) + OH-(aq)
เนื่องจากระบบนี้อยู่ในภาวะสมดุล สามารถเขียนสมการค่าคงที่สมดุลของ H2O ได้ดังนี้
 |
Kwคือค่าคงที่การแตกตัวของน้ำ มีค่าเท่ากับ 1 x 10-14ที่ 250C เนื่องจากน้ำบริสุทธิ์แตกตัวเป็นไอออนจะให้ความเข้มข้นของ H3O+และ OH-เท่ากัน
 |
ดังนั้น น้ำบริสุทธิ์จึงมีสภาพเป็นกลางเนื่องจากปริมาณ H3O+เท่ากับ OH-ค่าคงที่ี่สมดุลของน้ำมีค่าเปลี่ยนแปลงตามอุณหภูมิ แสดงดังตารางต่อไปนี้
ตารางค่า Kwของน้ำที่อุณหภูมิต่างๆ
| อุณหภูมิ(0C) | Kw |
| 0 10 20 25 30 40 50 60 |
0.114 x 10-14 |
กลับไปที่เนื้อหา
บทเรียนที่ 10 PH ของสารละลาย
เราสามารถบอกความเป็นกรดเป็นเบสของสารละลายโดยค่า pH
pH ย่อมาจากคำว่า positive potential of the hydrogen ions คือ ค่าที่แสดงถึงความเข้มข้นของไฮโดรเจนไอออน (H+) หรือไฮโดรเนียมไอออน (H3O+) ใช้บอกความเป็นกรดหรือเบสของสารละลาย โดยค่า pH ของสารละลายเป็นค่าลอการิทึมของความเข้มข้นของไฮโดรเจนไอออน
pH = -log [H3O+]
หรือ [H3O]+= 10-pHโดยที่ [H3O+] คือ ความเข้มข้นของ H3O+หรือ H+เป็นโมล/ลิตร
น้ำบริสุทธิ์ ที่อุณหภูมิ 250C จะมี [H3O+] = 1 x 10-7โมล/ลิตร
ดังนั้น pH = -log [H3O+] = -log [1 x 10-7] = 7
นั่นคือ pH ของน้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C เท่ากับ 7 ถือว่ามีสภาพเป็นกลาง คือไม่มีความเป็นกรดหรือเบส
ถ้า [H3O+]= 1 x 10-5;pH=-log [H3O+]=-log [1 x 10-5]=5(เป็นกรด)
ถ้า [H3O+]= 1 x 10-9;pH=-log [H3O+]=-log [1 x 10-9]=9 (เป็นเบส)
ดังนั้นสรุปว่า
pH < 7 สารละลายเป็นกรด
pH = 7 สารละลายเป็นกลาง
pH > 7 สารละลายเป็นเบส
หรืออาจจะเขียนเป็นสเกลได้ดังนี้
 |
นอกจากจะบอกความเป็นกรดเป็นเบสของสารละลายด้วยค่า pH แล้วยังสามารถบอกค่าความเป็นกรด-เบส ได้โดยใช้ค่า pOHp ของสารละลาย คือ ค่าที่บอกความเข้มข้นของ OH-
pOH = -log[OH-]
โดย pH + pOH = 14
ตารางแสดง สเกล pH ของสารละลายที่มีความเข้มข้นต่างๆ กัน
 |
วิธีวัด pH ของสารละลายวัดได้ 2 วิธี ดังนี้
1. วิธีเปรียบเทียบสีวิธีนี้เป็นการวัด pH โดยประมาณ (มีความถูกต้อง 0.5 หน่วย pH) ซึ่งทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบกับสารละลาย ทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบสีกับสารละลายบัฟเฟอร์ที่ทราบค่า pH แน่นอน ซึ่งได้เติมอินดิเคเตอร์ชนิดเดียวกันไปแล้ว หรือใช้กระดาษชุบอินดิเคเตอร์ (กระดาษ pH) จุ่มลงไปแล้วเปรียบเทียบกับสีมาตรฐาน
2. วิธีวัดความต่างศักย์วิธีนี้วัด pH ได้อย่างละเอียด (มีความถูกต้อง 0.01 หน่วย pH) โดยการใช้เครื่องมือที่เรียกว่า พีเอชมิเตอร์ ซึ่งวัด pH ของสารละลายได้โดยการวัดความต่างศักย์ระหว่างขั้วไฟฟ้า 2 ขั้ว

ภาพแสดงเครื่องพีเอชมิเตอร์
ตัวอย่างที่ 1ให้หาค่า pH ของสารละลายที่มี H3O+เท่ากับ 1 x 10-11และ 6 x 10-14โมล/ลิตร
วิธีทำ
[ H3O+] = 1 x 10-11
pH = -log[ H3O+] = -log[1 x 10-11] = 11
[ H3O+] = 6 x 10-4
pH = -log[ H3O+] = -log[6 x 10-4] = 4 - log6 = 4 - 0.78 = 3.22
ตัวอย่างที่ 2จงหา pH ของสารละลายที่มีความเข้มข้นของ H3O+= 4.8 x 10-13โมล/ลิตร
วิธีทำpH = -log[ H3O+]
= -log[4.8 x 10-13]
= 13 - log 4.8
= 12.32
ตัวอย่างที่ 3สารละลายชนิดหนึ่งมี pH = 4.00 จะมีความเข้มข้นของไฮโดรเนียมไอออนเป็นเท่าใด
วิธีทำpH = -log[ H3O+]
4 = -log[ H3O+]
[ H3O+] = 10-4
= 1 x 10-4
ตัวอย่างที่ 4จงคำนวณหา [H+], [OH-] , pH , และ pOH ของสารละลายที่มีกรดแก่ HX 0.01 โมลในน้ำ 500 cm3
วิธีทำ
กรดแก่ HX แตกตัวได้ 100 %
[HX] = 0.1 โมล/ลิตร = 0.02 โมล/ลิตร
HX ![]() H+(aq) + X-(aq)
H+(aq) + X-(aq)
0.02 โมล/ลิตร 0.02 โมล/ลิตร
เพราะฉะนั้น [H+] = 0.02 โมล/ลิตร
จาก [H+][OH-] = 1 x 10-14โมล/ลิตร
[OH-] = = 5.0 x 10--13
เพราะฉะนั้น [OH-] = 5.0 x 10--13โมล/ลิตร
pH = -log[H+] = -log(0.02) = 1.70
pH + pOH = 14
pOH = 14 - pH = 14 - 1.70 = 12.30
กลับไปที่เนื้อหา
บทเรียนที่ 11 อินดิเคเตอร์
อินดิเคเตอร์ คือ สารที่ใช้บอกความเป็นกรด-เบส ของสารละลายได้อย่างหนึ่ง สารประกอบที่เปลี่ยนสีได้ที่ pH เฉพาะตัว จะถูกนำมาใช้เป็นอินดิเคเตอร์ได้ เช่น ฟีนอล์ฟทาลีน จะไม่มีสีเมื่ออยู่ในสารละลายกรด และจะเปลี่ยนเป็นสีชมพู เมื่ออยู่ในสารละลายเบสที่มี pH 8.3
 |
ภาพฟีนอล์ฟทาลีน
อินดิเคเตอร์สำหรับกรด-เบส เป็นสารอินทรีย์ อาจเป็นกรดหรือเบสอ่อนๆ ซึ่งสามารถเปลี่ยนจากรูปหนึ่งไปเป็นอีกรูปหนึ่งได้ เมื่อ pH ของสารละลายเปลี่ยน
HIn เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปกรด (Acid form)
In-เป็นสัญลักษณ์ของอินดิเคเตอร์ที่อยู่ในรูปเบส (Basic form)
รูปกรดและรูปเบสมีภาวะสมดุล เขียนแสดงได้ด้วยสมการ ดังนี้
HIn (aq) + H2O (l)![]() H3O+(aq) + In-(aq)
H3O+(aq) + In-(aq)
ไม่มีสี * สีชมพู* ; (* = กรณีเป็นฟีนอล์ฟทาลีน)
(รูปกรด) (รูปเบส)
| Kind= |  |
HIn และ In-มีสีต่างกันและปริมาณต่างกัน จึงทำให้สีของสารละลายเปลี่ยนแปลงได้ ถ้าปริมาณ HInมากก็จะมีสีของรูปกรด ถ้ามีปริมาณ In-มากก็จะมีสีของรูปเบส การที่จะมีปริมาณ HIn หรือ In มากกว่าหรือน้อยกว่านั้นขึ้นอยู่กับปริมาณ H3O+ในสารละลาย ถ้ามี H3O+มากก็จะรวมกับ In-ได้เป็น HIn ได้มากจะเห็นสารละลายใสไม่มีสีของ HIn แต่ถ้าอยู่ในสารละลายที่มี OH-มาก OH-จะทำปฏิกิริยากับ H3O+ทำให้H3O+ลดลง ซึ่งจะมีผลทำให้เกิดปฏิกิริยาไปข้างหน้าได้ In-มากขึ้น จะเห็นสารละลายในรูปของ In-คือเห็นเป็นสีชมพู
ช่วง pH ที่อินดิเคเตอร์เปลี่ยนสีจากรูปหนึ่งไปเป็นอีกรูปหนึ่ง สารละลายจะมีสีผสมระหว่างรูปกรดและรูปเบส เรียกว่า ช่วง pH ของอินดิเคเตอร์ (pH range หรือ pH interval)
ช่วง pH ของอินดิเคเตอร์หาได้จากค่า Kindของอินดิเคเตอร์ดังนี้
HIn (aq) + H2O (l)![]() H3O+(aq) + In-(aq)
H3O+(aq) + In-(aq)
ไม่มีสี * (รูปกรด) สีชมพู* (รูปเบส) ; (* = กรณีเป็นฟีนอล์ฟทาลีน)
| Kind= |  |
| [H3O+] =Kind |
| -log [H3O+] = -logKind |
| pH = pKind |
| - จะเริ่มเห็นสีของรูปกรดเมื่อ |
pH = pKind- log10
pH = pKind- 1
| - จะเริ่มเห็นสีของรูปเบสเมื่อ |
| pH = pKind- log |
pH = pKind+ 1
นั่นคือ ช่วง pH ของอินดิเคเตอร์ = pKind![]() 1 หมายความว่า สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind
1 หมายความว่า สีของอินดิเคเตอร์จะเริ่มเปลี่ยนแปลงเมื่อ pH = pKind![]() 1 ซึ่งเป็นค่าโดยประมาณ แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In-] 10 เท่าขึ้นไป อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง
1 ซึ่งเป็นค่าโดยประมาณ แต่ถ้า [HIn] มากกว่าหรือน้อยกว่า [In-] 10 เท่าขึ้นไป อาจถึง 100 เท่า ช่วง pH ของอินดิเคเตอร์ก็จะเปลี่ยนไป ช่วง pH ของอินดิเคเตอร์ที่ถูกต้องจริงๆ ของแต่ละอินดิเคเตอร์หาได้จากการทดลอง
ตัวอย่างเช่น เมทิลเรด มีช่วง pH 4.4 - 6.2 หมายความว่า สารละลายที่หยดเมทิลเรดลงไป จะเปลี่ยนสีจากรูปกรด (แดง) ไปเป็นรูปเบส (เหลือง) ในช่วง pH ตั้งแต่ 4.4 - 6.2 นั่นคือ
- ถ้า pH < 4.4 จะให้สีแดง (รูปกรด)
- pH อยู่ระหว่าง 4.4 - 6.2 จะให้สีผสมระหว่างสีแดงกับเหลือง คือ สีส้ม
- pH > 6.2 จะให้สีเหลือง (รูปเบส)
สีของอินดิเคเตอร์แต่ละชนิด จะเปลี่ยนในช่วง pH ที่ต่างกัน ซึ่งแสดงได้ดังภาพ
 |
ภาพแสดงสีของอินดิเคเตอร์แต่ละชนิด
อย่างไรก็ตาม อินดิเคเตอร์ชนิดหนึ่งๆ จะใช้หาค่า pH ของสารละลายได้อย่างคร่าวๆ เท่านั้น เช่น เมื่อนำสารละลายมาเติม เมทิลออเรนจ์ลงไป (ช่วง pH ของเมทิลออเรนจ์เท่ากับ 3.0 - 4.4 และสีที่เปลี่ยนอยู่ในช่วง สีแดง![]() เหลือง) ถ้าสารละลายมีสีเหลืองหลังจากหยดเมทิลออเรนจ์ แสดงว่าสารละลายนี้มี pH ตั้งแต่ 4.4 ขึ้นไป ซึ่งอาจมีฤทธิ์เป็นกรด กลางหรือ เบส ก็ได้ ดังนั้น การหาค่า pH ของสารละลายหนึ่งๆ อาจจะต้องใช้อินดิเคเตอร์หลายๆ ตัว แล้วนำข้อมูลมาวิเคราะห์ pH ของสารละลายร่วมกัน
เหลือง) ถ้าสารละลายมีสีเหลืองหลังจากหยดเมทิลออเรนจ์ แสดงว่าสารละลายนี้มี pH ตั้งแต่ 4.4 ขึ้นไป ซึ่งอาจมีฤทธิ์เป็นกรด กลางหรือ เบส ก็ได้ ดังนั้น การหาค่า pH ของสารละลายหนึ่งๆ อาจจะต้องใช้อินดิเคเตอร์หลายๆ ตัว แล้วนำข้อมูลมาวิเคราะห์ pH ของสารละลายร่วมกัน
ตัวอย่างการทดลองหาค่า pH ของสารละลายชนิดหนึ่ง โดยใช้อินดิเคเตอร์ 5 ชนิดด้วยกัน ผลการทดลองเป็นดังนี้
| ชนิดของอินดิเคเตอร์ | ช่วง pH | สีที่เปลี่ยน | สีสารละลายที่ได้จากการทดลอง |
| 1. methyl yellow 2. Bromeresol green 3. Methyl red 4. Bromothymol blue 5. Phenophtalein |
2.9-4.0 3.8-5.4 4.4-6.2 6.0-7.6 8.0-9.6 |
สีแดง-เหลือง เหลือง-น้ำเงิน แดง-เหลือง เหลือง-น้ำเงิน ไม่มีสี-สีชมพู |
เหลือง น้ำเงิน ส้ม เหลือง ไม่มีสี |
ให้หาค่า pH ของสารละลายจากข้อมูลการทดลองข้างต้น
แนวคิด จากอินดิเคเตอร์ชนิดที่ 1 แสดงว่า pH ของสารละลาย > 4 จากอินดิเคเตอร์ชนิดที่ 2 แสดงว่า pH ของสารละลายอยู่ระหว่าง 4.4-6.2 จากอินดิเคเตอร์ชนิดที่ 3 แสดงว่า pH ของสารละลาย > 5.4 จากอินดิเคเตอร์ชนิดที่ 4 แสดงว่า pH ของสารละลาย < 6 จากอินดิเคเตอร์ชนิดที่ 5 แสดงว่า pH ของสารละลาย < 8.0 สรุปได้ว่า สารละลายมี pH อยู่ระหว่าง 5.4 - 6
การหา pH ของสารละลายโดยใช้อินดิเคเตอร์หลายๆ ชนิดนี้ ไม่สะดวกในการใช้ จึงมีการคิดที่จะนำอินดิเคเตอร์หลายๆ ชนิด ซึ่งเปลี่ยนสีในช่วง pH ต่างๆ กันมาผสมกันในสัดส่วนที่เหมาะสม จะสามารถใช้บอกค่า pH ของสารละลายได้ละเอียดขึ้น อินดิเคเตอร์ผสมนี้เรียกว่า ยูนิเวอร์ซัลอินดิเคเตอร์ ซึ่งสามารถเปลี่ยนสีได้ในสารละลายที่มี pH ต่างๆ กันเกือบทุกค่า
การใช้ยูนิเวอร์ซัลอินดิเคเตอร์ หยดยูนิเวอร์ซัลอินดิเคเตอร์ลงในสารละลายที่ต้องการหาค่า pH ประมาณ 3 หยดต่อสารละลาย 3 cm3สังเกตสีของสารละลายแล้วเปรียบเทียบกับสีมาตรฐานของยูนิเวอร์ซัลอินดิเคเตอร์ที่ pH ต่างๆ ว่าสีของสารละลายตรงกับสีมาตรฐานที่ pH ใด ก็จะมีค่าเท่ากับ pH นั้น
ตาราง การเปลี่ยนสีของสารละลาย เมื่อใช้ยูนิเวอร์ซัลอินดิเคเตอร์
| pH สารละลาย | สี |
| 3 | แดง |
| 4 | ส้มแดง |
| 5 | ส้ม |
| 6 | ส้มเหลือง |
| 7 | เหลืองเขียว |
| 8 | เขียว |
| 9 | น้ำเงินเขียว |
| 10 | ม่วง |
| 11 | ม่วงแดง |
กลับไปที่เนื้อหา
บทเรียนที่ 12 สารละลายกรด-เบสในชีวิตประจำวัน
สารละลายกรด-เบส ในชีวิตสารละลายกรด-เบสในชีวิตประจำวันประจำวัน
ค่า pH ของสารละลายในสิ่งมีชีวิตมีค่าเฉพาะตัว เช่น pH ของเอนไซม์ในกระเพาะอาหารมีค่าประมาณ 1.5 pH ของเลือดและน้ำลาย มีค่าเท่ากับ 7.4 และ 6.8 ตามลำดับ
ตารางแสดงค่า pH ของสารละลายในร่างกาย
| สาร | ช่วง pH |
| น้ำย่อยในกระเพาะอาหาร ปัสสาวะ น้ำลาย เลือด น้ำดี |
1.6-2.5 5.5-7.0 6.2-7.4 7.35-7.45 7.8-8.6 |
นอกจากสารละลายในร่างกายเราจะมีค่า pH เฉพาะตัวแล้ว ก็จะพบว่าสารละลายกรดและสารละลายเบสที่พบในชีวิตประจำวันนั้น มีทั้งกรดอ่อนจนถึงกรดแก่ และเบสอ่อนถึงเบสแก่ น้ำบริสุทธิ์มีสภาพเป็นกลางไม่เป็นกรดหรือเบส ในขณะที่น้ำฝนจะมีความเป็นกรดอ่อนๆ เนื่องจากในอากาศมีแก๊ส CO2ซึ่งรวมกับน้ำได้กรดคาร์บอนิก ซึ่งเป็นกรดอ่อน ส่วนในน้ำทะเลจะมีเกลือแร่ต่างๆ ซึ่งเมื่อละลายในน้ำจะได้สารละลายไฮดรอกไซด์ ซึ่งมีสภาพเป็นเบส
นกรด (Acid rain)
น้ำฝนที่มี pH ประมาณ 5.6 - 6.0 ซึ่งมีภาวะเป็นกรดอ่อนๆ ปัจจุบันในประเทศอุตสาหกรรม pH ของน้ำฝนมีค่าต่ำกว่า 5.6 ทั้งนี้เนื่องจากมีการเผาไหม้เชื้อเพลิง เช่น ถ่านหิน น้ำมัน เป็นต้น ซึ่งเชื้อเพลิงเหล่านี้มีสารซัลเฟอร์ (S) อยู่ ทำให้เกิดแก๊สSO2ซึ่งเมื่อถูกปล่อยออกมาสู่บรรยากาศ และละลายในน้ำ หรือถูกออกซิไดส์ต่อเป็นSO3แล้วละลายในน้ำฝนได้กรดH2SO4แล้วจะไปเพิ่มความเป็นกรดให้กับน้ำฝน ซึ่งอาจจะทำให้ pH ต่ำกว่า 3 ในบริเวณที่มีสภาพแวดล้อมไม่ดี
SO3(g) + H2O (l)![]() H2SO4(aq)
H2SO4(aq)
ผลที่เกิดขึ้นคือ ฝนกรดจะไปทำลายต้นไม้ ทำลายชีวิตสัตว์น้ำ ทำให้โลหะเกิดการผุกร่อน หินถูกกัดเซาะ เป็นต้น
SO2อาจจะรวมกับน้ำได้เป็น H2SO3และนอกจากสารประกอบของซัลเฟอร์แล้วก็อาจมีสารประกอบของ N ซึ่งจะถูกเปลี่ยนเป็น NO2, HNO2และ HNO3ได้เช่นกัน ซึ่งเมื่อละลายในน้ำฝนก็จะไปเพิ่มความเป็นกรดให้กับน้ำฝนได้ ปฏิกิริยาที่เกิดขึ้นคือ
2NO (g) + O2(g)![]() 2NO2(g)
2NO2(g)
2NO (g) + H2O (l)![]() HNO2(aq) + HNO3(aq)
HNO2(aq) + HNO3(aq)
ความเป็นกรดเบสของน้ำและดินมีความสำคัญต่อการเพาะปลูกและการเลี้ยงสัตว์น้ำ เช่น กุ้ง ซึ่งในการเลี้ยงกุ้ง pH ของน้ำต้องเป็นกลาง กุ้งจึงจะเจริญเติบโตได้ดี เป็นต้น และโดยทั่วไปดินที่มี pH ต่ำ เกินไปอาจจะไม่เหมาะสมต่อการเจริญเติบโตของพืช พืชแต่ละชนิดจะเติบโตในภาวะที่ต่างกัน ข้าวจะเจริญเติบโตในดินเปรี้ยว คือ เป็นกรดเล็กน้อย ดังนั้น จึงต้องมีการตรวจวัด pH ของดินและน้ำ เพื่อช่วยให้เกษตรสามารถจัดการกับการเพาะปลุกได้ดี เช่น ถ้า pH ต่ำมากก็อาจใช้ปูนขาว หรือขึ้เถ้าโรยลงไปในดินเพื่อลดความเป็นกรดของดินได้
กลับไปที่เนื้อหา
บทเรียนที่ 13 ปฏิกิริยาระหว่างกรด-เบส
1.ปฏิกิริยาระหว่างกรดกับเบส
จากทฤษฎีกรด-เบสของเบรินสเตตและลาวรี กรดคือสารที่ให้โปรตอน และเบสคือ สารที่รับโปรตอน เมื่อกรดทำปฏิกิริยากับเบส จึงมีการถ่ายโอนโปรตอนระหว่างกรดและเบสนั่นเอง ตัวอย่างเช่น ปฏิกิริยาระหว่าง HCl และ NaOH สามารถเขียนปฏิกิริยาได้ดังนี้
HCl (aq) + NaOH (aq)NaCl (aq) + H2O
HCl เป็นกรดจะให้โปรตอน (H+) กับเบส NaOH ได้เกลือ NaCl กับน้ำ โปรตอนถ่ายโอนจากกรด HCl ไปให้กับเบส NaOH เมื่อเขียนสมการไอออนิกสุทธิระหว่างกรดและเบสจะได้ดังนี้
H+(aq) + OH-(aq)H2O (l)
ปฏิกิริยาระหว่าง H+จากสารละลายกรดกับ OH-จากสารละลายเบสได้ H2O เรียกว่า ปฏิกิริยาสะเทิน (Neutralization reaction) ปฏิกิริยาระหว่างกรดกับเบส จะได้เกลือกับน้ำเป็นส่วนใหญ่ แต่จะมีบางปฏิกิริยาที่ได้เกลือเพียงอย่างเดียว เช่น ปฏิกิริยาระหว่าง HCl กับ NH3ได้เกลือ NH4Cl ซึ่งเกลือ NH4Cl จะแตกตัวให้ NH4+และ Cl-ทำให้สารละลายนำไฟฟ้าได้
HCl (aq) + NH3NH4Cl (aq)
NH4Cl (aq) NH4+(aq) + Cl-(aq)
ตัวอย่างปฏิกิริยาระหว่างกรดซัลฟิวริกกับแบเรียมไฮดรอกไซด์จะได้ตะกอน BaSO4กับน้ำ
H2SO4(aq) + Ba(OH)2(aq)BaSO4(s) + 2H2O (l)
สารละลาย H2SO4และสารละลาย BaSO4นำไฟฟ้าได้ แต่เมื่อนำมาผสมเข้าด้วยกันแล้วสารละลายที่ได้ไม่สามารถนำไฟฟ้าได้เพราะ BaSO4เป็นของแข็งที่ละลายน้ำได้น้อยมาก จึงมีไอออนที่จะนำไฟฟ้าได้อยู่น้อยมาก ซึ่งไอออนที่เกิดขึ้นอาจเกิดขึ้นเนื่องจากการแตกตัวของน้ำ ทำให้สารละลายผสมสามารถนำไฟฟ้าได้เล็กน้อย
ปฏิกิริยาระหว่างกรดกับเบส สามารถแบ่งได้ดังนี้
1.ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสแก่ KOH ได้เกลือ KCl และน้ำ ดังนี้
HCl (aq) + KOH (aq)KCl (aq) + H2O (l)
2.ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรดแก่ HCl กับเบสอ่อน NH4OH ได้เกลือ NH4Cl และน้ำ
HCl (aq) + NH4OH (aq)NH4Cl (aq) + H2O (l)
3.ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
เช่น ปฏิกิริยาระหว่างกรด CH3COOH และเบส NaOH ได้เกลือโซเดียมแอซิเตต (CH3COONa) และน้ำ
CH3COOH (aq) + NaOH (aq)CH3COONa (aq) + H2O (l)
4.ปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อน
เช่น ปฏิกิริยาระหว่างกรด HCN กับเบส NH4OH ได้เกลือ NH4CN และน้ำ
HCN (aq) + NH4OH (aq)NH4CN (aq) + H2O (l)
ปฏิกิริยาระหว่างกรดและเบสในน้ำนี้จะทำให้สารละลายที่ได้แสดงสมบัติเป็นกรด เบส หรือกลางได้ ซึ่งพิจารณาได้เป็น 2 กรณี
1.ในกรณีกรดและเบสทำปฏิกิริยากันแล้วมีกรดหรือเบสเหลืออยู่ ถ้ามีกรดเหลืออยู่สารละลายแสดงสมบัติเป็นกรด ถ้ามีเบสเหลืออยู่สารละลายก็จะแสดงสมบัติเป็นเบส
2.ถ้ากรดกับเบสทำปฏิกิริยากันหมดพอดี ได้เกลือกับน้ำ สารละลายของเกลือที่ได้จากปฏิกิริยา จะแสดงสมบัติเป็นกรด เบส หรือกลาง ขึ้นอยู่กับชนิดของเกลือนั้นว่ามาจากกรดและเบสประเภทใด ทั้งนี้เพราะเกลือแต่ละชนิดจะเกิดการแตกตัวและทำปฏิกิริยากับน้ำ เรียกว่า ไฮโดรไลซีส ซึ่งจะทำให้สารละลายแสดงสมบัติกรด-เบสต่างกัน รายละเอียดอยู่ในหัวข้อต่อไป
2.ปฏิกิริยาของกรดหรือเบสกับสารบางชนิด
กรดนอกจากจะสามารถทำปฏิกิริยาสะเทินกับเบสได้เกลือกับน้ำ แล้วยังสามารถทำปฏิกิริยากับโลหะบางชนิด เช่น Zn, Fe, ได้แก๊ส H2และเกลือของโลหะนั้น หรือทำปฏิกิริยากับเกลือคาร์บอนเนต เช่น CaCO3, Na2CO3หรือเกลือ NaHCO3ได้แก๊ส CO2
ตัวอย่างปฏิกิริยาระหว่าง HCl กับ CaCO3จะได้เกลือและแก๊ส CO2
HCl(aq) + CaCO3(s)CaCl2(aq) + CO2(g)
เบสก็เช่นเดียวกันนอกจากจะทำปฏิกิริยาสะเทินกับกรดได้เกลือกับน้ำแล้ว ยังสามารถทำปฏิกิริยากับเกลือแอมโมเนียมเช่น NH4Cl, (NH4)2SO4, จะได้แก๊ส NH3หรือทำปฏิกิริยากับเกลือ เช่นปฏิกิริยาระหว่าง NaOH กับ FeCl3ได้สารผลิตภัณฑ์ดังนี้
3NaOH (aq) + FeCl3(aq)Fe(OH)2(s) + 3NaCl (aq)
ดังนั้น จะเห็นได้ว่ากรดและเบสทำปฏิกิริยากันเองได้ และทั้งกรดและเบสก็สามารถทำปฏิกิริยากับสารอื่นได้ด้วย
กลับไปที่เนื้อหา
บทเรียนที่ 14 ปฏิกิริยาระหว่างกรด-เบส (2)
นอกจากจะสามารถทำปฏิกิริยาสะเทินกับเบสได้เกลือกับน้ำ แล้วยังสามารถทำปฏิกิริยากับโลหะบางชนิด เช่น Zn, Fe, ได้แก๊ส H2 และเกลือของโลหะนั้น หรือทำปฏิกิริยากับเกลือคาร์บอนเนต เช่น CaCO3, Na2CO3หรือเกลือ NaHCO3ได้แก๊ส CO2
ตัวอย่างปฏิกิริยาระหว่าง HCl กับ CaCO3จะได้เกลือและแก๊ส CO2
HCl(aq) + CaCO3(s)CaCl2(aq) + CO2(g)
เบสก็เช่นเดียวกันนอกจากจะทำปฏิกิริยาสะเทินกับกรดได้เกลือกับน้ำแล้ว ยังสามารถทำปฏิกิริยากับเกลือแอมโมเนียมเช่น NH4Cl, (NH4)2SO4, จะได้แก๊ส NH3หรือทำปฏิกิริยากับเกลือ เช่นปฏิกิริยาระหว่าง NaOH กับ FeCl3ได้สารผลิตภัณฑ์ดังนี้
3NaOH (aq) + FeCl3(aq)Fe(OH)2(s) + 3NaCl (aq)
ดังนั้น จะเห็นได้ว่ากรดและเบสทำปฏิกิริยากันเองได้ และทั้งกรดและเบสก็สามารถทำปฏิกิริยากับสารอื่นได้ด้วย
เกลือเป็นสารประกอบไอออนิก ประกอบด้วยไอออนบวก (แคตไอออน) และไอออนลบ (แอนไอออน) ยกเว้น OH-ตัวอย่างเช่น NaCl ประกอบด้วยโซเดียมไอออน (Na+) และคลอไรด์ไอออน (Cl-) แบเรียมซัลเฟต (BaSO4) ประกอบด้วยแบเรียมไอออน (Ba2+) และซัลเฟตไอออน (SO42-) เกลือ NaCl ละลายในน้ำได้ดีและให้ Na+และ Cl-แต่เกลือ BaSO4เป็นเกลือที่ไม่ละลายน้ำ ทำให้สารละลายของเกลือ NaCl นำไฟฟ้าได้ดี แต่สารละลายของเกลือ BaSO4ไม่นำไฟฟ้า
เราอาจจำแนกเกลือออกได้เป็นประเภทต่างๆ ดังนี้
1.เกลือปกติ (Normal salt)
เกลือปกติเป็นเกลือที่ไม่มีไฮโดรเจนหรือไฮดรอกไซด์ไอออนที่อาจถูกแทนที่ ดังนั้น จึงประกอบด้วยไอออนบวกคือโลหะ หรือกลุ่มธาตุที่เทียบเท่าโลหะ เช่น NH4+(แอมโมเนียมไอออน) กับไอออนลบซึ่งเป็นอนุมูลกรด (Acid radical) ตัวอย่างของเกลือปกติ เช่น NaCl, K2SO4, Ca3(PO4)2, NH4NO3, (NH4)2SO4, ZnSO4เป็นต้น
2.เกลือกรด (Acid salt)
เกลือประเภทนี้มี H อะตอมอยู่ในโมเลกุลของเกลือ ซึ่งสามารถไอออไนซ์ได้ (แตกตัวเป็นไอออนได้) เช่น NaHSO4, NaHCO3, Na2HPO4, NaH2PO4เป็นต้น
3.เกลือเบสิก (Base salt)
เกลือประเภทนี้มีไอออนลบ OH-และไอออนบวก เช่น Pb(OH)Cl, Bi(OH)2Cl เป็นต้น
4.เกลือสองเชิง (Double salt)
เกิดจากเกลือปกติสองชนิดรวมกันเป็นโมเลกุลใหญ่ เช่น K2SO4, Al(SO4)3.24H2O เป็นต้น
5.เกลือเชิงซ้อน (Complex salt)
ประกอบด้วยไอออนลบที่ไอออนเชิงซ้อน เช่น K3Fe(CN)6เป็นต้น
การเรียกชื่อเกลือ
1.ให้อ่านโลหะแล้วตามด้วยอนุมูลกรด เช่น
NaCl = โซเดียมคลอไรด์
KI = โพแทสเซียมไอโอไดด์
MgS = แมกนีเซียมซัลไฟด์
ถ้าอนุมูลกรดมาจากกรดที่ลงท้ายด้วย ous ต้องเปลี่ยนเป็น ite แต่ถ้าลงท้ายด้วย ic ต้องเปลี่ยนเป็น ate เช่น
Na2CO3= โซเดียมคาร์บอเนต
Ca3(PO4)2= แคลเซียมฟอสเฟต
K2SO4= โพแทสเซียมซัลเฟต
Na2SO4= โซเดียมซัลเฟต
2.ถ้าโลหะมีเลขออกซิเดชัน (ประจุไฟฟ้า) มากกว่า 1 ค่าให้บอกไว้ในวงเล็บหลังโลหะนั้น แล้วอ่านตามด้วยอนุมูลกรด เช่น
Fe(NO3)2= ไอร์ออน (II) ไนเตรต
Fe(NO3)3= ไอร์ออน (III) ไนเตรต
SnCl2= ทิน (II) คลอไรด์
SnCl4= ทิน (IV) คลอไรด์
วิธีการเตรียมเกลือ
1.เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
กรด + เบสเกลือ + น้ำ
เช่น HCl (aq) + NaOH (aq)NaCl (aq) + H2O (l)
H2SO4(aq) + Ba(OH)2(aq)BaSO4(s) + 2H2O (l)
“เกลือที่เกิดจากกรดและเบสทำปฏิกิริยากัน ไอออนบวกของเกลือจะมาจากเบส ส่วนไอออนลบของเกลือมาจากกรด”
เกลือที่เกิดจากปฏิกิริยาระหว่างกรดกับเบส แบ่งออกได้เป็น
1.1 เกลือที่เกิดจากกรดแก่และเบสแก่ ตัวอย่างเช่น
- NaCl เกิดจากกรด HCl กับเบส NaOH,
HCl (aq) + NaOH (aq)NaCl (aq) + H2O (l)
- Ca(NO3)2เกิดจาก HNO3และ Ca(OH)2
HNO3(aq) + Ca(OH)2(aq)Ca(NO3)2(aq) + H2O (l)
1.2 เกลือที่เกิดจากกรดอ่อนกับเบสแก่ เช่น
- NaClO เกิดจาก HClO และ NaOH
HClO (aq) + NaOH (aq)NaClO (aq) + H2O (l)
- Ba(C2H3O2)2เกิดจาก C2H3O2H และ Ba(OH)2
C2H3O2H(aq) + Ba(OH)2(aq)Ba(C2H3O2)2(aq) + H2O (l)
1.3 เกลือที่เกิดจากกรดแก่กับเบสอ่อน เช่น
- NH4Cl เกิดจาก HCl กับ NH3
HCl (aq) + NH3(g)NH4Cl (aq) + H2O (l)
- Al(NO3)3เกิดจาก HNO3(aq) และ Al(OH)3(aq)
HNO3(aq) + Al(OH)3(aq)Al(NO3)3(aq) + H2O (l)
1.4 เกลือที่เกิดจากกรดอ่อนและเบสอ่อน เช่น
- NH4CN เกิดจากกรด HCN กับเบส NH3
HCN(aq) + NH3(g)NH4CN (aq) + H2O (l)
- FeCO3เกิดจากกรด H2CO3(aq) กับเบส Fe(OH)2(aq)
H2CO3(aq) + Fe(OH)2(aq)FeCO3(aq) + H2O (l)
2. เตรียมจากปฏิกิริยาของโลหะกับกรด
โลหะ + กรดเกลือ + แก๊ส
โลหะ + กรดเกลือ + น้ำ + แก๊ส
เช่น
Mg (s) + 2HCl (aq)MgCl2(aq) + H2(g)
Zn(s) + H2SO4(aq)ZnSO4(aq) + H2(g)
3Cu(s) + 8HNO3(aq)3Cu(NO3)2(aq) + H2O (l) + 2NO (g)
3. เตรียมจากปฏิกิริยาของโลหะออกไซด์กับกรด
โลหะออกไซด์ + กรดเกลือ + น้ำ
เช่น CaO (s) + H2SO4(aq)CaSO4(s) + H2O (l)
CuO (s) + H2SO4(aq)CuSO4(s) + H2O (l)
MgO (s) + 2HCl (aq)MgCl2(aq) + H2O (l)
4. เตรียมจากปฏิกิริยาของเกลือกับกรด เช่น
FeS(s) + 2HCl (aq)FeCl2(aq) + H2S (g)
Na2CO3(s) + H2SO4(aq)Na2SO4(aq) + H2CO3(aq)
NaHCO3(s) + HCl(aq)NaCl(aq) + H2O (l) + CO2(g)
BaCO3(s) + 2HCl (aq)BaCl2(aq) + H2O (l) + CO2(g)
5.เตรียมจากปฏิกิริยาของเกลือกับเกลือ
NaCl (aq) + AgNO3(aq)AgCl(s) + NaNO3(aq)
BaCl2(aq) + Na2SO4(aq)BaSO4(s) + 2NaCl (aq)
ZnCl2(aq) + Na2S (aq)ZnS (s) + 2NaCl (aq)
6.โดยการรวมตัวกันโดยตรงของโลหะกับอโลหะ
2Na(s) + Cl2(g)2NaCl (aq)
Fe (s) + S (s)FeS
เกลือหลายชนิดมีประโยชน์มากทั้งในชีวิตประจำวัน และในอุตสาหกรรม ดังแสดงในตาราง

ตัวอย่างที่ 1จงเขียนสมการ และเรียกชื่อเกลือที่เกิดจากปฏิกิริยาระหว่างสาร ต่อไปนี้
ก. กรดคาร์บอนิก กับแคลเซียมไฮดรอกไซด์
ข. โซเดียมซัลไฟด์กับกรดซัลฟิวริก
ค. เหล็กกับกรดไฮโดรคลอริก
วิธีทำ
ก. H2CO3(aq) + Ca(OH)2(aq)CaCO3(s) + 2H2O (l)
แคลเซียมคาร์บอเนต
ข. Na2S (s) + H2SO4(aq)Na2SO4(aq) + H2S (g)
โซเดียมซัลเฟต
หรืออาจเกิดปฏิกิริยาได้อีกแบบหนึ่งดังนี้
Na2S (s) + 2H2SO4(aq)2NaHSO4(aq) + H2S (g)
โซเดียมไฮโดรเจนซัลเฟต
ค. Fe(s) + 2HCl(aq)FeCl2(aq) + H2(g)
ไอร์ออน(II) คลอไรด์
ตัวอย่างที่ 2จะต้องใช้สาระลายกรดและเบสคู่ใดทำปฏิกิริยากันจึงจะได้เกลือต่อไปนี้
ก. KBr
ข. NH4NO3
ค. BaSO4
ง. NH4HCO3
วิธีทำ
ก. KOH (aq) + HBr (aq)KBr (aq) + H2O (l)
ข. NH4OH (aq) + HNO3(aq)NH4NO3(aq) + H2O (l)
ค. H2SO4(aq) + Ba(OH)2(aq)BaSO4(s) + H2O (l)
ง. H2CO3(aq) + NH4OH (aq)NH4HCO3(aq) + H2O (l)
ตัวอย่างที่ 3จงเขียนสมการแสดงปฏิกิริยา ระหว่างสารต่อไปนี้พร้อมทั้งเรียกชื่อเกลือที่เกิดขึ้นด้วย
ก. CH3COOH กับ Ca(OH)2
ข. HCl กับ Na2CO3
ค. H2SO4กับ NaOH
วิธีทำ
ก. CH3COOH (aq) + Ca(OH)2(aq)(CH3COO)2Ca (aq) + 2H2O (l)
แคลเซียมแอซิเตต
ข. 2HCl (aq) + Na2CO3(s)2NaCl (aq) + H2O (l) + CO2(g)
โซเดียมคลอไรด์
ค. H2SO4(aq) + NaOH (aq)NaHSO4(aq) + H2O (l)
โซเดียมไฮโดรเจนซัลเฟต
หรือ
H2SO4(aq) + 2NaOH (aq)Na2SO4(aq) + H2O (l)
โซเดียมซัลเฟต
3.ปฏิกิริยาไฮโดรไลซีสของเกลือ (Hydrolysis of Salts)
ไฮโดรไลซีส หมายถึง ปฏิกิริยาระหว่างสาร(เกลือ) กับน้ำ
ไฮโดรไลซีสของเกลือ หมายถึง ปฏิกิริยาระหว่างเกลือกับน้ำ เกลือเป็นอิเล็กโทรไลต์แก่ เมื่อเกลือละลายในน้ำ เกลือจะแตกตัวออกเป็นไอออนบวกและไอออนลบทั้งหมด ดังนั้น สมบัติของสารละลายของเกลือ จึงขึ้นอยู่กับไอออนบวกและไอออนลบในสารละลายนั้น ไอออนบางตัวสามารถที่จะทำปฏิกิริยากับน้ำและให้ H+หรือ OH-ได้ ปฏิกิริยานี้จึงเรียกว่า ปฏิกิริยาไฮโดรไลซีส เช่น
- ไอออนลบ เช่น X-เมื่อทำปฏิกิริยากับน้ำ จะเขียนสมการได้ดังนี้
X-(aq) + H2O (l)HX (aq) + OH-(aq)
จะเห็นว่าจากปฏิกิริยาไฮโดรไลซีสของไอออนลบ X-ที่เกิดขึ้น X- (aq) จะรับ H+จากน้ำแล้วได้ OH-(aq) ดังนั้นสารละลายที่ได้จึงมีสมบัติเป็นเบส
- สำหรับไอออนบวก เช่น NH4+(aq) เมื่อทำปฏิกิริยากับน้ำ จะเขียนสมการได้ดังนี้
NH4+(aq) + H2O(l)NH3(g) + H3O+(aq)
จะเห็นว่าจากปฏิกิริยาไฮโดรไลซีสของไอออนบวก NH4+(aq) ที่เกิดขึ้น NH4+จะให้โปรตอนกับ H2O (l) แล้วได้ H3O+(aq) ดังนั้นสารละลายที่ได้จึงมีสมบัติเป็นกรด
ดังนั้นจึงอาจสรุปได้ว่า “ถ้าไอออนลบของเกลือเกิดปฏิกิริยาไฮโดรไลซีสจะทำให้สารละลายแสดงสมบัติความเป็นเบส และถ้าไอออนบวกของเกลือเกิดปฏิกิริยาไฮโดรไลซีส จะทำให้สารละลายแสดงสมบัติความเป็นกรด”
- การพิจารณาว่าไอออนลบใดจะเกิดไฮโดรไลซีสหรือไม่นั้นมีหลักพิจารณาดังนี้
1. ถ้าเป็นไอออนลบของกรดแก่ เช่น Cl-, Br-, I-, NO3-, และ ClO4-จะไม่ทำปฏิกิริยากับน้ำ ดังนั้น จะไม่มีผลต่อค่าความเป็นกรด-เบสของสารละลาย
2. ไอออนลบของกรดอ่อน เช่น CH3COO-, ClO-, CN-, และ CO32-สามารถรับโปรตอนจากน้ำเกิดปฏิกิริยาไฮโดรไลซีสได้สารละลายที่เป็นเบส เช่น ปฏิกิริยาของ CH3COO-กับน้ำ
CH3COO-(aq) + H2O (l)CH3COOH (aq) + OH-(aq)
- การพิจารณาว่าไอออนบวกใดจะเกิดปฏิกิริยาไฮโดรไลซีสหรือไม่มีหลักพิจารณาดังนี้
1. ไอออนบวกของโลหะหมู่ IA หรือ IIA (ยกเว้น Be) ได้แก่ Li+ , Na+ , K+ , Mg2+ , Ca2+ และ Ba2+ จะไม่เกิดปฏิกิริยาไฮโดรไลซีส รวมทั้งไอออนบวกของเบสแก่ทั้งหมด
2. แอมโมเนียมไอออนของเกลือแอมโมเนียมจะเกิดปฏิกิริยาไฮโดรไลซีส และทำให้สารละลายเป็นกรด
1. การไฮโดรไลซีสของเกลือที่เกิดจากกรดแก่และเบสแก่
เกลือประเภทนี้เมื่อละลายในน้ำจะไม่เกิดปฏิกิริยาไฮโดรไลซีสกับน้ำ ทั้งนี้เพราะ ทั้งไอออนบวกที่มาจากเบสแก่ และไอออนลบที่มจากกรดแก่ ต่างก็ไม่ทำปฏิกิริยากับน้ำ เช่น NaCl เมื่อละลายน้ำได้ Na+และ Cl-ทั้ง Na+ซึ่งมาจากเบสแก่ และ Cl-ซึ่งมาจากกรดแก่ HCl จะไม่ทำปฏิกิริยากับน้ำ ไม่มีผลต่อค่า pH ของสารละลาย สารละลายจึงเป็นกลาง คือมี [H3O+] และ [OH-] ที่แตกตัวจากน้ำมีปริมาณเท่ากัน pH ของสารละลายเท่ากับ 7
2. การไฮโดรไลซีสของเกลือที่เกิดจากกรดอ่อนกับเบสแก่
เกลือประเภทนี้เมื่อละลายน้ำจะได้ไอออนลบที่มาจากกรดอ่อนที่มีสมบัติเป็นคู่เบสที่แรงพอสมควร ไอออนลบที่เกิดขึ้นจะเกิดปฏิกิริยาไฮโดรไลซีสกับน้ำได้ OH-ไอออนทำให้สารละลายแสดงสมบัติความเป็นเบส
ตัวอย่างเช่น NaClO เมื่อละลายน้ำจะให้ Na+และ ClO-ดังนี้
NaClO (s)Na+(aq) + ClO-(aq)
ClO-จะเกิดปฏิกิริยาไฮโดรไลซีส โดยรับโปรตอนจากน้ำได้เป็น HClO และ OH-ตามสมการ
ClO-(aq) + H2O (l)HClO (aq) + OH-(aq)
สำหรับ Na+(aq) ไอออน ซึ่งมาจากเบสแก่ NaOH ไม่เกิดการไฮโดรไลซีส
ดังนั้นสารละลายที่เกิดจากการละลายของเกลือ NaClO ในน้ำแล้วเกิดการไฮโดรไลซีสของ ClO-(aq) จะได้ OH-ไอออน จึงแสดงสมบัติเป็นเบส pH ของสารละลายมีค่ามากกว่า 7
3. การไฮโดรไลซีสของเกลือที่เกิดจากกรดแก่กับเบสอ่อน
เกลือประเภทนี้เมื่อละลายน้ำจะให้ไอออนบวกที่มาจากเบสที่เป็นคู่กรด ที่มีความแรงพอสมควร ไอออนบวกนี้จะเกิดปฏิกิริยาไฮโดรไลซีสกับน้ำให้ H3O+ทำให้สารละลายแสดงสมบัติเป็นกรด
ส่วนไอออนลบซึ่งมาจากกรดแก่ ไม่เกิดปฏิกิริยาไฮโดรไลซีส ตัวอย่างเช่น
NH4Cl ซึ่งเกิดจากกรดแก่ HCl กับเบสอ่อน NH3
NH4Cl แตกตัวในน้ำได้ NH4+และ Cl-ทั้งหมด
NH4Cl (aq)NH4+(aq) + Cl-(aq)
Cl-ไม่เกิดการไฮโดรไลซีส แต่ NH4+เกิดไฮโดรไลซีส โดย NH4+จะให้โปรตอนกับ H2O ได้เป็น NH3(aq) และ H3O (aq) ดังสมการ
NH4+(aq) + H2O (l)NH3(aq) + H3O+ (aq)
จะเห็นได้ว่าผลจากการไฮโดรไลซีสของ NH4Cl จะได้ H3O+ ดังนั้นสารละลายของเกลือ NH4Cl จึงแสดงสมบัติเป็นกรด pH ของสารละลายมีค่าน้อยกว่า 7
4.การไฮโดรไลซีสของเกลือที่เกิดจากกรดอ่อนและเบสอ่อน
เกลือประเภทนี้เมื่อละลายน้ำได้ไอออนบวกและไอออนลบ ซึ่งไอออนทั้งสองนี้ สามารถเกิดปฏิกิริยาไฮโดรไลซีสได้ทั้งคู่ ไอออนบวกของเกลือจะเกิดปฏิกิริยาไฮโดรไลซีสได้ H3O+ ส่วนไอออนลบได้ OH-ดังนั้นความเป็นกรด-เบสของสารละลายจึงขึ้นอยู่กับว่าไอออนบวกหรือไอออนลบเกิดปฏิกิริยาการไฮโดรไลซีสได้ดีกว่ากัน โดยพิจารณาจากค่าคงที่ของการแตกตัวของคู่เบส (Kb) (ไอออนลบ) หรือค่าคงที่การแตกตัวของคู่กรด Ka (ไอออนบวก)
ตัวอย่างเช่น เกลือ NH4CN ที่เกิดจากกรดอ่อน HCN และเบสอ่อน NH4OH
NH4OH แตกตัวในน้ำให้ NH4+และ CN-ดังสมการ
NH4CN (aq)NH4+(aq) + CN-(aq)
NH4+และ CN-เกิดปฏิกิริยาการไฮโดรไลซีสดังนี้
NH4+(aq) + H2O (l)NH3(aq) + H3O+(aq) ; Ka= 5.6 x 10-10
CN-(aq) + H2O (l)HCN (aq) + OH-(aq) ; Kb= 5.6 x 10-5
เนื่องจาก ค่า Kb> Kaดังนั้นแสดงว่า CN-เกิดปฏิกิริยาไฮโดรไลซีสให้ OH-ได้ดีกว่า NH4+ดังนั้น [OH-] > [NH3] สารละลายของเกลือ NH4CN จึงแสดงสมบัติเป็นเบส pH มีค่ามากกว่า 7
ตัวอย่างที่ 4 จงเขียนสมการแสดงการละลายน้ำของเกลือโซเดียมแอซิเตต และให้บอกว่าสารละลายเป็นกรดหรือเบส
วิธีทำ
เกลือโซเดียมแอซิเตต มีสูตรโมเลกุลเป็น CH3COONa เมื่อละลายน้ำจะแตกตัวให้ Na+และ CH3COO-หมดดังสมการ
CH3COONa (s)Na+(aq) + CH3COO-(aq)
Na+ไอออน ไม่เกิดปฏิกิริยาไฮโดรไลซีส
CH3COO-เกิดปฏิกิริยาไฮโดรไลซีส โดย CH3COO-รับโปรตอนจากน้ำได้เป็นกรดแอซิติก
CH3COO-(aq) + H2O (l)CH3COOH (aq) + OH-(aq)
จะเห็นว่าผลจากการเกิดปฏิกิริยาไฮโดรไลซีสได้ OH-ดังนั้นสารละลายของเกลือโซเดียมแอซิเตตจึงมีสมบัติเป็นเบส
ตัวอย่างที่ 5 F-ไอออนเกิดปฏิกิริยาการไฮโดรไลซีสหรือไม่ ถ้าเกิดสารละลายเป็นกรดหรือเบส
วิธีทำ F-ไอออนเป็นไอออนลบของเกลือที่เกิดจากกรดอ่อน HF ดังนั้น F-ไอออนเป็นคู่เบสที่มีความแรงเมื่อทำปฏิกิริยากับน้ำจึงสามารถรับโปรตอนจากน้ำได้เป็น HF และ OH-ดังสมการ
F-(aq) + H2O (l)HF(aq) + OH-(aq)
จะเห็นได้ว่าผลจากการเกิดปฏิกิริยาไฮโดรไลซีสของ F-จะได้ OH-ดังนั้นสารละลายจึงแสดงสมบัติความเป็นเบส
ตัวอย่างที่ 6 NH4Br เมื่อละลายน้ำจะมีผลต่อค่า pH ของสารละลายอย่างไร ?
วิธีทำ NH4Br ละลายในน้ำจะแตกตัวให้NH4+และ Br-
NH4Br (s)NH4+(aq) + Br-(aq)
Br- มาจากกรดแก่ HBr จึงไม่เกิดปฏิกิริยาไฮโดรไลซีส
NH4+เกิดปฏิกิริยาไฮโดรไลซีสได้ H3O+ทำให้สารละลายแสดงสมบัติความเป็นกรดโดย ให้ H+กับน้ำได้ NH3(aq) และ H3O+(aq) ดังนี้
NH4+(aq) + H2O (l)NH3(aq) + H3O+(aq)
5.การไฮโดรไลซีสของไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก
ไอออนลบของเกลือที่เกิดจากกรดพอลิโปรติก เช่น CO32-, PO43-สามารถเกิดปฏิกิริยาการไฮโดรไลซีสได้หลายขั้น เนื่องจากสามารถรับ H+จาก H2O ได้มากกว่า 1 โปรตอน เช่น
ปฏิกิริยาการไฮโดรไลซีสของเกลือ Na2CO3(s)
เมื่อ เกลือ Na2CO3(s) ละลายน้ำ จะเกิดการแตกตัวเป็นไอออนได้หมด คือ
Na2CO3(s)Na+(aq) + CO32-(aq)
Na+ไม่เกิดปฏิกิริยาไฮโดรไลซีส เนื่องจากมาจาก เบสแก่ NaOH
CO32-(aq) เกิดปฏิกิริยาการไฮโดรไลซีสได้ 2 ขั้นตอนดังนี้
CO32-(aq) + H2O (l)HCO3-(aq) + OH-(aq)
และ HCO3-(aq) + H2O (l)H2CO3(aq) + OH-(aq)
กลับไปที่เนื้อหา
บทเรียนที่ 15 การไทเทรตกรด-เบส
การไทเทรตกรด-เบส|อินดิเคเตอร์กับการไทเทรตกรด-เบส|การทดลองไทเทรต
การไทเทรตกรด-เบส (Acid-base titration)
การไทเทรตกรด-เบส หมายถึง กระบวนการหาปริมาณสาร โดยวิธีใช้สารละลายมาตรฐานที่ทราบค่าความเข้มข้นที่ แน่นอน ให้ทำปฏิกิริยากับสารตัวอย่าง โดยอาศัยหลักการเกิดปฏิกิริยาระหว่างสารละลายกรดและเบสที่เข้าทำปฏิกิริยากันพอดี ทำให้คำนวณหาความเข้มข้นหรือปริมาณของสารตัวอย่างดังกล่าวได้
วิธีการไทเทรตกรด-เบส คือ นำสารละลายกรดหรือเบสตัวอย่างที่ต้องการวิเคราะห์หาปริมาณ มาทำการไทเทรตกับสารละลายเบสหรือกรดมาตรฐานที่ทราบค่าความเข้มข้นที่แน่นอน กล่าวคือ ถ้าสารละลายตัวอย่างเป็นสารละลายกรด ก็ต้องใช้สารละลายมาตรฐานเป็นเบส นำมาทำการไทเทรต แล้วบันทึกปริมาตรของสารละลายมาตรฐานที่ใช้ในการทำปฏิกิริยาพอดีกัน จากนั้นนำไปคำนวณหาปริมาณของสารตัวอย่างต่อไป หรือทางตรงกันข้าม ถ้าใช้สารละลายตัวอย่างเป็นเบส ก็ต้องใช้สารละลายมาตรฐานเป็นกรด
ตัวอย่างเช่น การหาค่าสารละลายกรด HCl ว่ามีความเข้มข้นเท่าใดเราอาจใช้สารละลายมาตรฐาน NaOH เข้มข้น 0.100 โมล/ลิตร มาทำการไทเทรตกับสารละลาย HCl ตัวอย่าง จำนวนหนึ่ง (อาจจะเป็น 50 cm3) เมื่อทราบปริมาตรของ NaOH ที่ใช้ในการทำปฏิกิริยาพอดีกับ HCl จำนวน 50 cm3นี้โดยอินดิเคเตอร์เป็นตัวบอกจุดยุติ แล้วเราก็สามารถคำนวณหาความเข้มข้นของกรด HCl ได้
สารละลายมาตรฐาน ที่ทราบความเข้มข้นแน่นอน บรรจุอยู่ในเครื่องแก้วที่เรียกว่า บิวเรตต์ ซึ่งจะมีก๊อกไขปิด-เปิดเพื่อหยดสารละลายมาตรฐานมายังขวดรูปกรวยที่บรรจุสารละลายตัวอย่างที่ต้องการวิเคราะห์ ในการไทเทรต ค่อยๆ หยดสารละลายมาตรฐานลงมาทำปฏิกิริยากับสารตัวอย่างในขวดรูปกรวย เขย่าหรือหมุนขวดรูปกรวยเพื่อให้สารผสมกันพอดี ไทเรตจนกระทั่งอินดิเคเตอร์เปลี่ยนสีก็หยุดไทเทรต แล้วบันทึกปริมาตรสารละลายมาตรฐานที่ใช้ เพื่อนำไปคำนวณหา pH สารละลายต่อไป
เครื่องแก้วเชิงปริมาตร ที่ใช้ในการถ่ายเทของเหลวตัวอย่าง ลงในขวดรูปกรวยจะใช้เครื่องแก้วที่สามารถ อ่านปริมาตรได้ค่าที่ละเอียด และมีค่าถูกต้องมากที่สุด นั่นคือจะใช้ ปิเปตต์ (จะไม่ใช้กระบอกตวงเพราะให้ค่าที่ไม่ละเอียด และความถูกต้องน้อย) ซึ่งมีขนาดต่างๆ ให้เลือกใช้ เช่น ขนาด 1 cm3, 5, 10, 25, 50 cm3เป็นต้น วิธีใช้ปิเปตต์จะใช้ลูกยางช่วยในการดูดสารละลาย โดยในตอนแรก บีบอากาศออกจากลูกยาง ที่อยู่ปลายบนของปิเปตต์ แล้วจุ่มปลายปิเปตต์ ลงในสารละลายที่ต้องการปิเปตต์ แล้วค่อยๆ ปล่อยลูกยาง สารละลายจะถูกดูดขึ้นมาในปิเปตต์ เมื่อสารละลายอยู่เหนือขีดบอกปริมาตร ดึงลูกยางออก รีบใช้นิ้วชี้กดที่ปลายปิเปตต์ค่อยๆ ปล่อยสารละลายออกจนถึงขีดบอกปริมาตรบน จากนั้นก็ปล่อยสารละลาย ออกจากปิเปตต์สู่ขวดรูปกรวยจนหมด

การไทเทรตกรด-เบส
รูปแสดงการใช้ปิเปตต์

รูปแสดงการใช้บิวเรตต์
อินดิเคเตอร์กับการไทเทรตกรด-เบส
อินดิเคเตอร์กรด-เบส ที่เหมาะสมกับปฏิกิริยาการไทเทรตจะต้องมีค่า pH ที่จุดกึ่งกลางช่วงการเปลี่ยนสีใกล้เคียงหรือเท่ากับ pH ที่จุดสมมูลของปฏิกิริยา นอกจากนี้ การเลือกใช้อินดิเคเตอร์กรด-เบส ต้องพิจารณาสีที่ปรากฎ จะต้องมีความเข้มมากพอที่จะมองเห็นได้ง่าย หรือเห็นการเปลี่ยนสีได้ชัดเจน ช่วงการเปลี่ยนสีของอินดิเคเตอร์ จะเกิดขึ้นในช่วง 2 หน่วย pH
ตัวอย่างเช่น การไทเทรตกรดแก่กับเบสแก่ pH ของสารละลายผลิตภัณฑ์ที่เกิดจากปฏิกิริยาการไทเทรต เมื่อถึงจุดสมมูลมีค่าใกล้เคียง 7 ก็ควรเลือกใช้อินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนสีใกล้เคียงกับ 7 เช่น อาจใช้โบรโมไทมอลบลูหรือ ฟีนอล์ฟทาลีน ซึ่งจะเปลี่ยนจากไม่มีสีเป็นสีชมพู ในช่วง pH 8.20-10.00 เป็นต้น ดังนั้น ถ้าทราบ pH ของสารละลายที่จุดสมมูลของปฏิกิริยาการไทเทรตก็สามารถเลือกอินดิเคเตอร์ที่เหมาะสมได้
การเลือกอินดิเคเตอร์ ก็ขึ้นอยู่กับชนิดของปฏิกิริยาระหว่างกรดกับเบส เพราะที่จุดสมมูลของแต่ละปฏิกิริยานั้น มีค่า pH ที่ต่างกัน
การฟของการไทเทรตจะช่วยในการเลือกอินดิเคเตอร์ที่เหมาะสมได้ดี เพราะกราฟจะแสดงค่า pH ของสารละลายขณะไทเทรต ตั้งแต่ก่อนจุดสมมูล ที่จุดสมมูล และหลังจุดสมมูล จุดที่ pH ของสารละลายเปลี่ยนแปลงมาก ซึ่งเป็นจุดสมมูลนั้น จะบอกช่วง pH ของอินดิเคเตอร์ที่จะเลือกใช้ ในการพิจารณาเลือกอินดิเคเตอร์ จากกราฟของการไทเทรต จะแบ่งออกตามชนิดของปฏิกิริยาดังนี้
1.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสแก่
รูปกราฟของการไทเทรตระหว่างกรดแก่และเบสแก่ จะแสดง pH ที่จุดสมมูลอยู่ที่ pH ใกล้เคียง 7
จากกราฟ จะเห็นว่าค่า pH เปลี่ยนแปลงรวดเร็วที่จุดใกล้ๆ จุดยุติ (ตั้งแต่ pH 4-10) ดังนั้นอินดิเคเตอร์ที่มีช่วง pH ของการเปลี่ยนแปลงสีระหว่าง 4 ถึง 10 ก็สามารถนำมาใช้ได้ ซึ่งอินดิเคเตอร์ที่เหมาะสมที่อาจใช้ได้ ได้แก่ เมทิลเรด (4.4-6.2) โบรโมไทมอลบลู (6.0-7.5) และฟีนอล์ฟทาลีน (8.2-10.0) ดังแสดงในภาพ แต่เรามักจะนิยมใช้ฟีนอล์ฟทาลีน เพราะสังเกตการเปลี่ยนแปลงสีได้ชัดเจน สำหรับ โบรโมคลีซอล กรีน (3.8-5.4) ไม่เหมาะสมที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแก่และเบสแก่ เพราะช่วงเปลี่ยนสีที่เป็นรูปเบสของอินดิเคเตอร์ จะเกิดก่อนจุดสมมูล ทำให้เกิดความคลาดเคลื่อนในการบอกจุดยุติ
2.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
การเลือกอินดิเคเตอร์สำหรับการไทเทรตกรดอ่อน เช่น กรดแอซิติก กับเบสแก่ เช่น NaOH จะมีข้อจำกัดมากกว่าที่จุดสมมูลของการไทเทรต สารละลายจะมีโซเดียมแอซิเตต ทำให้สารละลายเป็นเบส มี pH มากกว่า 7

รูปกราฟแสดงการไทเทรตระหว่างกรดอ่อนกับเบสแก่และอินดิเคเตอร์ที่เหมาะสม
จากกราฟจะเห็นได้ว่า เมทิลเรด จะเปลี่ยนสีก่อนจุดสมมูลจึงไม่เหมาะที่จะใช้เป็นอินดิเคเตอร์สำหรับกรดแอซิติกกับ NaOH (เข้มข้น 0.100 M) ฟีนอล์ฟทาลีนเปลี่ยนสีที่ช่วงจุดสมมูลพอดี โบรโมไทมอลบลู อาจจะใช้เป็นอินดิเคเตอร์ได้ดี เมื่อใช้สีมาตรฐานเทียบ
3.อินดิเคเตอร์สำหรับปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
การเปลี่ยนแปลง pH ของสารละลายขณะไทเทรตเบสอ่อน เช่น NH3กับกรดแก่ เช่น HCl จะค่อยๆ ลดลง เมื่อใช้ HCl เป็นสารมาตรฐาน ที่จุดยุติจะได้เกลือ NH4Cl และ pH < 7 ในการไทเทรต 0.100 M NH3กับ 0.100 M HCl จะได้กราฟของการไทเทรต (ดังภาพ)

รูปกราฟของการไทเทรตระหว่าง 0.1000 M NH3กับ 0.1000 M HCl
จากกราฟ เราสามารถพิจารณาชาวง pH 3-7.5 ในการเลือกอินดิเคเตอร์ ซึ่งเราอาจใช้โบรโมไทมอลบลูหรือเมทิลเรดได้ แต่ไม่ควรใช้ฟีนอล์ฟทาลีนเพราะช่วง pH ของฟีนอล์ฟทาลีนมากกว่า 7 ทำให้เกิดความคลาดเคลื่อนในการบอกจุดสมมูล
ตัวอย่างที่ 1กำหนดช่วง pH ของอินดิเคเตอร์ให้ดังนี้

จงเลือกอินดิเคเตอร์ที่เหมาะสมที่สุดในการไทเทรตระหว่างสารละลาย 0.1 โมล/ลิตร HCN จำนวน 50 cm3กับ 0.1 โมล/ลิตร จำนวน 50 cm3กำหนดค่า Kaของกรด HCN = 7.2 x 10-10 ที่ 250C และ log 8.4 = 0.92
วิธีทำ
HCN (aq) + NaOH(aq)![]() NaCN (aq) + H2O (l)
NaCN (aq) + H2O (l)
| เพราะฉะนั้นจำนวนโมลของ HCN = | = 5 x 10-3โมล | |
| เพราะฉะนั้นจำนวนโมลของ NaOH = | = 5 x 10-3โมล | |
ดังนั้นสารละลายทั้งสองทำปฏิกิริยากันพอดีด้วยจำนวนโมลเท่ากันได้ผลิตภัณฑ์เป็น NaCN = 5 x 10-3 โมล ในปริมาตร 50 + 50 = 100 cm3
| เพราะฉะนั้น [NaCN] = | x 5 x 10-3= 0.05 โมล/ลิตร |
NaCN แตกตัวได้ 100 % ดังนี้
NaCN (aq)Na+(aq) + CN-(aq)
0.05 0.05 0.05 โมล/ลิตร
CN-(aq) + H2OHCN (aq) + OH-(aq)
ความเข้มข้นเริ่มต้น 0.05 0 0
ความเข้มข้นที่เปลี่ยนไป -x +x +x
ความเข้มข้นที่ภาวะสมดุล 0.05-x x x

| 1.4 x 10-5= | ||
| 1.4 x 10-5= | ( |
|
x = 8.4 x 10-4= [OH-]
pOH = -log[OH-] = -log[8.4 x 10-4] = -0.92 + 4 = 3.08
pH = 14 - pOH = 14 - 3.08 = 10.92
เนื่องจาก pH ของสารละลายหลังไทเทรตเท่ากับ 10.92 ดังนั้นจะต้องเลือกใช้อินดิเคเตอร์ไทมอลทาลีน ซึ่งมีช่วงการเปลี่ยนแปลง pH อยู่ระหว่าง 10.2-11.7 จึงจะเหมาะสมที่สุด
ตัวอย่างที่ 2นำสารละลาย HA ซึ่งเป็นกรดอ่อนชนิดหนึ่งปริมาตร 50.00 cm3ไปไทเทรตกับสารละลายมาตรฐาน NaOH เข้มข้น 0.15 โมล/ลิตร พบว่าเมื่อเติม NaOH ลงไป 12.00 cm3จะทำให้สารละลายที่ได้มี pH 7 และเมื่อเติม NaOH ลงไป 16.00 cm3จะถึงจุดยุติพอดี สารละลายกรด HA มีความเข้มข้นเริ่มต้นเท่าใด และการไทเทรตกรด-เบสคู่นี้ควรใช้อินดิเคเตอร์ชนิดใด (กำหนด Kaของกรดอ่อน HA = 1.7 x 10-6) กำหนดให้

วิธีทำ
ที่จุดยุติจำนวนโมล NaOH = 0.1500 x![]() mol
mol
สมมติความเข้มข้นเริ่มต้นของ HA = X โมล/ลิตร
HA + NaOHNaA + H2O
จำนวนโมล HA : NaOH = 1 : 1
เพราะฉะนั้นจำนวนโมล HA = 0.1500 x![]() ด้วย
ด้วย
= X(![]() )
)
X(![]() ) = 0.1500 x
) = 0.1500 x![]()
X = 0.048
ความเข้มข้นเริ่มต้น = 0.048 โมล/ลิตร
เพราะฉะนั้นความเข้มข้นของ NaA = 0.048 โมล/ลิตร
การไทเทรตกรดอ่อนกับเบสแก่ที่จุดยุติ มี NaA ซึ่งแตกตัวให้ A-
A-(aq) + H2O (l)HA (aq) + OH-(aq)
ความเข้มข้นเริ่มต้น 0.048 0 0
ความเข้มข้นที่เปลี่ยนไป -x +x +x
ความเข้มข้นที่ภาวะสมดุล 0.048-x x x

5.88 x 10-9=![]()
1.4 x 10-5=![]() (
(![]() x มีค่าน้อยมาก 0.048-x
x มีค่าน้อยมาก 0.048-x![]() 0.048)
0.048)
x = 1.68 x 10-5= [OH-]
pOH = -log[OH-] = -log[1.68 x 10-5] = 4.77
pH = 14 - pOH = 14 - 4.77 = 9.22
ดังนั้น ควรใช้ฟีนอล์ฟทาลีนเป็นอินดิเคเตอร์
กลับไปที่เนื้อหา




