โมลและปริมาณต่อโมล
![]()
บทเรียนที่ 1 มวลอะตอม
มวลอะตอม
อะตอมมีขนาดเล็กมากจึงมีมวลหรือน้ำหนักน้อยมาก อะตอมของธาตุ 1 อะตอมที่หนักที่สุดจะมีน้ำหนักเพียงประมาณ 4.0 x 10-22 กรัม การคิดน้ำหนักหรือมวลที่แท้จริงในหน่วยกรัมจึงไม่สะดวก ดังนั้นจึงมีการคิดหาวิธีที่จะใช้มวลหรือน้ำหนักเปรียบเทียบ (Relative mass หรือ Relative weight) ซึ่งเรียกว่า มวล อะตอมหรือน้ำหนักอะตอม
ในสมัยของดอลตันใช้ธาตุที่เบาที่สุด คือ H เป็นตัวเปรียบเทียบเพื่อหามวลอะตอมของธาตุอื่น โดยกำหนดให้
มวลของ H 1 อะตอม = 1 หน่วย amu
1 หน่วย amu = .66 x 10-24กรัม
มวลอะตอมของธาตุ = มวลของธาตุ 1 อะตอม
มวลของ H 1 อะตอม
ต่อมามีการเสนอให้ใช้ออกซิเจนเป็นธาตุมาตรฐานแทนธาตุไฮโดรเจ เนื่องจากออกซิเจน 1 อะตอม มวลเป็น16 เท่าของไฮโดรเจน 1 อะตอม จึงเขียนเป็นความสัมพันธ์ได้เป็น
มวลอะตอมของธาตุ = มวลของธาตุ 1 อะตอม /1/16 ของ O 1 อะตอม
ในปัจจุบันอะตอมของธาตุที่ใช้เป็นมาตรฐานคือ คาร์บอนโดยใช้126C ซึ่งเป็นไอโซโทปที่มีมากที่สุดของคาร์บอน
มวลอะตอมของธาตุ = มวลของธาตุ 1 อะตอม /1/12 ของ C-12 1 อะตอม
เช่น Na มีมวลอะตอมในตารางธาตุ เป็น 23 แสดงว่า
มวลอะตอมของ Na = มวลของธาตุ 1 อะตอม /1/12 ของ C-12 1 อะตอม
มวลของ Na 1 อะตอม = มวลของ Na x 1/12 ของ C 12 อะตอม
แทนค่า Na 1 อะตอม = 23 x 1.66 x 10-24กรัม
หมายความว่า Na 1 อะตอม มีมวลจริงๆ = 23 x 1.66 x 10-24กรัม
Na 1 อะตอมมีมวลเปรียบเทียบเป็น 23 เท่าของมวลของ H 1 อะตอม
Na 1 อะตอมมีมวลเปรียบเทียบเป็น 23 amu
ตัวอย่างที่1โพแทสเซียม 1 อะตอมหนัก 39.1 x 1.66 x 10-24 กรัม มวลอะตอมของโพแทสเซียมมีค่าเท่าใด
มวลอะตอมของ K = มวลของ K 1 อะตอม
1/12 ของ C-12 1 อะตอม
แทนค่า มวลอะตอมของ K = 39.1 x 1.66 x 10-24/1.66 x 10-24
= 39.1
ตัวอย่างที่2ธาตุ X มีมวลอะตอม 55.8 ถ้าธาตุ X 1 อะตอม จะมีมวลเป็นกี่กรัมและกี่ amu
วิธีทำ มวลแทนค่าอะตอมของ X = มวลของ X 1 อะตอม
1/12 ของ C-12 1 อะตอม
แทนค่า 55.8 = มวลของ X 1 อะตอม /1.66 x 10-24
มวลของ X 1 อะตอม = 55.8 x 1.66 x 10-24กรัม
ถ้ามวล 1.66 x 10-24กรัม = 1 amu
มวลของ X 55.8 x 1.66 x 10-24กรัม = 1 x 55.8 x 1.66 x 10-24= 55.8 ตอบ1.66 x 10-24
- มวลอะตอมที่ปรากฏอยู่ในตารางธาตุทั้งหมดเป็นค่าที่ได้จากการเปรียบเทียบกับน้ำหนักอะตอมของ1/2 ของมวลของ C-12 1 อะตอม ซึ่งมีค่าเท่ากับ 1 amu หรือเท่ากับ 1.66 x 10-24g ดังนั้น ถ้าอยากทราบมวลจริงๆ ของแต่ละธาตุในตารางธาตุ ก็สามารถหาได้จากการเอามวลอะตอมของธาตุต่างๆ มาคูณกับ 1.66 x 10-24g นั่นเอง
- มวลอะตอมของธาตุส่วนใหญ่ไม่เป็นเลขจำนวนเต็ม เพราะคิดจากน้ำหนักเฉลี่ยของไอโซโทปของธาตุแต่ละชนิด
- ธาตุส่วนใหญ่ในธรรมชาติมีหลายไอโซโทป แต่ละไอโซโทปมีปริมาณที่มากน้อยต่างกัน นักวิทยาศาสตร์สามารถหามวลอะตอมและปริมาณไอโซโทปของธาตุโดยใช้เครื่องมือที่เรียกว่า แมสสเปกโทรมิเตอร์ (MassSpectrometer)
กลับไปที่เนื้อหา
บทเรียนที่ 2 มวลอะตอมเฉลี่ย
การหามวลอะตอมของธาตุจากมวลอะตอมและปริมาณของไอโซโทป
1. ธาตุส่วนใหญ่ในธรรมชาติมีได้หลายไอโซโทปในปริมาณมากน้อยต่างกัน นักวิทยาศาสตร์หามวลอะตอมและปริมาณของไอโซโทปแต่ละธาตุโดยใช้เครื่องมือที่เรียกว่า แมสสโปกโตรมิเตอร์
2. เนื่องจากอะตอมของธาตุในธรรมชาติมีปริมาณของแต่ละไอโซโทปไม่เท่ากัน เช่น Mg มีอยู่ 3 ไอโซโทป คือ ในจำนวนนี้ จะมี อยู่ในธรรมชาติมากกว่าไอโซโทปอื่นๆ ดังนี้
ไอโซโทป |
ปริมาณในธรรมชาติ(%) |
|
24Mg |
78.70 |
|
25Mg |
10.13 |
|
26Mg |
11.17 |
ดังนั้น การคิดมวลอะตอมของ Mg จึงจะต้องคิดค่าเฉลี่ยตามปริมาณมากน้อยที่มีอยู่ในธรรมชาตินั้น ๆ
- ด้วยเหตุนี้เอง เราจึงจะพบค่าตัวเลขที่แสดงมวลอะตอมเป็นเลขทศนิยม เช่น 0 = 15.994; Na = 22.9898 เป็นต้น ทั้งนี้เพราะเราไม่ได้ใช้เลขมวลของไอโซโทปใดไอโซโทปหนึ่ง แต่เราคิดทุกไอโซโทปที่มีอยู่ในธรรมชาติโดยนำมาหาค่าเฉลี่ย
- สูตรการหามวลอะตอมเฉลี่ย
มวลอะตอมเฉลี่ยหาได้จากสูตร =
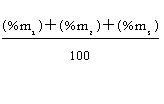
* หรือ M =
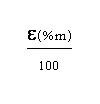
เมื่อ m1, m2m3…. = เป็นมวลอะตอมของแต่ละไอโซโทป % = เป็นเปอร์เซ็นต์ในธรรมชาติของแต่ละไอโซโทปนั้น ๆ ถ้าโจทย์ไม่บอกค่ามวลอะตอมมาให้ใช้เลขมวลแทน m ในกรณีที่กำหนดเป็นสัดส่วนที่ไม่ใช่ร้อยละ (x เป็นสัดส่วน) มวลอะตอมเฉลี่ย =
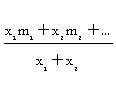
โจทย์อาจให้ข้อมูลอื่น ๆ มาให้ แล้วให้หา
- เปอร์เซ็นต์ของแต่ละไอโซโทป
- มวลของแต่ละไอโซโทป
- หามวลอะตอมเฉลี่ยอย่างใดอย่างหนึ่งก็ได้
ตารางแสดงวิธีคำนวณมวลอะตอมและปริมาณไอโซโทปของธาตุบางธาตุในธรรมชาติ
ธาตุ |
ไอโซโทป |
มวลอะตอมของ |
ปริมาณไอโซโทป |
มวลอะตอม |
การคำนวณหามวลอะตอม |
||
|
ไอโซโทป |
(ร้อยละ) |
(เฉลี่ย) |
(เฉลี่ย |
||||
|
คาร์บอน |
C |
*12.000 |
*98.89 |
*12.011 |
|||
|
C |
13.003 |
1.11 |
|||||
|
ออกซิเจน |
O |
15.995 |
99.76 |
||||
|
O |
16.999 |
0.04 |
15.999 |
|||
|
O |
17.999 |
0.20 |
|||||
|
นีออน |
Ne |
19.992 |
90.51 |
||||
|
Ne |
20.994 |
0.27 |
20.179 |
|||
|
Ne |
21.991 |
9.22 |
|||||
คลอรีน |
Cl |
34.969 |
75.77 |
35.453 |
|||
|
Cl |
36.966 |
24.23 |
|||||
ข้อสังเกต(*) ค่ามวลอะตอมเฉลี่ยที่ได้จะมีค่าใกล้เคียงกับมวลอะตอมของไอโซโทปที่มีเปอร์เซ็นต์มากในธรรมชาติ
กลับไปที่เนื้อหา
บทเรียนที่ 3 มวลโมเลกุล
มวลโมเลกุล
เนื่องจากโมเลกุลมีขนาดเล็กมากเช่นเดียวกับอะตอม ดังนั้น มวลของโมเลกุลจึงนิยมบอกเป็นค่าเปรียบเทียบเช่นกัน
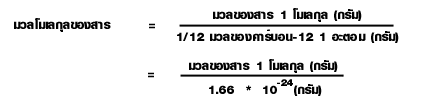
ลักษณะสำคัญของมวลโมเลกุล
1. มวลโมเลกุลไม่มีหน่วย เพราะเป็นค่าเปรียบเทียบกับค่ามาตรฐาน
2. มวลของสาร 1 โมเลกุล คือมวลที่แท้จริงของโมเลกุลนั้น ๆ 1 โมเลกุล
3. มวลโมเลกุลคำนวณได้จากมวลอะตอมรวมกัน เพราะโมเลกุลเกิดจากอะตอมรวมกัน หรือได้จากมวลของสาร 1 โมเลกุล เปรียบเทียบค่ามาตรฐาน
4. มวลมาตรฐานที่ถูกเปรียบเทียบต้องมีค่าเท่ากันหมดในทุก ๆ โมเลกุล
การคำนวณมวลโมเลกุลของสาร
ตัวอย่างจงหามวลโมเลกุลของ CaSO4. 2H2O กำหนดมวลอะตอมของ Ca = 40, S = 32, O = 16 และ H = 1
วิธีทำมวลโมเลกุลของ CaSO 4 . 2H 2O = มวลอะตอมของทุกธาตุใน CaSO4. 2H2O รวมกัน
= 40+32+(16 x 4)+2(2)+2(16)
= 40+32+64+4+32 = 172
ดังนั้น มวลโมเลกุลของ CaSO4. 2H2O = 172ตอบ
กลับไปที่เนื้อหา
บทเรียนที่ 4 โมล
|
|
|
ก่อนที่นักเรียนจะเรียนรู้ว่าโมล คืออะไร เรามาทำความรู้จักกับอะตอม มวลโมเลกุล สูตรโมเลกุล และน้ำหนักโมเลกุลกันเสียก่อน |
|
| อะตอม |
เป็นส่วนที่เล็กที่สุดของธาตุ ที่สามารถแสดงคุณสมบัติของธาตุนั้นๆ ได้ เช่น H , S , Al , Fe เป็นต้นส่วนธาตุที่มีเลขอะตอมเหมือนกัน แต่มีเลขมวลต่างกันก็จัดเป็นธาตุเดียวกัน มีสมบัติทางเคมีเหมือนกัน แต่มีสมบัติทางกายภาพบางประการต่างกัน เรียกว่า เป็นไอโซโทปกัน เช่น |
| โมเลกุล |
เกิดจากการรวมกันของอะตอม สามารถแบ่งออกได้เป็น 1. โมเลกุลอะตอมเดี่ยว ได้แก่ พวกแก๊สเฉื่อย He, Ne, Ar , Kr , Xe, Rn 2. โมเลกุลอะตอมคู่ เช่น H2, O2,N2,HCl , CO , HF 3. โมเลกุลหลายอะตอม P4, S8, H2O, CH4, C6H12O6 |
อะตอม มีเส้นผ่านศูนย์กลางประมาณ 10-10เมตร (1A ํ) อะตอมที่เบาที่สุดหนัก 1.66 x 10-24กรัม อะตอมที่หนักที่สุดหนัก 250 x 1.66 x 10-24กรัม
| มวลอะตอม |
เป็นมวลเปรียบเทียบ โดยเทียบจากมวลของ C-12 1 อะตอม มีหน่วยเป็น amu (atomic mass unit) ในธรรมชาติธาตุแต่ละชนิดอาจมีหลายไอโซโทป และพบในจำนวนที่ต่างกัน มวลอะตอมที่ระบุในตารางธาตุ จึงเป็นมวลอะตอมเฉลี่ยของไอโซโทปทั้งหมด ซึ่งเรียกว่า มวลอะตอมเฉลี่ย เปอร์เซนต์ของธาตุ = อัตราส่วนที่พบในธรรมชาติ x 100% ดังนั้น มวลอะตอมที่เขียนไว้ในตารางธาตุ ก็คือ มวลอะตอมเฉลี่ยของธาตุ นั่นเอง |
ตัวอย่างที่ 1
ในธรรมชาติพบไอโซโทปของ Ne ได้ 3 ไอโซโทปโดยมีเปอร์เซนต์ในธรรมชาติและมวลอะตอมดังนี้
20Ne มี 90.51%, 19.99244 amu,
21Ne มี 0.27%, 20.99395 amu
22Ne มี 9.22%, 21.99138 amu
จงคำนวณน้ำหนักเฉลี่ยของมวลอะตอมนีออน
แนวคิด
| อัตราส่วนที่พบของ20Ne x มวลอะตอม= | |
| อัตราส่วนที่พบของ21Ne x มวลอะตอม= | |
| อัตราส่วนที่พบของ22Ne x มวลอะตอม= | |
| ดังนั้น มวลอะตอมเฉลี่ยของ Ne = 18.0952amu+ 0.0567amu + 2.0276amu = 20.1795amu | |
หมายเหตุ 1 amu = 1.66 x 10-24g ในบางครั้งเมื่อกล่าวถึงมวลอะตอม หรือมวลโมเลกุลอาจละหน่วยได้
มวลโมเลกุลเป็นผลบวกของมวลอะตอมของแต่ละธาตุในโมเลกุลนั้น
ตัวอย่างที่ 2
การคำนวณมวลโมเลกุลของ NH3
มวลอะตอมของ N = 14 และมวลอะตอมของ H = 1
ดังนั้นมวลโมเลกุลของNH3= 14 + (1x3) = 17
ตัวอย่างที่ 3
จงคำนวณมวลโมเลกุลของ KMnO4
มวลอะตอมของ K= 39 มวลอะตอมของ Mn = 55 และมวลอะตอมของ O = 16
ดังนั้น มวลโมเลกุลของ KMnO4= 39 +55+ (16x4) = 158
ตัวอย่างที่ 4จงคำนวณมวลโมเลกุลตามสูตรของ MgCl2
มวลอะตอมของ Mg= 24 มวลอะตอมของ Cl = 35.5
ดังนั้น มวลโมเลกุลของ MgCl2= 24 + (35.5x2) = 95
| โมล |
เราสามารถนับจำนวนอะตอมหรือโมเลกุลที่อยู่ในสารชนิดหนึ่งได้หรือไม่? เรานับได้แต่เราไม่สามารถมองเห็นได้ด้วยตาเปล่า ดังนั้น ถ้ากำหนดหน่วยขึ้นมาเพื่อที่จะสามารถมองเห็นภาพได้ชัดเจน เช่น ใช้หน่วยโหลเพื่อใช้นับของจำนวน 12 ชิ้น หรือของจำนวน 12 โหล เป็นจำนวน 1 กุรุส ดังนั้น โมลก็ถือว่าเป็นตัวคูณจำนวนที่ต้องการแสดงว่ามีมากจนสามารถเห็นภาพของจำนวนได้ว่ามากหรือน้อยเท่าใด รูปข้างล่างแสดงถึงจำนวนเชอร์รี่ 1 ลูก แต่ถ้าเพิ่มจำนวนมากขึ้น เป็น 12 ลูก เราก็จะเปลี่ยนว่ามี เชอร์รี่ 1โหล เอาเป็นว่า เรารู้กันว่า 1 โหลมันมี 12 ลูก แต่ถัาเรากำหนดเองว่า ทีนี้จะใส่เชอร์รี่ลงไป 40 ลูก กำหนดว่ามันคือ 1 ถาด ถ้าสมมติว่าเราอยากจะสั่งเชอร์รี่ 1 โมลต้องมีกี่ลูกนะ? (แต่ในความเป็นจริงไม่มีใครใช้โมลในการนับจำนวนของ เราเอาไว้ใช้กับอะตอมน่าจะเหมาะสมกว่า) แล้วถ้าลองนำเชอร์รี่มาชั่งนำหนัก 1ลูก จะเท่ากับ กล้วย 1 ลูกหรือไม่ คำตอบคือไม่เท่ากันอยู่แล้ว |
ดังนั้นอะตอมเป็นหน่วยที่เล็กเราจึงกำหนดหน่วยเป็นโมลซึ่ง 1 โมล มีจำนวนเท่ากับ 6.02x1023อนุภาค (อะตอม ,โมเลกุล หรือไอออน) เราเรียกค่านี้ว่า ค่าคงที่ของอาโวกาโดร (NA)
ดังนั้น โมล คือ จำนวนของสารซึ่งมีจำนวนอนุภาคเท่ากับจำนวนอะตอม ของ C-12 จำนวน 12 กรัม โดยเขียนความสัมพันธ์ได้ว่า
| 1 โมลของ C | = 6.02 x 1023อะตอม | = 12 g |
| 1 โมลของ CO2 | = 6.02 x 1023โมเลกุล | = 44 g |
| 1 โมลของ NaCl | = 6.02 x 1023โมเลกุล | = 58.5 g |
ดังนั้น สารใดๆ 1 โมล มีมวลเท่ากับมวลอะตอม หรือมวลโมเลกุล หน่วยเป็นกรัม
เราจะได้ความสัมพันธ์ของโมล คือ

ตัวอย่างที่ 5จงคำนวณจำนวนกรัมของ 0.155 โมลของ CH4
แนวคิด
|
มวลโมเลกุลของ CH4= 12+(4x1) = |
16 |
|
ดังนั้นจำนวนกรัมของ CH4= |
|
ตัวอย่างที่ 6จงคำนวณ
1. จำนวนกรัมของโซเดียม 1 อะตอม
2. จำนวนอะตอมของ Cl ที่พบใน 1.38 กรัม ของ MgCl2
แนวคิด
1. จำนวนกรัมของโซเดียม 1 อะตอม
![]()
2. จำนวนอะตอมของ Cl ที่พบใน 1.38 กรัม ของ MgCl2

ตัวอย่างที่ 7He 1 กรัม มีจำนวนอะตอมเท่าไร
แนวคิด
มวลโมเลกุลของ He = 4 g/mol

กลับไปที่เนื้อหา



