สมบัติของธาตุและสารประกอบ
- 1. การแนะนำ
- 2. บทเรียนที่ 2 ปฏิกิริยาของธาตุตามหมู่
- 3. บทเรียนที่ 3 สมบัติของธาตุแทรนซิชัน
- 4. บทเรียนที่ 4 สารประกอบของธาตุแทรนซิชัน
- 5. บทเรียนที่ 5 สมบัติของธาตุแทรนซิชัน
- 6. บทเรียนที่ 6 การศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส
- 7. บทเรียนที่ 7 การทดลองเตรียมสารประกอบเฮกซะแอมมีนนิกเกิล (II) ซัลเฟต
- 8. บทเรียนที่ 8 สารประกอบเชิงซ้อนและลิแกนด์
- 9. บทเรียนที่ 9 นิวเคลียร์
- - ทุกหน้า -
บทเรียนที่ 1 สารประกอบออกไซด์และสารประกอบคลอไรด์
สารประกอบออกไซด์ หมายถึง สารประกอบที่เกิดจากธาตุออกซิเจนรวมกับธาตุอื่น ๆ ซึ่งอาจจะเป็นโลหะหรืออโลหะก็ได้ เช่น Na2O, P2O3, NO2
การเตรียมสารประกอบออกไซด์ อาจจะทำได้โดยนำออกซิเจนมาเผารวมกับธาตุต่าง ๆ เช่น
4Na (s) + O2(g) --------------> 2Na2O (s)
2Ca(s) + O2(g) --------------> 2CaO (s)
4Al(s) + O2(g) ---------------> 2Al2O3(s)
C(s) + O2(g) --------------> CO2(g)
สมบัติบางประการของสารประกอบออกไซด์
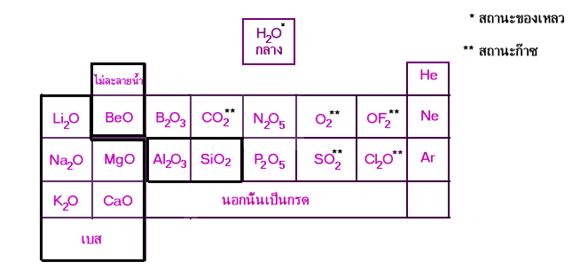
จากการศึกษาสมบัติบางประการของสารประกอบออกไซด์ของ 20 ธาตุแรก เกี่ยวกับสูตรของสารประกอบ จุดหลอมเหลว สถานะ การละลายน้ำ และความเป็นกรด - เบสของสารละลายได้ผลสรุปดังนี้
1. เมื่อใช้ความเป็นโลหะและอโลหะเป็นเกณฑ์ จะแบ่งสารออกได้เป็น 2 กลุ่มดังนี้
ก . ออกไซด์ของโลหะ เช่น Li2O BeO Na2O MgO Al2O3K2O CaO
ข . ออกไซด์ของอโลหะ เช่น H2O CO2N2O5F2O P2O5SO2Cl2O
2. การแบ่งกลุ่มย่อยอาจจะใช้สมบัติความเป็นกรด - เบสของสารละลาย เช่น
ก . ออกไซด์ของโลหะ
- สารละลายเป็นกรด -
- สารละลายเป็นเบส ได้แก่ Li2O Na2O MgO K2O และ CaO
- สารละลายเป็นกลาง ได้แก่ -
- พวกไม่ละลายน้ำ ได้แก่ BeO Al2O3B2O3SiO2ข . ออกไซด์ของอโลหะ
- สารละลายเป็นกรด ได้แก่ CO2N2O5F2O P2O5SO2และ Cl2O
- สารละลายเป็นเบส ได้แก่ -
- สารละลายเป็นกลาง ได้แก่ H2O
- พวกไม่ละลายน้ำ ได้แก่ -
4. เมื่อใช้จุดหลอมเหลวเป็นเกณฑ์จะได้กลุ่มย่อยดังนี้
|
ออกไซด์ที่เป็นของแข็ง |
ออกไซด์ที่เป็นของแข็งและ |
ออกไซด์ที่เป็นของเหลวหรือ |
|||
|
สูตร |
จุดหลอมเหลว(0C) |
สูตร |
จุดหลอมเหลว(0C) |
สูตร |
จุดหลอมเหลว(0C) |
|
Li2O |
1700 |
K2O |
350 |
H2O(l) |
0 |
|
Na2O |
1275 |
B2O3 |
460 |
CO2(g) |
-57 |
|
BeO |
2530 |
P2O5 |
580 |
N2O5(g) |
-102 |
|
MgO |
2800 |
- |
- |
F2O(g) |
-218 |
|
CaO |
2580 |
- |
- |
P2O5(g) |
-224 |
|
Al2O3 |
2045 |
- |
- |
SO2(g) |
-73 |
|
- |
- |
- |
- |
Cl2O(g) |
-20 |
โดยสรุป
ก . ออกไซด์ของโลหะ มีสถานะเป็นของแข็งที่มีจุดหลอมเหลวค่อนข้างสูง พวกที่ละลายน้ำได้สารละลายจะแสดงสมบัติเป็นเบส เปลี่ยนสีกระดาษลิตมัสจากแดงเป็นน้ำเงิน
ข . ออกไซด์ของอโลหะ มีสถานะเป็นได้ทั้งของแข็ง ของเหลวและก๊าซ ส่วนมากมีจุดหลอมเหลวค่อนข้างต่ำพวกที่ละลายน้ำได้สารละลายจะแสดงสมบัติเป็นกรด
เมื่อนำสารประกอบออกไซด์มาจัดเรียงเป็นหมวดหมู่เดียวกันตามตารางธาตุ จะได้ดังนี้
สารประกอบคลอไรด์
สารประกอบคลอไรด์หมายถึง สารประกอบธาตุคู่ระหว่างธาตุคลอรีนกับธาตุอื่นๆ เช่น NaCl CaCl2HCl และ CCl4เป็นต้น
สารประกอบคลอไรด์สามารถเตรียมได้โดยตรง โดยผ่านก๊าซคลอรีนแห้งไปบนธาตุที่กำลังร้อน ดังนั้นในขั้นแรกจึงต้องเตรียมก๊าซคลอรีนก่อนแล้วจึงผ่านก๊าซคลอรีนที่ได้นั้นลงไปบนธาตุที่ร้อนดังกล่าว
การเตรียมก๊าซคลอรีนในห้องปฏิบัติการ ใช้ปฏิกิริยาระหว่างโปตัสเซียมเพอร์แมงกาเนต (KMnO 4) กับก๊าซไฮโดรคลอริก(HCl) เข้มข้นประมาณ 10 mol/dm 3 ซึ่งเกิดปฏิกิริยาต่อไปนี้
KMnO4(s) +16 HCl (aq) --->2KCl (aq)+ 2MnCl2(aq) +8H2(l) + 5Cl2(g)
หมายเหตุ: ก๊าซคลอรีนเป็นก๊าซพิษ ดังนั้นการเตรียมจึงต้องทำอย่างระมัดระวัง
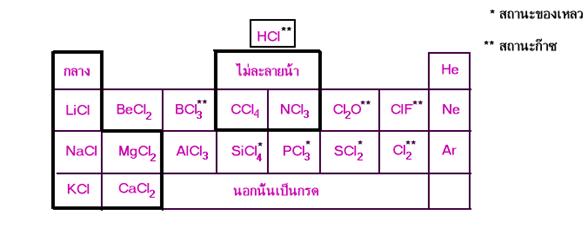
สมบัติของสารประกอบคลอไรด์
1. การแตกตัวเป็นไอออนทดสอบได้โดยใช้สารละลาย AgNO 3 ซึ่งถ้ามีCl - จะเกิดตะกอนของ AgCl จัดว่าเป็นวิธีทดสอบคลอไรด์ไอออนวิธีหนึ่ง จากสมการดังต่อไปนี้
Ag +(aq) + Cl-(aq) -------> AgCl (s)
2. แบ่งสารประกอบคลอไรด์ออกเป็น 2 กลุ่มใหญ่ๆ คือ คลอไรด์ของโลหะและคลอไรด์ของอโลหะดังนี้
ก . คลอไรด์ของโลหะ ได้แก่ LiCl BeCl2NaCl MgCl2AlCl3KCl และ CaCl2
ข . คลอไรด์ของอโลหะ ได้แก่ HCl BCl3CCl4NCl3Cl2O ClF PCl5SiCl4และ SCl2
3. เมื่อใช้ความเป็นกรด - เบสของสารละลาย จะแบ่งกลุ่มย่อยได้ดังนี้
ก . คลอไรด์ของโลหะ
- สารละลายเป็นกรด ได้แก่ AlCl3BeCl2
- สารละลายเป็นกลาง ได้แก่ LiCl NaCl MgCl2KCl และ CaCl2
- สารละลายเป็นเบส -ข . คลอไรด์ของอโลหะ
- สารละลายเป็นกรด ได้แก่ HCl BCl3Cl2O ClF PCl5SiCl4และ SCl2
- สารละลายเป็นกลาง ได้แก่ -
- สารละลายเป็นเบส ได้แก่ -
4. เมื่อใช้สถานะและจุดหลอมเหลว จะแบ่งกลุ่มย่อยได้ดังในตาราง
|
คลอไรด์ที่เป็นของแข็ง |
คลอไรด์ที่เป็นของแข็งและ |
คลอไรด์ที่เป็นของเหลวหรือก๊าซ |
|||
|
สูตร |
จุดหลอมเหลว( 0C) |
สูตร |
จุดหลอมเหลว( 0C) |
สูตร |
จุดหลอมเหลว( 0C) |
|
LiCl |
610 |
AlCl3 |
198 |
SCl2 |
-80 |
|
NaCl |
801 |
PCl5 |
148 |
CCl4 |
-23 |
|
KCl |
770 |
- |
- |
ClF |
-154 |
|
BeCl2 |
405 |
- |
- |
Cl2O |
-20 |
|
MgCl2 |
712 |
- |
- |
BCl3 |
-107 |
|
CaCl2 |
772 |
- |
- |
NCl3 |
-27 |
|
- |
- |
- |
- |
SiCl4 |
-68 |
|
- |
- |
- |
- |
HCl |
-114 |
เมื่อนำคลอไรด์มาจัดรวมกันเป็นหมวดหมู่ หมวดหมู่เดียวกันตามตารางธาตุ จะได้ดังนี้
กลับไปที่เนื้อหา
บทเรียนที่ 2 ปฏิกิริยาของธาตุและสารประกอบตามหมู่
นักเรียนได้ศึกษาสมบัติของธาตุในตารางธาตุ และสมบัติของสารประกอบของคาบที่ 2 และ 3 มาแล้ว ต่อไปนี้จะได้ศึกษาสมบัติบางประการของธาตุและสารประกอบตามหมู่ โดยใช้ธาตุหมู่ IA, IIA และ VIIA เป็นหลัก
ตารางที่ 7.33 สมบัติบางประการของธาตุหมู่ IA
|
สมบัติ \ ธาตุ |
Li |
Na |
K |
Rb |
Cs |
|
เลขอะตอม การจัดเรียงอิเล็กตรอน มวลอะตอม ไอโซโทปที่สำคัญ รัศมีอะตอม (pm) IE1(kJ/mol) อิเล็กโทรเนกาติวิตี อิเล็กตรอนอัฟฟินิตี(kJ/mol) จุดหลอมเหลว (0C) จุดเดือด(0C) ความหนาแน่น(g/cm3) % โดยมวลที่พบบนโลก สีของเปลวไฟ |
3 2,1 6.941 6Li,7Li 152 526 0.98 57 180 1330 0.53 0.0065 แดงสด |
11 2, 8, 1 22.990 23Na 186 502 0.92 21 98 892 0.97 2.6 เหลือง |
19 2, 8, 8, 1 39.098 39K,40K,41K 227 425 0.82 - 64 760 0.86 2.4 ม่วงน้ำเงิน |
37 2,8,18,8,1 85.468 85Rb,87Rb 248 409 0.82 - 39 688 1.53 0.031 ม่วงแดง |
55 2,8,18,18,8,1 132.905 133Cs 265 382 0.79 - 29 690 1.87 0.0007 น้ำเงิน |
จากข้อมูลในตารางและจากข้อมูลอื่นๆ จะสรุปสมบัติทั่วๆ ไปของธาตุหมู่ IA ได้ดังนี้
1. เป็นธาตุที่มี 1 เวเลนต์อิเล็กตรอน
2. เป็นของแข็ง ยกเว้น Cs เป็นของเหลว แต่จัดว่าเป็นประเภทโลหะอ่อน สามารถตัดด้วยมีดได้ง่าย ทำให้เป็นชิ้น แผ่น หรือดึงเป็นเส้นลวดได้ง่าย
3. เป็นโลหะที่นำไฟฟ้าและนำความร้อนได้ดีมาก เพราะมีพันธะโลหะ
4. ความเป็นโลหะเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
5. ทำปฏิกิริยากับน้ำ เกิดปฏิกิริยารุนแรง คายความร้อนมาก และติดไฟได้ได้สารละลายที่แสดงสมบัติเป็นเบส จึงเรียกว่า โลหะแอลคาไล
เขียนสมการทั่วๆ ไป สำหรับแสดงปฏิกิริยากับน้ำได้ดังนี้
2M + 2H2O ฎ 2MOH + H2
เช่น
2Na + 2H2O ฎ 2NaOH + H2
2Li + 2H2O ฎ 2LiOH + H2
เนื่องจากเกิดปฏิกิริยากับน้ำได้ง่าย และยังสามารถทำปฏิกิริยากับ O2ได้ด้วย ดังนั้นจึงต้องเก็บโลหะแอลคาไลในน้ำมัน
6. เป็นธาตุที่ชอบให้อิเล็กตรอนแก่ธาตุอื่นๆ เรียกว่า electropositive element แล้วกลายเป็นไอออนที่ประจุ +1
7. รัศมีอะตอมและรัศมีไอออนเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
8. มีค่า IE1น้อยที่สุด ในคาบเดียวกัน และค่า IE1จะลดลงเมื่อเลขอะตอมเพิ่มขึ้น เพราะขนาดอะตอมใหญ่ขึ้น
9. มีค่าอิเล็กโทรเนกาติวิตีน้อย เมื่อเทียบกับธาตุอื่นๆ ในคาบเดียวกัน และค่าอิเล็กโทรเนกาติวิตีจะลดลงเมื่อเลขอะตอมเพิ่มขึ้น
10. เป็นโลหะที่มีจุดหลอมเหลวต่ำกว่าโลหะอื่นๆ ในคาบเดียวกัน นอกจากนี้จุดหลอมเหลวและจุดเดือดจะลดลงเมื่อเลขอะตอมเพิ่มขึ้น เพราะความแรงของพันธะโลหะลดลง
11. เป็นตัวรีดิวซ์ที่ดีมาก โดยเฉพาะ Li เป็นตัวรีดิวซ์ที่ดีที่สุด
12. ความหนาแน่นน้อยกว่าโลหะอื่นๆ ที่อยู่ในคาบเดียวกัน แต่ความหนาแน่นมีแนวโน้มเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
13. ทำปฏิกิริยากับธาตุต่างๆ เกิดเป็นสารประกอบได้ง่าย และเป็นสารประกอบไอออนิก สารประกอบคลอไรด์ คาร์บอเนต ซัลเฟต ไนเตรต ฟอสเฟต โดยมีจุดหลอมเหลวสูงมาก (ดังตาราง 7.34)
14. สารประกอบของธาตุหมู่ IA ละลายน้ำได้ดีมาก ดังแสดงในตารางที่ 7.35
15. เมื่อเผาสารประกอบของหมู่ IA จะได้เปลวไฟที่มีสีต่างๆ กัน เช่น Li มีสีแดงสด หรือแดงเลือดนก Na ให้สีเหลือง K ให้สีม่วงน้ำเงิน เป็นต้น
ตารางที่ 7.34 แสดงจุดหลอมเหลวของสารประกอบของธาตุหมู่ IA บางชนิด
|
ธาตุ |
จุดหลอมเหลวของสารประกอบ (0C) |
||||
|
Cl- |
SO42- |
CO32- |
NO32- |
PO43- |
|
|
Li Na K Rb Cs |
610 801 770 772 645 |
857 884 1074 1060 1010 |
618 854 897 837 610* |
261 310 338 305 414 |
- 1340 1340 - - |
* สลายตัวขณะหลอมเหลว
ตารางที่ 7.35 แสดงการละลายของสารประกอบของธาตุหมู่ IA บางชนิด (250C)
|
ธาตุ |
การละลายของเกลือ (g/H2O 100 g) |
|||||||
|
เกลือ Cl- |
เกลือ CO32- |
เกลือ NO3- |
เกลือ SO42- |
|||||
|
Li Na K Rb Cs |
LiCl.H2O NaCl KCl RbCl CsCl |
85 36 35 94 190 |
Li2CO3 Na2CO3.10H2O K2CO3.H2O Rb2CO3 Cs2CO3 |
1.29 2.94 112 450 มาก |
LiNO3.3H2O NaNO3 KNO3 RbNO3 CsNO3 |
85 92 38 65 27 |
Li2SO4.H2O Na2SO4.10H2O K2SO4 Rb2SO4 Cs2SO4 |
35 28 12 51 182 |
สำหรับสมบัติของธาตุหมู่ IIA และสารประกอบของธาตุหมู่ IIA เป็นดังนี้
ตารางที่ 7.36 แสดงสมบัติบางประการของธาตุหมู่ IIA
|
สมบัติ \ ธาตุ |
Be |
Mg |
Ca |
Sr |
Ba |
|
เลขอะตอม การจัดเรียงอิเล็กตรอน รัศมีอะตอม (pm) ความหนาแน่น(g/cm3) จุดหลอมเหลว (0C) จุดเดือด(0C) IE1(kJ/mol) อิเล็กโทรเนกาติวิตี อิเล็กตรอนอัฟฟินิตี(kJ/mol) E0(V) ไอโซโทปที่สำคัญ มวลอะตอม % โดยมวลที่พบบนโลก สีของเปลวไฟ |
4 2,2 112 1.85 1280 2770 906 1.6 -66 -1.85 9Be 9.012 0.0006 - |
12 2, 8, 2 160 1.74 469 1110 744 1.3 -67 -2.36 24Mg 25Mg 26Mg 24.312 1.9 - |
20 2, 8, 8, 2 197 1.55 839 1440 596 1.0 - -2.87 40Ca 42Ca 44Ca 40.08 3.4 แดงอิฐ |
38 2,8,18,8,2 215 2.60 770 1380 556 0.9 - -2.89 86Sr ,87Sr 88Sr ,89Sr 87.62 0.030 แดงเข้ม |
56 2,8,18,18,8,2 217 3.50 714 1640 509 0.9 - -2.90 136Ba 137Ba 138Ba 137.34 0.025 เขียว |
สรุปสมบัติทั่วๆ ไปของธาตุหมู่ IIA ได้ดังนี้
1. เป็นธาตุที่มี 2 เวเลนต์อิเล็กตรอน เมื่อเป็นไอออนจึงมีประจุเป็น +2
2. เป็นธาตุที่จัดอยู่ในกลุ่มของโลหะ ความเป็นโลหะเพิ่มมากขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
3. เป็นโลหะที่นำความร้อนและนำไฟฟ้าได้ดี เพราะมีพันธะโลหะ
4. มีความหนาแน่นมากกว่าโลหะหมู่ IA ดังนั้นจึงมีความแข็งแรงมากกว่าโลหะหมู่ IA และความหนาแน่นมีแนวโน้มเพิ่มมากขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
5. รัศมีอะตอมเล็กกว่าหมู่ IA และค่อยๆ เพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
6. จุดหลอมเหลวและจุดเดือดมีค่าค่อนข้างสูง แต่มีแนวโน้มที่ลดลงเมื่อมวลอะตอมเพิ่มขึ้น
7. IE1มีค่าค่อนข้างน้อย (แต่มากกว่าหมู่ IA ในคาบเดียวกัน) และมีแนวโน้มลดลงเมื่อเลขอะตอมเพิ่มขึ้น
8. อิเล็กโทนเนกาติวิตีมีค่าน้อย และมีค่าลดลงเมื่อเลขอะตอมเพิ่มขึ้น
9. เป็นตัวรีดิวซ์ที่ดี ค่า E0มีค่าลดลงตามลำดับเมื่อเลขอะตอมเพิ่มขึ้น แสดงว่าความสามารถในการเป็นตัวรีดิวซ์จะเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น
10. ทำปฏิกิริยากับน้ำได้ก๊าซ H2และสารละลายแสดงสมบัติเป็นเบส แต่ปฏิกิริยาไม่รุนแรงเหมือนกับธาตุหมู่ IA เมื่อเลขอะตอมเพิ่มขึ้น การทำปฏิกิริยากับน้ำจะเกิดได้เร็วขึ้น
เขียนสมการทั่วๆ ไปได้ดังนี้
M + 2H2O ฎ M(OH)2+ H2
เช่น
Mg + 2H2O ฎ Mg(OH)2+ H2
Ca + 2H2O ฎ Ca(OH)2+ H2
11. เกิดเป็นสารประกอบต่างๆ ได้เช่น คลอไรด์ ออกไซด์ ซัลไฟด์ ซัลเฟต เป็นต้น โดยมีสูตรและสมบัติต่างๆ คล้ายๆ กัน
12. สารประกอบของหมู่ IIA ส่วนมากเป็นสารประกอบไอออนิก (ยกเว้นสารประกอบของธาตุ Be เช่น BeCl2, BeSO4เป็นสารประกอบโคเวเลนต์ ) ดังนั้นส่วนมากจึงละลายน้ำได้ เช่นเกลือไนเตรต เกลือคลอไรด์ ละลายน้ำได้ แต่เกลือคาร์บอนเนต เกลือซัลเฟต (ยกเว้น MgSO4) และเกลือฟอสเฟต ละลายน้ำได้น้อยมาก
13. เมื่อเผาสารประกอบของธาตุหมู่ IIA จะให้เปลวไฟสีต่างๆ กัน เช่น
|
สารประกอบของ |
ตัวอย่าง |
สีของเปลวไฟ |
|
Ca Sr Ba |
CaCO3CaCl2 SrCO3SrSO4 BaCO3BaSO4 |
แดงเข้ม แดงเข้ม แดงเลือดนก เขียว |
ตารางที่ 7.37 แสดงการละลายที่ 250C ของสารประกอบของหมู่ IIA บางชนิด
|
ธาตุ |
การละลายของเกลือ (g/H2O 100 g) |
|||
|
เกลือ SO42- |
ค่าการละลาย |
เกลือ CO32- |
ค่าการละลาย |
|
|
Mg Ca Sr Ba |
MgSO4 CaSO4 SrSO4 BaSO4 |
0.36 1.1 x 10-3 6.2 x 10-5 9.0 x 10-7 |
MgCO3 CaCO3 SrCO3 BaCO3 |
1.3 x 10-4 1.3 x 10-5 7.0 x 10-6 9.0 x 10-6 |
ตารางที่ 7.38 แสดงสมบัติบางประการของธาตุหมู่ VIIA
|
สมบัติ \ ธาตุ |
F |
Cl |
Br |
I |
|
เลขอะตอม การจัดเรียงอิเล็กตรอน มวลอะตอม รัศมีอะตอม (pm)* จุดหลอมเหลว (0C) จุดเดือด(0C) ความหนาแน่น(g/cm3)** IE1(kJ/mol) อิเล็กโทรเนกาติวิตี อิเล็กตรอนอัฟฟินิตี(kJ/mol) E0(V) สถานะปกติ สี ไอโซโทปที่สำคัญ % โดยมวลที่พบบนโลก |
9 2,7 18.998 71 -220 -188 1.51 1687 4.0 333 +2.87 ก๊าซ เหลืองอ่อน 19F 0.027 |
17 2, 8, 7 35.453 99 -101 -34.5 1.56 1257 3.0 348 +1.36 ก๊าซ เขียวอ่อน 35Cl,37Cl 0.19 |
35 2, 8, 8, 7 79.909 144 -7 59 3.12 1146 2.8 340 +1.09 ของเหลว น้ำตาลแดง 79Br,81Br 0.00016 |
53 2,8,18,8,7 126.904 133 114 184 4.93 1015 2.5 297 +0.54 ของแข็ง ม่วงเข้ม 127I 0.00003 |
* หมายถึงรัศมีโคเวเลนต์
** ความหนาแน่นของ F2, Cl2ในสถานะของเหลว ถ้าเป็นก๊าซจะเท่ากับ 0.00170 และ 0.00312 g/cm3ตามลำดับ
สรุปสมบัติทั่วๆ ไปของธาตุหมู่ VIIA ได้ดังนี้
1. เป็นพวกอโลหะ มีเวเลนต์อิเล็กตรอนเท่ากับ 7 สภาวะปกติ F2และ Cl2เป็นก๊าซสีเหลืองอ่อนและเขียวอ่อนตามลำดับ Br2เป็นของเหลวสีน้ำตาลแดง และ I2เป็นของแข็งสีม่วง ซึ่งสีของธาตุแฮโลเจนจะเข้มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น ทุกตัวเป็นสารพิษ
2. ความเป็นอโลหะจะลดลงเมื่อเลขอะตอมเพิ่มขึ้น หรือความเป็นโลหะจะเพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
3. ธาตุแฮโลเจนทุกตัวอยู่ในสภาพโมเลกุลอะตอมคู่ (diatomic molecule) ทุกสถานะทั้งของแข็ง ของเหลวและก๊าซ โดยยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์
4. ไม่นำความร้อนและไฟฟ้าเพราะเป็นอโลหะ
5. อะตอมมีขนาดเล็กเมื่อเปรียบเทียบกับธาตุในคาบเดียวกัน แต่มีขนาดใหญ่ขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
6. ธาตุหมู่ VIIA ละลายในน้ำได้เล็กน้อยและให้สีต่างๆ กัน เนื่องจากเป็นโมเลกุลไม่มีขั้วจึงละลายได้ดีในตัวทำละลายอินทรีย์ เช่น ใน CCl4
Cl2ใน CCl4ไม่มีสี
Br2ใน CCl4สีส้ม
I2ใน CCl4สีม่วง
ซึ่งในตัวทำละลายดังกล่าวนี้ธาตุหมู่ VIIA ทุกชนิดจะอยู่ในรูปของโมเลกุลอิสระเหมือนกับในสภาวะเป็นก๊าซ
ในตัวทำละลายที่มีขั้ว เช่น H2O, C2H5OH , CH3COCH3, ทั้ง Br2และ I2จะมีสีน้ำตาลแดง เนื่องจากเกิดสารประกอบเชิงซ้อนขึ้น
7. ความหนาแน่นน้อย แต่ความหนาแน่นจะเพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น
8. มีจุดหลอมเหลว จุดเดือดและความร้อนแฝงของการเกิดไอต่ำ เนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุล (คือแรงวันเดอร์วาลส์) น้อย แต่จุดหลอมเหลว จุดเดือดและความร้อนแฝงของการเกิดไอเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น เพราะมีแรงวันเดอร์วาลส์เพิ่มขึ้น นอกจากนี้การระเหยของธาตุหมู่ VIIA จะค่อยๆ ลดลงเมื่อเลขอะตอมเพิ่มขึ้น เพราะแรงวันเดอร์วาลส์เพิ่มขึ้น
9. มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุด ในคาบเดียวกัน และค่าอิเล็กโทรเนกาติวิตีจะค่อยๆ ลดลงเมื่อเลขอะตอมเพิ่มขึ้น
10. มี IE1ค่อนข้างสูง และค่า IE1จะค่อยๆ ลดลงเมื่อเลขอะตอมเพิ่มขึ้น เนื่องจากขนาดใหญ่ขึ้น
11. มีเลขออกซิเดชันได้หลายค่า เนื่องจากมี 7 เวเลนต์อิเล็กตรอน ซึ่งสามารถจะให้หรือรับอิเล็กตรอนจากธาตุอื่น หรือใช้อิเล็กตรอนร่วมกับธาตุอื่นๆ ซึ่งมีค่าอิเล็กโทรเนกาติวิตีต่างๆ กันได้ ทำให้มีเลขออกซิเดชันหลายค่า เช่น ตัวอย่างของธาตุ Cl มีเลขออกซิเดชันตั้วแต่ -1 ถึง +7
12. เกิดสารประกอบได้หลายชนิด เช่น NaCl CaF2HF KI และยังเกิดสารประกอบที่มีธาตุองค์ประกอบชนิดเดียวกันได้หลายชนิด เพราะมีเลขออกซิเดชันหลายค่า
เช่น NaClO NaClO2NaClO3NaClO4
Cl2O ClO2ClO3และ Cl2O7เป็นต้น
13. ธาตุที่อยู่ตอนบนของหมู่ สามารถทำปฏิกิริยากับสารประกอบแฮไลด์ของธาตุที่อยู่ตอนล่างได้ แต่ธาตุอยู่ตอนล่างจะไม่ทำปฏิกิริยากับสารประกอบแฮไลด์ของธาตุที่อยู่ตอนบน จึงสรุปได้ว่า “ความสามารถในการทำปฏิกิริยาของธาตุหมู่ VIIA จะลดลงจากบนลงล่าง” เช่น
F2ทำปฏิกิริยากับ NaCl ได้ แต่ Cl2ไม่ทำปฏิกิริยากับ NaF
F2+ 2NaCl ฎ 2NaF + Cl2
Cl2+ NaF ฎ ไม่เกิดปฏิกิริยา
ธาตุอื่นๆ ก็เช่นเดียวกัน
Cl2+ 2NaBr ฎ 2NaCl + Br2
Br2+ NaCl ฎ ไม่เกิดปฏิกิริยา
14. การเตรียมธาตุแฮโลเจนบางธาตุทำได้ดังนี้
2KMnO4+ 16HCl (conc) ฎ KCl + 2MnCl2+ 8H2O + 5Cl2
MnO2+ 4HCl (conc) ฎ MnCl2+ 2H2O + Cl2
2NaBr + MnO2+ 3H2SO4(conc) ฎ 2NaHSO4+ MnSO4+ 2H2O + Br2
15. ปฏิกิริยาที่สำคัญของสารประกอบแฮไลด์ เป็นดังในตารางต่อไปนี้
ตารางที่ 7.39 ปฏิกิริยาของสารประกอบแฮไลด์
|
เมื่อเติมสาร |
ผลที่สังเกตได้ |
|||
|
F-(aq) |
Cl-(aq) |
Br-(aq) |
I-(aq) |
|
|
Pb(NO3)2 AgNO3(aq) การละลายของ AgX ใน ก. Dil. NH3 ข. conc.NH3 AgX เมื่อถูกแสง |
ตะกอนขาว PbF2 - ละลาย ละลาย - |
ตะกอนขาว PbCl2 ตะกอนขาว AgCl ละลาย ละลาย AgCl กลายเป็นสีม่วงเทา |
ตะกอนเหลือง PbBr2 ตะกอนเหลืองอ่อน AgBr ไม่ละลาย ละลาย AgBr กลายเป็นสีเขียวเหลือง |
ตะกอนเหลือง PbBr2 ตะกอนเหลือง AgI ไม่ละลาย ละลาย - |
ปฏิกิริยากับสารละลาย AgNO3และ NH3หรือแสงสว่าง จัดได้ว่าเป็นวิธีการทดสอบแฮไลด์ไอออน
F-(aq) ไม่ให้ตะกอนกับ AgNO3(aq)
Cl-(aq) ให้ตะกอนขาว AgCl ซึ่งเปลี่ยนเป็นสีเทาเมื่อถูกแสงและละลายได้ใน NH3(aq)
Br-(aq) ให้ตะกอนเหลืองอ่อน AgBr ซึ่งเปลี่ยนเป็นสีเขียว-เหลือง เมื่อถูกแสงและละลายได้ ใน NH3เข้มข้น
I-(aq) ให้ตะกอนเหลือง AgI ซึ่งไม่เปลี่ยนสีเมื่อถูกแสงและไม่ละลายใน NH3
การละลายได้ใน NH3(aq) เพราะเกิดสารประกอบเชิงซ้อนที่ละลายได้
AgCl (s) + 2NH3(aq) ฎ [Ag(NH3)2]+(aq) + Cl-(aq)
กลับไปที่เนื้อหา
บทเรียนที่ 3 สมบัติของธาตุแทรนซิชัน
ธาตุแทรนซิชันมีสมบัติคล้ายคลึงกันทั้งในแนวนอนและแนวดิ่ง ซึ่งทุกธาตุต่างเป็นพวกโลหะ แต่มีความแตกต่างจากโลหะหมู่ IA และหมู่ IIA หลายประการดังนี้
1.ธาตุแทรนซิชัน เป็นโลหะซึ่งส่วนใหญ่มีจุดหลอมเหลว จุดเดือด และความหนาแน่นสูง
2. เวเลนต์อิเล็กตรอนของธาตุแทรนซิชันในคาบที่ 4 เท่ากับ 2 ยกเว้นโครเมียม กับทองแดง ซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 1
3. อิเล็กตรอนในระดับพลังงานถัดเข้ามานับจากระดับพลังงานของเวเลนซ์อิเล็กตรอน ส่วนใหญ่มีจำนวนไม่เท่ากัน ส่วนของธาตุหมู่ IA และหมู่ IIA ในคาบเดียวกันมีจำนวนอิเล็กตรอนในระดับพลังงานถัดเข้ามาเท่ากับ 8
4.รัศมีอะตอมมีขนาดใกล้เคียงกันและมีแนวโน้มลดลงเมื่อเลขอะตอมเพิ่มขึ้นตามคาบ
5. ความหนาแน่นมีแนวโน้มเพิ่มขึ้นตามคาบ
6.ธาตุแทรนซิชันมีสมบัติคล้ายคลึงกันตามคาบมากกว่าธาตุอื่นๆ ในตารางธาตุ
นอกจากสมบัติที่ธาตุแทรนซิชันแตกต่างจากโลหะหมู่ IA และหมู่ IIA แล้ว ธาตุแทรนซิชันยังมีสมบัติพิเศษที่เด่นชัดอีกหลายประการ ดังนี้
1.โลหะแทรนซิชันเป็นตัวนำไฟฟ้าและนำความร้อนที่ดี โดยเฉพาะอย่างยิ่งธาตุในหมู่ IB คือ ทองแดง เงิน และทอง
2.รัศมีอะตอมของธาตุแทรนซิชันโดยทั่วไปมีขนาดลดลงเมื่อเลขอะตอมเพิ่มขึ้น แต่รัศมีอะตอมของธาตุต่างๆ จากโครเมียม (Cr) ถึงทองแดง (Cu) มีขนาดใกล้เคียงกันมาก ทั้งนี้เนื่องจากแม้ว่าธาตุในแถวเดียวกันจะมีประจุในนิวเคลียสเพิ่มขึ้นซึ่งทำให้หมอกอิเล็กตรอนเล็กลงก็ตาม แต่อิเล็กตรอนในระดับพลังงานย่อยมีจำนวนมากขึ้นและมีแรงต้านกับการหดขนาดของหมอกอิเล็กตรอน จึงทำให้ขนาดอะตอมของธาตุแทรนซิชันไม่ค่อยเปลี่ยนแปลงมากนัก และจะลดลงอย่างช้า ๆ เท่านั้น
3.พลังงานไอออไนเซชันลำดับที่ 1 ที่เปลี่ยนแปลงอย่างไม่สม่ำเสมอเป็นผลจากการต้านกันระหว่างประจุของนิวเคลียสที่เพิ่มขึ้น กับการเพิ่มอิเล็กตรอนในระดับพลังงานย่อย
4. มีเลขออกซิเดชันได้หลายค่า ยกเว้น IIIB และหมู่ IIB ซึ่งเกิดสารประกอบที่มีเลขออกซิเดชัน +3 และ +2 ตามลำดับ ส่วนธาตุแทรนซิชันอื่น ๆ สามารถแสดงเลขออกซิเดชันร่วมกันเป็นอย่างน้อย
5.สารประกอบส่วนมากของธาตุแทรนซิชันมีสี (ยกเว้นหมู่ IIIB)
6.มีแนวโน้มเกิดสารประกอบเชิงซ้อน (Complex compounds) ได้ง่ายกว่าธาตุหมู่ IA และหมู่ IIA
แสดงสมบัติของธาตุแทรนซิชันเทียบกับธาตุหมู่IA และ IIA
|
สมบัติ ธาตุ |
เลขอะตอม |
รัศมีอะตอม (pm) |
จุดหลอมเหลว (OC) |
จุดเดือด (OC) |
ความหนาแน่น (g/ cm3) |
IE1 (kJ/mol) |
อิเล็กโทรเนกาติวิตี |
|
K |
19 |
227 |
64 |
760 |
0.86 |
425 |
0.82 |
|
Ca |
20 |
197 |
839 |
1490 |
1.54 |
596 |
1.00 |
|
Sc |
21 |
160 |
1540 |
2730 |
3.0 |
632 |
1.36 |
|
Ti |
22 |
150 |
1680 |
3260 |
4.5 |
661 |
1.54 |
|
V |
23 |
140 |
1900 |
3400 |
6.1 |
648 |
1.63 |
|
Cr |
24 |
130 |
1890 |
2480 |
7.2 |
653 |
1.66 |
|
Mn |
25 |
140 |
1240 |
2100 |
7.4 |
716 |
1.55 |
|
Fe |
26 |
130 |
1535 |
2750 |
7.9 |
762 |
1.83 |
|
Co |
27 |
130 |
1500 |
2900 |
8.9 |
757 |
1.88 |
|
Ni |
28 |
130 |
1450 |
2730 |
8.9 |
736 |
1.91 |
|
Cu |
29 |
130 |
1080 |
2600 |
8.9 |
908 |
1.90 |
|
Zn |
30 |
130 |
420 |
910 |
7.1 |
577 |
1.68 |
กลับไปที่เนื้อหา
บทเรียนที่ 4 สารประกอบของธาตุแทรนซิชัน
สารเคมี เช่น KMnO4 และ CuSO4 เป็นสารประกอบของธาตุแทรนซิชัน สารประกอบของธาตุในกลุ่มนี้แตกต่างจากสารประกอบของโลหะในกลุ่ม A อย่างไร จากการศึกษาสารประกอบของโครเมียมและแมงกานีสจะได้ดังนี้จากผลการทดลอง ทำให้ทราบว่าโครเมียมและแมงกานีสมีเลขออกซิเดชันได้หลายค่า
นอกจากนี้สารประกอบของทั้งโครเมียมและแมงกานีสที่มีเลขออกซิเดชันแตกต่างกันจะมีสีแตกต่างกันด้วย เช่นโครเมียมที่มีเลขออกซิเดชัน +2 และ +3 จะมีสีฟ้าและเขียวตามลำดับ ส่วนแมงกานีสที่มีเลขออกซิเดชัน+3 +6 และ +7 จะมีสีน้ำตาล สีเขียว และสีม่วงแดงตามลำดับ และจะพบว่าโครเมียมเกิดเป็นไอออนที่มีประจุได้ตั้งแต่ +1 ถึง +6 โดยที่การเกิดเป็น Cr+ อะตอมจะเสีย 1 อิเล็กตรอนในระดับพลังงานนอกสุดก่อนคือ 4s เมื่อเกิดเป็นไอออนที่มีประจุสูงขึ้น อะตอมจะเสียอิเล็กตรอนเพิ่มขึ้นซึ่งเป็นอิเล็กตรอนที่อยู่ในระดับพลังงาน 3d การที่โครเมียมสามารถให้อิเล็กตรอนในระดับพลังงานที่ถัดเข้าไปจากระดับพลังงานนอกสุดและเกิดเป็นไอออนที่เสถียร ทำให้โครเมียมมีเลขออกซิเดชันได้หลายค่า ธาตุแทรนซิชันอื่น ๆ ก็สามารถให้อิเล็กตรอนในลักษณะเดียวกับโครเมียมและมีเลขออกซิเดชันได้หลายค่าจึงเกิดสารประกอบได้หลายชนิด
ตารางแสดงสีของไอออนของธาตุMn และ Cr
|
สูตร |
ชื่อ |
สี |
|
Cr2+ |
โครเมียม (II) ไอออน |
น้ำเงิน |
|
Cr3+ |
โครเมียม (III) ไอออน |
เขียว |
|
โครเมตไอออน |
เหลือง |
|
|
ไดโครเมตไอออน |
ส้ม |
|
|
Mn2+ |
แมงกานีส (II) ไอออน |
ชมพูอ่อน |
|
Mn(OH)3 |
แมงกานีส (III) ไฮดรอกไซด์ |
น้ำตาล |
|
MnO2 |
แมงกานีส (IV) ออกไซด์ |
ดำ |
|
แมงกาเนตไอออน |
เขียว |
|
|
เปอร์แมงกาเนตไอออน |
ม่วงแดง |
กลับไปที่เนื้อหา
บทเรียนที่ 5 สมบัติของธาตุแทรนซิชัน
1. การจัดอิเล็กตรอนของธาตุแทรนซิชัน โลหะในคาบที่ 4 มีเลขอะตอม 21 ถึง 30 จะมีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ยกเว้นCrและCuมีเวเลนซ์อิเล็กตรอนเท่ากับ 1 คล้ายกับของธาตุหมู่1AและIIAซึ่งการจัดอิเล็กตรอนของธาตุหมู่IAและIIAอิเล็กตรอนที่เพิ่มขึ้นมาจะจัดเข้าอยู่ในระดับพลังงานย่อย 4s–orbitalแต่ธาตุแทรนซิชันจะจัดอิเล็กตรอนเพิ่มใน 3d–orbital
ก.การจัดอิเล็กตรอนของCrคือ1s2 , 2s22p6 , 3s23p43d5 , 4s1ซึ่งการจัดลักษณะเช่นนี้เป็นลักษณะhalf filled electronic configurationโดยระดับพลังงานย่อยของ 3d–orbitalมีอิเล็กตรอนบรรจุอยู่ออร์บิทัลละ 1 อิเล็กตรอน
ข.การจัดอิเล็กตรอนของCuคือ1s2 , 2s22p6 , 3s23p63d10 , 4s1ซึ่งการจัดลักษณะเช่นนี้ทำให้ระดับพลังงานย่อยของ 3d–orbitalมีอิเล็กตรอนบรรจุอยู่เต็มออร์บิทัล ซึ่งเสถียรมากกว่าการจัดแบบ1s2 , 2s22p6 , 3s23p63d9 , 4s2
ค.โลหะแทรนซิชันมีเลขออกซิเดชันได้หลายค่า เนื่องจากการจัดอิเล็กตรอนในระดับพลังงานย่อย3d–orbitalเป็นผลให้สามารถให้อิเล็กตรอนได้หลายตัว ซึ่งต่างจากหมู่IAและIIAจะมีเลขออกซิเดชันได้เพียงค่าเดียวคือ +1 และ +2
ตารางแสดงการจัดอิเล็กตรอนของธาตุแทรนซิชันเทียบกับธาตุหมู่IA และIIA
|
ธาตุ |
เลขอะตอม |
การจัดอิเล็กตรอนในระดับพลังงานย่อย |
การจัดอิเล็กตรอนในระดับพลังงานหลัก |
|
K |
19 |
1s2 2s22p6 3s23p63d0 4s1 |
2 8 8 1 |
|
Ca |
20 |
1s2 2s22p6 3s23p63d0 4s2 |
2 8 8 2 |
|
Sc |
21 |
1s2 2s22p6 3s23p63d1 4s2 |
2 8 9 2 |
|
Ti |
22 |
1s2 2s22p6 3s23p63d2 4s2 |
2 8 10 2 |
|
V |
23 |
1s2 2s22p6 3s23p63d3 4s2 |
2 8 11 2 |
|
Cr |
24 |
1s2 2s22p6 3s23p63d5 4s1 |
2 8 13 1 |
|
Mn |
25 |
1s2 2s22p6 3s23p63d5 4s2 |
2 8 13 2 |
|
Fe |
26 |
1s2 2s22p6 3s23p63d6 4s2 |
2 8 14 2 |
|
Co |
27 |
1s2 2s22p6 3s23p63d7 4s2 |
2 8 15 2 |
|
Ni |
28 |
1s2 2s22p6 3s23p63d8 4s2 |
2 8 16 2 |
|
Cu |
29 |
1s2 2s22p6 3s23p63d10 4s1 |
2 8 18 1 |
|
Zn |
30 |
1s2 2s22p6 3s23p63d10 4s2 |
2 8 18 2 |
2. ธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับธาตุKและCaเช่น พลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมีค่าต่ำ แต่จุดหลอมเหลว จุดเดือด ความหนาแน่นมีค่าสูง และสูงมากกว่าหมู่IAและIIA
ก. ดหลอมเหลว จุดเดือดของโลหะแทรนซิชันสูงกว่าโลหะหมู่IA และIIAมาก ยกเว้นZnมีจุดหลอมเหลวและจุดเดือดใกล้เคียงกับหมู่IA และIIAแต่จุดหลอมเหลวและจุดเดือดของโลหะแทรนซิชันด้วยกันเองมีค่าใกล้เคียงกัน จุดเดือดของโลหะขึ้นอยู่กับพันธะโลหะ และความแข็งแรงของพันธะโลหะจะแปรผกผันกับขนาดอะตอม อะตอมที่มีขนาดเล็กจะมีพันธะโลหะแข็งแรงมากกว่า
ข. ค่าIE1 ของโลหะแทรนซิชันจะสูงกว่าหมู่IAและ IIAแต่แนวโน้มของโลหะแทรนซิชันจะมีค่าIE1ใกล้เคียงกัน
ค. ขนาดอะตอมของโลหะแทรนซิชันจะเล็กกว่าโลหะหมู่IAและIIAแต่มีขนาดอะตอมใกล้เคียงกันเอง
กลับไปที่เนื้อหา
บทเรียนที่ 6 การศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส
การทดลอง
การศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส
โพแทสเซียมไดโครเมต (K2Cr2O7)
|
จุดประสงค์การทดลอง |
1. ทำการทดลองเพื่อศึกษาสมบัติบางประการของสารประกอบของธาตุโครเมียมและแมงกานีสได้
2. บอกเหตุผลที่ธาตุโครเมียมและแมงกานีสเกิดสารประกอบได้หลายชนิดและมีสีต่างกันได้
3. บอกชื่อสารประกอบหรือไอออนของโครเมียมและแมงกานีสจากสีของสารได้
|
สารเคมีและอุปกรณ์ |
|
รายการ |
ต่อ 1 กลุ่ม |
|
สารเคมี |
|
|
1. สารละลายโพแทสเซียมไดโครเมต 0.1 mol/ dm3 |
2 cm3 |
|
2. สารละลายกรดซัลฟิวริก 1 mol/ dm3 |
5 cm3 |
|
3. สารละลายไฮโดรเจนเปอร์ออกไซด์ 6% |
25 cm3 |
|
4. โซเดียมไฮดรอกไซด์ |
2 – 3 เกล็ด |
|
5. แมงกานีส ( IV ) ออกไซด์ |
0.3 g ( ครึ่งช้อนเบอร์ 1 ) |
|
6. สารละลายโซเดียมซัลไฟด์ 0.1 mol/ dm3 |
2 cm3 |
|
7. สารละลายโซเดียมไฮดรอกไซด์ 2 mol/ dm3 |
2 cm3 |
|
8. น้ำกลั่น |
10 cm3 |
|
รายการ |
ต่อ 1 กลุ่ม |
|
อุปกรณ์ 1. หลอดทดลองขนาดเล็ก 2. หลอดทดลองขนาดกลลาง 3. กระบอกฉีดยาขนาด 10 cm3 4. หลอดหยดอย่างยาว 5. กรวยกรอง 6. กระดาษกรอง 7. ช้อนตวงเบอร์ 1 8. ช้อนตวงเบอร์ 2 9. ตะเกียงแอลกอฮอล์ 10. ที่จับหลอดทดลอง |
4 หลอด 2 หลอด 1 อัน 2 อัน 1 อัน 1 แผ่น 1 อัน 1 อัน 1 ดวง 1 อัน |
| การเตรียมการล่วงหน้า |
1. เตรียมสารละลายโพแทสเซียมไดโครเมต 0.1 mol/ dm350 cm3โดยใช้โพแทสเซียมไดโครเมต 1.47 g ละลายในน้ำ แล้วทำให้มีปริมาตรเป็น 50 cm3
2. เตรียมสารละลายกรดซัลฟิวริก 1 mol/ dm3 100 cm3 โดยใช้สารละลายกรดซัลฟิวริกเข้มข้น 18 mol/ dm3 5.6 cm3 ใส่ลงในน้ำ 60 cm3 เติมน้ำจนมีปริมาตรเป็น 100 cm3
3. เตรียมสารละลายโซเดียมไฮดรอกไซด์ 2 mol/ dm3 50 cm3 โดยใช้โซเดียมไฮดรอกไซด์ 4 g ละลายในน้ำแล้วทำให้มีปริมาตรเป็น 50 cm3
4. เตรียมสารละลายโซเดียมซัลไฟด์ 0.1 mol/ dm3 50 cm3 โดยใช้โซเดียมซัลไฟด์ 0.4 g ละลายในน้ำแล้วทำให้มีปริมาตรเป็น 50 cm3
| อภิปรายก่อนการทดลองและวิธีทดลอง |
มีข้อแนะนำเกี่ยวกับการทดลองดังนี้
1. การทดลองตอนที่ 1 แนะนำให้นักเรียนเติม H2O2พร้อมกับเขย่าจนเห็นการเปลี่ยนแปลงอย่างชัดเจนก่อนจะทำการทดลองขั้นต่อไป
2. การทดลองตอนที่ 2 แนะนำการเผาโซเดียมไฮดรอกไซด์กับแมงกานีส ( IV ) ออกไซด์ โดยเผาจนหลอมเหลว และเผาต่อไปจนเกิดสารสีเขียวจึงหยุดเผา ปล่อยให้เย็นแล้วจึงเติมน้ำ
วิธีทดลอง
ตอนที่ 1
ใส่สารละลาย K2Cr2O7 เข้มข้น 0.1 mol/dm3 จำนวน 10 cm3 ในหลอดทดลองขนาดเล็ก เติมสารละลาย H2SO4 เข้มข้น 1 mol/dm3 ลงไป 1 cm3 เขย่าจนเป็นเนื้อเดียวกันแล้วเติมสารละลาย H2O2 เข้มข้นร้อยละ 6 ลงไป 1 cm3 เขย่าและสังเกตการเปลี่ยนแปลง
ตอนที่ 2
1. ใส่ NaOH ประมาณ 0.5 g ลงในหลอดทดลองขนาดกลาง และใส่ MnO2 ลงไปประมาณ 0.3 g เผาจนสังเกตเห็นการเปลี่ยนสี ตั้งไว้ให้เย็นแล้วเติมน้ำกลั่นลงไป 5 cm3 เขย่าและตั้งไว้จนส่วนที่ไม่ละลายตกตะกอน สังเกตสีของสารละลาย
2. นำสารละลายจากข้อ 1 ประมาณ 4 cm3 ใส่ในหลอดทดลองขนาดกลางเติมสารละลาย H2SO4 เข้มข้น 1 mol/dm3 ลงไปประมาณ 2 cm3 เขย่าและสังเกตการเปลี่ยนแปลง
3. นำสารละลายจากข้อ 2 มาเติมสารละลาย NaS เข้มข้น 0.1 mol/dm3 ทีละหยดพร้อมกับเขย่าจนตะกอนไม่เกิดเพิ่มขึ้นอีก สังเกตสีของตะกอนและสารละลาย กรองและเก็บสารละลายไว้ทำการทดลองต่อไป
4. นำสารละลายจากข้อ 3 ประมาณ 2 cm3 มาเติมสารละลาย NaOH เข้มข้น 2 mol/dm3 ลงไปทีละหยดพร้อมกับเขย่าจนไม่เกิดตะกอนเพิ่มขึ้นอีก สังเกตสีของตะกอนที่เกิดขึ้นในตอนแรกและหลังจากที่เขย่าแล้ว ประมาณ 2 นาที
| ผลการทดลอง |
|
ตอนที่ 1 |
ตอนที่ 2 |
|
สารละลายสีเขียวและมีฟองก๊าซเกิดขึ้น |
1. สารละลายสีเขียว 2. สารละลายสีม่วงแดง 3. สารละลายสีชมพูอ่อนมากหรือไม่มีสีและตะกอนขุ่นขาว 4. ตะกอนสีน้ำตาลอ่อน หลังจากเก็บไว้ 10 นาที ตะกอนจะเปลี่ยนเป็นสีน้ำตาลเข้ม |
| อภิปรายหลังการทดลอง |
ให้นักเรียนเปรียบเทียบสีของสารละลายจากการทดลองกับสีของสารประกอบหรือไอออนในตารางต่อไปนี้
ตารางแสดงสีของสารประกอบและสีของไอออนในน้ำของโครเมียมและแมงกานีส
|
สูตร |
ชื่อ |
สี |
|
Cr2+ |
โครเมียม ( II ) ไอออน |
น้ำเงิน |
|
Cr3+ |
โครเมียม ( III ) ไอออน |
เขียว |
|
CrO42– |
โครเมตไอออน |
เหลือง |
|
Cr2O72– |
ไดโครเมตไอออน |
ส้ม |
|
Mn2+ |
แมงกานีส ( II ) ไอออน |
ชมพูอ่อน |
|
Mn (OH )3 |
แมงกานนีส ( III ) ไฮดรอกไซด์ |
น้ำตาล |
|
MnO42– |
แมงกาเนตไอออน |
เขียว |
|
MnO4– |
เปอร์แมงกาเนตไอออน |
ม่วงแดง |
เพื่อให้ตอบคำถามและสรุปได้ว่า
1. โครเมียมและแมงกานีสเกิดสารประกอบได้หลายชนิดและมีสีต่างกัน ธาตุทั้งสองนี้จึงมีเลขออกซิเดชันได้หลายค่า
2. การทดลองตอนที่ 2 สารละลายมีสีเขียว สีม่วงแดง สีชมพูอ่อน (ถ้าเจือจางมากจะไม่มีสี) และสีน้ำตาลนั้น เป็นสารละลายที่มีไอออนของแมงกานีสต่อไปนี้คือ MnO42– MnO4– Mn2+ และ Mn3+ ตามลำดับ
ให้นักเรียนศึกษาเลขออกซิเดชันของธาตุแทรนซิชันอื่นจากตาราง 7.8 ในแบบเรียนแล้วร่วมกันอภิปรายจนได้ข้อสรุปว่าธาตุแทรนซิชันส่วนใหญ่มีเลขออกซิเดชันได้หลายค่า
| ข้อแนะนำเพิ่มเติม |
ปฏิกิริยาที่เกิดขึ้นในตอนที่ 1
1. เมื่อเติม H2O2 ลงในสารละลายของ Cr2O72– ในกรด H2SO4
|
Cr2O72–(aq) |
® |
Cr3+(aq) |
|
สีส้ม |
สีเขียว |
เลขออกซิเดชันของโครเมียมเปลี่ยนจาก +6 เป็น +3 แสดงว่า Cr2O72– ในสารละลายกรดรับอิเล็กตรอนจาก H2O2 ดังสมการ
|
Cr2O72–(aq) |
-- |
Cr3+(aq) |
|
3H2O2 |
® |
3O2+ 6H++ 6e– |
|
Cr2O72–+ 3H2O2+ 8H+ |
® |
2 Cr3++ 3O2+ 7H2O |
ปฏิกิริยาที่เกิดขึ้นในการทดลองตอนที่ 2
1. เมื่อเผา NaOH กับ MnO2
|
MnO2(aq) |
® |
MnO42–(aq) |
|
สีดำ |
® |
สีเขียว |
เลขออกซิเดชันของ Mn เปลี่ยนจาก +4 เป็น +6 แสดงว่า MnO2 ในเบสให้อิเล็กตรอนแก่ O2 และน้ำดังสมการ
|
2MnO2+ 8OH– |
® |
2MnO42–+ 4H2O + 4e– |
|
O2+ 2H2O + 4e– |
® |
4OH– |
|
O2+ 2MnO2+ 4OH– |
® |
2MnO42–+ 2H2O |
2. เมื่อเติมกรด H2SO4 ลงในสารละลายของ MnO42–
|
MnO42–(aq) |
® |
MnO4–(aq) |
|
สีเขียว |
® |
สีม่วงแดง |
เลขออกซิเดชันของ Mn เปลี่ยนจาก +6 เป็น +7 แสดงว่า MnO42–ให้อิเล็กตรอนแก่ O2 และ H+ จากกรด
|
4MnO42–(aq) |
® |
4MnO4–(aq) + 4e– |
|
O2(g) + 4H+(aq) + 4e– |
® |
2H2O(l) |
|
O2(g) + 4MnO42–(aq) + 4H+(aq) |
® |
4MnO4–+ 2H2O |
3. เมื่อเติมสารละลาย Na2S ลงในสารละลายของ MnO4–
|
MnO4–(aq) |
® |
Mn2+(aq) |
|
สีม่วงแดง |
® |
สีชมพูอ่อน |
เลขออกซิเดชันของ Mn เปลี่ยนจาก +7 เป็น +2 แสดงว่า S2– ให้อิเล็กตรอนแก่ MnO4– ในกรด ดังสมการ
|
2MnO4–+ 16H++ 10e– |
® |
2Mn2++ 8H2O |
|
5S2– |
® |
5S + 10e– |
|
2MnO4–+ 16H++ 5S2– |
® |
2Mn2++ 8H2O + 5S |
4. เมื่อเติม NaOH ลงในสารละลายของ Mn2+
|
Mn2+(aq) |
® |
Mn3+(aq) |
|
ไม่มีสี |
® |
สีน้ำตาล |
เลขออกซิเดชันของ Mn เปลี่ยนจาก +2 เป็น +3 แสดงว่า Mn2+ ให้อิเล็กตรอนแก่ O2 และ H2O ดังสมการ
|
4Mn2+ |
® |
4Mn3++ 4e– |
|
O2+ 2H2O + 4e– |
® |
4OH– |
|
4Mn2++ O2+ 2H2O |
® |
4Mn3++ 4OH– |
(Mn2+ ในสารละลายเบสจะอยู่ในรูปของ Mn(OH)2 ซึ่งถูกออกซิไดส์เป็น Mn3+ ได้ง่าย)
กลับไปที่เนื้อหา
บทเรียนที่ 7 การทดลองเตรียมสารประกอบเฮกซะแอมมึนนิกเกิล (ll) ซัลเฟต
|
การทดลองเตรียมสารประกอบเฮกซะแอมมีนนิกเกิล (II) ซัลเฟต |
| จุดประสงค์การทดลอง |
1. ทำการทดลองเพื่อเตรียมสารประกอบเซิงซ้อนของธาตุแทรนซิชันได้
2. อธิบายการเปลี่ยนสีของสารประกอบของธาตุแทรนซิชันเมื่อองค์ประกอบที่ล้อมรอบอะตอมกลางเปลี่ยนไปได้
| สารเคมีและอุปกรณ์ |
|
รายการ |
ต่อ 1 กลุ่ม |
|
สารเคมี |
|
| 1. นิกเกิล (II) ซัลเฟต เฮกซะไฮเดรต | 2 g ( 4 ช้อนเบอร์1) |
|
2. คอปเปอรE(II) ซัลเฟต เพนตะไฮเดรต |
2 g ( 4 ช้อนเบอร์1) |
| 3. สารละลายแอมโมเนียเข้มข้น | 10 cm3 |
| 4. เอทานอลเข้มข้น 95% | 26 cm3 |
| 5. น้ำกลั่น | 4 cm3 |
| อุปกรณ์ | |
| 1. หลอดทดลองขนาดใหญ่ | 1 แท่ง |
| 2. กระบอกฉีดยาขนาด 10 cm3 | 1 อัน |
| 3. หลอดหยด | 1 อัน |
| 4. กระดาษกรอง | 2 แผ่น |
| 5. กรวยกรอง | 1 อัน |
| 6. กระจกนาฬิกา | 1 แผ่น |
| 7. จุกยางปิด ( หลอดทดลองขนาดใหญ่ | 1 อัน |
| อภิปรายก่อนการทดลอง |
ครูแบ่งให้นักเรียนเลือกทำการทดลองโดยใข้ NiSO4.6H2O หรือ CuSO4.5H2O อย่างใดอย่างหนึ่ง และแนะนำเกี่ยวกับการทดลองดังนี้
1. แอมโมเนียเข้มข้น มีกลิ่นฉุนมากเมื่อเข้าตาหรือจมูกจะแสบ และเป็นอันตรายต่อระบบหายใจ
2. ให้ใช้จุกยางปิดหลอดทดลองเพื่อลดการฟุ้งกระจายของแก๊สแอมโมเนียขณะเขย่าหลอดให้สารผสมกัน
3. ให้ความรู้เรื่องการล้างตะกอนด้วยเอทานอลและการเก็บตะกอนข้ามคืน
| ผลการทดลอง |
|
สารตั้งต้น |
ลักษณะของสารใหม่ที่ได้ |
การเปลี่ยนแปลงเมื่อเก็บไว้ข้ามคืน |
|
NiSO4.6H2O
|
ผลึกสีน้ำเงิน |
ผลึกสีน้ำเงินเปลี่ยนเป็นผลึกสีน้ำเงินแกมเขียว |
|
CuSO4.5H2O |
ผลึกสีครามเข้ม |
ผลึกสีครามเปลี่ยนเป็นผลึกสีเขียวแกมฟ้าลักษณะไม่เป็นผลึก |
| อภิปรายหลังการทดลอง |
1. การเตรียมสารประกอบเซิงซ้อนของนิเกิล
ครูและนักเรียนร่วมกันอภิปรายผลการทดลองจนได้ข้อสรุปว่า ตะกอนสีน้ำเงินที่ได้เป็นสารใหม่ซึ่งแตกต่างไปจากสารสีเขียวเดิม โดยที่สารตั้งต้นและผลิตภัณฑ์เป็นสารประกอบของนิเกิล มีเลขออกซิเดชันเท่ากับ +2 เมื่อ Ni2+ถูกล้อมรอบด้วยโมเลกุลของน้ำ 6โมเลกุลจะเกิดผลึกสีเขียว เมื่อโมเลกุลของแอมโมเนียมาแทนที่น้ำ 6 โมเลกุลจะเกิดผลึกสีฟ้าเข้ม ดังสมการ
|
[Ni(H2O )6]2++ 6NH3 |
® |
[Ni(NH3)6]2++ 6H2O |
|
สีเขียว |
สีฟ้าเข้ม |
เมื่อตั้งทิ้งไว้ข้ามคืนผลึกสีฟ้าเข้มจะเปลี่ยนเป็นสีเขียวแกมฟ้า เพราะว่าโมเลกุลของน้ำจะเข้าไปล้อมรอบ Ni2+แทนที่โมเลกุลของแอมโมเนียบางส่วน
2. การเตรียมสารประกอบเซิงซ้อนของ คอปเปอร์
ครูและนักเรียนร่วมกันกันอภิปรายจนได้ข้อสรุปว่า
2.1 ผลิตภัณฑ์ที่ได้เป็นผลิตภัณฑ์สีครามเข้มของเตตระแอมมีนคอปเปอร์ (II) ซัลเฟต [Cu (NH3)4SO4.H2O] ซึ่งแตกต่างจากสีของ CuSO4.5H2O เขียนสมการได้ดังนี้
|
CuSO4.5H2O + 4NH3 |
® |
Cu (NH3)4SO4.H2O + 4H2O |
2.2. เมื่อเก็บผลึกเตตระแอมมีนคอปเปอร์ (II) ซัลเฟต ไว้ข้ามคืน สารนี้จะเปลี่ยนเป็นสีเขียวแกมฟ้า เพราะที่อุณหภูมิ 30°C เตตระแอมมีนคอปเปอร์ (II) ซัลเฟต จะแยกสลายให้น้ำแอมโมเนียอย่างละ 1 โมเลกุล ได้สารใหม่คือ ไตรแอมแอมมีนคอปเปอร์ (II) ซัลเฟต ซึ่งมีสีเขียวแกมฟ้าและไม่มีผลึก สมการการเปลี่ยนแปลงเป็นดังนี้
|
Cu (NH3)4SO4.H2O |
® |
Cu(NH3)3.SO4+ NH3+ H2O |
สรุปผลการทดลอง
ธาตุแทรนซิชันชนิดเดียวกันเกิดไอออนเซิงซ้อนได้หลายชนิดมีสีต่าง ๆ กันขึ้นอยู่กับชนิดและจำนวนของไอออน อะตอม หรือโมเลกุลที่ล้อมรอบอะตอมของธาตุแทรนซิชันนั้น ๆ
กลับไปที่เนื้อหา
บทเรียนที่ 8 สารประกอบเชิงซ้อนและลิแกนด์
โลหะแทรนซิชันมีโครงสร้างทางอิเล็กตรอนที่แตกต่างไปจากโลหะหมู่ที่ IA และหมู่ IIA คือสามารถรวมกับไอออน หรือหมู่ไอออน โมเลกุลหรือสารบางชนิดที่มีอิเล็กตรอนคู่ว่างอยู่ เกิดเป็นสารประกอบโคเวเลนต์ที่เรียกว่า สารประกอบโคออดิเนชัน หรือสารประกอบเชิงซ้อน (Coordination complex, Complex compound)
สารประกอบเชิงซ้อนหรือไอออนเชิงซ้อน โดยทั่ว ๆ ไป ประกอบด้วยอะตอมหรือไอออนที่อยู่ตรงกลางซึ่งส่วนใหญ่เป็นโลหะเรียกว่า นิวเคลียสอะตอม ( Nuclear atom ) มีกลุ่มของไอออนหรือโมเลกุลต่าง ๆ ห้อมล้อมอยู่ ไอออนหรือโมเลกุลที่ห้อมล้อมอยู่นี้เรียกว่า ลิแกนต์ ( ligsnd) โดยปกติพันธะระหว่างอะตอมกลางกับลิแกนต์เป็นพันธะโคออร์ดิเนตโคเวเลนต์ ดังนั้นจึงเรียกสารประกอบเซิงซ้อนเหล่านี้อีกขื่อหนึ่งว่า สารประกอบโคออดิเนชัน เช่น MnO4- มีแมงกานีสเป็นอะตอมกลาง มีออกซิเจนล้อมรอบ Fe(CN)63- มีเหล็กเป็นอะตอมกลางและมีไซยาไนด์ไอออนล้อมรอบ ดังนี้
|
permanganate ion |
hexayano ferrate (III) ion |
ตารางแสดงสารประกอบเชิงซ้อนบางชนิดและไอออนองค์ประกอบ
|
สารประกอบเชิงซ้อน |
ไอออนบวก |
ไอออนลบ |
สีของสารประกอบ |
|
KMnO4 |
K+ |
[MnO4]- |
ม่วงแดง |
|
K2MnO4 |
K+ |
[MnO4]2- |
เขียว |
|
PbCrO4 |
Pb2+ |
[CrO4]2+ |
เหลือง |
|
K3[Fe(CN)6] |
K+ |
[Fe(CN)6]3- |
ส้มแดง |
|
Cu[(NH3)4SO4}] |
[Cu(NH3)4]2+ |
[SO4]2- |
คราม |
|
Cu[(H2O)5SO4] |
[Cu(H2O)5]2+ |
[SO4]2- |
น้ำเงิน |
ธาตุแทรนซิชันส่วนใหญ่เกิดสารประกอบเชิงซ้อนหรือไอออนเชิงซ้อนที่มีสีต่าง ๆ กัน ธาตุแทรนซิชันธาตุหนึ่งอาจเกิดสารประกอบที่มีธาตุองค์ประกอบเหมือนกันได้มากกว่าหนึ่งชนิด เช่น K2Cr2O7 มีสีส้ม K2CrO4 มีสีเหลือง ซึ่งการเกิดสีของสารประกอบแทรนซิชันนี้นอกจากขึ้นอยู่กับเลขออกซิเดชันของธาตุแทรนซิชันแล้ว ยังขึ้นอยู่กับ ลิแกนด์ (Ligand) ที่มาล้อมรอบอะตอมของธาตุแทนรซิชันด้วย
สารที่จัดว่าเป็นสารประกอบโคออรE เนชัน เช่น FeCl4-ion and CrCl3· 6 NH3เนื่องจากประกอบด้วยไอออนหรือโมเลกุลที่เชื่อมต่อหรือเกิดโคออรEิเนตกับโลหะแทรนซิชัน ซึ่งอาจเรียกอีกอย่างหนึ่งว่า ไอออนเชิงซ้อน (complex ion หรือ coordination complexe) เพราะจัดเป็นไอออนเชิงซ้อนตามทฤษฎีกรด-เบสของลิวอิส (Lewis acid-base complexe) ไอออนหรือโมเลกุลที่เกาะเกี่ยวพันกับไอออนของโลหะแทรนซิชันแล้วเกิดเป็นสารเชิงซ้อนเรียกว่า ลิแกนดE(ligand) ซึ่งมาจากภาษาละติน หมายถึงผูกมัด หรือเกี่ยวพัน จำนวนลิแกนดEี่ล้อมรอบโลหะแทรนซิชันเรียกว่าโคออรEเนชันนัมเบอรE(coordination number)
แม้ว่าสารเชิงซ้อนจะมีส่วนที่สำคัญในองคEระกอบทางเคมีของโลหะแทรนซิชันก็ตาม ธาตุหมู่หลักบางชนิดอาจเกิดสารเชิงซ้อนไดEเช่น อะลูมิเนียม (Al) ดีบุก (Sn) และตะกั่ว (Pb) สามารถสร้างไอออนเชิงซ้อนเป็น AlF63-, SnCl42-และ PbI42-เป็นต้น
กลับไปที่เนื้อหา
บทเรียนที่ 9 นิวเคลียร์
กัมมันตภาพรังสี
เป็นกระบวนการเปลี่ยนแปลงภายในนิวเคลียสของอะตอมของธาตุเพื่อเกิดเป็นนิวเคลียสใหม่ที่เสถียรกว่าเดิม ขณะเดียวกันจะปล่อยรังสีออกมาด้วย กระบวนการนี้เกิดขึ้นได้อย่างอิสระไม่ขึ้นกับสภาวะของสารหรืออิทธิพลอื่นใดจากภายนอก เช่น อุณหภูมิ ความดัน ฯลฯ นิวเคลียสที่เกิดการเปลี่ยนแปลงได้ในลักษณะเช่นนี้จะเป็นนิวเคลียสที่มีอัตราส่วนจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสม คือมีจำนวนนิวตรอนแตกต่างจากจำนวนโปรตอนมาก หรืออาจกล่าวโดยสรุปได้ว่า
|
กัมมันตภาพรังสี คือปรากฏการณ์ที่ธาตุแผ่รังสีได้อย่างต่อเนื่อง ธาตุกัมมันตรังสี คือธาตุที่มีสมบัติแผ่รังสีได้ |
|
หลังจากการค้นพบกัมมันตภาพรังสีของแบกเกอเรลเป็นที่เปิดเผย รัทเทอร์ฟอร์ด (Rutherford) ได้ทำการทดลองเพื่อแสดงให้เห็นว่ารังสีที่เปล่งจากธาตุกัมมันตรังสีจะมีกัมมันตภาพรังสีแผ่ออกมาด้วย รังสีจะมีอยู่ด้วยกัน 3 แบบ คือ รังสีแอลฟา (a) รังสีบีตา (b) รังสีแกมมา (g) ซึ่งมีสมบัติแตกต่างกันดังนี้ 1. รังสีแอลฟา (alpha : a) เป็นนิวเคลียสของธาตุฮีเลียม สัญลักษณ์นิวเคลียร์เป็น ซึ่งประกอบด้วยโปรตอนและนิวตรอนชนิดละ 2 อนุภาค มีประจุไฟฟ้า +2 อำนาจทะลุทะลวงต่ำ ไม่สามารถกระดาษและโลหะบางได้ สามารถเดินทางได้ในช่วงที่สั้นมาก เพียงไม่กี่เซนติเมตรในอากาศ เมื่ออยู่ในสนามไฟฟ้าจะเบี่ยงเบนไปทางขั้วลบ รังสีแอลฟาจะทำให้โมเลกุลของอากาศแตกตัวเป็นไอออน บางครั้งเรียกรังสีแอลฟาว่าอนุภาคแอลฟา 2. รังสีบีตา (beta : b) มีสมบัติเหมือนอิเล็กตรอนใช้สัญลักษณ์นิวเคลียร์เป็น มีประจุไฟฟ้า -1 มีมวลเท่ากับมวลของอิเล็กตรอน มีอำนาจทะลุทะลวงสูงกว่ารังสีแอลฟาประมาณ 100 เท่า และมีความเร็วใกล้เคียงกับความเร็วแสง รังสีบีตาบางครั้งอาจเรียกว่าอนุภาคบีตา 3. รังสีแกมมา (gamma : g) เป็นคลื่นแม่เหล็กไฟฟ้า มีความยาวคลื่นสั้นมาก ไม่มีประจุและมวล มีอำนาจทะลุทะลวงสูงกว่ารังสีบีตา สามารถทะลุทะลวงผ่านสิ่งขวางกั้นได้ดี ไม่เบี่ยงเบนในสนามไฟฟ้า |
นอกจากรังสีหรืออนุภาคทั้ง 3 ชนิด ยังมีอนุภาคอย่างอื่นอีกที่มีความสำคัญ เช่น โปรตอน โพสิตรอน และนิวตรอน ซึ่งสรุปสมบัติของรังสีและอนุภาคต่าง ๆ ดังตารางต่อไปนี้
| อนุภาคหรือรังสี | สัญลักษณ์ | ประจุ | มวล |
| แอลฟา | +2 | 4 | |
| บีตา | -1 | 0 | |
| แกมมา | g | 0 | 0 |
| โพสิตรอน | +1 | 0 | |
| นิวตรอน | 0 | 1 | |
| โปรตอน | +1 | 1 |
กลับไปที่เนื้อหา



