โลหะ
![]()
โลหะคืออะไร
วัสดุประเภทโลหะ(Metals)คือวัสดุที่ได้จากการถลุงสินแร่ต่าง ๆ อันได้แก่ เหล็ก ทองแดงอลูมิเนียม นิเกิล ดีบุก สังกะสี ทองคำ ตะกั่ว เป็นต้น โลหะเมื่อถลุงได้จากสินแร่ในตอนแรกนั้น ส่วนใหญ่จะเป็นโลหะเนื้อค่อนข้างบริสุทธิ์ โลหะเหล่านี้มักจะมีเนื้ออ่อนไม่แข็งแรงเพียงพอที่จะนำมาใช้ในงานอุตสาหกรรมโดยตรง ส่วนมากจะนำไปปรับปรุงคุณสมบัติก่อน การใช้งาน
1.เป็นตัวนำความร้อนได้ดี
2.เป็นตัวนำไฟฟ้าที่ดี
3.มีความคงทนถาวรตามสภาพ
4.ไม่เสื่อมสลายหรือเปลี่ยนแปลงสถานะภาพง่าย
5.เป็นของแข็งที่อุณหภูมิปกติ ยกเว้นโลหะปรอท
6.มีความแข็งและความเหนียวสูง ยกเว้นโลหะปรอท
7. ผิวมันขาว
8. มีการขยายตัวที่อุณหภูมิสูง
2. ประเภทวัสดุโลหะ วัสดุโลหะแบ่งออกได้เป็น 2 ประเภทคือ
2.1 วัสดุโลหะประเภทเหล็ก(Ferous Metals)หมายถึง โลหะที่มีพื้นฐานเป็นเหล็กประกอบอยู่ ได้แก่ เหล็กเหนียว เหล็กหล่อ เหล็กกล้า ฯลฯ เป็นวัสดุโลหะที่ใช้กันมากที่สุดในวงการอุตสาหกรรม เนื่องจากเป็นวัสดุที่มีความแข็งแรงสูง สามารถปรับปรุงคุณภาพและเปลี่ยนแปลงรูปทรงได้หลายวิธี เช่น การหล่อ การกลึง การอัดรีดขึ้นรูป เป็นต้น
2.2 วัสดุโลหะประเภทไม่ใช่เหล็ก (Non-Ferous Metals)หมายถึง โลหะที่ไม่มีส่วนเกี่ยวข้องกับเหล็กเลยในขณะที่เป็นโลหะบริสุทธิ์ ได้แก่ ดีบุก อลูมิเนียม สังกะสี ตะกั่ว ทองแดง ทองคำ เงิน ทองคำขาว แมกนีเซียม พลวง เป็นต้น วัสดุโลหะประเภทที่ไม่ใช่เหล็กนี้ บางชนิดราคาสูงกว่าเหล็กมาก จึงต้องกำหนดใช้กับงานทางอุตสาหกรรมบางประเภทที่เหมาะสมเท่านั้น เช่น ทองแดงใช้กับงานไฟฟ้า ดีบุกใช้กับงานที่ต้องการทนต่อการกัดกร่อนเป็นสนิม อลูมิเนียมใช้กับงานที่ต้องการน้ำหนักเบา เป็นต้น
แร่โลหะ หมายถึง แร่ที่มีธาตุโลหะเป็นส่วนประกอบสำคัญ สามารถนำไปถลุงหรือแยกเอาโลหะมาใช้ประโยชน์ ซึ่งอาจจำแนกเป็น แร่โลหะพื้นฐาน แร่โลหะหนัก แร่โลหะหายาก แร่โลหะมีค่า แร่ที่ใช้ในอุตสาหกรรมเหล็ก
สินแร่โลหะสำคัญในประเทศไทย ได้แก่ ดีบุก ทังสเตน พลวง แมงกานีส ตะกั่ว สังกะสี ทองแดง ทองคำ เงิน และโครมเมียม
กลับไปที่เนื้อหา
โลหะนำไฟฟ้าได้อย่างไร
โลหะสามารถนำไฟฟ้าและความร้อนได้ดี มีลักษณะเป็นเงาและมีความวาวเมื่อถูกแสง นอกจากนี้ยังสามารถดึงเป็นเส้น ตีเป็นแผ่น หรือบิดงอได้โดยไม่แตกหัก ซึ่งคุณสมบัติที่สำคัญเหล่านี้ก็เนื่องจากโลหะยึดกันด้วยพันธะชนิดหนึ่ง นั่นก็คือพันธะโลหะ
ทฤษฎีที่ใช้อธิบายพันธะโลหะ
1. แบบจำลองทะเลอิเล็กตรอน ( electron sea model )
2. ทฤษฎีแถบพลังงาน ( band theory )
1. แบบจำลองทะเลอิเล็กตรอน ( electron sea model )
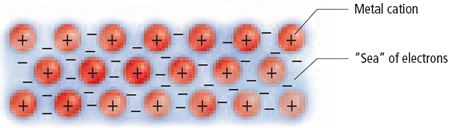
เรามักเรียกแบบจำลองของการเกิดพันธะโลหะนี้ว่า ทะเลอิเล็กตรอนเนื่องจากในผลึกของโลหะมีจำนวนอิเล็กตรอนมหาศาลที่ไหลไปมาได้อย่างอิสระตลอดเวลา
แล้วทำไมอิเล็กตรอนในโลหะถึงเคลื่อนที่ได้ตลอดเวลา ?
โลหะมีค่าพลังงานไออไนเซซันที่ต่ำ ดังนั้นจึงยึดอิเล็กตรอนวงนอกสุดไว้อย่างหลวมๆ ทำให้อิเล็กตรอนเหล่านี้เคลื่อนที่ไปมารอบๆโลหะตลอดเวลาเหมือนกับว่าไม่ได้เป็นอิเล็กตรอนของอะตอมตัวใดตัวหนึ่ง แต่เป็นเสมือนกับว่าเป็นของอะตอมทุกตัว (มีล้านๆอะตอมในผลึกโลหะ)
ซึ่งอิเล็กตรอนเหล่านี้ทำหน้าที่คล้ายซีเมนต์ ที่ช่วยยึดไอออนของโลหะที่มีประจุบวกให้อยู่ในตำแหน่งที่คงที่การที่อิเล็กตรอนสามารถไหลไปมาในโลหะได้นี้ทำให้โลหะมีคุณสมบัติเป็นตัวนำความร้อนและไฟฟ้าที่ดี(เมื่อมีสนามไฟฟ้ากระทำอิเล็กตรอนจะเคลื่อนที่เข้าหาขั้วบวก) และการที่อิเล็กตรอนทำหน้าที่คล้ายซีเมนต์นี้ (cement effect) ทำให้โลหะแข็ง ผิวหน้าของโลหะเป็นมันวาวเนื่องจากโลหะสามารถดูดกลืน และคายพลังงานได้ในช่วงความยาวคลื่นที่ต่อเนื่องกัน ทั้งนี้เนื่องจากอิเล็กตรอนอยู่ไม่ประจำที่และเคลื่อนที่ได้อย่างอิสระจึงสามารถมีพลังงานเท่าไหร่ก็ได้
2. ทฤษฎีแถบพลังงาน (band theory)
เมื่อออร์บิทัลอะตอมสองออร์บิทัลมารวมกันจะได้ออร์บิทัลโมเลกุลสองชนิดคือ ออร์บิทัลโมเลกุลแบบมีพันธะ (bonding molecular orbital) และออร์บิทัลโมเลกุลแบบต้านพันธะ (anti-bonding molecular orbital) ดังเช่นกรณีของ Li2(Li : 1s22s1) ซึ่งแสดงออร์บิทัลโมเลกุลที่ระดับ 2s ได้ดังนี้
เมื่อมีอะตอมมากขึ้นและจำนวนออร์บิทัลโมเลกุลมากขึ้น ระดับพลังงานจะใกล้ชิดกันมากขึ้นจนดูเหมือนว่าเป็นแถบต่อเนื่องกัน แถบดังกล่าวนี้ เรียกว่าแถบพลังงาน (energy band)ดังรูป
อิเล็กตรอนจะมีพลังงานค่าต่างๆได้ภายในแถบ หรือภายในแถบที่มีการซ้อนเหลื่อมกันเท่านั้น (กรณีที่ระดับพลังงานไม่ห่างกันมากแถบพลังงานสามารถซ้อนเหลื่อมกันได้) แถบพลังงานนี้เรียกว่าแถบอนุญาต (allowed band)สำหรับช่วงที่ว่างที่ไม่มีแถบพลังงานเรียกว่าช่องต้องห้าม (forbidden gap) ดังรูป
ตัวนำไฟฟ้า กึ่งตัวนำ และฉนวน
เมื่อพิจารณากรณีของสารตัวนำไฟฟ้าจะเห็นว่าแถบเวเลนซ์มีลักษณะเป็นแถบที่เต็มบางส่วนซึ่งก็คือ ในออร์บิทัลมีทั้งส่วนที่ว่างและส่วนที่มีอิเล็กตรอนบรรจุอยู่ ซึ่งลักษณะเช่นนี้ เมื่ออิเล็กตรอนได้รับพลังงานจากสนามไฟฟ้า ก็จะสามารถเคลื่อนที่ไปอยู่ในส่วนที่ว่างของออร์บิทัลได้ทำให้โลหะนำไฟฟ้าได้ อย่างไรก็ตาม นอกจากโลหะจะมีแถบเวเลนซ์ที่มีลักษณะเป็นแถบที่เต็มบางส่วนแล้ว ยังสามารถมีแถบที่เต็มแล้วแต่สามารถเกิดการซ้อนเหลื่อม กับแถบนำไฟฟ้า(แถบที่ว่าง) ที่มีระดับพลังงานสูงกว่าแต่ใกล้เคียงกันได้จึงทำให้โลหะนำไฟฟ้าได้ หรือแม้แต่แถบที่เต็มบางส่วน ก็สามารถซ้อนเหลื่อมกับแถบนำไฟฟ้าที่มีระดับพลังงานสูงกว่าแต่ใกล้เคียงกันได้
กรณีของสารกึ่งตัวนำไฟฟ้าเมื่ออิเล็กตรอนได้รับพลังงานจากสนามไฟฟ้า อิเล็กตรอนในแถบเวเลนซ์ (แถบที่เต็มแล้ว) ไม่สามารถเคลื่อนที่ไปอยู่ในแถบนำไฟฟ้าได้เนื่องจากช่องต้องห้ามค่อนข้างกว้าง แต่อย่างไรก็ตาม ถ้าทำการกระตุ้นอิเล็กตรอนโดยให้พลังงานที่สูงกว่าช่วงของช่องต้องห้าม เช่น ให้ความร้อน หรือฉายแสง อิเล็กตรอนก็จะสามารถเข้ามาอยู่ในแถบนำไฟฟ้าได้ ดังนั้นจึงสามารถนำไฟฟ้าได้ โดยทั่วไปแล้วช่องต้องห้ามระหว่างแถบเวเลนซ์ และแถบนำไฟฟ้าของสารกึ่งตัวนำมักจะไม่กว้างนัก และโลหะกึ่งตัวนำมักจะเป็นตัวนำที่ดีเมื่ออุณหภูมิสูงขึ้น
กลับไปที่เนื้อหา
สมบัติของโลหะ
- เป็นตัวนำไฟฟ้าได้ดีเพราะมีอิเล็กตรอนเคลื่อนที่ไปได้ง่ายทั่วทั้งก้อนของโลหะ แต่โลหะนำไฟฟ้าได้น้อยลงเมื่ออุณหภูมิสูงขึ้น เนื่องจากไอออนบวกมีการสั่นสะเทือนด้วยความถี่และช่วงกว้างที่สูงขึ้นทำให้อิเล็กตรอนเคลื่อนที่ไม่สะดวก
- โลหะนำความร้อนได้ดีเพราะมีอิเล็กตรอนที่เคลื่อนที่ได้โดยอิเล็กตรอนซึ่งอยู่ตรงตำแหน่งที่มีอุณหภูมิสูง จะมีพลังงานจลน์สูง และอิเล็กตรอนที่มีพลังงานจลน์สูงจะเคลื่อนที่ไปยังส่วนอื่นของโลหะจึงสามารถถ่ายเทความร้อนให้แก่ส่วนอื่น ๆ ของแท่งโลหะที่มีอุณหภูมิต่ำกว่าได้
- โลหะตีแผ่เป็นแผ่นหรือดึงออกเป็นเส้นได้เพราะไอออนบวกแต่ละไอออนอยู่ในสภาพเหมือนกันๆ กัน และได้รับแรงดึงดูดจากประจุลบเท่ากันทั้งแท่งโลหะ ไอออนบวกจึงเลื่อนไถลผ่านกันได้โดยไม่หลุดจากกัน เพราะมีกลุ่มขอองอิเล็กตรอนทำหน้าที่คอยยึดไอออนบวกเหล่านี้ไว้
- โลหะมีผิวเป็นมันวาวเพราะกลุ่มของอิเล็กตรอนที่เคลื่อนที่ได้โดยอิสระจะรับและกระจายแสงออกมา จึงทำให้ โลหะสามารถสะท้อนแสงซึ่งเป็นคลื่นแม่เหล็กไฟฟ้าได้
- โลหะมีจุดหลอมเหลวสูงเพราะพันธะในโลหะเป็นพันธะที่เกิดจากแรงยึดเหนี่ยวระหว่างวาเลนซ์อิเล็กตรอนอิสระทั้งหมดในด้อนโลหะกับไอออนจึงเป็นพันธะที่แข็งแรงมาก
คุณสมบัติของโลหะ คือ ลักษณะเด่น, ความสามารถ, ลักษณะเฉพาะ, ความแข็งแกร่ง, ข้อดี, ข้อเสีย และลักษณะผิดปกติของวัสดุ สิ่งที่กล่าวมาเหล่านี้มีไว้เพื่อเปรียบเทียบถึงความแตกต่างของวัสดุในทางทางวิศวกรรม จำเป็นต้องทราบถึงคุณสมบัติของวัสดุ ก็เพื่อดูว่าวัสดุนั้น สามารถทนทานต่อแรงที่กระทำ, ทนทานต่อการพังทลาย, ทนทานต่อการเสียรูป, ทนทานต่อการกัดกร่อน หรืออื่น ๆ ได้หรือไม่
คุณสมบัติของโลหะ สามารถแบ่งออกได้ดังตารางที่ 4.1 ดังนี้
|
คุณสมบัติของโลหะ |
|||||
|
คุณสมบัติทางกล |
คุณสมบัติที่มีความสัมพันธ์กันระหว่างความเค้น/ความเครียด |
คุณสมบัติทางเคมี |
คุณสมบัติทางไฟฟ้า |
คุณสมบัติทางความร้อน |
คุณสมบัติอื่น ๆ |
|
oความแข็ง oความแข็งแกร่ง oความเปราะ oความเหนียว oความเค้น oความแข็งแกร่งทางดึง oความแข็งแกร่งต่อการกดอัด oความทนทานต่อการเฉือน oความทนทานต่อการบิด oความทนทานต่อการดัด oความทนทานต่อการพังทลาย oความทนทาน oความทนทานต่อการกระแทก |
oความสามารถในการดัด o%การยืดตัว oความเครียด oความยืดหยุ่น oความเป็นพลาสติก oการดัดแปลงง่าย oโมดูลัสความยืดหยุ่น oผังไดอะแกรมความเค้น ความเครียด oช่วงยืดหยุ่น oช่วงพลาสติก oการคืบ oอัตราส่วนพอยต์สัน |
oความต้านทานต่อการกัดกร่อน oความทนทานต่อกรด oความทนทานต่อด่าง oความทนทานต่อสารเคมีอื่น ๆ |
oการนำไฟฟ้า oความต้านทานไฟฟ้า oความแข็งแกร่งของฉนวน oความไวต่อแม่เหล็ก |
oสัมประสิทธิ์ทางความร้อน oอุณหภูมิหลอมเหลว oการนำความร้อน oความจุความร้อน oความร้อนจำเพาะ |
oน้ำหนัก oความหนาแน่น oน้ำหนักจำเพาะ oการสึกหรอ oความสามารถที่กระทำด้วยเครื่องกล oความสามารถในการเชื่อม |
ตารางที่ 4.1 กลุ่มประเภทคุณสมบัติวัสดุทั่วไป
1. คุณสมบัติทางกล (Mechanical properties) เช่น ความแข็งแกร่ง (Strength), ความแข็ง (Hardness)
2. คุณสมบัติความสัมพันธ์ระหว่างความเค้น/ความเครียด เช่น โมดูลัสความยืดหยุ่น (Modulus of elasticity)
3. คุณสมบัติทางเคมี (Chemical properties) เช่น ความทนทานต่อการกัดกร่อน
4. คุณสมบัติทางไฟฟ้า (Electrical properties) เช่น ความต้านทานทางไฟฟ้า
5. คุณสมบัติทางความร้อน (Thermal properties) เช่น อุณหภูมิจุดหลอมเหลว
6. คุณสมบัติด้านอื่น ๆ เช่น ความหนาแน่น และความสึกหรอ (Wear)
4.1 คุณสมบัติทางกลความแข็ง, ความเหนียว (Ductility) และความแข็งแกร่ง เป็นคุณสมบัติขั้นพื้นฐานในทางกลของวิชาโลหะวิทยา
คุณสมบัติทั้งสามเหล่านี้จะมีความสัมพันธ์ที่เชื่อมโยงกันด้วย กล่าวคือ เมื่อความแข็ง และความแข็งแกร่งเพิ่มขึ้น ความเหนียวจะลดลง ทำให้วัสดุนั้นมีแนวโน้มเป็น วัสดุเปราะ (Brittle) ในทางกลับกันวัสดุที่มีความเหนียวมาก จะทำให้ความแข็ง และความแข็งแกร่งลดลง
ความแข็งแกร่ง, ความแข็ง และความเหนียว ปกติแล้วเป็นสิ่งที่มีความต้องการที่จะให้เกิดขึ้นในโลหะ ส่วนความเปราะ (ตรงกันข้ามกับความเหนียว) เป็นสิ่งที่ไม่ต้องการให้เกิดในโลหะ ดังนั้น ในทางโลหะวิทยา ต้องทำการศึกษา ทดลอง เพื่อให้วัสดุมีความสามารถในด้านความแข็งแกร่ง ความแข็ง ที่เพิ่มขึ้น โดยไม่ทำให้ความเหนียวลดลง
4.1.2 ความแข็ง
ความแข็ง คือความต้านทานต่อการเสียรูปวัสดุอย่างถาวร วัสดุที่มีความแข็งสูง ค่าความแข็งแกร่งก็จะสูงตามไปด้วย ในการหลอมโลหะเมื่อเพิ่มส่วนผสมของธาตุลงไปในโลหะหลอมทำให้ความสามารถด้านความแข็ง และความแข็งแกร่งมีคุณภาพดีขึ้น และไม่ทำให้ความเหนียวลดลง
ความแข็ง (Hardness) เป็นคุณสมบัติที่มีสำคัญของโลหะ เป็นการยากที่จะให้คำอธิบายได้อย่างชัดเจน แต่ความหมายที่สามารถบอกได้ดีที่สุดก็คือ ความแข็ง คือ การต้านทานต่อการเสียรูปของวัสดุ หรือ ความต้านทานต่อการกระทำต่อวัสดุ เมื่อวัสดุสูญเสียความต้านทาน ก็จะก่อให้เกิด ความเสียหาย (Damaged), รอยบุ๋ม (Dent), ความเสื่อม หรือความทรุดโทรมอื่น ๆ ซึ่งเป็นผลที่ได้จากแรง หรือความกดดันที่กระทำต่อวัสดุนั้น ในความต้องการที่จะรู้ค่าความแข็งของวัสดุ จำเป็นต้องหาเครื่องมือมาวัด เครื่องมือนี้จะสร้างรอยกดบุ๋มเป็นจุด บนพื้นผิว ด้วยแรงกดที่กระทำบนพื้นผิววัสดุที่ต้องการทราบความแข็ง ดูที่รูป แสดงตัวอย่างรอยบุ๋มบนวัสดุ
ความแข็ง คือคุณสมบัติของโลหะ ที่มีความสำคัญต่อวัสดุ ซึ่งมีการเกี่ยวพันกับคุณสมบัติอื่น ๆ ของโลหะด้วย เช่นความแข็งแกร่ง (Strength),ความเปราะ (Brittleness)และความสามารถในการยืดตัว (Ductility)ในการวัดความแข็งของโลหะนั้น จะเป็นการวัดความแข็งแกร่ง, ความเปราะ และยืดเป็นแผ่นของโลหะ โดยทางอ้อมโดยทราบจากการทดลอง แล้วนำมาคำนวณหาคุณสมบัติที่เกี่ยวข้องกันได้
ประโยชน์ที่ได้จากการทราบค่าความแข็งของโลหะมีมากมาย อาทิเช่น
- เลือกวัสดุให้เหมาะสมกับงานที่ทำ ดูว่าวัสดุนั้นมีความแข็งพอที่จะนำมาสร้างได้หรือไม่
- รู้ค่าความแข็งเพื่อสร้างชิ้นงานที่ต้องการออกแบบให้พังก่อน อีกชิ้นหนึ่ง (ไม่ได้กล่าวรายละเอียดในที่นี้ จะพบในเรื่องของการออกแบบสร้างเครื่องกล)
- รู้ถึงความทนทานของวัสดุที่นำมาทำ ซึ่งสามารถคำนวณอายุการใช้งานได้
- ฯลฯ
การวัดความแข็ง
มีวิธีการมากมายที่นำมาใช้วัดความแข็งของโลหะ แต่ในหนังสือเล่มนี้จะกล่าวถึงวิธีการวัดความแข็งสองวิธีที่ได้รับความนิยม ได้แก่วัดความแข็งโดยการกดเป็นรอย (Penetration hardness)และวัดความแข็งโดยการสร้างรอยขีดข่วน (Scratch hardness)
วัดความแข็งโดยการกดเป็นรอยเป็นเทคนิคการวัดที่มีความแม่นยำมากที่สุด ในการใช้เครื่องทดสอบเป็นตัววัด ตัวเครื่องกดนี้ใช้แรงในการกดชิ้นโลหะให้เกิดรอยบุ๋มลงไปในเนื้อโลหะ และทำการวัดขนาดรอยกด และแรงที่ใช้กด แล้วนำมาคำนวณเพื่อหาค่าความความแข็งของโลหะ
วัดความแข็งโดยการสร้างรอยขีดข่วน เป็นการวัดแบบรวดเร็ว และหยาบ ชิ้นงานโลหะที่ใช้วิธีนี้หาค่าความแข็ง โดยใช้ของมีคมที่มีความแข็งกว่าชิ้นงานตัวอย่าง มาขีดบนชิ้นงานให้เกิดรอยขีดข่วน การวัดแบบนี้จะไม่มีค่าออกมาเป็นตัวเลข แต่จะใช้ความรู้ และประสบการณ์ เพื่อตัดสินว่าชิ้นงานนั้นเป็นชิ้นงานที่ “แข็ง” หรือ “อ่อน” ซึ่งขึ้นอยู่กับผลของรอยขีดข่วน
การทดสอบวัดความแข็งโดยการกดเป็นรอย เมื่อเปรียบเทียบกับ การวัดความแข็งโดยการสร้างรอยขีดข่วน วิธีการแรกให้ความแม่นยำได้สูงกว่า แต่ก็มีราคาแพงกว่า ในอุตสาหกรรมส่วนมากจะใช้วิธีการแรกโดยการกดลงบนชิ้นงานมากกว่า
4.1.3 ความเหนียว และความเปราะ
ความเหนียว และความเปราะจะเป็นปฏิปักษ์ต่อกัน ตรงกันข้ามกันเสมอ คุณสมบัติของทั้งคู่จะถูกนำมาศึกษาในการเรียนรู้เกี่ยวกับความเหนียวของวัสดุถ้าวัสดุทดสอบสามารถยืดได้ค่อนข้างมากก่อนที่มันจะขาดออกจากกัน เราเรียกว่าวัสดุนั้นมีความเหนียวในทางกลับกันถ้าวัสดุมีการยืดตัวได้น้อย และขาดออกจากกัน แสดงถึงวัสดุนั้นมีความเปราะหรือมีความเหนียวน้อย
ในการผลิตโลหะออกมาใช้งานเกือบทั้งหมด เราต้องการคุณสมบัติความเหนียวของโลหะมากกว่าความเปราะ วัสดุที่เหนียวสามารถทนทานต่อการกระแทกที่หนักได้ดีกว่า และสามารถซึมซับพลังงานก่อนที่จะเกิดความเสียหายได้มากกว่าวัสดุที่มีความเปราะ วัสดุที่มีความเปราะปกติแล้วจะมีความแข็งแกร่งกว่าวัสดุเหนียว แต่ในปัจจุบันก็ไม่เสมอไป เมื่อเทคโนโลยีทางด้านโลหะวิทยามีมากขึ้น วัสดุเหนียวก็ถูกผลิตมาให้มีความทนทานต่อการยืดตัว (แข็งแกร่ง) ที่สูงกว่า
ตัวอย่างของวัสดุเหนียว เช่น เหล็กกล้าคาร์บอนต่ำ, อลูมิเนียม, ยาง ส่วนตัวอย่างของวัสดุเปราะเช่น เหล็กหล่อ, แก้ว
กลับไปที่เนื้อหา
โลหะหนัก - โลหะเบา
โลหะที่ไม่ใช่เหล็ก
นอกจากโลหะที่เป็นเหล็กซึ่งมีความสำคัญในงานช่างอุตสาหกรรมแล้วยังมีโลหะที่ไม่ใช่เหล็กที่มีความสำคัญในงานช่างอุตสาหกรรมเช่นเดียวกันอีก โลหะที่ไม่ใช่เหล็กนี้แบ่งออกเป็น 2 ประเภทใหญ่ ๆ ด้วยกันคือ
1.โลหะหนัก
2.โลหะเบา
โลหะหนัก หมายถึงโลหะที่มีความหนาแน่นตั้งแต่ 4 กรับ/ซม ขึ้นไปโลหะหนักที่มีใช้ในงานอุตสาหกรรมอย่างกว้างขวางได้แก่
ทองแดง (COPPER)
-สัญญลักษณ์Cu
-ความหนาแน่น8.93 กรับ/ซม
-จุดหลอมเหลว 1070-1093 องศาเซลเซียส
ทองแดงบริสุทธิ์มีลักษณะอ่อนเหนียวเมื่อทิ้งไว้ในอากาศนาน ๆ จะเกิดออกไซด์สีเขียวมีชื่อว่า พาทินา เป็นสารพิษเมื่อรับประทานแล้วจะเกิดอัตราย ข้อดีของพาทินาคือเป็นตัวช่วยให้ทองแดงทนต่อลมฟ้าอากาศได้ดี การนำทองแดงมาใช้งานนั้นทำได้ 2 ลักษณะคือ
-นำไปรีดทองแดงสามารถนำไปรีดเป็นแผ่นเป็นเส้น เป็นท่อ ซึ่งมีคุณสมบัติเหนียวยืดตัวได้ดี ทองแดงที่รีดที่อุณหภูมิประมาณ 800-900 องศาเซลเซียส สามารถรีดได้เป็นแผ่นบางถึง 0.01 มม. ถ้าเป็นเส้นลวดรีดได้ 0.02 มม. ถ้านำทองแดงไปรีดเย็นจะทำให้ทองแดงแข็งและเปราะ
-นำไปหล่อทองแดงสามารถนำไปหล่อให้เป็นรูปร่างต่าง ๆ ตามต้องการ
ประโยชน์ของทองแดง
ใช้อุปกรณ์ไฟฟ้า เช่น สานไฟฟ้า หัวแร้งบัดกรี ท่อส่งน้ำยาในเครื่องทำความเย็นใช้ในงานเชื่อมประสานและภาชนะใส่ของต่าง ๆ และยังใช้เป็นทองแดงประสมเพื่อเพิ่มคุณสมบัติเด่นของทองแดงในโลหะประสมต่าง ๆ ตัวอย่าง เช่น
1.ทองเหลืองเป็นโลหะประสมที่เกิดจากทองแดงกับสังกะสีทองเหลืองมีคุณสมบัติในด้านทนต่อการกัดกร่อนได้ดีงานต่อการแปรรูปต่าง ๆ ประโยชน์ของทาองเหลืองได้แก่ใช้ทำทุ่นอาเมเจอร์ ชิ้นส่วนเครื่องมือกล ชิ้นส่วนนาฬิกา อุปกรณ์ไฟฟ้า ท่อส่ง น้ำมันในเครื่องยนต์ ฯลฯ
2.บรอนซ์เป็นโลหะประสมที่เกิดจากทองแดงกับดีบุกมีความแข็งแรงความเหนียว ทนต่อการกัดกร่อนได้สูง ประโยชน์ใช้ทำ สปริง แปรงลวด สะพานไฟ เฟือง ฯลฯ
สังกะสี (ZINC)
-สัญญลักษณ์Zn
-ความหนาแน่น 7.14 กรัม/ซม
-จุดหลอมเหลว 420 องศาเซลเซียส
สังกะสีเป็นโลหะที่มีเกรนหยาบและเปราะมีอัตราการขยายตัวสูงเมื่อได้รับความร้อนทนต่อกรดและเกลือรีดเป็นแผ่นและดึงเป็นเส้นได้ง่าย
ประโยชน์ของสังกะสี
สังกะสีถ้านำมาขึ้นรูปในขณะยังเย็นตัว จะทำให้สังกะสีเปราะและหักง่ายการรีดต้องใช้อุณหภูมิประมาณ 90-160 องศาเซลเซียส ในการพับสังกะสีต้องพับขวางกับทิศทางของการรีดเพื่อป้องกันการปริหัก อุณหภูมิที่ใช้ในการพับอยู่ระหว่าง 80-100 องศาเซลเซียส ถ้าอุณหภูมิเกิด 200 องศาเซลเซียส ในการรีดจะทำให้สังกะสีกรอบ
สังกะสีส่วนมากจะใช้เป็นโลหะเคลือบผิวเหล็ก เช่น เหล็กแผ่นอาบสังกะสีมุงหลังคา ลวด ท่อประปร ยังใช้เป็นขั้วลบในแบตเตอรี่ใช้ทำสี ทำชิ้นส่วนของรถยนต์ท่อเครื่องปรับอากาศ ฯลฯ
ตะกั่ว (LEAD)
-สัญลักษณ์Pb
-ความหนาแน่น11.36กรับ/ซม
-จุดหลอมเหลว327องศาเซลเซียส
ตะกั่วเป็นโลหะที่เนื้ออ่อน ทนต่อการกัดกร่อนได้ดี สารตะกั่วหรือไอของตะกั่ว หากสัมผัสหรือสูดไอตะกั่วเข้าในร่างกายมากจะเกิดอันตรายต่อร่างกาย ดังนั้นการทำงานที่เกี่ยวข้องกับตะกั่วจะต้องให้ความระมัดระวัง ต้องทำความเข้าใจและสนใจเป็นพิเศษ
ประโยชน์ของตะกั่ว
ตะกั่วถูกนำมาใช้งานในวงการอุตสาหกรรมอย่างกว้างขวางในชีวิตประจำวันก็ได้นำตะกั่วมาใช้กันอย่างแพร่หลาย เช่น แผ่นธาตุในแบตเตอรี่รถยนต์ เปลือกหุ้มสายเคเบิลและโทรศัพท์เป็นส่วนประสมในน้ำมันเบนซิน ตะกั่วบัดกรี ตัวพิมพ์ ลูกปืน ฟิวส์ไฟฟ้า ทำผนังกันรังสีต่าง ๆ
ดีบุก
-สัญลักษณ์Sn
-ความหนาแน่น 7.28 กรับ/ซม
-จุดหลอมเหลว 232 องศาเซลเซียส
ประเทศไทยนับได้ว่าเป็นประเทศที่มีดีบุกเป็นอันดับ 3 ของโลก ดีบุกบริสุทธิ์จะมีสีขาว
-เงินทนต่อการกัดกร่อนได้ดี มีเนื้ออ่อนรี ดขึ้นรูปได้ง่าย ใช้เคลือบโลหะอื่น ๆ ได้ดี
ประโยชน์ของดีบุก
ในชีวิตประจำวันดีบุกเข้ามามีบทบาทเกี่ยวข้องกับเครื่องใช้หลายอย่างได้แก่ เหล็กอาบดีบุก (แผ่นเหล็กวิมาส) ซึ่งนำมาทำกระป๋องบรรจุอาหาร นม ผักและผลไม้ต่าง ๆ ตะกั่วบัดกรี อุปกรณ์ไฟฟ้า วิทยุโทรทัศน์ต่าง ๆ
อุตสาหกรรมรถยนต์และเครื่องประดับต่าง ๆ เช่น แจกัน และเหรียญตราต่าง ๆ โลหะเบา หมายถึงโลหะที่มี ความหนาแน่นต่ำกว่า 4 กรับ/ซม โลหะเบามีใช้ในงานอุตสาหกรรมอย่างกว้างขวาง ที่นิยมใช้กันมากในปัจจุบันได้แก่
โลหะเบา หมายถึงโลหะที่มีความหนาแน่นน้อยกว่า4kg/dm3โดยทั่วไป ได้แก่
อลูมิเนี่ยม (ALUMINIUM)
-สัญลักษณ์Al
-ความหนาแน่น 2.7 กรับ/ซม
-จุดหลอมเหลว658 องศาเซลเซียส
อลูมิเนียมเป็นโลหะที่มีน้ำหนักเบาคือ เบากว่าเหล็กประมาณ 3 เท่า เนื้อโลหะจะมีสีขาวอ่อน เป็นตัวนำความร้อนและเป็นตัวนำไฟฟ้าที่ดีอลูมิเนียมบริสุทธิ์เมื่อทิ้งไว้ในอากาศนาน ๆ จะเกิดออกไซด์ที่ผิวบาง ๆ ทำให้อลูมิเนียมทนต่อการกัดกร่อนได้ดี อลูมิเนียมง่ายต่อการแปรรูปไม่ว่าจะด้วยการหล่อ รีดหรือดึง
ประโยชน์ของอลูมิเนียม
อลูมิเนียมถูกนำมาเกี่ยวข้องกับชีวิตประจำวันมากขึ้นเป็นลำดัง เช่น เครื่องใช้ต่าง ๆ ในการหุงต้มอาหาร สายไฟฟ้า กรอบหรือโครงของเครื่องใช้ไฟฟ้า ใช้ทำเฟอร์นิเจอร์ กระป๋องอาหาร สำเร็จรูป หลอดยาต่าง ๆ ใช้ทำชิ้นส่วนทั้งภายในและภายนอกรถยนต์ บางครั้งต้องการความแข็งแรงสูงแต่ต้องการน้ำหนักเบาก็สามารถทำได้โดยทำเป็นอลูมิเนียมประสมเช่น ชิ้นส่วนของเครื่องบิน ลูกสูบเครื่องยนต์ ฯลฯ
แมกนีเซียม (MAGNESIUM)
-สัญลักษณ์Mg
-ความหนาแน่น 1.74 กรับ/ซม
-จุดหลอมเหลว 650 องศาเซลเซียส
แมกนีเซียม เป็นโลหะเบาที่มีน้ำหนักเบาที่สุด มีลักษณะคล้ายกับอลูมิเนี่ยม การจะแยกโลหะทั้งสองนั้นจะต้องใช้วิธีการทางเคมีเข้าช่วยนำไปแปรรูปได้ง่าย แมกนีเซียมยิ่งบริสุทธิ์เท่าไรความแข็งแรงจะยิ่งลดน้อยลงเท่านั้น ส่วนแมกนีเซียมจึงถูกนำมาใช้งานในรูปของแมกนีเซียมประสม
ประโยชน์ของแมกนีเซียม
แมกนีเซียม เป็นโลหะที่ติดไฟได้ เปลวไฟสว่างไสวมาก ใช้ทำชิ้นส่วนของหลอดไฟ ถ่ายรูป ทำดอกไม้ไฟ ทำพลุส่องสว่าง แมกนีเซียมประสมใช้ทำชิ้นส่วนของเครื่องบินและอุตสาหกรรมในการผลิตอาวุธต่าง ๆ และล้อรถยนต์
เบริลเลียม
เบริลเลียม มีความหนาแน่น1.85 kg/dm3จุดหลอมเหลว1285 ° Cเป็นโลหะที่มีอัตราการยืดตัวน้อยมากถ้าใช้เป็นโลหะผสมจะทำให้โลหะผสมเหล่านั้นมีความแข็งเพิ่มมากขึ้น และจงอย่าลืมว่า ไอหรือฝุ่นของเบริลเลียมเป็นพิษต่อร่างกายเบริลเลียมสามารถนำไปใช้เป็นโลหะผสมทองแดง นอกจากนั้น ยังใช้กับงานที่ต้องการความแข็งแรงสูงและทนต่อการกัดกร่อนได้ดี
โลหะหนักเป็นอันตรายในอาหาร (food hazard) ประเภทอันตรายทางเคมี (chemical hazard) จึงเกิดการสะสมโลหะหนักในเนื้อเยื่อสัตว์ และเนื้อเยื่อพืช โดยสะสมสารมลพิษเพิ่มขึ้นตามลำดับขั้นการบริโภคจากประกาศกระทรวงสาธารณสุขฉบับที่ 98 (พ.ศ.2529) เรื่อง มาตรฐานอาหารที่มีสารปนเปื้อนมีข้อกำหนดเกี่ยวกับการปนเปื้อนของโลหะในอาหารดังนี้
- ดีบุก250 มิลลิกรัม ต่ออาหาร 1 กิโลกรัม
- สังกะสี 100 มิลลิกรัม ต่ออาหาร 1 กิโลกรัม
- ทองแดง 20 มิลลิกรัม ต่ออาหาร 1 กิโลกรัม
- ตะกั่ว 1 มิลลิกรัม ต่ออาหาร 1 กิโลกรัม เว้นแต่อาหารที่มีสารตะกั่วปนเปื้อนตามธรรมชาติในปริมาณสูง ให้มีได้ตามที่
ได้รับความเห็นชอบจากสำนักงานคณะกรรมการอาหารและยา - สารหนู2 มิลลิกรัม ต่ออาหาร 1 กิโลกรัม
- ปรอท0.5 มิลลิกรัม ต่ออาหาร 1 กิโลกรัม สำหรับอาหารทะเลและไม่เกิน 0.02 มิลลิกรัม ต่ออาหาร 1 กิโลกรัม
สำหรับอาหารอื่นชนิดของโลหะหนักที่มีการปนเปื้อนในอาหาร
ประเภท
ระดับของโลหะหนักที่อนุญาตให้มีได้ในเนื้อเยื่อสัตว์น้ำ (มิลลิกรัม / กิโลกรัม (น้ำหนักเปียก)
โครเมียม
ทองแดง
ตะกั่ว
สังกะสี
2
2
-
20
0.5
1
100
-
-
0.05
-
-
0.2
-
กุ้ง (รวมทั้งกั้ง/ปู)
-
-
2.0
-
-
0.5
-
-
-
2.0
-
-
1
-
การตรวจหาปริมาณโลหะหนักในอาหาร
การตรวจหาโลหะหนัก เช่นตะกั่วและปรอทในเนื้อสัตว์สัตว์น้ำเมล็ดธัญพืชน้ำมันพืชเครื่องดื่มทั่วไป และเครื่องดื่มที่ผสม
แอลกอฮอล์ (alcoholic beverage) นิยมใช้Atomic Absorption Spectroscopy(AAS) ซึ่งเป็นเทคนิคที่ใช้ตรวจหาธาตุอนินทรีย์(inorganic elements) ตัวอย่างจะถูกทำให้ร้อนขึ้นเพื่อเปลี่ยนสภาพเป็นอะตอม (atoms) ซึ่งสามารถดูดกลืนแสงได้ในปริมาณที่เป็นสัดส่วนกับความเข้มข้นของธาตุที่มีอยู่ในตัวอย่าง
กลับไปที่เนื้อหา
พันธะโลหะ (Metallic bonding)
เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอมโลหะดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลวอะตอมของโลหะมีอิเล็กตรอนพิเศษ
เฉพาะในวงโคจรชั้นนอกของมันเทียบกับคาบ(period)หรือระดับพลังงานของพวกมัน อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้
เปรียบได้กับทะเลอิเล็กตรอน(Sea of Electrons)ล้อมรอบแลตทิชขนาดใหญ่ของไอออนบวกพันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากในโลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้องในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ พันธะโลหะเขียนสูตรทางเคมีไม่ได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง อาจจะมีเป็นล้านๆ อะตอมก็ได้ พันธะโลหะจะมีความสำคัญต่อคุณสมบัติทางฟิสิกส์หลายอย่างของโลหะเช่น
- ความแข็งแรง
- ตีแผ่เป็นแผ่นได้(malleability)
- ดึงเป็นเส้นได้ (ductility)
- นำความร้อนไดดี
- นำไฟฟ้าได้ดีและนำได้ทุกทิศทาง
- เนื้อเป็นเงา (luster)
การเกิดพันธะเคมี
1. โลหะมีค่าพลังงานไอออไนเซชั่นต่ำมาก แสดงว่าอิเล็กตรอนของโลหะจะหลุดออกไปได้ง่าย เมื่อวาเลนซ์อิเล็กตรอนหลุดออกไป ก็จะเหลืออนุภาคบวกดังนี้
โลหะทุกอะตอมเป็นตัวให้อิเล็กตรอนทั้งสิ้นดังนั้นจะไม่มีอะตอมใดเลยที่ได้รับอิเล็กตรอน
2. โลหะมีเวเลนซ์อิเล็กตรอนน้อย ดังนั้นอิเล็กตรอนที่หลุดออกไป จะมีเพียง 1,2,3 ตัวเท่านั้น
3. โลหะมีค่าโคออร์ดิเนชั่นนัมเบอร์สูง ซึ่งเท่ากับ 8 หรือ12 หมายความว่า อะตอมหนึ่งจะมีอะตอมอื่นรอบล้อม 8 ถึง12 อะตอมดังนั้นการนำอิเล็กตรอนมาใช้ร่วมกันเป็นอิเล็กตรอนคู่ในลักษณะของพันธะโคเวเลนต์จึงเป็นไปไม่ได้
ดังนั้นการเกิดพันธะโลหะควรเป็นไปในลักษณะที่ว่าเวเลนซ์อิเล็กตรอนของอะตอมโลหะ ที่หลุดออกไปจะไม่เป็นของอะตอมใดอะตอมหนึ่งโดยเฉพาะแต่จะเป็นของอะตอมทั้ง หมด โดยที่อิเล็กตรอนจะเคลื่อนที่ไปยังอะตอมนี้บ้างอะตอมโน้นบ้าง ในผลึกของโลหะจึงเป็นการเอาอนุภาคบวกมาเรียงกัน ไว้อย่างมีระเบียบ และมีเวเลนซ์อิเล็กตรอนเคลื่อนที่ไปมาได้ทั่วอนุภาคบวกทั้งหมด หรืออาจกล่าวได้ว่า อนุภาคบวกเหล่านั้นจมอยู่ในทะเลอิเล็กตรอน แรงดึงดูดระหว่างอนุภาคบวกกับอิเล็กตรอนเรียกว่า“พันธะโลหะ”ซึ่งมีแรงยึดเหนี่ยวระหว่างพันธะแข็งแรงมาก
ภาพแสดงการเกิดพันธะโลหะ
กลับไปที่เนื้อหา





