ความสำคัญของเคมีอินทรีย์สังเคราะห์ต่อการพัฒนายารักษาโรค
ปัจจัยสี่ คือสิ่งที่มนุษย์จำเป็นต่อการดำรงชีวิต ซึ่งประกอบด้วยอาหาร เครื่องนุ่งห่ม ที่อยู่อาศัยและยารักษาโรค ถ้ามองประเทศไทยโดยรวมแล้ว ดูเหมือนว่าประเทศเรามีสิ่งเหล่านี้อยู่ครบ เราผลิตอาหารและเครื่องนุ่งห่มได้มากเกินปริมาณความต้องการของประเทศ จนต้องมีการส่งออกและนำรายได้เป็นกอบเป็นกำเข้าประเทศ สำหรับที่อยู่อาศัย ผู้คนส่วนใหญ่ก็มีเป็นของตนเอง ใหญ่บ้างเล็กบ้างตามกำลังซื้อของแต่ละคน ส่วนยารักษาโรคก็มีใช้เกือบครบทุกโรคตามสถานพยาบาลทั่วไป ดังนั้นดูเหมือนว่าประเทศไทยไม่ได้ขาดปัจจัยใดปัจจัยหนึ่งในสี่ปัจจัยนี้เลย แต่ในความเป็นจริงหาเป็นเช่นนั้นไม่ จะมีสักกี่คนที่รู้ว่าประเทศไทยไม่มีความสามารถในการผลิตยารักษาโรคได้เองเลย ประมาณ 2 ใน 3 ของยาที่บริโภคในประเทศนี้เป็นยาสำเร็จรูป ที่นำเข้าจากต่างประเทศ ส่วนอีก 1 ใน 3 ที่หลายคนเข้าใจว่ามีการผลิตในประเทศ ความจริงก็คือเป็นขั้นตอนปลายน้ำที่ผู้ประกอบการไทยนำเข้าวัตถุดิบทางยาจากต่างประเทศและนำมาพัฒนาเป็นตำรับยาในเชิงอุตสาหกรรม

ภาพนักวิทยาศาสตร์กับอุปกรณ์ทดลองทางวิทยาศาสตร์
อ้างตามคำแถลงของ นพ.สุวิทย์ วิบุลผลประเสริฐ ประธานคณะกรรมการกำกับทิศทางการวิจัยและพัฒนาระบบยา สถาบันวิจัยระบบสาธารณสุขเมื่อวันที่ 19 สิงหาคม 2554 ประเทศไทยกำลังประสบปัญหาเกี่ยวกับระบบค่าใช้จ่ายด้านสุขภาพ โดยเฉพาะอย่างยิ่งค่ายา ในช่วงระหว่างที่มีการเก็บข้อมูลตั้งแต่เดือนมีนาคม 2552 - มิถุนายน 2554 พบว่ามูลค่าการบริโภคยาในประเทศสูงถึง 134,482,077,585 บาท หรือคิดเป็นร้อยละ 35 ของค่าใช้จ่ายด้านสุขภาพ ซึ่งสูงกว่าประเทศที่พัฒนาแล้ว ที่ปกติจะไม่เกินร้อยละ 20 และที่น่าตกใจยิ่งกว่าคือ ประเทศไทยนำเข้ายาที่บรรจุแล้วจากต่างประเทศถึง 99,663.8 ล้านบาท ส่วนที่เหลือเป็นการบรรจุในประเทศ แต่ยังคงเป็นการนำเข้าวัตถุดิบจากต่างประเทศ คงเป็นการดีไม่น้อยถ้าหากเราสามารถที่จะลดการพึ่งพายาจากต่างประเทศลงได้ แล้วเป็นไปได้แค่ไหนที่เราจะผลิตยาได้เองจริง ๆ เรามาดูตัวอย่างการค้นพบยาที่สำคัญๆ เพื่อที่จะได้รู้ว่ายาแต่ละตัวมีที่มาอย่างไร
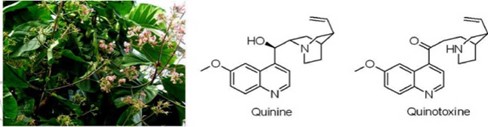
ยาควินิน (quinine) ซึ่งเคยใช้เป็นยาหลักใน การรักษาไข้มาลาเรียสามารถสกัดมาจากเปลือกของต้นซิงโคนา (cincona)
ในอดีตมีการใช้สมุนไพรเป็นยารักษาโรคโดยตรง จากนั้นก็มีการพัฒนาโดยการแยกเฉพาะสารที่ออกฤทธิ์มาใช้เป็นยารักษาโรค ยกตัวอย่างเช่น ยาควินิน (quinine) ซึ่งเคยใช้เป็นยาหลักในการรักษาไข้มาลาเรียสามารถสกัดมาจากเปลือกของต้นซิงโคนา (cincona) ในสภาวะปกติปริมาณควินินที่ผลิตได้มีเพียงพอกับ ความต้องการแต่ในช่วงสงครามโลกครั้งที่ 2 ความต้องการควินิน เพิ่มขึ้นอย่างรวดเร็วจนไม่สามารถผลิตได้ทัน จึงได้มีการพยายามสังเคราะห์สารนี้ขึ้นในห้องปฏิบัติการและในที่สุดนักเคมีชาวอเมริกันชื่อ อาร์.บี.วูดเวิร์ด (R. B. Woodward) และ ดับเบิลยู. อี. ดูเออริง (W. E. Doering ) ก็สามารถสังเคราะห์สารนี้ขึ้นมาได้ในปี ค.ศ. 1944 การค้นพบนี้ถือว่าเป็นการเปลี่ยนแปลงอย่างยิ่งใหญ่ทางเคมีอินทรีย์ เนื่องจากในสมัยนั้นเคมีอินทรีย์สังเคราะห์ยังเป็นการลองผิดลองถูก ไม่มีใครคิดว่าสารผลิตภัณฑ์ธรรมชาติ (natural product) ที่โครงสร้างซับซ้อนอย่างควินินจะสามารถถูกสังเคราะห์ขึ้นมาได้จากสารเคมีที่มีอยู่ในห้องปฏิบัติการ การค้นพบนี้เป็นแรงผลักดันให้มีการทำวิจัยทางด้านนี้กว้างขวางขึ้น มีการรายงานการสังเคราะห์ควินินโดยวิธีการอื่น ๆ ของนักเคมีอีกหลายท่านออกตามมา แต่ท้ายสุดก็ไม่ได้มีการนำวิธีการของใครไปใช้จริง เนื่องจากการสังเคราะห์มีความซับซ้อน และมีหลายขั้นตอน ซึ่งจะทำให้ต้นทุนในการผลิตยาโดยวิธีการสังเคราะห์สูงมากเกินไป ที่สำคัญหลังทศวรรษ 1940 ได้มีการนำยาอื่นที่ดีกว่ามาใช้ในการรักษาไข้มาลาเรีย ปัจจุบันยาที่ใช้เป็นหลักคือยาชุดต้านมาลาเรียเอซีที (ACT : Artemisinin-based Combination Therapy) ซึ่งเป็นการรวมเอายาอาร์ทีมิซินินและยารักษาไข้มาลาเรียตัวอื่นเข้าด้วยกัน เพื่อลดการดื้อยา ส่วนควินินจะถูกใช้เป็นทางเลือกสุดท้ายเท่านั้น อันเนื่องจากผลข้างเคียงที่ร้ายแรง ซึ่งอาจทำให้ถึงกับเสียชีวิตได้ในผู้ป่วยบางราย
แม้ว่าในอดีตการสังเคราะห์ควินินระดับอุตสาหกรรมเพื่อนำมาใช้เป็นยาจะไม่ได้เกิดขึ้น แต่ยารักษาโรคในปัจจุบันแทบจะเรียกได้ว่ามาจากการสังเคราะห์ทั้งสิ้น (ในกลุ่มของยาที่มีการใช้อย่างแพร่หลาย มีเพียงอาร์ทีมิซินินตัวเดียวเท่านั้นที่ยังมีการสกัดมาจากพืชโดยตรง) แน่นอนว่าการรักษาโรคโดยใช้ยาสมุนไพรมีข้อดีคือ ราคาถูกและหาได้ค่อนข้างง่าย โดยเฉพาะในประเทศเขตร้อนอย่างประเทศไทย ที่มีความหลากหลายทางชีวภาพสูง อย่างไรก็ตามการพึ่งสมุนไพรในการรักษาโรคก็อาจมีข้อจำกัดในเรื่องปริมาณ ในอดีตถือว่าเป็นเรื่องโชคดีที่ต้นซิงโคนาผลิตควินินออก มาในปริมาณที่ค่อนข้างสูง (สูงถึง 13% ของเปลือก) แต่กระนั้นในยามสงคราม ควินินก็มีไม่เพียงพอแม้ว่าจะมีการเร่งปลูกต้นซิงโคนาเพิ่มขึ้นก็ตาม ทหารในสนามรบทั้งฝ่ายสัมพันธมิตรและอักษะต้องเสียชีวิตจำนวนมากด้วยไข้มาลาเรียเนื่องจากขาดยารักษา
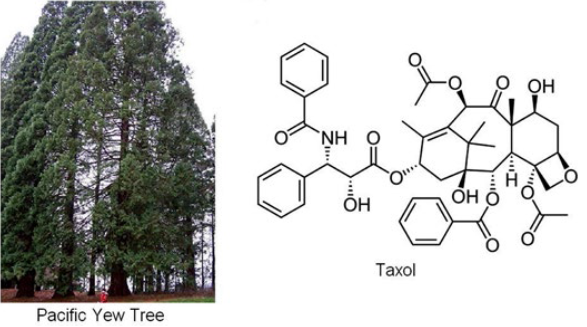
สารต้านมะเร็งแท็กซอล (taxol) ในเปลือกต้น Pacific yew
โดยทั่วไปพืชสมุนไพรมักจะผลิตสารที่ออกฤทธิ์เป็นยาในปริมาณที่ค่อนข้างตํ่า บางชนิดก็มีปริมาณน้อยมาก นอกจากนี้บางชนิดยังต้องใช้เวลาในการปลูกนานมากด้วย ดังนั้นแทบจะเป็นไปไม่ได้เลยที่เราจะผลิตยาทุกชนิดให้เพียงพอกับความต้องการโดยอาศัยแต่ธรรมชาติเพียงอย่างเดียว ยกตัวอย่างเช่น มีการค้นพบสารต้านมะเร็งแท็กซอล (taxol) ในเปลือกต้น Pacific yew ในสหรัฐอเมริกาในปี ค.ศ. 1967 โดยเปลือกทั้งหมดจากต้นไม้ใหญ่อายุกว่าร้อยปี ให้สารแท็กซอลออกมาเพียง 300 มิลลิกรัมเท่านั้น ซึ่งสามารถนำไปผลิตยาได้เพียง 1 เม็ด ลองคิดดูว่าเราจะต้องโค่นต้นไม้มากมายขนาดไหนเพื่อที่จะผลิต ในทศวรรษ 1970 ได้มีความพยายามในการสังเคราะห์แท็กซอลขึ้น แต่ก็ไม่มีวิธีไหนที่สามารถที่จะนำไปใช้ได้จริงในระดับอุตสาหกรรม จนกระทั่งในปี ค.ศ. 1981 นักเคมีชาวฝรั่งเศสชื่อ ปีแยร์ โปตีเย (Pierre Potier) พบว่าเขาสามารถที่จะแยกสาร 10-deacetylbaccatin ในปริมาณมากได้จากยางไม้รูปเข็มของต้น European yew สารนี้มีโครงสร้างคล้ายแท็กซอล ซึ่งจะทำให้การสังเคราะห์สั้นลง และในปี ค.ศ. 1988 การสังเคราะห์แท็กซอลของทีมงานเขาก็เป็นผลสำเร็จ แต่มันก็ไม่เหมาะที่จะนำไปใช้จริง เนื่องจากร้อยละของผลิตภัณฑ์ตํ่าเกินไป หลังจากนั้นนักเคมีชาวอเมริกันชื่อ รอเบิร์ต เอ. ฮอลตัน (Robert A. Holton) ก็ได้ใช้ข้อมูลจากงานวิจัยนี้ ในการคิดค้นวิธีการสังเคราะห์ที่ดีกว่าสำเร็จในปี ค.ศ. 1989 วิธีการนี้ได้รับการปรับปรุงจนสามารถนำไปใช้ผลิตแท็กซอลในระดับอุตสาหกรรมได้จริงในปี ค.ศ. 1992 ซึ่งเป็นปีที่แท็กซอลได้รับอนุญาตจากสำนักงานคณะกรรมการอาหารและยาของสหรัฐอเมริกา (FDA) ให้เป็นยารักษามะเร็งได้ จากข้อมูลนี้เราจะเห็นว่ากว่าจะได้ยามาสักตัวไม่ใช่เรื่องง่าย ต้องใช้เวลานานถึง 25 ปีตั้งแต่การค้นพบ กว่าจะได้รับอนุญาตจาก FDA และผลิตจำหน่ายได้ แต่ผลตอบแทนก็ถือว่าคุ้ม นอกจากการได้ช่วยชีวิตคนแล้ว บริษัทยาก็สามารถทำรายได้มหาศาลโดยบริษัทมียอดขายของแท็กซอลสูงสุดในปี ค.ศ. 2000 ทำรายได้ถึง 1,600 ล้านเหรียญสหรัฐ
นอกจากปริมาณในการผลิตแล้ว ข้อดีของการสังเคราะห์ยาคือ เราสามารถปรับเปลี่ยนโครงสร้างสารตามที่ต้องการได้ เช่น สารที่เราค้นพบจากธรรมชาติอาจมีฤทธิ์ทางยาแต่เป็นฤทธิ์ที่ตํ่า เราก็สามารถสังเคราะห์สารอนุพันธ์อื่นๆ ที่โครงสร้างคล้ายกันขึ้นมา แล้วนำสารเหล่านี้ไปทดสอบสมบัติ เราก็อาจโชคดีค้นพบสารที่มีฤทธิ์ดีกว่าเดิมได้ ยิ่งไปกว่านั้นในปัจจุบันเราสามารถที่จะออกแบบโครงสร้างยาได้เอง หากมีข้อมูลของตำแหน่งที่เราต้องการให้ยาไปออกฤทธิ์ ตัวอย่างยาที่ได้มาด้วยวิธีการนี้คือ โอเซลทามิเวียร์ (oseltamivir) ซึ่งเป็นยารักษาไข้หวัดนก ยานี้ลูกค้นพบโดย ซี. ยู. คิม (C. U. Kim) และทีมวิจัยจากบริษัท Gilead Sciences ในสหรัฐอเมริกา ในงานวิจัยนี้ได้มีการศึกษาโครงสร้างของเอนไซม์ neuraminidase ของเชื้อไวรัสด้วยการเอกซเรย์ ข้อมูลที่ได้ถูกนำมาใช้ในการออกแบบโครงสร้างสาร เพื่อที่จะใช้ยับยั้งเอนไซม์ตัวนี้ เนื่องจากเป็นเรื่องยากที่จะทำนายได้ว่าสารตัวไหนจะออกฤทธิ์ได้จริง จึงมีการออกแบบสารหลายตัวด้วยกัน หลังจากนั้นจะต้องมีการสังเคราะห์สารเหล่านี้ขึ้นมาจริง สารต่างๆ ที่สังเคราะห์ได้จะถูกนำไปทดสอบการออกฤทธิ์ หากออกฤทธิ์ได้แต่ถ้าฤทธิ์ยังไม่ดี ก็จะมีการปรับเปลี่ยนโครงสร้างสารเพิ่มเติม จนนำไปสู่การค้นพบโอเซลทามิเวียร์ ยานี้สามารถสังเคราะห์ได้จากสาร (-)-shikimic acid ซึ่งพบในโป๊ยกั๊กหรือจันทน์แปดกลีบ (Chinese star anise)
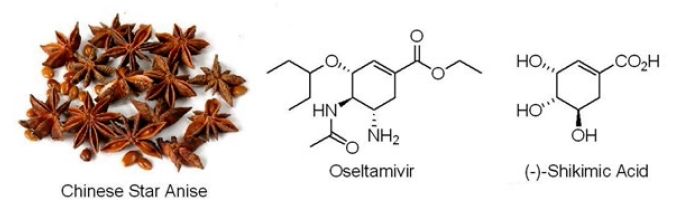
(-)-shikimic acid ซึ่งพบในโป๊ยกั๊กหรือจันทน์แปดกลีบ (Chinese star anise)
และการผลิตในสภาวะปกติก็เพียงพอกับความต้องการ แต่ในปี ค.ศ. 2005 เริ่มมีการกักตุนยานี้ในแต่ละประเทศ เนื่องจากความหวาดกลัวว่าไข้หวัดนกอาจมีการระบาดเป็นวงกว้าง ทำให้บริษัท Roche ซึ่งถือสิทธิบัตรของยานี้อยู่ ถึงกับผลิตยาได้ไม่ทันกับความต้องการในช่วงนั้น สำหรับประเทศไทย ได้มีการบังคับใช้สิทธิตามสิทธิบัตร (Compulsory Licensing, CL) สำหรับยานี้ ทำให้เราได้ยาราคาถูกลงและไม่ต้องพึ่งบริษัท Roche ในการผลิต แต่ผลเสียที่เกิดก็คือ เราถูกจับตามองจากสหรัฐอเมริกาในเรื่องการละเมิดทรัพย์สินทางปัญญา
จะเห็นได้ว่าการที่จะได้มาซึ่งยาตัวหนึ่งไม่ใช่เรื่องง่าย ต้องมีการวิเคราะห์หาสารที่จะเป็นยาก่อน ดังนั้นการวิจัยหายาจากสมุนไพรต้องได้รับการสนับสนุนแต่การวิจัยทางด้านนี้ด้านเดียว อาจไม่เพียงพอที่จะนำไปสู่ขั้นตอนการผลิตได้ จากตัวอย่างที่กล่าวมาเราจะเห็นว่า การที่จะนำยาไปใช้รักษาโรคได้จริงและมีในปริมาณที่เพียงพอต่อความต้องการ จำเป็นจะต้องมีการสังเคราะห์สารขึ้นมาด้วย ปัญหาก็คือปัจจุบันมีนักวิจัยไทยที่ทำงานทางด้านนี้น้อยมากๆ (ผู้เขียนประมาณว่าทั้งประเทศเรามีจำนวนไม่เกิน เลข 2 หลัก) ซึ่งอาจเป็นเพราะการทำงานวิจัยทางด้านนี้เป็นเรื่องที่ท้าทายความสามารถเป็นอย่างยิ่ง การสังเคราะห์สารที่มีโครงสร้างใหม่ขนาดใกล้เคียงกับโอเซลทามิเวียร์ อาจต้องใช้เวลานานถึง 5 ปี ถ้าขนาดใกล้เคียงกับแท็กซอลอาจใช้เวลามากกว่า 10 ปี และจะต้องใช้เงินในการวิจัยหลายล้านบาท แน่นอนว่ามันไม่ใช่งานวิจัยในอุดมคติของนักวิจัยไทย ที่ส่วนมากได้รับงบวิจัยน้อยและต้องส่งผลงานในระยะเวลาอันสั้น ยิ่งไปกว่านั้นการลงทุนตั้งบริษัทยา ต้องใช้เงินเป็นหมื่นเป็นแสนล้านบาท ซึ่งคงเป็นเรื่องยากที่จะมีเอกชนไทยมาลงทุน ความเป็นไปได้ที่เราจะผลิตยาได้เองและถือสิทธิบัตรเองเป็นเรื่องยากมาก ณ ตอนนี้ แต่ก็ไม่ใช่ว่าจะเป็นไปไม่ได้ หากได้รับการสนับสนุนจากรัฐบาลอย่างจริงจัง การแก้ปัญหาระยะยาวเกี่ยวกับยาที่นำเข้ามีราคาแพงไม่ใช่การทำ CL แต่เป็นการพัฒนาเทคโนโลยีทางด้านนี้ขึ้นมาเอง แน่นอนว่ายาที่เราผลิตได้อาจไม่ใช่ยาที่เราต้องการทำ CL แต่รายได้จากยาตัวนี้น่าจะช่วยลด ‘การขาดดุลทางยา’ ที่เป็นอยู่ในขณะนี้ได้ นอกจากนี้การที่เราผลิตยาได้เองจริงๆ ยังจะเป็นการแสดงถึงศักยภาพของประเทศไทย ในการผลิตและส่งออกสินค้าเทคโนโลยี ไม่ใช่เป็นแค่เพียงผู้บริโภคเทคโนโลยีอยู่อย่างเดียว
ในความเป็นจริงการสังเคราะห์ของวูดเวิร์ดเป็นแบบ formal synthesis เท่านั้น ไม่ใช่ total synthesis (สังเคราะห์เองหมด) อย่างชื่อเรื่องที่ตีพิมพ์หรืออย่างที่นักเคมีหลายคนเข้าใจ เนื่องจากวูดเวิร์ดสังเคราะห์สารจนถึงควิโนท็อกซิน (quinotoxine) เท่านั้น แล้วไม่ได้สังเคราะห์ต่อเองจนเสร็จแต่อาศัยรายงานวิจัยในปี ค.ศ. 1918 จองนักเคมีชาวเยอรมันชื่อ เพาล์ ราเบอ (Paul Rabe) และ คาร์ล คินด์เลอร์ (Karl Kindler) ที่ได้เปลี่ยนควิโนท็อกซิน ซึ่งเตรียมมาจากควินินกลับไปเป็นควินินเหมือนเดิม วูดเวิร์ดได้เขียนรายงานการสังเคราะห์สารผลิตภัณฑ์ธรรมชาติที่มีโครงสร้างซับซ้อนออกมาอีกหลายตัว และผลจากความสำเร็จในการสังเคราะห์สารเหล่านั้น ทำให้เขาได้รับรางวัลโนเบลในปี ค.ศ. 1965
บทความนี้เป็นส่วนหนึ่งของนิตยสาร สสวท. ปีที่ 41 ฉบับที่ 180 มกราคม - กุมภาพันธ์ 2556
ผู้อ่านสามารถติดตามบทความที่น่าสนใจเพิ่มเติมได้ที่ https://emagazine.ipst.ac.th/
บรรณานุกรม
ASTV manager newspaper. (Online), 19/8/2011.
Goodman, J.& Wash, V.(2001). The Story of Taxol: Nature and Politics in the Pursuit of an Anti-Cancer Drug. Cambridge University Press.
Kim, C. U.,Lew, w.,Williams, M. A.,Liu, H. Zhang, L. Swaminathan, s. Bischof-berger, N.,Chen, M. S.,Mendel, D. B.,Tai, C. Y..Laver, W. G. & Stevens,R. C. (1997) Influenza Neuraminidase Inhibitors Possessing a Novel Hy-
drophobic Interaction in the Enzyme Active Site: Design, Synthesis, and Structural Analysis of Carbocyclic Sialic Acid Analogues with Potent Anti-Influenza Activity Journal of The American Chemical Society.,119, 681-690.
Rabe, p. & Kindler, K. (1918) Uber die partielle Synthese des Chinins. Zur Kenntnis der China-Alkaloide XIX Chemiscse Berichte., 51, 466-467.
Woodword, R. B., Doering, W. E. 1945, The Total Synthesis of Quinine Journal of The American Chemical Society. 66, 849-849; Journal of The American Chemical Society. 1945, 67, 860-874.
-
คำที่เกี่ยวข้อง



