ปริมาณสารสัมพันธ์

บทเรียนที่ 1 ระบบและสิ่งแวดล้อม
ระบบกับสิ่งแวดล้อม
ระบบ คือ สิ่งต่าง ๆ ที่อยู่ภายในขอบเขตที่กำลังศึกษา ส่วนที่อยู่รอบ ๆ ระบบเรียกว่า สิ่งแวดล้อม
ระบบแบ่งออกเป็น 3 ชนิด คือ
1. ระบบปิด (closed system) คือ ระบบที่มีการแลกเปลี่ยนหรือถ่ายโอนพลังงานกับสิ่งแวดล้อมได้ แต่ถ่ายโอนหรือแลกเปลี่ยนมวลกับสิ่งแวดล้อมไม่ได้ หรือมวลของระบบคงที่เมื่อเกิดการเปลี่ยนแปลง เช่น การต้มน้ำในภาชนะปิดบนเตาไฟ ระบบคือภาชนะที่มีน้ำบรรจุอยู่ภายใน ส่วนเตาไฟและอากาศที่ล้อมรอบทั้งหมดเป็นสิ่งแวดล้อม ระบบจะรับความร้อนจากเตาไฟแล้วกลายเป็นไอคายพลังงานให้กับสิ่งแวดล้อม (มีการแลกเปลี่ยนหรือถ่ายโอนพลังงาน) เมื่อชั่งน้ำหนักของภาชนะที่บรรจุน้ำก่อนการต้มและหลังการต้มในภาชนะปิดจะเท่ากัน (มวลของระบบคงที่)
2. ระบบเปิด (open system) คือ ระบบที่มีการแลกเปลี่ยนหรือถ่ายโอนทั้งพลังงานและมวลให้กับสิ่งแวดล้อม หรือมวลของระบบไม่คงที่เมื่อเกิดการเปลี่ยนแปลง เช่น การต้มน้ำในภาชนะเปิดบนเตาไฟ ระบบคือ ภาชนะเปิดที่มีน้ำบรรจุอยู่เตาไฟและอากาศที่ล้อมรอบทั้งหมดคือสิ่งแวดล้อม ระบบที่มีการรับความร้อนจากเตาไฟและคายความร้อนให้กับสิ่งแวดล้อม(มีการแลกเปลี่ยนหรือถ่ายโอนพลังงาน) เมื่อชั่งน้ำหนักของภาชนะกับน้ำก่อนการต้มและหลังการต้มจะไม่เท่ากัน (มวลของระบบไม่คงที่)
3. ระบบโดดเดี่ยว (แยกตัวหรือเอกเทศ) คือ ระบบที่ไม่เกิดการแลกเปลี่ยนพลังงานหรือมวลสารกับสิ่งแวดล้อม เช่นน้ำร้อนในกระติกน้ำร้อน
กลับไปที่เนื้อหา
บทเรียนที่ 2 มวลอะตอมและมวลอะตอมเฉลี่ย
มวลอะตอมของธาตุและมวลของธาตุ 1 อะตอม
เนื่องจากอะตอมมีขนาดเล็กมากและมีมวลน้อยมากจนไม่สามารถชั่งได้ ดังนั้นเมื่อต้องการทราบมวลอะตอมของธาตุใดจึงใช้วิธีการเปรียบเทียบ โดยพิจารณาว่าอะตอมของธาตุหนึ่งมีมวลน้อยกว่าหรือมากกว่าอะตอมของอีกธาตุหนึ่งซึ่งเป็นตัวมาตรฐานกี่เท่า มวลของอะตอมที่ได้จากการเปรียบเทียบนี้เรียกว่า มวลอะตอมของธาตุ ดอลตันเสนอให้ใช้ไฮโดรเจนเป็นมาตรฐาน เพราะไฮโรเจนเป็นธาตุที่เบาที่สุดคือ 1 อะตอมมีมวลประมาณเท่ากับ 1.66 x 10-24 g และกำหนดให้ไฮโดรเจน 1 อะตอมซึ่งมีมวลประมาณ 1.66 x 10-24 g มีมวลเป็น 1 หน่วย หรือ 1 amu
.. . มวลอะตอมของธาตุ = มวลของธาตุ 1 อะตอม
มวลของไฮโดรเจน 1 อะตอม
กรณีนี้มวลอะตอมของธาตุคือตัวเลขที่แสดงให้ทราบว่าธาตุใดๆ 1 อะตอมมีมวลเป็นกี่เท่าของมวลไฮโดรเจน 1 อะตอม เช่น แคลเซียม (Ca) มีมวลอะตอม 40 หมายความว่า แคลเซียม 1 อะตอม มีมวลเป็น 40 เท่าของมวลของไฮโดรเจน 1 อะตอม
ต่อมานักเคมีชาวเบลเยียม ชื่อ J.S.Stas ได้ใช้ออกซิเจนเป็นมาตรฐานในการเปรียบเทียบ เนื่องจากออกซิเจน 1 อะตอมมีมวล 16 หน่วย หรือ 16 เท่าของไฮโดรเจน 1 อะตอม แต่มาตรฐานต้องมีมวล 1 หน่วยดังนั้นเขียนเป็นความสัมพันธ์ได้ดังนี้
มวลอะตอมของธาตุ = มวลของธาตุ 1 อะตอม
1/16 มวลของออกซิเจน 1 อะตอม
กรณีนี้ มวลอะตอมคือตัวเลขที่แสดงให้ทราบว่าธาตุใดๆ 1 อะตอมมีมวลเป็นกี่เท่าของ1/16 มวลของออกซิเจน 1 อะตอม เช่น แคลเซียมมีมวลอะตอม 40 หมายความว่า แคลเซียม 1 อะตอมมีมวลเป็น 40 เท่าของ 1/16 มวลของออกซิเจน 1 อะตอม
ในปี ค.ศ. 1961 นักวิทยาศาสตร์ได้ตกลงให้ใช้ C – 12 หรือ 12C ซึ่งเป็นไอโซโทปที่มีปริมาณมากที่สุดในธรรมชาติของคาร์บอนเป็นมาตรฐาน โดยกำหนดให้ C – 12 มีมวลเท่ากับ 12 หน่วย หรือ 12 amu. 1 หน่วยมาตรฐานจึงมีค่าเท่ากับ 1/12 มวลของ C – 12 , 1 อะตอม ดังนั้นมวลอะตอมของธาตุในปัจจุบันเขียนเป็นความสัมพันธ์ได้ดังนี้
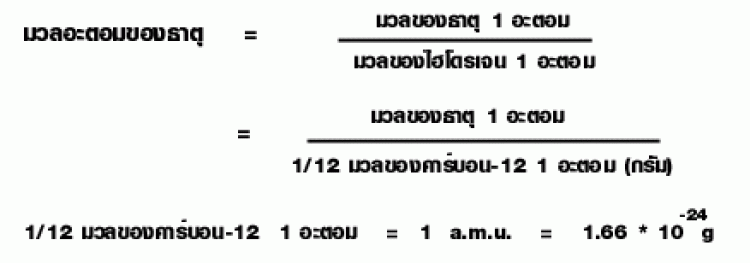
มวลอะตอมจึงเป็นเพียงตัวเลข (ไม่มีหน่วย) ที่บอกให้ทราบว่า ธาตุใดๆ 1 อะตอม มีมวลเป็นกี่เท่าของ 1/12 มวลของ C – 12 , 1 อะตอม เนื่องจาก 1/12 มวลของ C – 12 , 1 อะตอม = 1.66 x 10-24 กรัม หรือ 1 amu. = 1.66 x 10-24 กรัม ดังนั้น
หรือ มวลของธาตุ 1 อะตอม = มวลอะตอมของธาตุ x 1.66 x 10-24 กรัม
ข้อสังเกต มวลอะตอมเป็นตัวเลขที่ไม่มีหน่วย ส่วนมวลของธาตุ 1 อะตอมมีหน่วย
(กรัมหรือกิโลกรัม) เพราะมวลของธาตุ 1 อะตอมเป็นมวลที่แท้จริง
การคำนวณหามวลอะตอมจากปฏิกิริยาเคมีของธาตุ
ถ้าธาตุตั้งแต่ 2 ชนิดขึ้นไปทำปฏิกิริยากันแล้วได้สารประกอบเพียงชนิดเดียว ถ้าทราบมวลของธาตุที่ทำปฏิกิริยาพอดีกัน และทราบมวลอะตอมของธาตุหนึ่งสามารถคำนวณมวลอะตอมของธาตุอื่นๆได้
กำหนดให้ aA + bB + cC ------------ > AaBbCc
ถ้า WA , WB และ WC คือมวลของ A , B และ C ที่ทำปฏิกิริยากันพอดี
MA , MB และ MC คือมวลอะตอมของ A , B และ C ตามลำดับ
a , b และ c คือตัวเลขที่แสดงจำนวนอะตอมของ A , B และ C ที่ทำปฏิกิริยากันเป็นสารประกอบเช่นเมื่อทราบมวลอะตอมของธาตุ B สามารถคำนวณหามวลอะตอมของธาตุอื่นๆได้ดังนี้
ก. ถ้าทราบมวลอะตอมของธาตุ B คำนวณหามวลอะตอมของธาตุ C โดยใช้สูตรดังนี้
WC = MC x c
WB MB b
ข. ถ้าทราบมวลอะตอมของธาตุ B คำนวณหามวลอะตอมของธาตุ A โดยใช้สูตรดังนี้
WA = MA x a
WB MB b
ตัวอย่างที่ 1 ธาตุ X หนัก 17.73 กรัม ทำปฏิกิริยาเคมีกับออกซิเจนเกิดออกไซด์ XO 25.73 กรัม
มวลอะตอมของ X เป็นเท่าใด
วิธีทำ
WX = MX x 1
WO MO 1
WX = 17.73 กรัม
WO = 25.73 – 17.73 = 8 กรัม
MO = 16
แทนค่าในสูตร
17.73 = MX
8 16
MX = 17.73 x 16 = 35.46
8
ดังนั้นมวลอะตอมของธาตุ X = 35.46
ตัวอย่างที่ 2 นักเรียนผู้หนึ่งนำ XCl2 22.2 กรัม มาแยกออกเป็นโลหะ X และแก๊สคลอรีนด้วยวิธี
ทางไฟฟ้ามวลของโลหะ X ที่ได้เท่ากับ 8 กรัม ถ้ามวลอะตอมของคลอรีน = 35.5
มวลอะตอมของโลหะ X เป็นเท่าใด
วิธีทำ WX = MX x 1
WCl MCl 2
WX = 8 กรัม
WCl = 22.2 – 8 = 14.2 กรัม
MCl = 35.5
แทนค่าในสูตร
8 = MX x 1
14.2 35.5 2
MX = 8 x 35.5 x 2 = 40
14.2
ดังนั้นมวลอะตอมของโลหะ X = 40
ตัวอย่างที่ 3 ทังสเตนมีมวลอะตอม 183.84 amu จงหาน้ำหนักเป็นกรัมของทังสเตน 25 อะตอม
วิธีทำ
ทังสเตน 1 อะตอม มีมวล = 183.84 amu
ทังสเตน 25 อะตอม มีมวล = 183.84 x 25 amu
= 4.596 x 103 amu
เปลี่ยน amu เป็น g
มวล 1 amu = 1.66 x 10-24 g
ถ้ามวล 4.596 x 103 amu = 7.629 x 10-21 g
ดังนั้น ทังสเตน 25 อะตอม มีมวล 7.629 x 10-21 g
4.1.2 การหามวลอะตอมเฉลี่ยของธาตุ
เนื่องจากธาตุส่วนใหญ่ในธรรมชาติมีมากกว่าหนึ่งไอโซโทป แต่ละไอโซโทปมีมวลและปริมาณไม่เท่ากันดังนั้นการที่จะพิจารณาว่าธาตุแต่ละชนิดมีมวลอะตอมเท่าใดจึงต้องใช้ค่ามวลอะตอมเฉลี่ย หรือเรียกสั้นๆว่ามวลอะตอม
การคำนวณหามวลอะตอมเฉลี่ยของธาตุ
สามารถคำนวณได้ 2 วิธีคือ
1.ใช้วิธีเทียบเป็นขั้นๆ
2. ใช้สูตร
คำนวณหา
- มวลอะตอมเฉลี่ย
- มวลของไอโซโทปหนึ่ง
- เปอร์เซ็นต์ของไอโซโทปในธรรมชาติ
ตัวอย่างที่ 1 ออกซิเจนในธรรมชาติประกอบด้วย 3 ไอโซโทป คือ 168O (99.759%)
มีมวล = 15.9949 178O (0.037%) มีมวล = 16.9991 188O มีมวล = 17.9991
ตามลำดับ จงคำนวณหามวลอะตอมเฉลี่ยของออกซิเจน
วิธีทำ
= (15.9949 x 99.759) + (16.9991 x 0 .037) + (17.9991 x 0.204)
100 100 100
= 15.9994
ตัวอย่างที่ 2 คาร์บอนมีไอโซโทป 2 ชนิด คือ 12C และ 13C มีค่ามวลอะตอมเฉลี่ย 12.01113
12C มีในธรรมชาติ 98.89 % มีมวลอะตอม 12.00 13C มีในธรรมชาติ 1.11%
จงคำนวณหามวลอะตอมของ 13C
วิธีทำ สมมติให้มวลอะตอมของ 13C = X
จากสูตร
12.01113 = (12.000 x 98.89 ) + (X x 1.11)
100 100
12.01113 = 11.8668 + 0.0111X
0.0111X = 12.01113 – 11.8668 = 0.14433
X = 13.003
ดังนั้นมวลอะตอมของ 13C = 13.003
ตัวอย่างที่ 3 ธาตุคลอรีนในธรรมชาติมี 2 ไอโซโทป คือ 35Cl และ 37Cl มีมวลเท่ากับ 34.969 amu.
และ 36.956 amu. ตามลำดับ และมีมวลอะตอมเฉลี่ย = 35.45 จงคำนวณหาว่ามี 35Cl
และ 37Cl อย่างละกี่เปอร์เซ็นต์ในธรรมชาติ
วิธีทำ สมมติให้มี 35Cl ในธรรมชาติ = X %
มี 37Cl ในธรรมชาติ = 100 – X %
จากสูตร
35.45 = (34.969 x X) + (36.956 x 100-X)
100 100
= 0.34969X + 36.956 – 0.36956X
0.36956X – 0.34969X = 36.956 – 35.45
0.01987X = 1.506
X = 75.79%
ดังนั้นมี 35Cl ในธรรมชาติ = 75.79 %
มี 37Cl ในธรรมชาติ = 100 – 75.79 = 24.21%
กลับไปที่เนื้อหา
บทเรียนที่ 3 โมล
โมล เป็นหน่วยบอกจำนวนอนุภาคของสาร ซึ่งหมายถึงปริมาณของสารที่มีจำนวนอนุภาคเท่ากับจำนวนอะตอมของคาร์บอน-12 ที่มีมวล 12 กรัม เราทราบแล้วว่าคาร์บอน-12 จำนวน 1 อะตอม มีมวล 12.00 * 1.66 * 10-24 กรัม
ดังนั้น เราสามารถคำนวณหาจำนวนอะตอมของคาร์บอน-12 ที่มีมวล 12 กรัมได้ โดยสมมุติให้คาร์บอน 12 กรัมมีจำนวนอนุภาคเท่ากับ a อะตอม เมื่อเขียนในรูปอัตราส่วนที่เท่ากับอัตราส่วนแรกจะเป็นดังนี้
แสดงว่าคาร์บอน-12 ที่มีมวล 12 กรัม ประกอบด้วยอะตอมของคาร์บอน 6.024096 * 1023 อะตอม จำนวน 6.02 * 1023 นี้เรียกว่า เลขอาโวกาโดร และกำหนดให้สารที่มีจำนวนอนุภาคเท่ากับเลขอาโวกาโดร คิดเป็นปริมาณ 1 โมล ดังนั้น
สาร 1 โมลมี 6.02 * 1023 อนุภาค
สาร 2 โมลมี 2 * 6.02 * 1023 อนุภาค
สาร 0.5 โมลมี 0.5 * 6.02 * 1023 อนุภาค
![]()
การบอกปริมาณของสารเป็นโมล จะทำให้ทราบจำนวนอนุภาคของสารนั้นได้ ปริมาณของสารในหน่วยโมลมีความสัมพันธ์กับปริมาณอื่นๆดังนี้
1. จำนวนโมลของสาร
กลับไปที่เนื้อหา
ร้อยละความเข้มข้น
1.1 ร้อยละโดยมวล (percent mass by mass)
เป็นอัตราส่วนของมวลของตัวถูกละลายต่อมวลของสารละลาย ซึ่งคูณด้วย 100 มีสูตรเป็นดังนี้
![]()
ความเข้มข้นร้อยละโดยมวลจะไม่มีหน่วย เพราะเป็นอัตราส่วนของปริมาณที่หน่วยเหมือนกัน
1.2 ร้อยละโดยมวลต่อปริมาตร (percent mass by volume)
เป็นอัตราส่วนของมวลของตัวถูกละลายต่อปริมาตรของสารละลาย ซึ่งคูณด้วย 100 มีสูตรเป็นดังนี้

1.3 ร้อยละโดยปริมาตรต่อปริมาตร (percent volume by volume)
เป็นอัตราส่วนของปริมาตรของตัวถูกละลายต่อปริมาตรของสารละลาย ซึ่งคูณด้วย 100 มีสูตรเป็นดังนี้

ตัวอย่าง เมื่อนำโพแทสเซียมคลอไรด์ (KCl) 0.892 g ละลายในน้ำ 54.6 g จงคำนวณหาร้อยละโดยมวลของโพแทสเซียมคลอไรด์ในสารละลาย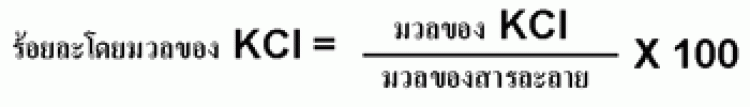
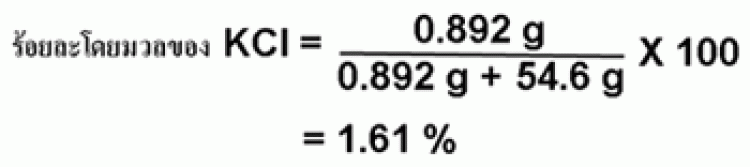
เพราะฉะนั้น เมื่อละลายโพแทสเซียมคลอไรด์ 0.892 g ในน้ำ 54.6 g สารละลายจะมีความเข้มข้นของโพแทสเซียมคลอไรด์ 1.61 % โดยมวล
กลับไปที่เนื้อหา
เศษส่วนโมล (mole fraction : X)
เป็นอัตราส่วนของจำนวนโมลขององค์ประกอบแต่ละชนิดที่อยู่ในสารละลาย จะเขียนแทนด้วยสัญลักษณ์ X เพราะฉะนั้น ถ้าจะคำนวณหาเศษส่วนโมลของสาร A ในสารละลาย สามารถเขียนได้ดังนี้

ความเข้มข้นในหน่วยเศษส่วนโมลจะไม่มีหน่วย เพราะเป็นอัตราส่วนของหน่วยปริมาณที่เหมือนกัน
ตัวอย่าง ที่อุณภูมิ 25 oC เมื่อนำเอทานอล (CH3CH2OH) 10.0 g ละลายในน้ำ 200 mL จงคำนวณหาเศษส่วนโมลของเอทานอลในสารละลาย
วิธีทำ ความหนาแน่นของน้ำที่อุณภูมิ 25 oC เท่ากับ 1 g/mL
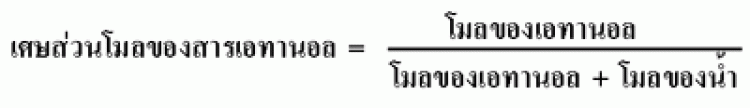
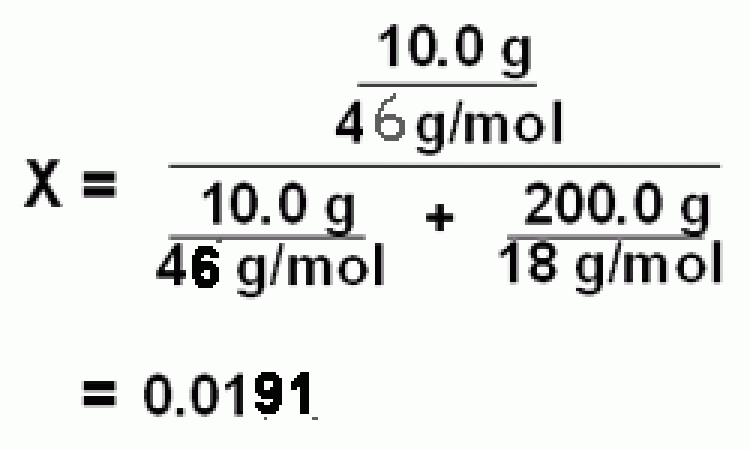
เพราะฉะนั้น เมื่อละลายเอทานอล จำนวน 10.0 g ละลายในน้ำ 200 mL สารละลายจะมีเศษส่วนโมลของเอทานอล
เท่ากับ 0.0191
โมลาริตี (molarity : M)
โมลาริตี หรือ โมลาร์ เป็นหน่วยความเข้มข้น ที่เป็นอัตราส่วนของจำนวนโมลของตัวถูกละลายที่อยู่ในสารละลาย ปริมาตร 1 ลิตร (L) จะเขียนแทนด้วยสัญลักษณ์ M สามารถเขียนเป็นสูตรได้ดังนี้
โมลาร์ มีหน่วยเป็น mol / L
ปริมาตรของสารละลาย โดยทั่วไปจะบอกเป็นหน่วยมิลลิลิตร (mL) ดังนั้น ความสัมพันธ์หน่วยของปริมาตร ระหว่าง มิลลิลิตร กับ ลิตร
เป็นดังนี้
1 L มีค่าเท่ากับ 1000 mL
ตัวอย่าง จงคำนวณหาโมลาร์ของกรดซัลฟิวริก (H2SO4) จำนวน 24.4 g ที่ละลายในน้ำ 250 mL
วิธีทำ
จำนวนโมลของกรดซัลฟิวริก 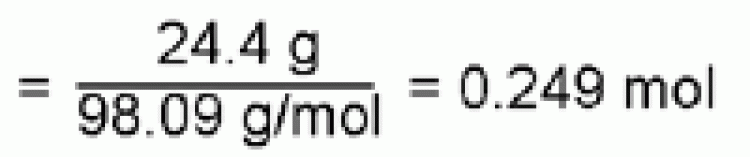
ในน้ำปริมาตร 250 mL มีกรดซัลฟิวริกอยู่ 0.249 mol
ดังนั้น ในน้ำปริมาตร 1000 mL จะมีกรดซัลฟิวริกอยู่ =
เมื่อนำกรดซัลฟิวริก (H2SO4) จำนวน 24.4 g ที่ละลายน้ำ 250 mL จะมีความเข้มข้น เท่ากับ 0.996 mol/L หรือ 0.996 M
โมแลลิตี (molality : m) โมแลลิตี หรือ โมแลล เป็นหน่วยความเข้มข้น ที่เป็นอัตราส่วนของจำนวนโมลของตัวถูกละลายต่อมวลของตัวทำละลายใน 1 กิโลกรัม (kg) จะเขียนแทนด้วยสัญลักษณ์ m สามารถเขียนเป็นสูตรได้ดังนี้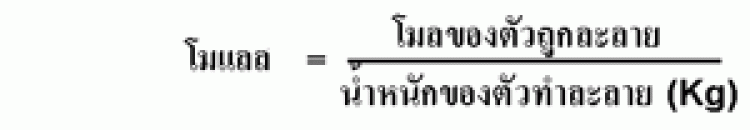
กลับไปที่เนื้อหา
บทเรียนที่ 6 การเตรียมสารละลาย
ในการเตรียมสารละลายต่าง ๆ ที่มีความเข้มข้นตามที่ต้องการสามารถทำได้หลายวิธี เช่น
1. การเตรียมสารละลายจากสารบริสุทธิ์
2. การเตรียมสารละลายจากสารละลายเข้มข้น
1. การเตรียมสารละลายจากสารบริสุทธิ์ ทำได้โดยละลายสารบริสุทธิ์ตามปริมาณที่ต้องการในตัวทำละลายปริมาณเล็กน้อย แล้วปรับ ปริมาตรของสารละลายให้ได้ตามที่ต้องการเตรียม ถ้าต้องการเตรียมเป็นหน่วยโมลต่อลูกบาศก์เดซิเมตร มีลำดับขั้นในการเตรียมดังนี้
ขั้นที่ 1 คำนวณหาปริมาณตัวละลายเป็นกรัม ตามที่ต้องการ
ขั้นที่ 2 ชั่งสารตามจำนวนที่ต้องการซึ่งคำนวณได้ตามขั้นที่ 1 (ถ้าเป็นของแข็ง) แต่ถ้าเป็นของเหลวอาจคำนวณหาปริมาตรแล้วใช้วิธีตวงปริมาตรก็ได้ ในการชั่งสารต้องใช้เครื่องชั่งอย่างละเอียด คือ อาจจะต้องใช้เครื่องชั่งที่ชั่งสารได้ถึงทศนิยมตำแหน่งที่ 4 ของกรัม หรือใช้เครื่องชั่งไฟฟ้า
ขั้นที่ 3 นำสารที่ชั่งได้ เทใส่ขวดวัดปริมาตรซึ่งมีขนาดเท่ากับปริมาตรของสารละลายที่ต้องการเตรียม เติมน้ำกลั่นในจำนวนพอที่ละลายสารหมด หรือก่อนเทสารเติมน้ำกลั่นจำนวนหนึ่งซึ่งพอที่จะละลายสารหมดแต่น้อยกว่าปริมาตรของสารละลายลงไปก่อน เขย่าให้สารละลายหมดแล้วเติมน้ำกลั่นลงในขวดวัดปริมาตรจนถึงขีดบอกปริมาตร ปิดจุกเขย่าให้ผสมเป็นเนื้อเดียว ก็จะได้สารละลายที่มีความเข้มข้นและปริมาตรตามที่ต้องการ
ขั้นที่ 4 เก็บสารละลายที่ได้ใส่ขวดที่เหมาะสม ปิดฝาขวดและปิดฉลากบอกชื่อสาร สูตรของสาร ความเข้มข้น และวันที่เตรียมสาร
หมายเหตุ ถ้าตัวถูกละลายเป็นของเหลวให้ชั่งหรือตวงปริมาตรตามที่ต้องการ เทใส่ขวดวัดปริมาตรใช้น้ำกลั่นล้างภาชนะที่ใส่ตัวละลาย หลาย ๆ ครั้งเทใส่ขวดวัดปริมาตร แล้วเติมน้ำกลั่นจนถึงขีดบอกปริมาตรก็จะได้สารละลายตามที่ต้องการ
ตัวอย่าง การเตรียมสารละลายโดยการละลายในน้ำ เช่น เมื่อต้องการเตรียมสารละลาย NaCl 0.1 mol/dm3 จำนวน 500 cm3 มีวิธีการดังนี้
วิธีทำ
ขั้นที่ 1 คำนวณหามวลของ NaCl ในสารละลาย 500 cm3
สารละลาย NaCl 1000 cm3 มีเนื้อ NaCl = 0.1 mol
สารละลาย NaCl 500 cm3 มีเนื้อ NaCl= (0.1 x 500) / 1000
= 0.05 mol
หามวลของ NaCl 0.05 mol
วิธีทำ สูตร จำนวนโมล = มวลสาร / มวลโมเลกุล
จากโจทย์ NaCl มีมวลสูตร (มวลโมเลกุล) = 23 + 35.5 = 58.5
ดังนั้น มวลสาร = 0.05 X 58.5
= 2.925 g
ดังนั้น จะต้องใช้ NaCl = 2.925 g
ขั้นที่ 2 ชั่ง NaCl ให้ได้ 2.925 g โดยใช้เครื่องชั่งที่ชั่งได้ทศนิยม 3 ตำแหน่ง
ขั้นที่ 3 เติมน้ำกลั่นลงในขวดวัดปริมาตรขนาด 500 cm3 จำนวนหนึ่งซึ่งน้อยกว่า 500 cm3 แต่สามารถละลาย NaCl 2.925 g ได้หมดแล้วเท NaCl 2.925 g ลงในขวดวัดปริมาตรหรือเท NaCl ลงในขวดวัดปริมาตรก่อนแล้วเติมน้ำกลั่นในจำนวนที่ละลาย NaCl 2.925 g ได้หมด เขย่าให้ NaCl ละลายจนหมดแล้วเติมน้ำกลั่นลงในขวดวัดปริมาตรจนถึงขีดบอกปริมาตร ปิดจุดเขย่าก็จะได้สารละลายตามที่ต้องการ
ขั้นที่ 4 ถ่ายสารละลาย NaCl ที่เตรียมเสร็จแล้วใส่ขวดที่เหมาะสม ปิดฝาขวด และปิดฉลากบอกชื่อสาร สูตร ของสาร ความเข้มข้นของสารละลาย และวันที่เตรียม
2. การเตรียมสารละลายจากสารละลายเข้มข้น เป็นการเตรียมสารละลายโดยใช้สารละลายเดิมซึ่งมีความเข้มข้นมากกว่าสารละลายที่จะเตรียม มาเติมน้ำให้เจือจางลงจนมีความเข้มข้นตามที่ต้องการในการทำให้สารละลายเข้มข้นเจือจางลงนั้น ความเข้มข้นของสารละลายจะถูกต้องเพียงใด ขึ้นอยู่กับการวัดปริมาตร อุปกรณ์ที่นิยมใช้วัดปริมาตรของสารละลายเดิม คือ ปิเปตต์ หรือกระบอกตวง ส่วนอุปกรณ์ที่ใช้วัดปริมาตรของสารละลายใหม่ คือ ขวดวัดปริมาตร อุปกรณ์วัดปริมาตรจะใช้ขนาดใดนั้นขึ้นอยู่กับปริมาตรของสารละลาย คือ จะต้องเลือกใช้ปิเปตต์หรือกระบอกตวง และขวดวัดปริมาตรที่มีปริมาตรเท่ากับปริมาตรของสารละลาย การเตรียมสารละลายโดยวิธีนี้มีลำดับขั้นการเตรียมดังนี้
ขั้นที่ 1 คำนวณหาปริมาตรของสารละลายเดิมที่จะใช้
โดยใช้สูตร M1V1 = M2V2
กำหนดให้ M1 = เป็นความเข้มข้นสารละลายก่อนเจือจาง
V1 = เป็นปริมาตรสารละลายก่อนเจือจาง
M2 = เป็นความเข้มข้นสารละลายหลังเจือจาง
V2 = เป็นปริมาตรสารละลายหลังเจือจาง
ตัวอย่าง เช่น ถ้ามีสารละลายโซเดียมไฮดรอกไซด์ (NaOH) เข้มข้น 1.0 mol/dm3 แต่ต้องการใช้สารละลายโซเดียมไฮดรอกไซด์เข้มข้น 0.1 mol/dm3 จำนวน 500 cm3 ทำได้ดังนี้
ขั้นที่ 1 คำนวณหาปริมาตรของสารละลายเดิมที่จะต้องใช้
วิธีทำ จากสูตร M1V1 = M2V2
จากโจทย์ M1 = 1.0 mol/dm3 V1 = ?
M2 = 0.1 mol/dm3 V2 = 500 cm3
แทนค่า V1 = (0.1 mol/dm3 x 500 cm3) / 1.0 mol/dm3
V1 = 50 cm3
ดังนั้น จะต้องใช้สารละลายเดิม = 50 cm3
ขั้นที่ 2 ใช้ปิเปตต์หรือกระบอกตวง ตวงสารละลาย NaOH 1.0 mol/dm3 มาจำนวน 50 cm3 แล้วถ่ายใส่ขวดวัดปริมาตรขนาด 500 cm3
ขั้นที่ 3 เติมน้ำกลั่นจนถึงขีดบอกปริมาตร 500 cm3 เขย่าก็จะได้สารละลาย NaOH 0.1 mol/dm3 จำนวน 500 cm3 ตามที่ต้องการ
ขั้นที่ 4 เก็บสารละลายไว้ในขวดที่เตรียมไว้ ปิดฝาขวด และปิดฉลากบอกชื่อสาร สูตรของสาร ความเข้มข้นของสารละลาย และวันที่เตรียม
กลับไปที่เนื้อหา
บทเรียนที่ 7 สมบัติคอลลิเกตีฟของสารละลาย
สารละลายเป็นสารเนื้อเดียวที่ได้จากการผสมสารบริสุทธ์ตั้งแต่ 2 ชนิดขึ้นไปเข้าด้วยกัน ถ้าสารที่นำมาผสมกันมีสถานะเดียวกันจะถือว่าสารที่มีปริมาณมากที่สุดเป็นตัวทำละลายส่วนสารที่มีปริมาณน้อยกว่าเป็นตัวละลาย จุดเดือดของสารละลายสูงกว่าตัวทำละลายบริสุทธิ์ และจุดหลอมเหลวของสารละลายต่ำกว่าตัวทำทำละลายบริสุทธิ์และถ้าสารละลายที่มีความเข้มข้นในหน่วยโมลต่อกิโลกรัมเท่ากัน จะมีจุดเดือดและจุดหลอมเหลวเท่ากัน โดยที่ตัวละลายจะเป็นสารใดก็ได้แต่ต้องเป็นสารที่ระเหยยากและไม่แตกตัวเป็นไอออนส่วนสารละลายที่มีความเข้มข้นต่างกัน แม้จะมีตัวทำละละายชนิดเดียวกันก็มีค่าจุดเดือดและจุดหลอมเหลวไม่เท่ากัน
สูตรเกี่ยวกับสารละลายที่มีสมบัติคอลลิเกตีฟ
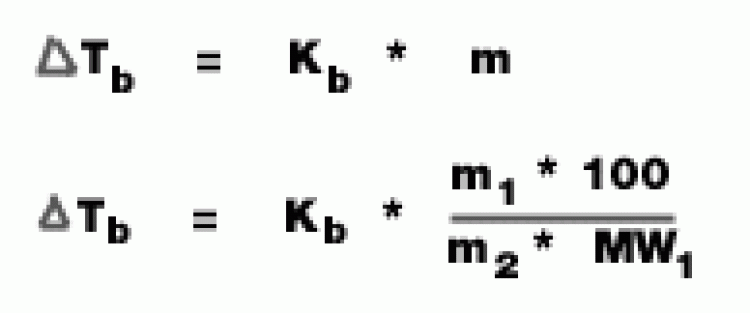
- จุดเดือด
Tb = จุดเดือดของสารละลาย - จุดเดือดของตัวทำละลาย (องศาเซลเซียส)
Kb = ค่าคงที่ของการเพิ่มขึ้นของจุดเดือดของสารละลาย (องศาเซลเซียส/mol/kg)
m = ความเข้มข้นของสารละลาย (mol/kg)
m1 = มวลตัวถูกละลาย (g)
m2 = มวลของตัวทำละลาย (g)
MW1 = มวลโมเลกุลของตัวถูกละลาย
2. จุดหลอมเหลว (หรือจุดเยือกแข็ง)
Tb = จุดเดือดของสารละลาย - จุดเดือดของตัวทำละลาย (องศาเซลเซียส)
Kb = ค่าคงที่ของการเพิ่มขึ้นของจุดเดือดของสารละลาย (องศาเซลเซียส/mol/kg)
m = ความเข้มข้นของสารละลาย (mol/kg)
m1 = มวลตัวถูกละลาย (g)
m2 = มวลของตัวทำละลาย (g)
MW1 = มวลโมเลกุลของตัวถูกละลาย
Tf = จุดเยือกแข็งของตัวทำละลาย - จุดเยือกแข็งของสารละลาย (องศาเซลเซียส)
Kf = ค่าคงที่ของการลดลงของจุดเยือกแข็งของสารละลาย (องศาเซลเซียส/mol/kg)
กลับไปที่เนื้อหา
บทเรียนที่ 8 มวลของสารในปฏิกิริยาเคมี
การเปลี่ยนแปลงของสารในปฏิกิริยาใดๆ ต้องมีการกำหนดขอบเขตการศึกษา ซึ่งมีองค์ประกอบที่สำคัญอยู่ 2 ส่วนคือ ส่วนที่อยู่ภายในขอบเขตของการศึกษาซึ่งรวมทั้งก่อนการเปลี่ยนแปลงและหลังการเปลี่ยนแปลงเรียกว่า ระบบ กับส่วนที่อยู่นอกขอบเขตที่ศึกษา เช่นภาชนะ อุปกรณ์ หรือเครื่องมือวัดต่างๆเรียกว่า สิ่งแวดล้อม เช่น การทำน้ำให้เป็นน้ำแข็ง ระบบก่อนการเปลี่ยนแปลงคือน้ำ และระบบหลังการเปลี่ยนแปลงคือน้ำแข็ง ส่วนสิ่งแวดล้อมก็คือภาชนะ ระบบมีอยู่2 ระบบดังนี้
1. ระบบปิด คือ ระบบที่ไม่มีการถ่ายเทมวลของสารระหว่างระบบกับสิ่งแวดล้อม
2. ระบบเปิด คือ ระบบที่มีการถ่ายเทมวลของสารระหว่างระบบกับสิ่งแวดล้อม
การศึกษาการเปลี่ยนแปลงของสารจำเป็นต้องระบุสมบัติต่างๆ ของระบบ เช่น มวล อุณหภูมิ ปริมาตร ความดัน ถ้าตรวจสอบได้ว่าสมบัติใดของระบบมีการเปลี่ยนแปลงก็ถือได้ว่ามีการเปลี่ยนแปลงเกิดขึ้นในระบบ สมบัติของสารและปัจจัยที่มีผลต่อสมบัติของระบบเรียกว่าภาวะของระบบ
ในปี พ.ศ. 2317 อองตวน-โลรอง ลาวัวซิเอ ได้ทดลองเผาสารในหลอดที่ปิดสนิทพบว่า มวลรวมของสารก่อนเกิดปฏิกิริยาเท่ากับมวลรวมของสารหลังทำปฏิกิริยา จึงตั้งเป็นกฎเรียกว่า กฎทรงมวล
โจเชฟ เพราสต์ ได้ศึกษาการเตรียมสารประกอบบางชนิด
พบว่าสารประกอบชนิดหนึ่งที่เตรียมด้วยวิธีการที่แตกต่างกันมีอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่งๆ จะมีค่าคงที่ จึงตั้งเป็นกฎเรียกว่า กฎสัดส่วนคงที่ ตัวอย่างเช่น สารประกอบคอปเปอร์(II)ซัลไฟด์ ( CuS ) ที่เกิดจากการรวมตัวของทองแดงและกำมะถันจะมีอัตราส่วนโดยมวลเท่ากับ2:1 เสมอ
ปริมาตรก๊าซในปฏิกิริยาเคมี
ก๊าซมีสมบัติฟุ้งกระจายและมีมวลน้อยมาก การวัดมวลโดยตรงทำได้ยากจึงนิยมวัดในหน่วยปริมาตร
ซึ่งสามารถอธิบายโดยใช้กฎดังต่อไปนี้
1. กฎของเกย์ลุสแซก
ในปี พ.ศ. 2531 โซเซฟ-ลุย-เก-ลูซัก
ได้ทดลองวัดปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่ได้จากปฏิกิริยาณ อุณหภมิและความดันเดียวกัน แล้วสรุปเป็นกฎการรวมปริมาตรของก๊าซว่า "ในปฏิกิริยาเคมีที่เป็นก๊าซ อัตราส่วนโดยปริมาตรของก๊าซที่ทำปฏิกิริยาพอดีกันและปริมาตรของก๊าซที่เกิดจากปฏิกิริยาที่อุณหภูมิและความดันเดียวกัน จะเป็นเลขจำนวนเต็มลงตัวน้อย ๆ"
2. กฎอาโวกาโดร
ในปี พ.ศ. 2354 อาเมเดโอ อาโวกาโดร ได้ศึกษากฎของเกย์-ลูสแซกและอธิบายว่าการที่อัตราส่วนโดยปริมาตรของก๊าซที่เข้าทำปฎิกิริยาและที่ได้จากปฏิกิริยาเป็นเลขจำนวนเต็มน้อยๆคงเป็นเพราะปริมาตรของก๊าซมีความสัมพันธ์กับจำนวนอนุภาคที่รวมตัวกันเป็นสารประกอบ อาโวกาโดรจึงเสนอสมสุติฐานว่า"ที่อุณหภูมิและความดันเดียวกัน ก๊าซทุกชนิดที่มีปริมาตรเท่ากันจะมีจำนวนโมเลกุลเท่ากัน"เช่น ปฏิกิริยาระหว่างก๊าซไฮโดรเจนกับก๊าซออกซิเจนจนเกิดเป็นไอน้ำ
ไฮโดรเจน + ออกซิเจน -------> ไอน้ำ
2 โมเลกุล
หรือ 1 โมเลกุล
หรือ 2 อะตอม
หมายเหตุ
อัตราส่วนโดยปริมาตรของก๊าซต่าง ๆ ในปฏิกิริยาจะเท่ากับอัตราส่วนโดยโมลของก๊าซต่าง ๆ
ในปฏิกิริยาเดียวกันนั้น เช่น
2 cm3 1 cm3 2 cm3
2n โมเลกุล
n โมเลกุล 2n โมเลกุล 1 โมเลกุล 2 โมเลกุล 1/2 โมเลกุล 1 โมเลกุล 1 อะตอม 2 อะตอม N2(g) + 3H2(g) ------> 2NH3(g)
ความสัมพันธ์ระหว่างปริมาณของสารในสมการเคมี
สำหรับปฏิกิริยาที่เป็นก๊าซล้วน ๆ สามารถใช้สัมประสิทธิ์ของก๊าซต่าง ๆ ในสมการ มาอ่านเป็นปริมาตรได้ แต่ต้องที่อุณหภูมิและความดันเดียวกัน
N2(g) + 3H2(g) ------> 2NH3(g) ที่อุณหภูมิ และความดันเดียวกัน
ปริมาตร (หน่วยปริมาตร) 1 3 2
การคำนวณเกี่ยวกับสมการเคมี มีหลักทั่วไปดังนี้
1. ต้องทราบสมการของปฏิกิริยาเคมีพร้อมดุล
2. พิจารณาเฉพาะสารที่โจทย์ถาม และกำหนดให้
3.แล้วนำสิ่งที่โจทย์กำหนดให้มาคิดคำนวณหาสิ่งที่ต้องการจากสมการได้โดยการเทียบบัญญัติไตรยางค์ ด้วยการใช้ความรู้เรื่องโมลหรืออาจจะคำนวณด้วยวิธีหนึ่งโดยนำจำนวนโมลของสารที่โจทย์ถามและโจทย์กำหนดให้มาเทียบอัตราส่วนกันจะเท่ากับจำนวนโมลที่เป็นสัมประสิทธิ์ของสารที่โจทย์ถามและโจทย์กำหนดให้ตามสมการ
สารกำหนดปริมาณ (Limiting Reagent) และร้อยละของผลได้ของสารผลิตภัณฑ์
สารกำหนดปริมาณ (Limiting Reagent)
สารที่เข้าทำปฏิกิริยามีปริมาณไม่พอดีกัน ปฏิกิริยาที่เกิดขึ้นจะสิ้นสุดเมื่อสารใดสารหนึ่งหมดสาร
ที่หมดก่อนจะเป็นตัวกำหนดปริมาณของผลิตภัณฑ์ของสารผลิตภัณฑ์ที่เกิดขึ้นเรียกว่าสารกำหนดปริมาณ (Limiting Reagent)
สารกำหนดปริมาณในการเกิดปฏิกิริยาเป็นการคำนวณสารจากสมการของปฏิกิริยาที่โจทย์บอกข้อมูลเกี่ยวกับสารตั้งต้นมาให้มากกว่าหนึ่งชนิด ลักษณะโจทย์มี 2 แบบ คือ
1. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด แต่ไม่บอกข้อมูลเกี่ยวกับสารผลิตภัณฑ์
ในการคำนวณต้องพิจารณาว่าสารใดถูกใช้ทำปฏิกิริยาหมด แล้วจึงใช้สารนั้นเป็นหลักในการคำนวณสิ่งที่ต้องการจากสมการได้
2. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด และบอกข้อมูลของสารผลิตภัณฑ์ชนิด
ใดชนิดหนึ่งมาให้ด้วย
ในการคำนวณให้ใช้ข้อมูลจากสารผลิตภัณฑ์เป็นเกณฑ์ในการเทียบหาสิ่งที่ต้องการจากสมการเคมี
ร้อยละของผลได้ของสารผลิตภัณฑ์
ในการคำนวณหาปริมาณของผลิตภัณฑ์จากสมการเคมีนั้น ค่าที่ได้เรียกว่า ผลได้ตามทฤษฎี
(Theoretical yield) แต่ในทางปฏิบัติจะได้ผลิตภัณฑ์น้อยกว่าตามทฤษฎี แต่จะได้มากหรือน้อยแค่ไหน ก็ขึ้นอยู่กับวิธีการและสารเคมีที่ใช้ เรียกผลที่ได้ว่านี้ ผลได้จริง (Actual yield)
สำหรับการรายงานผล การทดลองนั้น จะเปรียบเทียบค่าที่ได้ตามทฤษฎีในรูปร้อยละ
ซึ่งจะได้ความสัมพันธ์ดังนี้

อัตราส่วนโดยปริมาตร N2 : H2 : NH3 = 1 : 3 : 2
อัตราส่วนโดยโมล N2 : H2 : NH3 = 1 : 3 : 2
การหาสูตรเอมพิรีคัล
สูตรเอมพิริคัล เป็นสูตรที่แสดงอัตราส่วนอย่างต่ำของธาตุองค์ประกอบ เช่น ไฮโดรเจนเปอร์ออกไซด์มีสูตรโมเลกุลเป็น H2O2 อัตราส่วนอย่างต่ำของจำนวนอะตอม H : O เท่ากับ 1 : 1 สูตรเอมพิริคัลจึงเป็น HO กลูโคสมีสูตรโมเลกุลเป็น C6H12O6 อัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O เท่ากับ 1 : 2 : 1 สูตรเอมพิริคัลจึงเป็น CH2O
การหาสูตรเอมพิริคัล มีหลักดังนี้
1. ต้องทราบว่าสารที่จะหาสูตรเอมพิริคัลประกอบด้วยธาตุใดบ้าง
2. ต้องทราบมวลอะตอมของแต่ละธาตุในสารที่จะหาสูตรเอาพิริคัล
3. ต้องทราบมวลของแต่ละธาตุในสารที่จะหาสูตร
4. ให้ข้อมูลจากข้อ 1, 2 และ 3 หาอัตราส่วนโดยโมล ด้วยการนำมวลของแต่ละธาตุหารด้วยมวลอะตอมของมันมาเข้าอัตราส่วน
5. สำหรับการปัดจุดทศนิยมของตัวเลขในการหาอัตราส่วนโดยโมล โดยทำตัวเลขใดตัวเลขหนึ่ง ให้เป็น 1 แล้วจึงปัดจุดทศนิยมด้วยวิธีปัด 0.1 - 0.2 ทิ้ง ถ้าเป็น 0.8 - 0.9 ปัดขึ้นอีก 1 ถ้าเป็น 0.0 - 0.7
ปัดไม่ได้ต้องหาตัวเลขที่ต่ำที่สุดมาคูณตัวเลขของอัตราส่วนโดยโมลให้มีค่าใกล้กับที่จะปัดจุดทศนิยมได้ แล้วปัดจุดทศนิยมตัวเลขให้เป็นจำนวนเต็ม อนึ่งการปัดจุดทศนิยม ถ้าตัวเลขปัดจุดทศนิยมไม่ได้
ตัวเลขทุกตัวของอัตราส่วนโดยโมลนั้นก็จะไม่ปัดจุดทศนิยม หาตัวเลข มาคูณให้ได้ตัวเลขที่จะปัดจุดทศนิยมได้อัตราส่วนโดยโมลที่เป็นจำนวนเต็มได้สูตรเอมพิริคัล
การหาสูตรโมเลกุลของสารทั่วไป
สูตรโมเลกุลเป็นสูตรที่แสดงจำนวนอะตอมของธาตุองค์ประกอบที่มีอยู่ใน 1 โมเลกุลของสาร เช่น
ไฮโดรเจนมีสูตรโมเลกุลเป็น H2 แสดงว่า 1 โมเลกุลประกอบด้วยไฮโดรเจน 2 อะตอม ไฮโดรเจนเปอร์ออกไซด์มีสูตรโมเลกุลเป็น H2O2 แสดงว่า
1 โมเลกุลประกอบด้วยไฮโดรเจนและออกซิเจนธาตุละ 2 อะตอม
การหาสูตรโมเลกุลของสารทั่วไป มีหลักดังนี้
1. ต้องทราบสูตรเอมพิริคัล
2. ต้องทราบมวลโมเลกุลโดยโจทย์กำหนดมาให้ทางตรงหรือทางอ้อมก็ได้
3. นำข้อมูลที่ได้จากข้อ 1, 2 หาค่า n โดยใช้สูตร
(มวลของสูตรเอมพิริคัล) x n = มวลโมเลกุล
n = เลขเป็นจำนวนเต็มบวก เช่น 1, 2, 3
การปัดจุดทศนิยมของค่า n ตั้งแต่ 0.5 ขึ้นไป ให้ปัดขึ้นอีกหนึ่ง แต่ถ้าต่ำกว่า 0.5 ก็ปัดทิ้งไป เช่น 3.6
ก็ให้ปัดจุดทศนิยมเป็น4.0 และ 2.2 ปัดจุดทศนิยมเป็น 2.0
การหาสูตรโมเลกุลของก๊าซ และการหาร้อยละโดยมวลของธาตุจากสูตรเคมี
การหาสูตรโมเลกุลของก๊าซ มีหลักการดังนี้
1. สารทุกชนิดที่เกี่ยวข้องในปฏิกิริยาเป็นก๊าซหมด และสารที่จะหาสูตรโมเลกุลจะต้องเป็นก๊าซหรือไอเท่านั้น
2. สมมติสูตรโมเลกุลของก๊าซที่จะหาสูตรโดยทราบว่าประกอบด้วยธาตุใดบ้าง
3. ต้องทราบปริมาตรของก๊าซต่าง ๆ ที่เกี่ยวข้องกันในปฏิกิริยา และปริมาตรของก๊าซต้องวัดที่อุณหภูมิและความดันเดียวกัน
4. หาอัตราส่วนโดยปริมาตรก๊าซต่าง ๆ เป็นอย่างต่ำ
5. เปลี่ยนอัตราส่วนโดยปริมาตรของก๊าซเป็นอัตราส่วนโดยโมล โดยใช้กฎอาโวกาโดร
6. เขียนสมการของปฏิกิริยาเคมีตามโจทย์บอก แล้วเข้าสมการพีชคณิตของจำนวนอะตอมทั้งหมด ทางซ้ายและทางขวาของแต่ละธาตุให้เท่ากัน จะได้สมการพีชคณิตหลายสมการที่มีตัวแปรหลายตัว
จากนั้นก็คำนวณหาสูตรโมเลกุลของก๊าซได้
กลับไปที่เนื้อหา
บทเรียนที่ 9 ร้อยละผลได้
สารกำหนดปริมาณ (Limiting Reagent)
สารที่เข้าทำปฏิกิริยามีปริมาณไม่พอดีกัน ปฏิกิริยาที่เกิดขึ้นจะสิ้นสุดเมื่อสารใดสารหนึ่งหมด สาร ที่หมดก่อนจะเป็นตัวกำหนดปริมาณของผลิตภัณฑ์ของสารผลิตภัณฑ์ที่เกิดขึ้นเรียกว่า สารกำหนดปริมาณ (Limiting Reagent)สารกำหนดปริมาณในการเกิดปฏิกิริยาเป็นการคำนวณสารจากสมการของปฏิกิริยาที่โจทย์บอกข้อมูลเกี่ยวกับสารตั้งต้นมาให้มากกว่าหนึ่งชนิด ลักษณะโจทย์มี 2 แบบ คือ
1. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด แต่ไม่บอกข้อมูลเกี่ยวกับสารผลิตภัณฑ์ ในการคำนวณต้องพิจารณา ว่าสารใดถูกใช้ทำปฏิกิริยาหมด แล้วจึงใช้สารนั้นเป็นหลักในการคำนวณสิ่งที่ต้องการจากสมการได้
2. โจทย์บอกข้อมูลของสารตั้งต้นมาให้มากกว่าหนึ่งชนิด และบอกข้อมูลของสารผลิตภัณฑ์ชนิด ใดชนิดหนึ่งมาให้ด้วย ในการคำนวณให้ใช้ข้อมูลจากสารผลิตภัณฑ์เป็นเกณฑ์ในการเทียบหาสิ่งที่ต้องการจากสมการเคมี
ร้อยละของผลได้ของสารผลิตภัณฑ์
ในการคำนวณหาปริมาณของผลิตภัณฑ์จากสมการเคมีนั้น ค่าที่ได้เรียกว่า ผลได้ตามทฤษฎี (Theoretical yield) แต่ในทางปฏิบัติจะได้ผลิตภัณฑ์น้อยกว่าตามทฤษฎี แต่จะได้มากหรือน้อยแค่ไหน ก็ขึ้นอยู่กับวิธีการและสารเคมีที่ใช้ เรียกผลที่ได้ว่านี้ ผลได้จริง (Actual yield) สำหรับการรายงานผล การทดลองนั้น จะเปรียบเทียบค่าที่ได้ตามทฤษฎีในรูปร้อยละ ซึ่งจะได้ความสัมพันธ์ดังนี้
กลับไปที่เนื้อหา



