แก๊ส (gas)
![]()
สมบัติของแก๊ส
แก๊ส เป็นหนึ่งในสี่สถานะของสสาร ในภาวะที่อุณหภูมิและความดันเหมาะสม สารหลายชนิดสามรถเปลี่ยนสถานะเป็นของแข็ง ของเหลว หรือแก๊สได้ ธาตุที่เป็นอโลหะ เช่น ไฮโดรเจน ฟลูออรีน ออกซิเจน ไนโตรเจน แก๊สเฉื่อย และสารประกอบโคเวเลนต์ที่มีมวลโมเลกุลต่ำบางชนิด เช่น;CO , CO2;,;NH3;,;SO2;มีสถานะเป็นแก๊สที่อุณหภูมิห้องโดยปกติแก๊สมักจะหมายถึงสารที่มีสภานะเป็นแก๊สที่อุณหภูมิห้อง ส่วนสารที่เป็นของเหลวที่ภาวะปกติ แต่ถูกเปลี่ยนแก๊สจะเรียกว่า;ไอ;(Vapour)แก๊สมีแรงยึดเหนี่ยวระหว่างอนุภาคน้อยมาก อนุภาคจะอยู่ห่างกันมากเมื่อเปรียบเทียบกับของเหลวและของแข็ง ดังนั้น เมื่อบรรจุแก๊สไว้ในภาชนะ แก๊สจึงแพร่กระจายเต็มภาชนะที่บรรจุ ทำให้มีรูปร่างเปลี่ยนแปลงตามขนาดและรูปร่างของภาชนะ แก๊สมีความหนาแน่นต่ำกว่าของแข็งและของเหลวมาก สามารถบีบอัดให้มีปริมาตรลดลงได้ สมบัติของแก๊ส
สมบัติทั่วไปของแก็ส สมบัติทั่วไปของแก๊ส ได้แก่
1. แก๊สมีรูปร่างเป็นปริมาตรไม่แน่นอน เปลี่ยนแปลงไปตามภาชนะที่บรรจุ บรรจุ ในภาชนะใดก็จะมีรูปร่างเป็นปริมาตรตามภาชนะนั้น เช่น ถ้าบรรจุในภาชนะทรงกลมขนาด 1 ลิตร แก๊สจะมีรูปร่างเป็นทรงกลมมีปริมาตร 1 ลิตร เพราะแก็สมีแรงยึดเหนี่ยวระหว่างอนุภาค (โมเลกุล หรืออะตอม) น้อยมาก จึงทำให้อนุภาคของแก๊สสามารถเคลื่อนที่หรือแพร่กระจายเต็มภาชนะที่บรรจุ
2. ถ้าให้แก๊สอยู่ในภาชนะที่เปลี่ยนแปลงปริมาตรได้ ปริมาตรของแก๊สจะขึ้นอยู่กับอุณหภูมิ ความดันและจำนวนโมล ดังนั้นเมื่อบอกปริมาตรของแก๊สจะต้องบอกอุณหภูมิ ความดันและจำนวนโมลด้วย เช่น แก๊สออกซิเจน 1 โมลมีปริมาตร 22.4 dm3;ที่อุณหภูมิ 0 C ความดัน 1บรรยากาศ (STP)
3. สารที่อยู่ในสถานะแก๊สมีความหนาแน่นน้อยกว่าเมื่ออยู่ในสถานะของเหลวและของแข็งมาก เช่น ไอน้ำ มีความหนาแน่น 0.0006 g/cm3แต่น้ำมีความแน่นถึง 0.9584 g/cm3;ที่100 C
4. แก๊สสามารถแพร่ได้ และแพร่ได้เร็วเพราะแก็สมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยกว่าของเหลวและของแข็ง
5. แก็สต่างๆ ตั้งแต่ 2 ชนิดขึ้นไปเมื่อนำมาใส่ในภาชนะเดียวกัน แก๊สแต่ละชนิดจะแพร่ผสมกันอย่างสมบูรณ์ทุกส่วน นั้นคือส่วนผสมของแก๊สเป็นสารเดียว หรือเป็นสารละลาย (Solution)
6. แก๊สส่วนใหญ่ไม่มีสีและโปร่งใส่เช่นแก๊สออกซิเจน(O2)แก๊สไฮโดเจน(H2) แก๊สคาร์บอนไดออกไซด์(CO2)แต่แก๊สบางชนิดมีสี เช่น แก๊สไนโตเจนไดออกไซด์ (NO2) มีสีน้ำตาลแดง แก๊สคลอรีน(Cl2) มีสีเขียวแกมเหลือง แก๊สโอโซน (O3) ที่บริสุทธิ์มีสีน้ำเงินแก่ เป็นต้น

ปริมาตร อุณหภูมิ และความดัน
การวัดปริมาตรของแก๊ส เนื่องจากแก๊สบรรจุในภาชนะใดก็พุ่งกระจายเต็มภาชนะ ดั้งนั้น ปริมาตรของแก๊ส จึงมักหมายถึงปริมาตรของภาชนะที่บรรจุแก๊สนั้น;
หน่วยของปริมาตร หน่วยของปริมาตร ที่นิยมใช้คือ ลูกบาศก์เดซิเมตร (dm3) หรือลิตร (litre) หรือ ลูกบาศก์เซนติเมตร (cm3) (1 dm3=1000 cm3)
อุณหภูมิ (Temperature) เป็นมาตราส่วนที่ใช้บอกระดับความร้อน-เย็นของสาร แต่อุณหภูมิไม่ได้บอกให้ทราบถึงปริมาตรความร้อนของสาร กล่าวคือ สารที่มีอุณหภูมิเท่ากันแสดงว่ามีระดับความร้อนเท่ากันแต่อาจจะมีปริมาตรความร้อนเท่ากันก็ได้ เครื่องมือวัดอุณหภูมิที่ใช้กันอย่างแพร่หลายคือเทอร์โมมิเตอร์
การวัดอุณหภูมิของแก๊ส การวัดอุณหภูมิมาตราส่วนที่ใช้มีหลายแบบ คือ เซลเซียส;
เคลวิน ฟาเรนไฮต์ โรเมอร์และแรงกิน แต่การวัดอุณหภูมิของแก๊สส่วนใหญ่ใช้ มาตราส่วนเคลวิน;
(Kelvin Scale) หรือเรียกว่า มาตราส่วนสัมบูรณ์ (Absolute temperature scale) สัญลักษณ์ K และองศาเซลเซียส อุณหภูมิเคลวิน และองศาเซลเซียสมีความสัมพันธ์กันดังนี้
อุณหภูมิเคลวิน = องศาเซลเซียส + 273.15; เช่น27 องศาเซลเซียส เท่ากับ 300.15 K หาได้ดังนี้อุณหภูมิเคลวิน = 27 + 273.15 = 300.15 K หมายเหตุ เพื่อความสะดวกในการคำนวณอาจใช้ 273 (ค่าโดยประมาณ) แทน 273.15 การวัดอุณหภูมิของแก๊สส่วนใหญ่ใช้อุณหภูมิเคลวิน (K) เพราะปริมาตรของแก๊สแปรผันตรงกับอุณหภูมิ ;

หมายถึง แรงที่กระทำต่อหน่วยพื้นที่ ที่ตั้งฉากกับแรงนั้น เนื่องจากความดันของแก๊สเกิดจากโมเลกุลของแก๊สชนผันงภาชนะ เพราะฉะนั้นความดันของแก๊สคือแรงที่โมเลกุลของแก๊สกระทำต่อผนังต่อหนึ่งหน่วนพื้นที่ของภาชนะ และความดันของแก๊สมีค่าเท่ากันหมดไม่ว่าจะวัดที่ส่วนใดของภาชนะ
เครื่องมือวัดความดันของแก๊ส เครื่องมือที่ใช้วัดความดันของแก๊สเรียกว่า มาโนมิเตอร์ (Manometer) ซึ่งมีอยู่ 2 ชนิด คือ1. ชนิดปลายปิด2. ชนิดปลายเปิด
ชนิดปลายปิด และปลายเปิด มีลักษณะดังรูป

จากรูป ก. เพราะว่าที่ว่างเหนือปรอทเป็นสุญญากาศ
ดังนั้น ความดันของแก๊ส = h มิลลิเมตรปรอท (mmHg)
จากรูป ข. เพราะว่าปลายข้างเปิดมีความดันของบรรยากาศกดบนปรอท
ดังนั้น ความดันของแก๊ส = ความดันของบรรยากาศ + h มิลิเมตรปรอท (mmHg) เครื่องมือวัดความดันของบรรยากาศ ความดันบรรยากาศ คือความดันของอากาศบนพื้นผิวโลก และความดันของบรรยากาศนี้ขึ้นอยู่กับสถานที่ คือที่พื้นที่ผิวโลกมีความดันมากกว่าในที่สูงๆ เช่น ภูเขา ทั้งนี้เพราะในที่สูงมีอากาศเจือจางกว่า เครื่องมือที่ใช้วัดความดันของบรรยากาศคือ บารอมิเตอร์ (Barometer)

จากรูป บารอมิเตอร์อย่างง่ายประกอบด้วยหลอดแก้วยาวประมาณ 80 – 100 cm มีปลายข้างหนึ่งเปิด เดิมปรอทในหลอดแก้วจนเต็ม จากนั้นคว่ำหลอดแก้วในภาชนะที่บรรจุปรอทอยู่แล้ว ความสูงของลำปรอทในหลอดแก้จะลดลง ทำให้เกิดที่ว่างซึ่งเป็นสุญญากาศ เรียกว่า ที่ว่างทอริเซลเลียน(Torricellian Vacuum) ลำปรอทยังคงค้างในหลอดแก้งเนื่องจากความดันบรรยากาศที่กดที่ผิวปรอทในภาชนะ จากรูปลำปรอทสูงเท่ากับ h cm เพราะฉะนั้นความดันของบรรยากาศมีค่าเท่ากับ h cmHg เช่น ในที่ซึ่งมีความสูงเท่ากับระดับน้ำทะเลจะมีความดันเท่ากับ 76 cmHg หรือ 760 cmHg หรือ 1 บรรยากาศ (1 atm)
การวัดความดันของแก๊ส หน่วยที่ใช้วัดความดันได้แก่ บรรยากาศ มิลมิเมตรปรอท นิวตันต่อ ตารางเมตร ปอนด์ต่อตาราง นิ้ว บาร์ ทอร์ สำหรับหน่วยเอสไอ ใช้ปาสคาล (Pascal)
สัญลักษณ์ Pa และหน่วยต่างๆ มีความสัมพันธ์ ดังนี้
1 บรรยากาศ = 760 มิลลิเมตร
= 760 ทอร์ (Torr)
= 14.7 ปอนด์/ตารางนิ้ว (lb/in2)
= 1.01325 x 105 ปาสคาล (Pa)
= 1.01325 x 105 นิวตัน/ตารางเมตร (Nm-2)
= 1.01325 บาร์ (bar)
1 มิลลิเมตรปรอท = 133.3 นิวตัน/ตารางเมตร (Nm-2)
หมายเหตุ การวัดความดันของแก๊สอาจวัดโดยใช้บารอมิเตอร์ก็ได้
กลับไปที่เนื้อหา
ประเภทของแก๊ส
1. แก๊สอุดมคติ (Ideal gas) หรือเรียกว่าแก๊สสมบูรณ์ หรือแก๊สสมมติ2. แก๊สจริง;(Real gas)
แก๊สอุดมคติ;(Ideal gas);เป็นแก๊สที่ไม่มีอยู่จริง นักวิทยาศาสตร์กำหนดขึ้นเพื่ออธิบายสมบัติต่าง ๆ ที่เกี่ยวกับแก๊ส โดยให้มีพฤติกรรมเป็นไปตามกฎของแก๊สไม่ว่าที่อุณหภูมิหรือความดันใด แก๊สสมบูรณ์เป็นแก๊สที่ไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุลแบบจำลองของแก๊สอุดมคติสูตรแบบจำลองของแก๊ส
- แก๊สประกอบด้วยโมเลกุลจำนวนมาก; ทุกโมเลกุลมีลักษณะเป็นก้อนกลมที่มีขนาดเท่ากัน; มีความยืดหยุ่นสูง; ดังนั้นโมเลกุลเหล่านี้จะชนผนังและกระดอนแบบยืดหยุ่นสมบูรณ์
- ถือว่าปริมาตรรวมของโมเลกุลทุกตัวน้อยมาก; เมื่อเปรียบเทียบปริมาตรของแก๊สทั้งภาชนะ; จึงสามารถตัดปริมาตรของโมเลกุลทิ้งไป
- ไม่มีแรงใดๆ; กระทำต่อโมเลกุลไม่ว่าจะเป็นแรงผลักหรือแรงดึงดูด; หรือแม้กระทั่งแรงโน้มถ่วงของโลกที่กระทำต่อโมเลกุลด้วย
- การเคลื่อนที่ของโมเลกุลเป็นแบบสุ่ม; ซึ่งหมายถึงว่าโมเลกุลสามารถเคลื่อนที่ได้สะดวกทุกทิศทาง
เมื่อ P คือ ความดัน V คือ ปริมาตรของแก๊ส N คือ จำนวนโมเลกุลทั้งหมด n คือ จำนวนโมลของแก๊ส R คือ ค่าคงตัวของแก๊ส 8.314 J/mol x KKB คือ ค่านิจโบลต์ซมันน์ 1.38 x 10-23T คือ อุณหภูมิ (K)Vrms คือ อัตราเร็วรากที่สองของกำลังสองเฉลี่ย
แก๊สจริง (Real gas) หมายถึงแก๊สที่ไม่เป็นไปตามกฎต่าง ๆ ของแก๊สสมบูรณ์ เป็นแก๊สที่มีอยู่จริงในธรรมชาติ มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย แต่ในบางสภาวะแก๊สจริงอาจมีสมบัติใกล้เคียงกับแก๊สสมบูรณ์ได้ คือที่อุณหภูมิสูงและความดันต่ำมาก ๆ แก๊สจริงที่มีสมบัติใกล้เคียงกับแก๊สสมบูรณ์มากที่สุดที่อุณหภูมิห้องและความดัน 1 บรรยากาศคือแก๊สเฉื่อย (Innert gas) สมบัติของแก๊สที่ศึกษากันได้แก่ มวล ปริมาตร ความดัน อุณหภูมิ การนำความร้อน และการแพร่ เป็นต้น
เมื่อกล่าวถึงแก๊ส จะต้องระบุปริมาตร อุณหภูมิ และความดันด้วย เนื่องจากเป็นสมบัติเฉพาะของแก๊ส (Intensive properties) ปริมาตร (Volume) ในการวัดปริมาตรของแก๊สใช้หน่วยลูกบาศก์เดซิเมตร (dm3) ถ้าเป็นหน่วยย่อยใช้หน่วยลูกบาศก์เซนติเมตร (cm3) อุณหภูมิ (Temperature) เครื่องมือที่ใช้วัดอุณหภูมิคือเทอร์มอมิเตอร์ เทอร์มอคัพเพิล และไพโรมิเตอร์ มาตรส่วนที่ใช้วัดอุณหภูมิคือ เซลเซียส (OC) เคลวิน (K) ฟาเรนไฮต์ (F);และโรเมอร์ (R) สำหรับการคำนวณเรื่องแก๊สใช้ เคลวิน หรือเรียกว่าองศาสัมบูรณ์ (Absolute temperature) ความสัมพันธ์ระหว่างเคลวินกับเซลเซียส
| K 273.15 +OC |
เนื่องจากปริมาตรของแก๊สเปลี่ยนแปลงไปตามอุณหภูมิและความดัน เพื่อความสะดวกในการเปรียบเทียบปริมาตรของแก๊ส จึงกำหนดอุณหภูมิและความดันมาตรฐานขึ้น เรียกชื่อว่าสภาวะอุณหภูมิและความดันมาตรฐาน (Standard Temperature and Pressure : STP) ซึ่งมีอุณหภูมิเท่ากับ 0 OC ความดัน 1 บรรยากาศ หรือ 760 mmHg
พฤติกรรมของแก๊สจริง
คำว่าแก๊สจริง ;คือ;แก๊สที่มีพฤติกรรมไม่ตรงกับสมการของแก๊สสมบูรณ์แบบ แก๊สในธรรมชาติเกือบทั้งหมดนอกจากแก๊สเฉื่อยบางชนิด มีพฤติกรรมเป็นแก๊สจริง แก๊สที่มีอยู่จริงตามธรรมชาติก็มีหลากหลายชนิด แก๊สบางชนิดก็เป็นประโยชน์ต่อสิ่งมีชีวิต เช่น แก๊สออกซิเจนเป็นแก๊สที่เราใช้หายใจ ส่วนแก๊สคาร์บอนไดออกไซด์เป็นแก๊สที่ต้นไม้นำไปใช้ในกระบวนการสังเคราะห์ด้วยแสง แก๊สไนโตรเจนซึ่งเป็นแก๊สที่มีเปอร์เซนต์มากที่สุดในธรรมชาติ เป็นต้น แก๊สบางชนิดก็เป็นพิษต่อมนุษย์ เช่น คาร์บอนมอนอกไซด์ ถ้าสูดดมเข้าไปมากๆ อาจจะทำให้เสียชีวิตได้ แก๊สเหล่านี้ล้วนมีเอกลักษณ์เฉพาะตัวทั้งสมบัติทางกายภาพและทางเคมีเนื่องจากแก๊สมีขนาดเล็กมาก เราไม่สามารถจะดูพฤติกรรมแก๊สทีละโมเลกุลหรือทีละอะตอมได้ หรือถ้าจะดูทีละเป็นล้านๆ อะตอมพร้อมๆ กัน เราก็ต้องใช้ข้อมูลที่มหาศาลมาก ดังนั้น จึงเกิดมีทฤษฎีต่างๆ มากมายขึ้นมาเพื่อทำนายพฤติกรรมโดยรวมของแก๊สปริมาณมากๆ โดยพิจารณาจากแก๊สทีละน้อยๆ โมเลกุลแล้ว เราก็ใช้ความรู้ทางคณิตศาสตร์และทางสถิติเข้ามาคำนวณและทำนายพฤติกรรมแก๊สที่เกิดขึ้นทั้งหมดได้พฤติกรรมของแก๊สสมบูรณ์แบบ จะเกิดขึ้นได้นั้นมี สมมติฐานที่ว่า โมเลกุลในสถานะแก๊สไม่มีแรงกระทำต่อกัน ไม่ว่าจะเป็นแรงดึงดูดหรือแรงผลัก นอกจากนี้ยังสมมติว่าปริมาตรของโมเลกุลมีค่าน้อยมากเมื่อเทียบกับปริมาตรของภาชนะ ถ้าแก๊สมีพฤติกรรมที่สมบูรณ์แบบ ก็จะแสดงพฤติกรรมที่เป็นไปตามกฏของแก๊สในอุดมคติ คือ เป็นไปตามสูตรทางคณิตศาสตร์ที่ว่า![]() แต่แก๊สจริงมีพฤติกรรมไม่ได้เสมอต้นเสมอปลายเหมือนกับสูตร;
แต่แก๊สจริงมีพฤติกรรมไม่ได้เสมอต้นเสมอปลายเหมือนกับสูตร;![]() ที่ให้มา ไม่สามารถใช้ในทุกสภาวะ เช่น ถ้าความดันสูงมากๆ โมเลกุลของแก๊สจะอยู่ใกล้ชิดกันมากจนถึงระดับหนึ่งก็จะเกิดแรงดึงดูดและยึดเหนี่ยวกันจนแก๊สกลายเป็นของเหลวในที่สุด ซึ่งตามสมมติฐานที่กล่าวว่าโมเลกุลในสถานะแก๊สไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุล ก็จะไม่เป็นจริงถ้าโมเลกุลไม่มีแรงยึดเหนี่ยวต่อกัน แก๊สก็จะควบแน่นเป็นของเหลวไม่ได้ เป็นต้นแล้วแก๊สจริงจะแสดงพฤติกรรมที่ไม่เป็นไปตามกฏของแก๊สอุดมคติ ภายใต้สภาวะเช่นใดถ้าเราทำการทดลองโดยใช้แก๊สจริงชนิดต่างๆ จำนวนอย่างละ 1 โมลเท่าๆ กันจากสูตร;
ที่ให้มา ไม่สามารถใช้ในทุกสภาวะ เช่น ถ้าความดันสูงมากๆ โมเลกุลของแก๊สจะอยู่ใกล้ชิดกันมากจนถึงระดับหนึ่งก็จะเกิดแรงดึงดูดและยึดเหนี่ยวกันจนแก๊สกลายเป็นของเหลวในที่สุด ซึ่งตามสมมติฐานที่กล่าวว่าโมเลกุลในสถานะแก๊สไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุล ก็จะไม่เป็นจริงถ้าโมเลกุลไม่มีแรงยึดเหนี่ยวต่อกัน แก๊สก็จะควบแน่นเป็นของเหลวไม่ได้ เป็นต้นแล้วแก๊สจริงจะแสดงพฤติกรรมที่ไม่เป็นไปตามกฏของแก๊สอุดมคติ ภายใต้สภาวะเช่นใดถ้าเราทำการทดลองโดยใช้แก๊สจริงชนิดต่างๆ จำนวนอย่างละ 1 โมลเท่าๆ กันจากสูตร;![]() เมื่อ จำนวนโมล (n) เท่ากับ 1 จะได้ว่า
เมื่อ จำนวนโมล (n) เท่ากับ 1 จะได้ว่า![]()
![]() เราจะได้ว่าอัตราส่วนระหว่าง PV กับ RT จะเท่ากับ 1 เสมอถ้าเป็นแก๊สในอุดมคติ ไม่ว่าความดันจะเป็นเท่าใดก็ตามค่า อัตราส่วน;
เราจะได้ว่าอัตราส่วนระหว่าง PV กับ RT จะเท่ากับ 1 เสมอถ้าเป็นแก๊สในอุดมคติ ไม่ว่าความดันจะเป็นเท่าใดก็ตามค่า อัตราส่วน;![]() ;นี้เรียกว่า ค่าแฟกเตอร์การอัด (compressibility factor =Z);ของแก๊สแก๊สจริงจะไม่เป็นไปตามกฎของแก๊สเลย นักวิทยาศาสตร์ก็เลยสงสัยว่า น่าจะมีปัจจัยบางอย่างเข้ามาเกี่ยวข้องกับพฤติกรรมแก๊สจริงที่เกิดขึ้นจริงๆ และคนที่สามารถใช้ขบวนการทางคณิตศาสตร์เข้ามาอธิบาย ได้ผลดี และเข้าใจง่าย ก็คือ ฟานเดอวาลล์
;นี้เรียกว่า ค่าแฟกเตอร์การอัด (compressibility factor =Z);ของแก๊สแก๊สจริงจะไม่เป็นไปตามกฎของแก๊สเลย นักวิทยาศาสตร์ก็เลยสงสัยว่า น่าจะมีปัจจัยบางอย่างเข้ามาเกี่ยวข้องกับพฤติกรรมแก๊สจริงที่เกิดขึ้นจริงๆ และคนที่สามารถใช้ขบวนการทางคณิตศาสตร์เข้ามาอธิบาย ได้ผลดี และเข้าใจง่าย ก็คือ ฟานเดอวาลล์

ฟานเดอวาลส์Johannes Diderik van der Waals ค.ศ. 1837 -1923ฟานเดอวาลล์;นักฟิสิกส์จากประเทศเนเธอร์แลนด์ ได้แก้ไขสมการ;![]() เพื่อให้สามารถอธิบายพฤติกรรมของแก๊สได้ดีขึ้น สมการที่เขาได้เสนอขึ้นมานอกจากจะไม่ยุ่งยากในทางคณิตศาสตร์แล้วยัง สามารถทำนายพฤติกรรมแก๊สได้ดีอีกด้วยฟานเดอร์วาลส์จึงได้เสนอ ว่า ความดันของแก๊สสมบูรณ์แบบ(
เพื่อให้สามารถอธิบายพฤติกรรมของแก๊สได้ดีขึ้น สมการที่เขาได้เสนอขึ้นมานอกจากจะไม่ยุ่งยากในทางคณิตศาสตร์แล้วยัง สามารถทำนายพฤติกรรมแก๊สได้ดีอีกด้วยฟานเดอร์วาลส์จึงได้เสนอ ว่า ความดันของแก๊สสมบูรณ์แบบ(![]() ;)กับความดันที่วัดได้จริง(
;)กับความดันที่วัดได้จริง(![]() ) มีความสัมพันธ์กันดังนี้
) มีความสัมพันธ์กันดังนี้![]() เมื่อ a เป็นค่าคงที่ n และ V เป็นจำนวนโมลและปริมาตรของแก๊ส ตามลำดับสมการนี้หมายความว่าอย่างไร ?สมการนี้หมายความว่า ความดันที่วัดได้จริงจากการทดลอง(
เมื่อ a เป็นค่าคงที่ n และ V เป็นจำนวนโมลและปริมาตรของแก๊ส ตามลำดับสมการนี้หมายความว่าอย่างไร ?สมการนี้หมายความว่า ความดันที่วัดได้จริงจากการทดลอง(![]() ) นั้นมีค่าน้อยกว่าความดันของแก๊สสมบูรณ์แบบ(
) นั้นมีค่าน้อยกว่าความดันของแก๊สสมบูรณ์แบบ(![]() ) พจน์ที่นำมาบวกเข้าไปเป็นความดันที่ลดลงจากแรงดึงดูดระหว่างโมเลกุลในระบบในระบบที่ปริมาตรคงที่ ถ้ามีจำนวนโมเลกุล(n) มากขึ้นแก๊สก็จะอยู่ใกล้ชิดกันมาก แรงดึงระหว่างโมเลกุลก็มากเป็นยกกำลังสอง แต่ถ้าปริมาตรเพิ่มขึ้นก็จะทำให้ แรงดึงดูดระหว่างโมเลกุลลดลงเป็นยกกำลังสองเช่นกัน เพราะยิ่งปริมาตรมากเท่าใดโมเลกุลก็จะอยู่ห่างกันมากส่งผลทำให้มีแรงดึงดูดระหว่างกันน้อยลงอีกส่วนหนึ่งเป็นการแก้ไขเกี่ยวกับปริมาตรของโมเลกุลปริมาตร;V;ในสมการ;
) พจน์ที่นำมาบวกเข้าไปเป็นความดันที่ลดลงจากแรงดึงดูดระหว่างโมเลกุลในระบบในระบบที่ปริมาตรคงที่ ถ้ามีจำนวนโมเลกุล(n) มากขึ้นแก๊สก็จะอยู่ใกล้ชิดกันมาก แรงดึงระหว่างโมเลกุลก็มากเป็นยกกำลังสอง แต่ถ้าปริมาตรเพิ่มขึ้นก็จะทำให้ แรงดึงดูดระหว่างโมเลกุลลดลงเป็นยกกำลังสองเช่นกัน เพราะยิ่งปริมาตรมากเท่าใดโมเลกุลก็จะอยู่ห่างกันมากส่งผลทำให้มีแรงดึงดูดระหว่างกันน้อยลงอีกส่วนหนึ่งเป็นการแก้ไขเกี่ยวกับปริมาตรของโมเลกุลปริมาตร;V;ในสมการ;![]() หมายถึงปริมาตรของภาชนะ แต่ถึงแม้แต่ละโมเลกุลจะมีขนาดเล็กมาก ก็ต้องถือว่ามีปริมาตรอยู่แน่นอนค่าหนึ่งเมื่อโมเลกุลสองโมเลกุลอยู่ใกล้กัน แต่ละโมเลกุลมีรัศมี r หน่วย;สมมติว่าแต่ละโมเลกุลมีลักษณะเป็นทรงกลม ปริมาตรของแต่ละโมเลกุลจะเท่ากับ;
หมายถึงปริมาตรของภาชนะ แต่ถึงแม้แต่ละโมเลกุลจะมีขนาดเล็กมาก ก็ต้องถือว่ามีปริมาตรอยู่แน่นอนค่าหนึ่งเมื่อโมเลกุลสองโมเลกุลอยู่ใกล้กัน แต่ละโมเลกุลมีรัศมี r หน่วย;สมมติว่าแต่ละโมเลกุลมีลักษณะเป็นทรงกลม ปริมาตรของแต่ละโมเลกุลจะเท่ากับ;![]() แต่เนื่องจากถ้าพิจารณาปริมาตรที่โมเลกุลหนึ่งกันไม่ให้จุดศูนย์กลางของโมเลกุลอื่นๆ เข้ามา ก็คืออยู่ในรัศมี 2r (เส้นประสีแดง) ซึ่งก็คือเป็นระยะทางที่จุดศูนย์กลางของโมเลกุลสีน้ำเงินสามารถเข้ามาใกล้โมเลกุลสีแดงได้มากที่สุดเมื่อรัศมีกีดกันเท่ากับ 2r หน่วย หนึ่งโมเลกุลสีแดงจะมีปริมาตรกันไว้ =;
แต่เนื่องจากถ้าพิจารณาปริมาตรที่โมเลกุลหนึ่งกันไม่ให้จุดศูนย์กลางของโมเลกุลอื่นๆ เข้ามา ก็คืออยู่ในรัศมี 2r (เส้นประสีแดง) ซึ่งก็คือเป็นระยะทางที่จุดศูนย์กลางของโมเลกุลสีน้ำเงินสามารถเข้ามาใกล้โมเลกุลสีแดงได้มากที่สุดเมื่อรัศมีกีดกันเท่ากับ 2r หน่วย หนึ่งโมเลกุลสีแดงจะมีปริมาตรกันไว้ =;![]()
=;
นั่นคือปริมาตรกีดกันของหนึ่งโมเลกุล มีค่าเป็น 8 เท่าของปริมาตรแก๊สจริงๆ หนึ่งโมเลกุล และถ้าเป็นล้านๆ โมเลกุล ก็จะกลายเป็น ล้านๆ เท่าของหนึ่งโมเลกุลสำหรับ N โมเลกุลปริมาตรที่กีดกันไว้ =;![]() x N = nbดังนั้น ปริมาตรที่ใช้คำนวณควรเป็นจาก;
x N = nbดังนั้น ปริมาตรที่ใช้คำนวณควรเป็นจาก;![]()
![]() เมื่อ n เป็นจำนวนโมลของแก๊ส และ b เป็นค่าคงที่ พจน์ nb จึงหมายถึงปริมาตรของโมเลกุลแก๊ส n โมล และเมื่อผ่านการแก้ไขแล้ว สมการ;
เมื่อ n เป็นจำนวนโมลของแก๊ส และ b เป็นค่าคงที่ พจน์ nb จึงหมายถึงปริมาตรของโมเลกุลแก๊ส n โมล และเมื่อผ่านการแก้ไขแล้ว สมการ;![]() ก็จะกลายเป็น
ก็จะกลายเป็น![]()
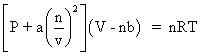 สมการนี้เรียกว่า;สมการฟานเดอร์วาลส์ (van der waals equation)
สมการนี้เรียกว่า;สมการฟานเดอร์วาลส์ (van der waals equation)
กลับไปที่เนื้อหา
กฎของแก๊ส (Gas Law);เป็นกฎที่ใช้สำหรับอธิบายสมบัติต่าง ๆ ของแก๊ส ได้แก่ ปริมาตร (V);ความดัน (P) และอุณหภูมิอุณหพลวัต (T) ของแก๊สนั้น ๆ กฎของแก๊สที่เราควรรู้จัก ประกอบด้วยกฎของบอยล์;กฎของชาร์ล;และกฎของเก-ลูซัก;(บางครั้งเขียนว่า "กฎของเก-ลัสแซก" หรือ "กฎของเกย์ลูสแซก") สำหรับรายละเอียดของกฎข้างต้นและกฎอื่น ๆ จะได้อธิบายข้างล่างนี้
กฎของบอยล์;(Boyle’s Law)

Robert Boyle เมื่อทดลองโดยใช้กระบอกฉีดยาและปิดปลายกระบอกฉีดยา เมื่อกดก้านกระบอกฉีดยาทำให้ปริมาตรของแก๊สในกระบอกฉีดยาลดลง และเมื่อปล่อยมือก้านกระบอกฉีดยาจะเลื่อนกลับสู่ตำแหน่งเดิม ในทำนองเดียวกันเมื่อดึงก้านกระบอกฉีดยาขึ้น ทำให้ปริมาตรของแก๊สในกระบอกฉีดเพิ่มขึ้น และเมื่อปล่อยมือก้านกระบอกฉีดยาจะเลื่อนกลับสู่ตำแหน่งเดิม สามารถใช้ทฤษฎีจลน์ของแก๊สอธิบายได้ว่า เมื่อปริมาตรของแก๊สในกระบอกฉีดยาลดลง ทำให้โมเลกุลของแก๊สอยู่ใกล้กันมากขึ้น จึงเกิดการชนกันเองและชนผนังภาชนะมากขึ้น เป็นผลให้ความดันของแก๊สในกระบอกฉีดยาเพิ่มขึ้นเมื่อเทียบกับตอนเริ่มต้น ในทางตรงกันข้ามการเพิ่มปริมาตรของแก๊สในกระบอกฉีดยาทำให้โมเลกุลของแก๊สอยู่ห่างกัน การชนกันเองของโมเลกุลของแก๊สและการชนผนังภาชนะน้อยลง ความดันของแก๊สในกระบอกฉีดยาจึงลดลงนักวิทยาศาสตร์ได้ทำการทดลองเพื่อศึกษาความสัมพันธ์ระหว่างปริมาตรกับความดันของแก๊ส โดยควบคุมให้อุณหภูมิคงที่ ได้ผลดังตารางต่อไปนี้
| การทดลอง ครั้งที่ |
ปริมาตร (V , dm3) |
ความดัน (P , mmHg) |
PV (mmHg. cm3) |
| 1 | 5.00 | 760 | 3.80 x 103 |
| 2 | 10.00 | 380 | 3.80 x 103 |
| 3 | 15.00 | 253 | 3.80 x 103 |
| 4 | 20.00 | 191 | 3.82 x 103 |
| 5 | 25.00 | 151 | 3.78 x 103 |
| 6 | 30.00 | 127 | 3.81 x 103 |
| 7 | 35.00 | 109 | 3.82 x 103 |
| 8 | 40.00 | 95 | 3.80 x 103 |
| 9 | 45.00 | 84 | 3.78 x 103 |
จากผลการทดลองในตารางพบว่า ผลคูณของความดันกับปริมาตร (PV) ของแก๊สในการทดลองแต่ละครั้งมีค่าค่อนข้างคงที่ และเมื่อเขียนกราฟแสดงความสัมพันธ์ระหว่างความดันกับปริมาตรของแก๊สจะได้ดังรูปต่อไปนี้จากข้อมูลในตารางและจากกราฟพบว่าขณะที่อุณหภูมิคงที่ ถ้าปริมาตรของแก๊สเพิ่มขึ้นจะทำให้ความดันของแก๊สลดลง และเมื่อปริมาตรของแก๊สลดลง ความดันของแก๊สจะเพิ่มขึ้นรอเบิร์ต บอยล์ (Robert Bolye) นักเคมีชาวอังกฤษ ได้ศึกษาเกี่ยวกับการเปลี่ยนปริมาตรของแก๊สในปี ค.ศ. 1662 (พ.ศ. 2205) และสรุปเป็นกฎเรียกว่า “กฎของบอยล์” ซึ่งมีสาระสำคัญดังนี้เมื่ออุณหภูมิและมวลของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผกผันกับความดันถ้าให้;P;แทนความดันของแก๊ส;V;แทนปริมาตรของแก๊ส ความสัมพันธ์ตามกฎของบอยล์เขียนแสดงความสัมพันธ์ได้ดังนี้VaPV kค่าคงที่ k ในสมการนี้ขึ้นอยู่กับอุณหภูมิ ปริมาตร มวลของแก๊ส และลักษณะเฉพาะของแก๊สแต่ละชนิด และจากผลการทดลองพบว่าผลคูณระหว่างปริมาตและความดันของแก๊สมีค่าคงที่เสมอ ดังนั้นถ้าให้;P1;และ;V1;เป็นความดันและปริมาตรที่สภาวะที่ 1 จะได้ว่า P1V1 k (1)และถ้าให้ P1 และ V1 เป็นความดันและปริมาตรที่สภาวะที่ 1 จะได้ว่าP2V2 k (2)(1) (2) P1V1P2V2 ผลที่ได้จากกฎของบอยล์เมื่อนำมาเขียนกราฟโดยให้ความดันเป็นแกนตั้ง และปริมาตรเป็นแกนนอน จะได้กราฟจากกราฟถ้าอุณหภูมิเปลี่ยนไปจะได้กราฟที่มีลักษณะไฮเปอร์โบลา และพบว่าอุณหภูมิยิ่งสูงขึ้น ลักษณะของเส้นกราฟเกือบจะเป็นเส้นตรง

จากกราฟนี้ กราฟแต่ละเส้นแสดงความสัมพันธ์ระหว่างความดันกับปริมาตรที่ต่างกัน และได้กราฟที่มีลักษณะเป็นเส้นโค้ง ซึ่งไม่สามารถบอกได้ชัดเจนว่าเป็นไปตามกฎของบอยล์หรือไม่ แต่ถ้าเขียนกราฟระหว่างความดันกับส่วนกลับของปริมาตรจะได้กราฟที่เป็นเส้นตรง ซึ่งถ้าหากมีการเบี่ยงเบนเกิดขึ้น เส้นจะเฉออกจากแนวเส้นตรงอย่างเห็นได้ชัดตัวอย่างที่;1;;;; แก๊สจำนวน 15;g;มีปริมาตร 10 ลิตร ที่ความดัน 150;mmHg;เมื่ออุณหภูมิคงที่; ถ้าเปลี่ยนความดันเป็น 50;mmHg; แก๊สจะมีปริมาตรเท่าใดวิธีทำ;P1;; =;; 150; mmHgP2;; =;; 50 ; mmHgV1;; =;; 10 ;;ลิตรV2;; =;; ?จากสูตร;;;;;;;;;; P1V1;; =;; P2V2150 x 10;; =;; 50 x V2V2;; = ;1500 / 50=;; 30;;;ลิตรตัวอย่างที่;2;;;; แก๊สชนิดหนึ่งมีความดันเริ่มต้นเท่ากับ 200;mmHg;;แก๊สชนิดนี้จะมีความดันสุดท้ายเป็นเท่าใดถ้าทำให้แก๊สมีปริมาตรลดลงเป็นครึ่งหนึ่งของปริมาตรเดิมเมื่ออุณหภูมิคงที่วิธีทำ;P1;; =;; 200; mmHgP2;; =;; ? ;;; mmHgV1;; =;; V1V2;; = ;V1/V2จากสูตร;;;;;;;;;; P1V1;; =;; P2V2200 x V1;; =;; P2;x (V1/V2)P2;; = ;200 x V1V1/V2=;; 400; mmHgกฎของชาร์ล;(Charle’s Law)ในการทดลองจุ่มกระบอกฉีดยาซึ่งบรรจุน้ำจำนวนหนึ่งลงในน้ำร้อน น้ำในกระบอกฉีดยาจะถูกดันออก ในทางตรงกันข้าม ถ้าจุ่มกระบอกฉีดยาลงในน้ำเย็น น้ำจากภายนอกจะเข้าไปแทนที่อากาศในกระบอกฉีดยา นั่นคือ การเพิ่มอุณหภูมิมีผลให้ปริมาตรของแก๊สเพิ่มขึ้น และการลดอุณหภูมิมีผลให้ปริมาตรของแก๊สลดลงด้วย แสดงว่าอุณหภูมิมีผลต่อการเปลี่ยนแปลงปริมาตรของแก๊ส การเปลี่ยนแปลงนี้ใช้ทฤษฎีจลน์ของแก๊สอธิบายได้ว่า การเพิ่มอุณหภูมิมีผลทำให้พลังงานจลน์เฉลี่ยของแก๊สเพิ่มขึ้น โมเลกุลของแก๊สจึงเคลื่อนที่เร็วขึ้น ทำให้โมเลกุลชนกันเองและชนผนังภาชนะมากขึ้น รวมทั้งพลังงานในการชนกันสูงขึ้นด้วย เป็นผลให้ความดันของแก๊สในกระบอกฉีดยาสูงขึ้นด้วย จึงดันน้ำออกจากกระบอกฉีดยาจนความดันของแก๊สภายในเท่ากับภายนอก จึงสังเกตเห็นว่าแก๊สในกระบอกฉีดยามีปริมาตรเพิ่มขึ้น ในกลับกันเมื่อลดอุณหภูมิ พลังงานจลน์เฉลี่ยของแก๊สในกระบอกฉีดยาจะลดลง ทำให้การชนกันเองระหว่างโมเลกุลของแก๊สและการชนผนังภาชนะน้อยลง รวมทั้งพลังงานในการชนลดลง ความดันของแก๊สในกระบอกฉีดยาจึงต่ำ อากาศภายนอกซึ่งมีความดันสูงกว่าจึงดันน้ำให้เข้าไปในกระบอกฉีดยา ความดันภายในจึงเพิ่มขึ้นจนเท่ากับความดันภายนอก จึงสังเกตเห็นว่าปริมาตรของแก๊สในกระบอกฉีดยาลดลงจนกระทั่งคงที่ ;จึงสรุปได้ว่าอุณหภูมิเป็นอีกปัจจัยหนึ่งที่มีผลต่อการเปลี่ยนปริมาตรของแก๊ส

Jacques Charlesจากผลการทดลองพบว่าเมื่อนำข้อมูลมาเขียนกราฟ จะได้กราฟเส้นตรงที่มีความชันคงที่ และทำให้คาดคะเนได้ว่า ถ้าลดอุณหภูมิของแก๊สลงเรื่อย ๆ แก๊สจะไม่มีปริมาตร หรือมีปริมาตรเป็นศูนย์ที่อุณหภูมิ –273OC;แต่โดยความเป็นจริงแก๊สจะไม่สามารถมีปริมาตรเป็นศูนย์ได้ เนื่องจากเมื่อลดอุณหภูมิลงเรื่อย ๆ แก๊สจะเปลี่ยนสถานะเป็นของเหลวก่อนที่อุณหภูมิจะถึง –273OC;;ซึ่งนักวิทยาศาสตร์ได้กำหนดให้อุณหภูมิ –273OC;มีค่าเท่ากับ 0 เคลวิน;(K);;โดยมีความสัมพันธ์ดังนี้
| T;; =;; 273 +; tOC |
เมื่อทดลองศึกษาการเปลี่ยนปริมาตรของแก๊สเมื่อเปลี่ยนอุณหภูมิ พบความสัมพันธ์ระหว่างปริมาตรแก๊สกับอุณหภูมิในหน่วยองศาเซลเซียสและในหน่วยเคลวิน ดังตาราง
| การทดลองครั้งที่ | t (;OC ) | T ( K ) | V (cm3) | V/T (cm3/K) |
| 1 | 10 | 283 | 100 | 0.35 |
| 2 | 50 | 323 | 114 | 0.35 |
| 3 | 100 | 373 | 132 | 0.35 |
| 4 | 200 | 473 | 167 | 0.35 |
จากตารางจะเห็นว่า เมื่อเปลี่ยนอุณหภูมิในหน่วยเซลเซียสเป็นหน่วยเคลวิน อัตราส่วนระหว่างปริมาตรกับอุณหภูมิเคลวินจะมีค่าคงที่จ๊าก–อาเล็กซองเดร์–เซซา ชาร์ล (Jacqes A.C. Charles) นักวิทยาศาสตร์ชาวฝรั่งเศส ได้ศึกษาความสัมพันธ์ระหว่างอุณหภูมิกับปริมาตรแก๊ส ในปี ค.ศ.1778 (พ.ศ.2321) และสรุปความ สัมพันธ์เป็นกฎ เรียกว่ากฎของชาร์ล ซึ่งมีใจความดังนี้
| “เมื่อมวลและความดันของแก๊สคงที่ ปริมาตรของแก๊สจะแปรผันตรงกับอุณหภูมิเคลวิน” |
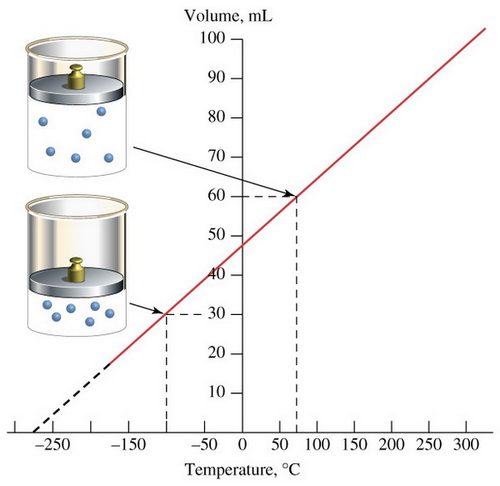
จากกฎของชาร์ล สามารถเขียนเป็นความสัมพันธ์ได้ดังนี้V;;;a;;; TV;; =;; kTV/T=;; kถ้าให้;;V1; เป็นปริมาตรของแก๊สที่อุณหภูมิ;;T1V2; เป็นปริมาตรของแก๊สที่อุณหภูมิ;;T2เนื่องจากอัตราส่วนระหว่าง;V;กับ;T;คงที่; ดังนั้นV1;= ;;V2T1 ; ; ; ; ;T2ตัวอย่างที่;3 แก๊สชนิดหนึ่งมีปริมาตร 80;cm3; ที่อุณหภูมิ; 45OC;;แก๊สนี้จะมีปริมาตรเท่าใดที่อุณหภูมิ; 0;OC; ถ้าความดันคงที่วิธีทำ;V1;; =;; 80;; cm3V2;; =;; ?T1;; =;; 273 + 45;; =;; 318;KT2;; =;; 273 + 0;;;; =;;;273 K80/318 ; = ; V2/273V2;; = ;80 x 273318=;; 68.68 ; cm3ตัวอย่างที่;4 แก๊สชนิดหนึ่งมีปริมาตร 30 ลิตร ที่อุณหภูมิ 25;OC; ถ้าความดันคงที่ แก๊สนี้จะมีปริมาตรเท่าใดเมื่ออุณหภูมิเปลี่ยนไปเป็น; 100;OCวิธีทำ;V1;; =;; 30;;;ลิตรV2;; =;; ?T1;; =;; 273 + 25;;; =;;;;; 298;KT2;; =;; 273 + 100;; =;;;; 373;K30;= ; ;;V2298 ; ; ; ; ; ;373V2 ; ; ;= ; ;30 x 373298=;; 37.55 ; ; ลิตร
กฎเกย์–ลูสแซกเกย์–ลูสแซกได้ทำการทดลองเพิ่มเติมต่อไป โดยให้ปริมาตรของแก๊สคงที่ เพื่อที่จะหาความสัมพันธ์ระหว่างความดันกับอุณหภูมิ ผลที่ได้คือ;ความดันของแก๊สใด ๆ จะแปรผันตรงกับอุณหภูมิเมื่อปริมาตรคงที่;ดังนั้นP ;;a;TP;; =;; kTP;=;; kTและ ; ; ; ; ; ;;P1;= ; ; ;P2T1 ; ; ; ; ; ; ; ; ;T2ตัวอย่างที่;5;;;; ถังใบหนึ่งถ้ามีแก๊สบรรจุอยู่จำนวนหนึ่ง มีความดัน 135 บรรยากาศ ที่อุณหภูมิ 20;OC; ถ้าให้แก๊สภายในถังร้อนขึ้นเป็น 85OC;จะมีความดันเท่าใดเมื่อปริมาตรคงที่วิธีทำP1;= ; ; ;P2T1 ; ; ; ; ; ; ; T2135/(273+20) = ;P2/(273 +85)P2 ; ; ; ; = ;135 ;x 358293=;; 164.9;;;;;;บรรยากาศ
จากกฎทั้งสามกฎข้างต้น นำมารวมได้เป็นกฎรวมแก๊ส ดังสมการ
ซึ่งจากกฎรวมแก๊ส เราสามารถเปลี่ยนให้เป็นกฎของแก๊สอุดมคติ หรือกฎแก๊สสมบูรณ์ โดยอาศัยกฎของอาโวกาโดร;ได้ดังสมการ
โดยที่V;เป็นปริมาตรของแก๊ส หน่วยเป็นลูกบาศก์เมตรP;เป็นความดันของแก๊ส หน่วยเป็นปาสกาล (หรือพาสคัล)T;เป็นอุณหภูมิอุณหพลวัต หน่วยเป็นเคลวินn;เป็นจำนวนโมลของแก๊สR;เป็นค่าคงตัวแก๊สอุดมคติ (ประมาณ 8.3145 จูลต่อ(โมล เคลวิน))นอกเหนือจากกฎที่ได้อธิบายไปแล้ว ก็ยังมีกฎการแพร่ของแกรห์ม;(หรือบางทีเขียนเป็น เกรแฮม);ทฤษฎีจลน์ของแก๊ส;และกฎความดันย่อยของดาลตัน;ซึ่งสามารถนำมาใช้อธิบายพฤติกรรมของแก๊สอุดมคติได้เช่นเดียวกัน อย่างไรก็ดี แก๊สอุดมคติอยู่ในสภาวะที่สมมติขึ้นมา กฎเหล่านี้จึงไม่สามารถอธิบายพฤติกรรมที่แท้จริงของแก๊สปกติได้
กลับไปที่เนื้อหา
การแพร่ผ่านของแก๊ส (Effusion)
หมายถึงกระบวนการที่โมเลกุลของแก๊สเคลื่อนที่จากบริเวณหนึ่งผ่านรูเล็ก ๆ ไปสู่อีกบริเวณหนึ่งโดยไม่มีการชนกันของโมเลกุล เช่น การบรรจุแก๊สไฮโดรเจนลงในภาชนะเครื่องปั้นดินเผาที่ไม่ได้เคลือบ มีรูพรุน แล้วตั้งทิ้งไว้ในอากาศ ไฮโดรเจนฟุ้งกระจายภายในภาชนะออกมาข้างนอก และอากาศข้างนอกฟุ้งกระจายเข้าไปในภาชนะโดยมีการผ่านรูเล็ก ๆ ของภาชนะ
การแพร่ (Diffusion)
หมายถึงกระบวนการที่โมเลกุลของแก๊สเคลื่อนที่จากบริเวณที่มีความเข้มข้นสูงไปสู่บริเวณที่มีความเข้มข้นต่ำกว่า โดยโมเลกุลมีการชนกันตลอดเวลา
กฎการแพร่ของเกรย์แฮม Thomas Graham
ในปี ค.ศ.1833 โทมัส เกรแฮม (Thomas Graham) พบว่า “อัตราการแพร่และอัตราการแพร่ผ่านของแก๊สจะแปรผกผันกับรากที่สองของความหนาแน่นของแก๊ส ภายใต้อุณหภูมิและความดันเดียวกัน” และตั้งเป็นกฎ เรียกว่า กฎการแพร่ของเกรแฮม
ถ้า r = อัตราการแพร่ของแก๊ส
d = ความหนาแน่นของแก๊ส
จะได้ว่า r a
r =
ถ้าเปรียบเทียบอัตราการแพร่ของแก๊สภายใต้สภาวะเดียวกัน จะได้ดังนี้
r1 = …………….. (1)
r2 = …………….. (2)
(1) / (2) =
แต่ความหนาแน่นแปรผันตรงกับมวลโมเลกุล
ดังนั้น =
ในกรณีความหนาแน่นกับอัตราการแพร่ อธิบายได้ดังนี้
เมื่ออุณหภูมิและความดันคงที่ ความหนาแน่นของแก๊สจะแปรผันตามมวลโมเลกุลของแก๊ส เมื่อ M1 และ M2 เป็นมวลโมเลกุลของแก๊สที่มีความหนาแน่น d1 และ d2 ตามลำดับ จะได้ความสัมพันธ์ดังนี้
ดังนั้น = =
อัตราการแพร่ของแก๊สแปรผกผันกับเวลา
จะได้ว่า r a
r =
ถ้าเปรียบเทียบระหว่างแก๊สสองชนิด จะได้ความสัมพันธ์ดังนี้
=
ในกรณีที่ต้องการเปรียบเทียบอัตราการแพร่ของแก๊สกับระยะทางและเวลา ให้แทนอัตราการแพร่ (v = ) ลงในสูตรดังกล่าว จะได้ความสัมพันธ์ดังนี้
= . = =
ในกรณีที่การแพร่ของแก๊สมีระยะทางเท่ากัน (s1= s2) จะได้
= = =
ในกรณีที่การแพร่ของแก๊สใช้เวลาเท่ากัน (t1= t2) จะได้
= = =
กฎการแพร่ของแก๊สนอกจากจะใช้คำนวณเกี่ยวกับการแพร่ของแก๊สแล้ว ยังสามารถใช้คำนวณมวลโมเลกุลหรือความหนาแน่นของแก๊สได้ด้วย โดยการคำนวณเปรียบเทียบกับแก๊สที่ทราบความหนาแน่นหรือมวลโมเลกุล นอกจากนี้ยังสามารถใช้หลักการแพร่ของแก๊สแยกแก๊สผสมที่มีมวลโมเลกุลต่างกันมาก ๆ ออกจากกันได้ด้วย เช่น ถ้าต้องการแยกแก๊สผสมระหว่างCH4 กับ CO2 จะทำได้โดยนำแก๊สผสมไปแพร่ผ่านผนังที่มีรูพรุนไปสู่สูญญากาศ แก๊ส CH4 มีมวลโมเลกุลน้อยกว่า CO2 จะมีอัตราการแพร่เร็วกว่า ดังนั้น ในการแพร่ช่วงแรก ๆ จะได้แก๊สส่วนใหญ่เป็น CH4
ตัวอย่างที่ 11 จงเปรียบเทียบอัตราการแพร่ของแก๊ส NH3 และ CO2 (N=14 , H=1 , C=12 , O=12)
วิธีทำ =
=
=
= 1.6
= 1.6
ดังนั้น NH3 แพร่ได้เร็วกว่า CO2 1.6 เท่า
ตัวอย่างที่ 12 แก๊สไฮโดรเจนมีปริมาตร 1 dm3 มีความหนาแน่น 0.09 g/ dm3 แพร่กระจายหมดในเวลา 1 นาที จงคำนวณหาเวลาที่แก๊สแอมโมเนียซึ่งมีปริมาตร 1 dm3 ความหนาแน่น 0.71 g/ dm3 แพร่กระจายได้ภาวะเดียวกัน
วิธีทำ =
=
=
= 2.8 นาที
กลับไปที่เนื้อหา
ทฤษฎีจลน์ของแก๊ส
ทฤษฎีจลน์ของแก๊ส (Kinetic Theory of Gases) เป็นทฤษฎีที่พยายามอธิบายสมบัติต่างๆ ของแก๊สโดยศึกษาจากทิศทางเคลื่อนที่ของโมเลกุลแก๊สและลักษณะของโมเลกุลแก๊ส
ในช่วงแรก การเริ่มศึกษาทฤษฎีนี้โดยเจมส์ คลาร์ก แมกซ์เวลล์;นับเป็นจุดเริ่มต้นของการศึกษาอุณหพลศาสตร์ในมุมมองจุลภาค;คือศึกษาความสัมพันธ์ระหว่างพลังงานอุณหภูมิ;และการเคลื่อนที่ของอะตอม;โดยใช้กฎการเคลื่อนที่ของนิวตันโดยตรง แทนที่จะเป็นการศึกษาอุณหพลศาสตร์แบบดั้งเดิมที่ทำกันในมุมมองของระดับมหภาค;คือการศึกษาความสัมพันธ์ของค่าเฉลี่ยของคุณสมบัติต่าง ๆ ในระบบที่สามารถวัดได้ เช่น;ความดัน;หรือปริมาตร;ความสำเร็จของทฤษฎีนี้ ทำให้นักวิทยาศาสตร์ในสมัยนั้นเริ่มเชื่อว่า อะตอม มีอยู่จริง (ในสมัยนั้นยังมีการถกเถียงเรื่องนี้กันอยู่กว้างขวาง)
ทฤษฎีนี้คิดโดยอาศัยสมมติฐานต่อไปนี้
- แก๊สประกอบด้วยอนุภาคมีมวลที่เล็กมากเรียกว่า;โมเลกุล
- แก๊สเคลื่อนที่เป็นเส้นตรงด้วยความเร็วคงที่ในทิศทางที่ไม่แน่นอน จนกว่าที่จะชนกับภาชนะหรือชนกับโมเลกุลอื่น
- การชนระหว่างโมเลกุลของแก๊สสองโมเลกุลเป็นการชนแบบยืดหยุ่นสมบูรณ์
- การชนระหว่างโมเลกุลของแก๊สกับผิวภาชนะเป็นการชนแบบยืดหยุ่นสมบูรณ์
- แรงที่แก๊สกระทำต่อโมเลกุลอื่นมีขนาดน้อยมากจนไม่สนใจได้ ยกเว้นเมื่อชนกับโมเลกุลอื่นหรือชนกับภาชนะ
- ปริมาตรรวมของโมเลกุลแก๊สมีค่าน้อยมากเมื่อเทียบกับปริมาตรของภาชนะ
- ระยะห่างระหว่างโมเลกุลมีค่ามากเมื่อเทียบกับขนาดโมเลกุล
- พลังงานจลน์ของระบบขึ้นอยู่กับอุณหภูมิเท่านั้น ปัจจัยอื่นมีผลน้อยมาก
- ก๊าซจำนวนหนึ่งมีความดัน 275 กิโลนิวตัน ปริมาตร 0.09 ลูกบาศก์เมตรและอุณหภูมิ 185 องศาเซลเซียส ถ้าเกิดการเปลี่ยนแปลงสภาวะที่มีความดันคงที่จนอุณหภูมิลดลงเหลือ 15 องศาเซลเซียส จงหาปริมาณความร้อนและงานที่ใช้โดยกำหนดให้ค่าคงที่เฉพาะของก๊าซ R = 0.29 kJ/kg-K
แก๊สที่มีสมบัติครบตามสมมติฐานดังกล่าวจัดเป็นแก๊สในอุดมคติหรือแก๊สสมมุติ ในความเป็นจริงแก๊สที่จะเป็นไปตามนี้ได้ ต้องมีความหนาแน่นน้อยมากและมีอุณหภูมิสูง
การใช้ทฤษฎีจลน์อธิบายสมบัติของแก๊ส
ทฤษฎีจลน์ของแก๊สสามารถใช้อธิบายสมบัติของแก๊สในเรื่องที่เกี่ยวข้องกับอุณหภูมิ;ความดัน;ปริมาตร;และจำนวนโมเลกุล;(หรือโมล) ของแก๊สได้;
ทำไมแก๊สจึงมีรูปร่างและปริมาตรไม่แน่นอนขึ้นอยู่กับภาชนะที่บรรจุ
ตามทฤษฎีจลน์ของแก๊สทราบว่าโมเลกุลของแก๊สนั้นมีขนาดเล็กมาก ไม่มีแรงยึดเหนี่ยวระหว่างกันและกัน ดังนั้นไม่ว่าจะบรรจุแก๊สไว้ในภาชนะใดก็ตาม โมเลกุลของแก๊สก็จะเคลื่อนที่แพร่กระจายเต็มพื้นที่ภาชนะที่บรรจุ จึงทำให้แก๊สนั้นมีรูปร่างเหมือนภาชนะที่บรรจุ และแก๊สนั้นจะมีปริมาตรเท่าภาชนะที่บรรจุด้วย
ตามทฤษฎีจลน์ของแก๊สกล่าวว่าโมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่เป็นเส้นตรงอยู่ตลอดเวลาด้วยอัตราเร็วคงที่เกิดการชนกันเองและชนผนังภาชนะอยู่ตลอดเวลา การที่โมเลกุลของแก๊สเคลื่อนที่ชนผนังภาชนะอยู่ตลอดเวลา ทำให้เกิดแรงดัน;และผลรวมของแรงดันทั้งหมดที่มีต่อหนึ่งหน่วยพื้นที่เรียกว่า ความดันของแก๊ส
กลับไปที่เนื้อหา
-
7173 แก๊ส (gas) /lesson-chemistry/item/7173-gasเพิ่มในรายการโปรด




