การละลาย (Solubility)
![]()
ความหมายของการละลาย
การละลาย (Dissolve) คือ การที่สารชนิดหนึ่ง (ตัวถูกละลาย) แตกตัวออกเป็นอนุภาคเล็ก ๆ และแทรกตัวในสารอีกชนิดหนึ่ง (ตัวทำละลาย) โดยทั่วไปเราพิจารณาว่า
- สารที่มีปริมาณมากกว่าเป็น ตัวทำละลาย (Solvent)
- สารที่มีปริมาณน้อยกว่าเป็น ตัวถูกละลาย (Solute)
- สารละลายที่มีน้ำเป็นตัวทำละลายเรียกว่า aqueous solution (aq)
การที่อนุภาคของตัวถูกละลายจะเข้าไปแทรกตัวอยู่ระหว่างอนุภาคของตัวทำละลายได้หรือไม่ จะขึ้นอยู่กับแรงดึงดูดระหว่างโมเลกุลของตัวทำละลายกับตัวทำละลาย แรงดึงดูดโมเลกุลระหว่างตัวทำละลายกับตัวถูกละลาย และแรงดึงดูดระหว่างโมเลกุลตัวถูกละลายกับตัวถูกละลาย
ปกติแล้ว การที่ตัวถูกละลายจะละลายในตัวทำละลายหนึ่ง ๆ ได้นั้น สารทั้งสองชนิดจะต้องมีสมบัติเหมือนกัน
ตามกฎ like dissolves like ก็คือ ตัวถูกละลายที่มีขั้วจะละลายในตัวทำละลายที่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลมีขั้วเป็นแรงไดโพล-ไดโพล (dipole - dipole) แต่จะไม่ละลายในตัวทำละลายที่ไม่มีขั้ว เช่น เอทานอล (CH3CH2OH) ละลายในน้ำ (H2O) แต่ไม่ละลายในเฮกเซน (C6H14)
ในทางตรงข้าม ตัวถูกละลายที่ไม่มีขั้วจะละลายในตัวทำละลายที่ไม่มีขั้ว เพราะแรงดึงดูดระหว่างโมเลกุลไม่มีขั้ว เป็นแรงแวนเดอร์วาลล์ (Van der Waals force) เหมือนกัน แต่จะไม่ละลายในตัวทำละลายที่มีขั้ว เช่น คาร์บอนเตตระคลอไรด์ (CCl4) ละลายในเบนซีน (C6H6) ไม่ละลายในน้ำ แต่ถ้าในกรณีที่สารหนึ่งมีขั้วน้อยกว่าอีกสารตัวหนึ่ง ความสามารถในการละลายก็ลดลง หรืออาจจะกล่าวอีกนัยคือละลายได้เพียงบางส่วนเท่านั้น
จากที่กล่าวมาจะเป็นการละลายของของเหลวในของเหลวด้วยกัน ในกรณีที่เป็นการละลายของของแข็งในของเหลวก็สามารถอธิบายโดยใช้แรงดึงดูดระหว่างโมเลกุลเช่นเดียวกัน ถ้าตัวถูกละลายเป็นสารประกอบไอออนิก ซึ่งมีแรงดึงดูดระหว่างไอออนสูงมาก ก็จะละลายในตัวทำละลายที่มีขั้วแรงได้ดีกว่าตัวทำละลายที่มีขั้วน้อยกว่า เพราะฉะนั้น สารประกอบไอออนิกจึงละลายได้ดีในตัวทำละลายที่มีขั้วแรงมากๆ เช่น เกลือ (โซเดียมคลอไรด์ : NaCl) ละลายได้ดีในน้ำ มากกว่าในตัวทำละลายที่เป็นสารประกอบพวกไฮโดรคาร์บอน (hydrocarbon compounds)
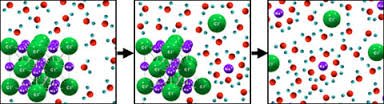
การละลายจะเป็นประเภทใดขึ้นอยู่กับชนิดของสารและตัวทำละลายที่เกี่ยวข้อง ในขณะที่สารเกิดการละลาย ตัวละลายที่เป็นของแข็งจะแยกตัวเป็นอนุภาคเล็กๆ และยึดเหนี่ยวกับโมเลกุลของตัวละลาย กระบวนการนี้เกี่ยวข้องกับพลังงาน ถ้าพลังงานที่ใช้แยกอนุภาคของของแข็งมีปริมาณน้อยกว่า พลังงานที่เกิดจากการยึดเหนี่ยวระหว่างอนุภาคของตัวละลายกับตัวทำละลาย การละลายของสารนี้จะปล่อยพลังงานออกมา สารละลายจะมีอุณหภูมิสูงขึ้น การละลายประเภทนี้เรียกว่า การละลายประเภทคายความร้อน
ในทางกลับกัน ถ้าพลังงานที่ใช้ในการแยกอนุภาคของตัวละลายที่เป็นของแข็งมีปริมาณมากกว่า พลังงานที่เกิดจากการยึดเหนี่ยวระหว่างอนุภาคของตัวละลายกับตัวทำละลาย การละลายของสารนี้จะดูดพลังงาน สารละลายจะมีอุณหภูมิต่ำลง การละลายประเภทนี้เรียกว่า การละลายประเภทดูดความร้อน การละลายของของเหลวหรือแก๊สในตัวทำละลายชนิดต่างๆ เกิดขึ้นได้ในทำนองเดียวกัน การละลายของสารแต่ละชนิดจะเป็นการละลายของสารประเภทดูดหรือคายความร้อนเป็นสมบัติเฉพาะตัวของสาร
กลับไปที่เนื้อหา
กระบวนการเกิดสารละลาย
สารละลาย คือ สารเนื้อเดียวที่เกิดจากสารบริสุทธิ์ตั้งแต่ 2 ชนิดขึ้นไปผสมกัน สารละลายจึงไม่เป็นสารบริสุทธิ์แต่เกิดจากการรวมตัวของสารบริสุทธิ์ โดยที่รวมกันแล้วยังต้องเป็นสารเนื้อเดียว (Homogeneous) เนื่องจากอนุภาคของตัวถูกละลายแทรกตัวในอนุภาคของตัวทำละลายอย่างสม่ำเสมอโดยองค์ประกอบที่มีปริมาณมากที่สุด เรียกว่าตัวทำละลาย (Solvent)ส่วนองค์ประกอบอื่น ๆ ที่มีปริมาณน้อยกว่า เรียกว่า ตัวถูกละลาย (Solute)
การที่อนุภาคของตัวถูกละลายเข้าไปแทนที่อนุภาคของตัวทำละลายเกิดขึ้นได้เมื่อ
- ทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลของตัวทำละลาย
- ทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลของตัวถูกละลาย
- สร้างแรงยึดเหนี่ยวระหว่างโมเลกุลของตัวทำละลายและตัวถูกละลาย
สารแต่ละชนิดมีกระบวนการละลายแตกต่างกัน ยกตัวอย่างเช่น การละลายของสารประกอบไอออนิก
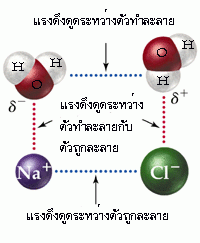
เมื่อให้สารประกอบไออออนิกละลายน้ำ จะเกิดการเปลี่ยนแปลง 2 ขั้นตอน ดังนี้
ขั้นที่ 1 ของแข็งไอออนิกสลายตัวเป็นไอออนบวกและไอออนลบในสภาวะก๊าซ ขั้นนี้เป็นการเปลี่ยนแปลงประเภทดูดพลังงาน เพราะต้องใช้พลังงานเพื่อสลายแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบ พลังงานที่ใช้ในขั้นนี้ เรียกว่า พลังงานแลตทิช หรือพลังงานโครงร่างผลึก (Lattice Energy)
ขั้นที่ 2 ไอออนบวกและไอออนลบในภวะก๊าซรวมตัวกับโมเลกุลของน้ำ กลายเป็นไอออนที่ถูกไฮเดรต เนื่องจากขั้นนี้เกิดแรงยึดเหนี่ยวระหว่างไอออนบวกและไอออนลบกับโมเลกุลของน้ำ ขั้นนี้จึงเป็นการเปลี่ยนแปลงประเภทคายพลังงาน พลังงานที่คายออกมาเรียกว่า พลังงานไฮเดรชัน เช่น เมื่อโซเดียมคลอไรด์ละลายน้ำจะเกิดการเปลี่ยนแปลง 2 ขั้น ดังนี้
การละลายน้ำของสารประกอบไอออนิก อาจเป็นการเปลี่ยนแปลงประเภทดูดความร้อนหรือคายความร้อนก็ได้ ขึ้นอยู่กับค่าพลังงานแลตทิช และพลังงานไฮเดรชัน พิจารณาได้ดังนี้
1. ถ้าพลังงานแลตทิชมากกว่าพลังงานไฮเดรชัน การละลายน้ำของสารประกอบไอออนิกนั้นเป็นการเปลี่ยนแปลงประเภทดูดความร้อน
2.ถ้าพลังงานแลตทิชน้อยกว่าพลังงานไฮเดรชัน การละลายน้ำของสารประกอบไอออนิกนั้นเป็นการเปลี่ยนแปลงประเภทคายความร้อน
3.ถ้าพลังงานแลตทิชเท่ากับพลังงานไฮเดรชัน การละลายน้ำของสารประกอบไอออนิกนั้นไม่มีการเปลี่ยนแปลงพลังงาน
4.ถ้าพลังงานแลตทิชมากกว่าพลังงานไฮเดรชันมาก ๆ สารประกอบไอออนิกนั้นละลายน้ำได้น้อยมาก จนถึอว่าไม่ละลาย เหตุที่ไม่ละลายเพราะว่า แรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบแข็งแรงมาก โมเลกุลของน้ำจึงไม่สามารถดึงให้แยกออกจากันได้ หรือกล่าวได้ว่า แรงดึงดูดระหว่างไอออนบวกกับไอออนลบแข็งแรงกว่าแรงดึงดูดระหว่างไอออนกับโมเลกุลของน้ำมาก
เหตุที่ไม่ละลายเพราะว่า แรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบแข็งแรงมาก โมเลกุลของน้ำจึง
ไม่สามารถดึงให้แยกออกจากันได้ หรือกล่าวได้ว่า แรงดึงดูดระหว่างไอออนบวกกับไอออนลบแข็งแรงกว่าแรงดึงดูด
ระหว่างไอออนกับโมเลกุลของน้ำมาก

ความสามารถในการละลายน้ำของสารประกอบไอออนิก
จากการพิจารณาว่าเมื่อสารไอออนิกละลายในน้ำเป็นการละลายประเภทดูดหรือคายความร้อน นอกจากพิจารณาจากพลังงานแลตทิช และพลังงานไฮเดรชันดังกล่าวข้างต้นแล้ว ยังสามารถพิจารณาได้จากควาสามารถในการละลายของสารไอออนิกนั้นในน้ำดังนี้
1. สารไอออนิกใดละลายน้ำได้มากขึ้นเมื่ออุณหภูมิสูงขึ้น การละลายของสารไอออนิกนั้น เป็นการละลายประเภทดูดความร้อน
2. สารไอออนิกใดละลายน้ำได้น้อยลงเมื่ออุณหภูมิสูงขึ้น การละลายของสารไอออนิกนั้น เป็นการละลายประเภทคายความร้อน
สรุปกระบวนการละลายของตัวถูกละลายในตัวทำละลาย ประกอบด้วย
- การทำลายแรงยึดเหนี่ยว solvent - solvent และ solute - solute ----> Hdiss มีค่าบวก (ดูดพลังงาน)
- การเกิดแรงยึดเหนี่ยว solvent -solute ----> Hbind มีค่าลบ (คายพลังงาน)
- ความร้อนของการละลาย Hsoln= Hdiss +Hbind
กลับไปที่เนื้อหา
สภาพการละลายได้
สภาพการละลายได้หมายถึง ความสามารถในการละลายได้ของตัวทำละลายจนอิ่มตัว ซึ่งนอกจากจะขึ้นอยู่กับชนิดของตัวละลายและตัวทำละลายแล้วยังขึ้นอยู่กับสภาพแวดล้อมอื่นๆ อีก ได้แก่ อุณหภูมิ และความดัน เช่น สภาพการละลายของโซเดียมคลอไรด์ในน้ำ 100 กรัม ณ อุณหภูมิ 20 องศาเซลเซียส เท่ากับ 36.0 กรัม แต่ถ้าเพิ่มอุณหภูมิเป็น 60 องศาเซลเซียส สภาพการละลายจะเปลี่ยนไปคือ ละลายได้เพิ่มขึ้นเป็น 37.3 กรัม ส่วนการละลายของแก๊สจะละลายได้มากขึ้นถ้าอุณหภูมิลดลงและความดันเพิ่มมากขึ้น เช่น การละลายของแก๊สคาร์บอนไดออกไซด์ในน้ำอัดลม
ความสามารถในการละลายของสาร
ณ อุณหภูมิเดียวกัน สารแต่ละชนิดละลายไม่เท่ากัน ทั้งนี้ขึ้นอยู่กับปัจจัยดังนี้คือ
1. ชนิดของตัวทำละลาย
2. ชนิดของตัวถูกละลาย
3. ความดัน ในกรณีที่ตัวถูกละลายมีสถานะเป็นก๊าซ ถ้าความดันเพิ่มจะละลายได้มากขึ้น
4. อุณหภูมิความสามารถในการละลายของสารบางชนิดเพิ่มขึ้น เมื่ออุณหภูมิเพิ่ม แต่บางชนิดละลายได้น้อยลง (ตกตะกอนผลึกออกมา) เมื่ออุณหภูมิเพิ่ม ดังกราฟปริมาณตัวถูกละลายกับอุณหภูมิ
การละลายได้ (solubility)
ในสารละลายของเหลว ที่อุณหภูมิหนึ่งๆ ปริมาณของตัวถูกละลายที่สามารถละลายในตัวทำละลายได้ จะมีปริมาณจำกัด โดยเรียกสารละลายที่ตัวถูกละลายไม่สามารถละลายเพิ่มได้อีกว่า สารละลายอิ่มตัว (saturated solution)
โดยปริมาณของตัวถูกละลายที่ละลายได้ในสารละลายอิ่มตัว ณ ที่อุณหภูมิหนึ่ง ๆ เรียกว่า การละลายได้ (solubility) เช่น เกลือแกง (NaCl) ละลายในน้ำ 100 ลูกบาศก์เซนติเมตร ที่อุณหภูมิ 100 oC สามารถละลายได้ 39.1 กรัม แต่ถ้าใส่เกลือไปมากกว่านี้ ส่วนที่เหลือก็จะไม่ละลาย
ในสารละลายที่อิ่มตัว ตัวถูกละลายจะมีอัตราการละลายจะเท่ากับอัตราการกลับคืนมาเป็นของแข็ง เพราะฉะนั้น ความเข้มข้นของสารละลายของสารละลายที่อิ่มตัวจะคงที่ ตัวถูกละลายที่ไม่สามารถละลายจะไม่ทำให้ความเข้มข้นของสารละลายเปลี่ยนแปลงแต่อย่างใด ถ้าตัวทำละลายเป็นน้ำ โดยทั่วไปนิยมบอกหน่วย หรือปริมาณของการละลายได้ของตัวถูกละลายเป็นกรัม (g) ในตัวทำละลายน้ำ 100 กรัม
นอกจากนั้น การละลายได้ของตัวถูกละลายจะขึ้นอยู่กับปัจจัยหลายประการ เช่น ธรรมชาติของตัวทำละลายและตัวถูกละลาย อุณหภูมิ และความดัน เป็นต้น
อิทธิพลของอุณหภูมิที่มีต่อการละลายได้
ถ้าการละลายของสารเป็นการ ดูดความร้อน ดังปฏิกิริยา
ตัวถูกละลาย (s) + ตัวทำละลาย (l) + ความร้อน <-------> สารละลาย (l)
เมื่ออุณหภูมิเพิ่มขึ้น โดยทั่วไป การละลายได้ของสารจะเพิ่มขึ้น
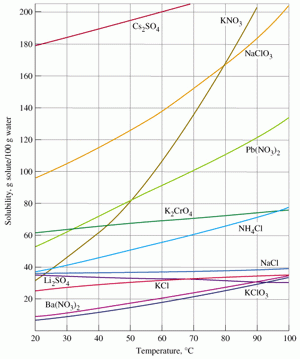
จากกราฟจากกราฟ จะเห็นได้ว่า เมื่ออุณหภูมิสูงขึ้น แนวโน้มของการละลายของสารในน้ำ 100 กรัม จะเพิ่มสูงขึ้น เราสามารถบอกความสามารถในการละลายได้จากความชันของกราฟ โดย สารที่มีความชันมาก เมื่อเพิ่มอุณหภูมิแนวโน้มการดูดความร้อนสูง ดังนั้น การละลายจะสูง เช่น KNO3, NaClO3, Cs2SO4 เป็นต้น ในทางกลับกันสารที่มีความชันน้อย เมื่อเพิ่มอุณหภูมิ แนวโน้มการดูดความร้อนจะน้อย ดังนั้น การละลายจะน้อย เช่น K2CrO4, KClO3 เป็นต้น
ในทางตรงกันข้าม ถ้าการละลายของตัวถูกละลายในตัวทำละลายเป็นการ คายความร้อน การให้ความร้อนแก่ระบบ จะยิ่งทำให้ตัวถูกละลายละลายได้น้อยลง อิทธิพลของความดันที่มีต่อการละลายได้ การเพิ่มความดันมีผลอย่างมากต่อการละลายของแก๊สในของเหลว มากกว่าการละลายของของแข็งในของเหลว
ตัวถูกละลาย (s) + ตัวทำละลาย (l) + ความดัน <-------> สารละลาย (l)
เมื่อเพิ่มความดันต่อแก๊ส พบว่า แก๊สสามารถละลายในของเหลวได้มากขึ้น จำนวนโมเลกุลของแก๊สที่อยู่เหนือของเหลวจะลดลง และความเข้มข้นของแก๊สในสารละลายจะเพิ่มขี้น
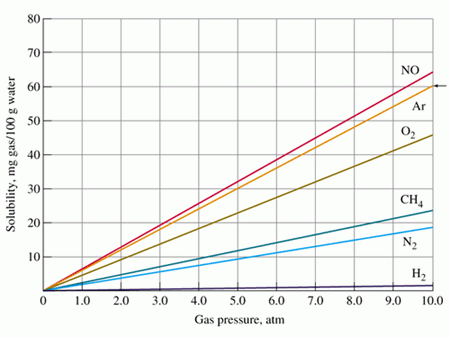
จากกราฟ จะเห็นได้ว่า แนวโน้มการละลายได้ของแก๊สในน้ำ 100 กรัม เพิ่มสูงขึ้น เมื่อเพิ่มความดันให้แก๊ส ความชันของกราฟจะบอกความสามารถในการละลาย เพราะฉะนั้นจากกราฟ เราสามารถเรียงลำดับความสามารถ ในการละลายของแก๊สได้ ดังต่อไปนี้ NO>Ar>O2>CH4>N2>H2 ตามลำดับ
กลับไปที่เนื้อหา
ความสามารถในการละลายของน้ำ
น้ำเป็นตัวทำละลายที่ดีมาก น้ำสามารถละลายสารเกือบทุกชนิดได้ จึงไม่น่าแปลกใจว่าน้ำทะเลหรือของเหลวอื่น ๆ ในธรรมชาติแม้กระทั่งสิ่งมีชีวิตจะมีน้ำเป็นองค์ประกอบหลัก คำว่าสารละลายจะประกอบด้วยองค์ประกอบสองส่วนด้วยกัน คือตัวทำละลาย(solvent)ซึ่งเป็นของเหลวและมีสัดส่วนในปริมาณมากกว่า องค์ประกอบอีกตัวหนึ่ง คือตัวถูกละลาย(solute)ซึ่งมักจะเป็นของเหลวหรือก๊าซ ในสารละลายใด ๆ ที่มีการผสมเป็นเนื้อเดียวกัน หมายถึงตัวถูกละลายแพร่กระจายไปใน ตัวทำละลายได้อย่างทั่วถึง มีคุณสมบัติเดียวกันทุกส่วน ต่างจากของผสม (mixture)ซึ่งตัวทำละลายและตัวถูกละลาย จะไม่ผสมเป็นเนื้อเดียวกัน คุณสมบัติในแต่ละส่วนอาจไม่เหมือนกัน
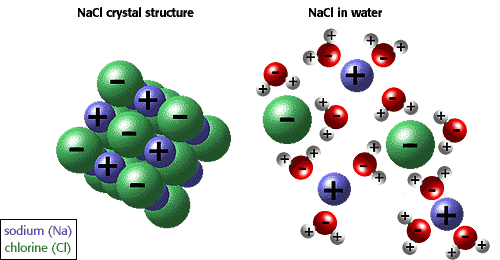
ความสามารถในการเป็นตัวทำละลายที่ดีของน้ำนั้นเนื่องมาจากคุณสมบัติความมีขั้วในโมเลกุลของน้ำ ถ้าพิจารณาการละลายของเกลือแกงในน้ำไอออน (ion)ซึ่งหมายถึงอะตอมหรือกลุ่มของอะตอมที่มีประจุอันเนื่องมาจากการรับหรือสูญเสียอิเล็กตรอน ซึ่งแตกต่างไปจากการใช้อิเล็กตรอนร่วมกันในพันธะโคเวเลนต์โดยโซเดียมไอออนในเกลือจะสูญเสียอิเล็กตรอน ในขณะที่คลอไรด์จะเป็นตัวรับอิเล็กตรอน ทำให้อะตอมของโซเดียมและคลอไรด์ในเกลือยึดกันอยู่ โดยพันธะมาจากแรงยึดเหนี่ยวระหว่างอะตอมต่างประจุเราเรียกพันธะแบบนี้ว่าพันธะไอออนิก (ionic bond)เมื่อเกลือละลายในน้ำ (ภาพที่ 5.3) ความมีขั้วของน้ำจะแยกอะตอมของโซเดียมและคลอไรด์ออกจากกัน ให้สังเกตว่า โซเดียมคลอไรด์ไม่ได้อยู่ในสภาพของเกลือในน้ำ อะตอมของธาตุทั้งสองจะแยกออกจากกัน เมื่อเกิดการระเหยของน้ำ อะตอมทั้งสองจึงสร้างตัวเป็นผลึกเกลือ
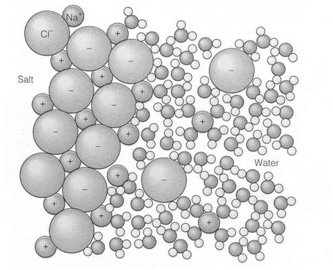
ภาพการละลายของเกลือซึ่งเป็นสารประกอบไอออนิกในน้ำ ไอออนของโซเดียมและคลอไรด์จะถูกล้อมรอบด้วยโมเลกุลของน้ำโดยหันด้านประจุตรงข้ามมาล้อมรอบ
ที่มา Garrison (2007)
ในทางตรงกันข้าม น้ำมันไม่สามารถละลายน้ำได้ถึงแม้ว่าจะเขย่าให้ผสมกันอย่างแรง เมื่อน้ำมันผสมกับน้ำลักษณะของสารดังกล่าวนี้จะเป็นของผสม เนื่องจากโมเลกุลของน้ำมันเป็นสารประกอบไม่มีขั้ว ซึ่งหมายถึงปลายทั้งสองด้านของน้ำมัน จะไม่มีประจุบวกหรือประจุลบ คุณสมบัติดังกล่าวจะมีข้อดีสำหรับเซลล์ของสิ่งมีชีวิตที่มีผนังเซลล์เป็นสารประกอบประเภทไขมัน
เราทราบกันดีว่าน้ำทะเลเป็นสารประกอบที่มีไอออนหรือสารประกอบที่ไม่ใช่ไอออนละลายอยู่มาก อนุภาคเหล่านี้สามารถเคลื่อนที่ไปยังมวลน้ำอื่นได้โดยขบวนการแพร่ (diffusion)ซึ่งหมายถึงการเคลื่อนที่แบบสุ่มของอนุภาคในสารละลาย ถ้าเราใส่เกลือเม็ดลงในน้ำ น้ำจะทำการละลายเม็ดเกลืออย่างรวดเร็ว ในระยะแรกความเข้มข้นของโซเดียมไอออน และคลอไรด์ไอออนในบริเวณใกล้ก้อนเกลือจะสูง และเมื่อน้ำละลายเม็ดเกลือโดยสมบูรณ์แล้วไอออนทั้งสองจะแพร่ไปยังทุกส่วนของน้ำ ทำให้กลายเป็นสารละลายที่เป็นเนื้อเดียวกัน ก๊าซในบรรยากาศก็สามารถแพร่ลงสู่ผิวหน้าน้ำได้โดยขบวนการแพร่เช่นเดียวกัน
เมื่อไม่มีสารใด ๆ สามารถจะละลายในน้ำได้แล้วจะถือว่าสารละลายนั้นเป็นสารละลายอิ่มตัว ซึ่งในความเข้มข้นระดับนี้อัตราการละลายของสารที่จะถูกละลายได้ใหม่จะเท่ากับอัตราการตกผลึกของสารเดิมในน้ำนั้น
กลับไปที่เนื้อหา
อันตรายจากการใช้สารทำละลาย
สารทำละลาย (Solvents) คือสารที่มีคุณสมบัติในการละลายสารอื่นได้ดี ระเหยได้ง่าย มีความไวไฟสูง มักมีใช้กัน ในอุตสาหกรรมประเภทต่างๆ หรือ มีผสมอยู่ในผลิตภัณฑ์ที่ใช้กันโดยทั่วไป เช่นการผสมสี การพ่นสี แลคเกอร์ กาวยาง น้ำยาทำความสะอาดชิ้นงานและเครื่องจักร น้ำยาขจัดคราบรอยเปื้อน น้ำยาลบคำผิด ฯลฯ ตัวอย่างของสารที่ใช้กัน เช่น ทินเนอร์ น้ำมันเบนซิน โทลูอีน ไซลีน ไตรคลอ โรอีเธน ไตรคลอโรเอทธีลีน เป็นต้น
การระเหยของสาร คือการที่สารนั้นกลายเป็นส่วนหนึ่งของอากาศ เราหายใจเข้าไปแล้วสารจะถูกซึ่มเข้าสู่กระแสเลือด ผ่าน หัวใจแล้วถูกสูบฉีดเข้าไปสู่อวัยวะต่าง ๆ ภายในร่างกายและทำอันตรายต่ออวัยวะนั้น ๆ เช่น ตับไต สมองและเป็นอันตรายต่อสุขภาพร่างกาย อันตรายของสารทำละลายต่อสุขภาพ
- อันตรายต่อระบบทางเดินหายใจ หากหายใจเอาไอระเหยของสารเข้าไปมาก ๆ จะรู้สึกว่าหายใจขัด มีอาการระคายเคืองในคอ มึนศีรษะ คลื่นเหียน ระบบทางเดินอาหารอาจหยุดทำงานได้
- เรื้อรัง สารเคมีจะเข้าสู่ถุงลมปอด ซึ่มเข้าสู่กระแสเลือด และนำไปสู่อวัยวะภายในต่าง ๆ ทำให้เกิดโรคตับ โรคไต หรือ ทำลายระบบประสาทส่วนกลาง ทำลายเนื้อเยื่อของระบบทางเดินหายใจ เมื่อได้รับสารทำละลายบ่อย ๆ อาจทำให้ติดสารนั้นได้ เช่น การติดทินเนอร์



 เฉียบพลันสารทำละลายมีคุณสมบัติในการละลายไขมันได้ดี หากสัมผัสที่ผิวหนังจะละลายไขมันที่ผิวหนัง ทำให้ผิวหนัง แห้ง แตก ระคายเคือง และไหม้ได้ อีกทั้งยังสามารถซึมผ่านผิวหนังเข้าสู่กระแสเลือด และทำอันตรายเช่นเดียวกับสารที่เข้าทางระบบ ทางเดินหายใจ
เฉียบพลันสารทำละลายมีคุณสมบัติในการละลายไขมันได้ดี หากสัมผัสที่ผิวหนังจะละลายไขมันที่ผิวหนัง ทำให้ผิวหนัง แห้ง แตก ระคายเคือง และไหม้ได้ อีกทั้งยังสามารถซึมผ่านผิวหนังเข้าสู่กระแสเลือด และทำอันตรายเช่นเดียวกับสารที่เข้าทางระบบ ทางเดินหายใจ

 เรื้อรัง หากสัมผัสกับสารทำละลายเป็นเวลานาน ๆ ทำให้เป็นโรคผิวหนังอักเสบ (Contact Dermatitis)โดยมีอาการเป็นตุ่ม พุพอง รู้สึกเจ็บง่ายต่อการติดเชื้อแบคทีเรีย ซึ่งจะทำให้เกิดอาการอักเสบรุนแรงขึ้น
เรื้อรัง หากสัมผัสกับสารทำละลายเป็นเวลานาน ๆ ทำให้เป็นโรคผิวหนังอักเสบ (Contact Dermatitis)โดยมีอาการเป็นตุ่ม พุพอง รู้สึกเจ็บง่ายต่อการติดเชื้อแบคทีเรีย ซึ่งจะทำให้เกิดอาการอักเสบรุนแรงขึ้น



 เฉียบพลัน ถ้าสารทำละลายกระเซ็นเข้าตาจะทำให้เกิดอาการแสบตา ตาแดง น้ำตาไหล เกิดอาการระคายเคือง
เฉียบพลัน ถ้าสารทำละลายกระเซ็นเข้าตาจะทำให้เกิดอาการแสบตา ตาแดง น้ำตาไหล เกิดอาการระคายเคือง

 เรื้อรัง เกิดจากการทำงานในบริเวณที่มีละออง ไอระเหยของสารทำลายเป็นเวลานาน ๆ มีอาการคือ ตาพร่ามัว เยื่อบุตาระคายเคือง สมรรถภาพการมองเห็นเสื่อมแบบถาวร
เรื้อรัง เกิดจากการทำงานในบริเวณที่มีละออง ไอระเหยของสารทำลายเป็นเวลานาน ๆ มีอาการคือ ตาพร่ามัว เยื่อบุตาระคายเคือง สมรรถภาพการมองเห็นเสื่อมแบบถาวร

 การหายใจ ให้นำผู้นั้นออกมารับอากาศบริสุทธิ์ บางครั้งอาจต้องทำการผายปอด หากผู้ได้รับสารหยุดหายใจ
การหายใจ ให้นำผู้นั้นออกมารับอากาศบริสุทธิ์ บางครั้งอาจต้องทำการผายปอด หากผู้ได้รับสารหยุดหายใจ
 การกิน ห้ามให้ดื่มกินอะไรตามไป นอกจากมีระบุไว้ในเอกสารความปลอดภัย ของสารเคมีตัวนั้น ๆ (MSDS : Material Safety Data Sheet) แล้วนำส่งแพทย์ทันที
การกิน ห้ามให้ดื่มกินอะไรตามไป นอกจากมีระบุไว้ในเอกสารความปลอดภัย ของสารเคมีตัวนั้น ๆ (MSDS : Material Safety Data Sheet) แล้วนำส่งแพทย์ทันที
 ผิวหนัง เปิดน้ำให้ชะผ่านบริเวณที่โดนสารละลาย 15-20 นาที โดยห้ามทำการขัดถูบาดแผล ขณะเดียวกันก็ถอดเสื้อผ้าที่เปื้อนสารเคมีออกในขณะที่น้ำยังชะอยู่ ปิดแผลด้วยผ้า หรือวัสดุที่ผ่านการฆ่าเชื้อแล้ว ห้ามใส่ครีมลงบนแผล ดูอาการหากไม่ดีขึ้น ให้พาไปพบแพทย์
ผิวหนัง เปิดน้ำให้ชะผ่านบริเวณที่โดนสารละลาย 15-20 นาที โดยห้ามทำการขัดถูบาดแผล ขณะเดียวกันก็ถอดเสื้อผ้าที่เปื้อนสารเคมีออกในขณะที่น้ำยังชะอยู่ ปิดแผลด้วยผ้า หรือวัสดุที่ผ่านการฆ่าเชื้อแล้ว ห้ามใส่ครีมลงบนแผล ดูอาการหากไม่ดีขึ้น ให้พาไปพบแพทย์
 ตา ให้ไปที่ที่ล้างตาที่ใกล้ที่สุดทันที หากไม่มีให้ไปที่ก๊อกน้ำ สำหรับผู้ที่ใส่คอนแทคเลนส์ให้ถอดออกเพราะ จะเป็นตัวจับสารทำละลายไว้ ให้น้ำชะล้างตา 15-20 นาที โดยล้างจากหัวตาไปหางตา โดยให้ตาที่โดนสารนั้นอยู่ข้างล่างเพื่อไม่ไห้ตาอีกข้างรับสารไปด้วย ห้ามใส่ครีม ดูอาการหากยังไม่ดีขึ้นให้พาไปพบแพทย์
ตา ให้ไปที่ที่ล้างตาที่ใกล้ที่สุดทันที หากไม่มีให้ไปที่ก๊อกน้ำ สำหรับผู้ที่ใส่คอนแทคเลนส์ให้ถอดออกเพราะ จะเป็นตัวจับสารทำละลายไว้ ให้น้ำชะล้างตา 15-20 นาที โดยล้างจากหัวตาไปหางตา โดยให้ตาที่โดนสารนั้นอยู่ข้างล่างเพื่อไม่ไห้ตาอีกข้างรับสารไปด้วย ห้ามใส่ครีม ดูอาการหากยังไม่ดีขึ้นให้พาไปพบแพทย์


 1. ผู้ใช้ควรศึกษาคุณสมบัติและอันตรายของสารทำละลายชนิดที่ใช้อยู่ ซึ่งหาดูได้จากเอกสารความปลอดภัยของสารเคมี (MSDS : Material Safety Data Sheet) หรือฉลากที่ติดมากับผลิตภัณฑ์
1. ผู้ใช้ควรศึกษาคุณสมบัติและอันตรายของสารทำละลายชนิดที่ใช้อยู่ ซึ่งหาดูได้จากเอกสารความปลอดภัยของสารเคมี (MSDS : Material Safety Data Sheet) หรือฉลากที่ติดมากับผลิตภัณฑ์ 2. ใช้สารทำละลายด้วยความระมัดระวัง และถูกต้องตามคำแนะนำ
2. ใช้สารทำละลายด้วยความระมัดระวัง และถูกต้องตามคำแนะนำ 3. ในส่วนของงานที่ใช้สารทำละลายควรทำในระบบปิด หรือมีการระบายอากาศที่ดี ควรแยกการทำงานนี้ออกจากส่วนอื่น เพื่อป้องกันผู้อื่นไม่ให้รับสารเข้าไป
3. ในส่วนของงานที่ใช้สารทำละลายควรทำในระบบปิด หรือมีการระบายอากาศที่ดี ควรแยกการทำงานนี้ออกจากส่วนอื่น เพื่อป้องกันผู้อื่นไม่ให้รับสารเข้าไป 4. ป้องกันไม่ให้สารทำละลายเข้าสู่ร่างกาย โดยสวมอุปกรณ์ป้องกันที่ถูกต้อง และเหมาะสมขณะทำงาน รวมทั้งทราบถึงวิธีการใช้และการบำรุงรักษาอย่างถูกวิธี
4. ป้องกันไม่ให้สารทำละลายเข้าสู่ร่างกาย โดยสวมอุปกรณ์ป้องกันที่ถูกต้อง และเหมาะสมขณะทำงาน รวมทั้งทราบถึงวิธีการใช้และการบำรุงรักษาอย่างถูกวิธี 5. ห้ามใช้สารทำละลายล้างทำความสะอาดมือหรืออวัยวะอื่น ๆ
5. ห้ามใช้สารทำละลายล้างทำความสะอาดมือหรืออวัยวะอื่น ๆ 6. ห้ามสูบบุหรี่ขณะทำงาน เพราะทำให้สารทำละลายเข้าสู่ร่างกาย และอาจเกิดอัคคีภัยได้เพราะมีความไวไฟสูง
6. ห้ามสูบบุหรี่ขณะทำงาน เพราะทำให้สารทำละลายเข้าสู่ร่างกาย และอาจเกิดอัคคีภัยได้เพราะมีความไวไฟสูง 7. หลังทำงานควรล้างมือหรืออาบน้ำให้สะอาดด้วยสบู่
7. หลังทำงานควรล้างมือหรืออาบน้ำให้สะอาดด้วยสบู่



อุปกรณ์ป้องกันระบบทางเดินหายใจชนิดป้องกันละออง ไอระเหยของสารเคมี

อุปกรณ์ป้องกันสารเคมีกระเด็นเข้าตา

ถุงมือยาง ผ้ากันเปื้อนสำหรับสารเคมี ตามชนิดของสารทำละลาย


1. ต้องจัดสถานที่สำหรับเก็บสารทำละลายให้เป็นสัดส่วน ห้ามเก็บรวมกับสารเคมีตัวอื่น ๆ เช่น กรด ด่าง หรือสารไวไฟ
2. เก็บสารทำละลายไว้ในภาชนะปิด อยู่ในที่เย็น การระบายอากาศดี และควรแบ่งสารทำละลายมาใช้คราวละน้อย ๆ
3. กรณีการเกิดเพลิงไหม้ สารทำละลายบางชนิดสามารถสลายตัวแล้วให้แก๊สพิษ ดังนั้นในการดับเพลิงต้องสวมอุปกรณ์ ป้องกันระบบหายใจ
4. น้ำยาดับเพลิงควรใช้ชนิดโฟม ที่ไม่ละลายในตัวทำละลาย
5. ในกรณีทำสารทำละลายหก รั่ว ต้องรีบดำเนินการควบคุมให้เร็วที่สุด โดยปฎิบัติตามคู่มือแนะนำความปลอดภัย
6. สารทำละลายบางชนิดเป็นสารไวไฟ การนำมาใช้งานจะต้องระมัดระวัง ห่างจากแหล่งความร้อนหรือประกายไฟ อุปกรณ์ไฟฟ้าที่จะต้องใช้ต้องเป็นแบบป้องกันการเกิดประกายไฟ หรือการระเบิด เช่น มอเตอร์ สวิทช์

กลับไปที่เนื้อหา



