ทฤษฎีจลน์ของแก๊ส (Kinetic Theory of Gases)
กฏข้อที่หนึ่งของเทอร์โมโดนามิกส์
สำหรับการศึกษาในหัวข้อนี้ เรากำหนดให้จักรวาลสามารถแบ่งออกได้เป็นสองส่วน1)ระบบ(system)คือ อะไรก็ได้ในจักรวาลนี้ ที่เราสนใจที่จะศึกษาทำความเข้าใจ ซึ่งอาจจะเป็นเครื่องยนต์, ปฏิกิริยาเคมี, เซลล์ของสิ่งมีชีวิตและอื่นๆ2)สิ่งแวดล้อม(surrounding)คือ บริเวณอื่นที่เราใช้ในการสังเกตการเปลี่ยนแปลงที่เกิดขึ้นภายในระบบ
โดยทั่วไประบบสามารถแบ่งออกได้เป็นดังนี้
1) ระบบเปิด(open system)คือ ระบบที่สามารถเกิดการถ่ายเทมวลสาร เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้
2) ระบบปิด(closed system)คือ ระบบที่ไม่สามารถเกิดการถ่ายเทมวลสาร เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้(แต่อาจเกิดการถ่ายเทพลังงานได้)
3) ระบบโดดเดี่ยว(isolated system)คือ ระบบที่ไม่สามารถเกิดการถ่ายเทมวลสารและพลังงาน เข้า-ออก จากระบบไปสู่สิ่งแวดล้อมได้
การศึกษาวิชาเทอร์โมไดนามิกส์ ส่วนใหญ่จะสนใจการเปลี่ยนแปลงพลังงานที่เกิดขึ้นเมื่อเกิดกระบวนการต่างๆ เช่น การหลอมเหลวของสสาร, การเกิดปฏิกิริยาเคมี และอื่นๆ สำหรับกระบวนการที่เกิดขึ้นแล้วมีการให้พลังงานกับสิ่งแวดล้อม เราเรียกว่า กระบวนการแบบคายความร้อน (exothermic process) ตัวอย่างของกระบวนการเปลี่ยนแปลงแบบนี้ก็ได้แก่ การเผาไหม้ต่างๆในทางตรงกันข้ามถ้ากระบวนการที่เกิดขึ้นแล้วมีการรับพลังงานจากสิ่งแวดล้อม เราเรียกว่า กระบวนการแบบดูดความร้อน(endothermic process)ซึ่งได้แก่ การหลอมเหลว, การระเหย ของสสาร
กฏข้อที่หนึ่งของเทอร์โมไดนามิกส์ กล่าวว่า "พลังงานทั้หมดในระบบมีค่าคงที่ พลังงานไม่มีการสูญหาย แต่สามารถเปลี่ยนรูปได้"
พลังงานภายในนี้สามารถเปลี่ยนรูปไปมาระหว่างพลังงาน 2 รูปแบบด้วยกัน
1.พลังงานความร้อนที่เข้าหรือออกจากระบบ
2.งานที่เกิดขึ้นจากระบบ
ซึ่งสามารถเขียนในรูปความสัมพันธ์ได้ดังนี้
ΔQ = พลังงานความร้อนที่เข้าหรือออกจากระบบ
ΔW = งานเนื่องจากการขยายตัวของแก๊ส
ΔU = พลังงานภายในระบบที่เพิ่มขึ้น
ข้อสังเกตุ
1.ถ้าต้องการคำนวณหาปริมาณความร้อนจากวัตถุที่เป็นของแข็งหรือของเหลว
2.ถ้าต้องการคำนวณหปริมาณความร้อนจากแก๊สให้ใช้สมการ
ความหมายของสมการนี้ คือ เมื่อเราให้ความร้อน (Q) กับระบบแล้ว ความร้อนบางส่วน จะถูกใช้ไปสำหรับการทำงาน (W) และความร้อนส่วนที่เหลือ จึงจะไปเพิ่มพลังงานภายใน (U) ให้กับระบบ เพื่อให้เข้าใจมากขึ้นลองสังเกตรูปด้านล่างต่อไป
จากรูปคือเราให้ความร้อน Q แก่กระบอกสูบซึ่งบรรจุสิ่งที่เราสนใจ โดยมีสถานะเป็น ของแข็ง ของเหลว หรือก๊าซ ก็ได้ทั้งนั้น แต่ส่วนใหญ่เรากล่าวกันอยู่บ่อยๆ คือ บรรจุก๊าซ ในที่นี้ขอพิจารณาสิ่งที่เราสนใจในกระบอกสูบ ทั้ง 3 สถานะ แต่ในส่วนของสถานะ ก๊าซ จะกล่าวถึงมากกว่าของแข็งและ ของเหลว
กลับไปที่เนื้อหา
อุณหถูมิและความดันผสมตามทฤษฎีจลน์ของแก๊ส
เราทราบมาแล้วว่า แก๊สทุกชนิด ไม่ว่าจะเป็นแก๊สออกซิเจน คาร์บอนไดออกไซด์ หรือแก๊สไฮโดรเจน แก๊สเหล่านี้ต่างก็ต้องการปริมาตรและมีความดันอยู่ค่าหนึ่งตามปริมาณของแก๊สและอุณหภูมินั้นๆ แต่ถ้าเรานำแก๊สสองชนิดหรือมากกว่าสองชนิดขึ้นไปมาผสมกันโดยแก๊สเหล่านั้นต้องไม่ทำปฏิกิริยากัน พฤติกรรมของแก๊สที่ผสมกันนั้น โดยเฉพาะในเรื่องของความดันจะเป็นไปอย่างไร
จอห์น ดาลตันได้สนใจศึกษาเกี่ยวกับ ความดันของแก๊สผสมต่างๆ และเขาก็ได้ตั้งกฏความดันย่อยของแก๊สขึ้นมาในปี ค.ศ. 1801 ด้วย ข้อสรุปกฏความดันย่อยกล่าวว่า"ความดันรวมของแก๊สผสมจะเท่ากับผลรวมของความดันย่อยของแก๊สแต่ละชนิดที่ผสมกัน "

จอห์น ดอลตัน (John Dalton) ค.ศ. 1776- 1844
พิจารณารูปด้านล่างเมื่อแก๊ส A และ B มีปริมาตรอย่างละ 5 ลิตร เมื่อนำแก๊ส A และ B มาบรรจุรวมกันในภาชนะใหม่ขนาด 5 ลิตรเท่าเดิม ความดันใหม่ของแก๊สผสมจะเท่ากับ ผลรวมความดันของ แก๊ส A และ B ตามสมการ
Ptotal= PA+PB
เมื่อ Ptotal คือความดันรวมของแก๊สผสม
PA และ PB คือความดันของแก๊ส A และ B ตามลำดับ
ตัวอย่างเช่น ถ้าเรามี แก๊สไฮโดรเจน 0.5 โมล ปริมาตร 5 ลิตร ที่อุณหภูมิ 20 องศาเซลเซียส ความดันเท่ากับ 2.4 บรรยากาศ ดังรูป ก และ ในรูป ข มีแก๊สฮีเลียม 1.25 โมล ปริมาตร 5 ลิตร ที่อุณหภูมิ เดียวกัน ความดันของแก๊สฮีเลียม 6 บรรยากาศ
เมื่อนำแก๊สไฮโดรเจนและแก๊สฮีเลียมจากรูป ก และรูป ข มารวมกันในถังปริมาตร 5 ลิตร และอุณหภูมิเท่าเดิม 20 องศาเซลเซียส จะได้แก๊สผสมในรูป ค. ด้านล่าง ซึ่งความดันรวมจะเท่ากับความดันของแก๊สทั้งสองรวมกัน นั่นคือ 8.4 atm
แก๊สผสมนี้จะมีจำนวนโมลและความดันเพิ่มขึ้น ความดันใหม่ที่เกิดขึ้นก็เป็นผลรวมของแก๊สทั้งสองนั่นเอง ดังนั้นถ้าพูดถึงความดันของแก๊สผสมจะมีคำศัพท์ สองคำที่ควรรู้ คือความดันรวมและความดันย่อย
ความดันรวมคือความดันทั้งหมดที่เราทำการวัดได้หลังจากที่แก๊สสองชนิดหรือมากกว่าผสมเข้าเป็นเนื้อเดียวกันเรียบร้อย ส่วนความดันย่อยก็หมายถึงความดันของแก๊สแต่ละชนิดที่เป็นองค์ประกอบอยู่ในแก๊สผสมนั้นๆ
ในความเป็นจริง เราจะสามารถวัดความดันของแก๊สได้นั้น ก็เป็นความดันรวมของแก๊สทั้งหมดที่อยู่ในระบบ แต่ถ้าเราอยากจะรู้ความดันย่อยเราสามารถคำนวณได้จากกฏของดอลตัน มาพิจารณาดูความสัมพันธ์ของกฏความดันย่อยต่อไปอีก
นอกจากนี้ ดาลตันยังได้ตั้งข้อสังเกตว่า ที่ว่างระหว่างโมเลกุลของแก๊สในภาชนะปิดใดๆมีมาก (หมายถึง ระยะทางที่ใกล้ที่สุดที่จะพบแก๊สสองโมเลกุลอยู่ติดกันนั้นมีระยะทางมากกว่ารัศมีของโมเลกุลแก๊สมาก ๆ)ดังนั้นแก๊สแต่ละโมเลกุลในภาชนะจึงไม่ไปรบกวนการเคลื่อนที่ของโมเลกุลอื่น แต่ถ้ามีการเพิ่มอุณหภูมิหรือเพิ่มความดันในภาชนะมากขึ้นก็จะส่งผลทำให้แก๊สแต่ละโมเลกุลเกิดแรงกระทำต่อกันได้เพิ่มขึ้น
กลับไปที่เนื้อหา
แก๊สอุดมคติ (Ideal gas)
แก๊ส (gas) คือ สถานะของสารที่มีสมบัติทั่วไป ได้แก่
- แก๊สมีปริมาตรไม่แน่นอน เปลี่ยนไปตามภาชนะที่บรรจุ เมื่อบรรจุแก๊สในภาชนะใดก็จะมีรูปร่างเหมือนภาชนะนั้น เช่น แก๊สที่บรรจุในลูกโป่ง
- เมื่อแก๊สอยู่ในภาชนะที่เปลี่ยนแปลงรูปรูปร่างได้ ปริมาตรของแก๊สจะขึั้นอยู่กับอุณหภูมิ ความดัน และจำนวนโมล เช่น แก๊สคาร์บอนไดออกไซด์ 1 โมล มีปริมาตร 22.4 dm3ที่อุณหภูมิ 00C ความดัน 1 บรรยากาศ หรือที่เรียกว่า STP (standard temperature and pressure)
- แก๊สมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยมาก จึงทำให้แก๊สสามารถแพร่ได้ และแพร่ได้อย่างรวดเร็ว
- การผสมแก๊สตั้งแต่สองชนิดขึ้นไป จะเป็นสารละลาย (Solution) เนื่องจากแก๊สแต่ละชนิดจะแพร่ผสมกันอย่างสมบูรณ์ทุกส่วน
- แก๊สส่วนใหญ่ไม่มีสีและโปร่งใส่เช่นแก๊สออกซิเจน(O2)แก๊สไฮโดเจน(H2) แก๊สคาร์บอนไดออกไซด์(CO2)แต่แก๊สบางชนิดมีสี เช่น แก๊สไนโตเจนไดออกไซด์ (NO2) มีสีน้ำตาลแดง แก๊สคลอรีน(Cl2) มีสีเขียวแกมเหลือง แก๊สโอโซน (O3) ที่บริสุทธิ์มีสีน้ำเงินแก่ เป็นต้น
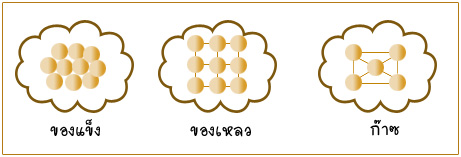
การจัดเรียงโมโลกุลของสารใสสถานะต่างๆ กัน
http://www.myfirstbrain.com/student_view.aspx?ID=69776
ปัจจุบันแก๊สอาจแบ่งออกได้เป็นสามชนิด ดังนี้
1.แก๊สอะตอมเดี่ยว(monatomic gas)หนึ่งโมเลกุลของแก๊สชนิดนี้ประกอบด้วยอะตอมเพียงอะตอมเดียวเช่น แก๊สฮีเลียม(He) นีออน(Ne) อาร์กอน(Ar)
2.แก๊สอะตอมคู่(diatomic gas)หนึ่งโมเลกุลของแก๊สชนิดนี้ประกอบด้วยอะตอม 2 อะตอม เช่น แก๊สไฮโดรเจน(H2) ออกซิเจน (O2) ไนโตรเจน(N2)
3.แก๊สหลายอะตอมหนึ่งโมเลกุลของแก๊สชนิดนี้ประกอบด้วยอะตอมตั้งแต่ 3 อะตอม ขึ้นไป เช่นแก๊สโอโซน(O3) มีเทน(CH4) แอมโมเนีย(NH3) ซัลเฟอร์ไดออกไซด์(SO2) เป็นต้น
ความรู้เพิ่มเติมเลขอโวกาโดร(Avogadro’s number,NA) คือ จำนวนอะตอมของคาร์บอน 12 (C-12) ซึ่งมีมวลรวมกันได้ 12 กรัม ปัจจุบันพบว่าNAมีค่าเท่ากับ 6.02 x 1023โมเลกุลต่อโมล
สมบัติของแก๊สอุดมคติ (Ideal gas)
ในการศึกษาสมบัติของแก๊ส เพื่อให้ง่ายต่อการศึกษา เราพิจารณาว่าแก๊สเป็นแก๊สอุดมคติ (Ideal gas) ซึ่งนักฟิสิกส์คนสำคัญที่ศึกษาสมบัติของแก๊สได้แก่ลุดวิก เอดูอาล โบลต์ซมานน์(Ludwig Eduard Boltzmann)และเจมส์ คลาร์ก แมกซ์เวลล์ (James Clerk Maxwell)ผลงานการศึกษาของพวกเขาได้พัฒนามาเป็นทฤษฎีจลน์ของแก๊สในปัจจุบัน โดยมีแนวคิดที่ว่า สมบัติทางกายภาพของแก๊สนั้นอธิบายได้จากการเคลื่อนที่ของแต่ละโมเลกุลของแก๊สเหล่านั้นโดยการใช้แบบจำลองหรือทฤษฎีในระดับจุลภาค (microscopic model) คือพิจารณาคุณสมบัติของโมเลกุลของแก๊สเพียงหนึ่งหรือสองโมเลกุลเพื่อเป็นตัวแทนของโมเลกุลล้านๆ โมเลกุลในระดับมหภาค (macroscopic model) ซึ่งแก๊สอุดมคติมีสมบัติดังนี้
1. แก๊สอุดมคติประกอบด้วยอนุภาคขนาดเล็กมาก อาจเรียกว่า"point mass" โดยอนุภาคขนาดเล็กนี้มีมวลเกือบเป็นศูนย์ นั่นหมายความว่าเราสามารถอนุมานให้แก๊สอุดมคติไม่มีปริมาตร (no volume)
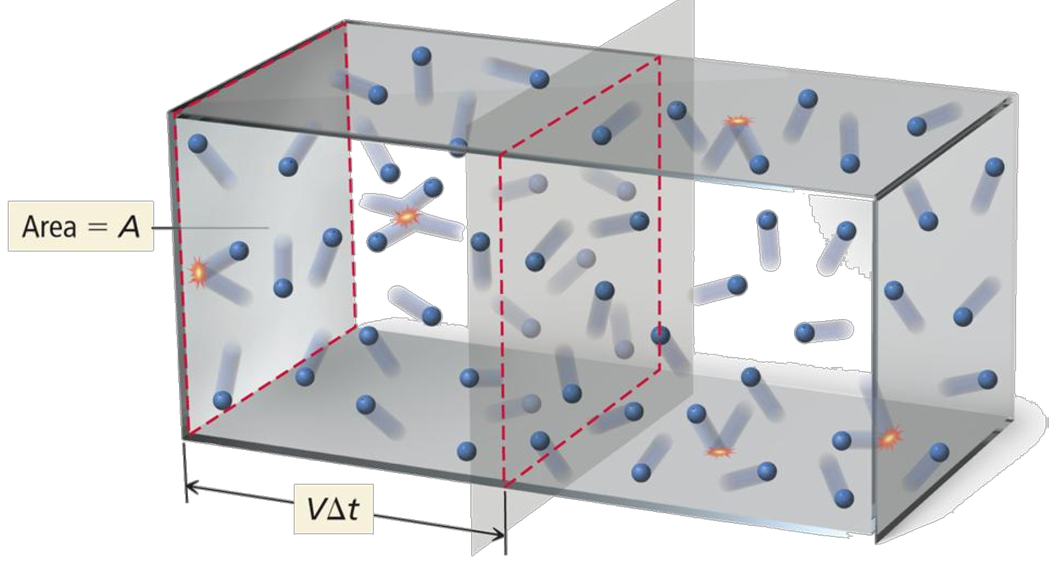
อนุภาคแก๊สอุดมคติมีขนาดเล็กมากเมื่อเทียบกับขนาดของภาชนะ
และมีการเคลื่อนที่แบบไร้ทิศทาง หรือเรียกว่า การเคลื่อนที่แบบบราวน์ (Brownian motion)
http://www.docstoc.com/docs/116195446/Ideal-Gas-Law-from-Kinetic-Theory
2. การชนกันระหว่างอนุภาคแก๊สอุดมคติเป็นการชนกันแบบยืดหยุ่นสมบูรณ์ (perfectly elastic collision)กล่าวคือ เป็นการชนกันของอนุภาคที่ไม่มีการสูญเสียพลังงานจลน์ หรือไม่มีแรงกระทำระหว่างกันของอนุภาค
ตัวอย่างการชนแบบยืดหยุ่น สามารถพิจารณาจากลูกบอลทกระทบพื้น โดยสามารถเกิดขึ้นได้ 2 กรณีคือ การชนแบบยืดหยุ่น และการชนแบบไม่ยืดหยุ่น ตัวอย่างของการชนแบบยืดหยุ่น ดังรูป
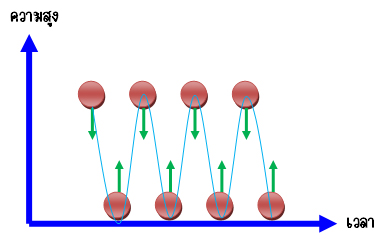
เมื่อลูกบอลกระทบพื้นแล้วกระดอนสูงขึ้นมา เท่าเดิมตลอดแม้เวลาจะผ่านไปนานเท่าไหร่ก็ตามนี่เป็นลักษณะการชนที่มีการ อนุรักษ์พลังงานคือพิจารณาพลังงานจลน์ของลูกบอลก่อนที่ลูกบอลจะกระทบพื้นจะ เท่ากับพลังงานจลน์ที่ลูกบอลกระดอนขึ้นมา ณ ตำแหน่งความสูงนั้น
แต่ถ้าเป็นการชนแบบไม่ยืดหยุ่น ลูกบอลก็จะกระดอนได้ไม่กี่ครั้งก็จะหยุดไปดังรูป เนื่องจากลูกบอลถ่ายเทพลังงานให้กับพื้น ทำให้พลังงานจลน์ของลูกบอลลดลงเรื่อยๆ และหยุดไปในที่สุด
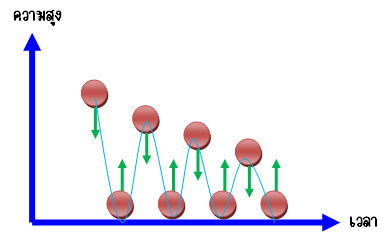
ในธรรมชาติแก๊สจะมีการสูญเสียพลังงานให้กับสิ่งแวดล้อม หรือมีพฤติกรรมที่แตกต่างจากที่กล่าวมา เรียกว่า แก๊สจริง (real gases) เมื่อพิจารณาที่อุณหภูมิความดันมาตรฐาน (standard temperature and pressure, STP) แก๊สจริงจะมีสมบัติใกล้เคียงกับแก๊สอุดมคติ เช่น แก๊สไนโตรเจน โฮโดรเจน หรือ ออกซิเจน เป็นต้น นักฟิสิกส์ได้ศึกษาสมบัติของแก๊สโดยใช้สมมติฐานของแก๊สอุดมคติ เพื่อความสะดวกในการพิจารณาตัวแปร และลดเงื่อนไขต่างๆ ที่เกี่ยวข้อง ทำให้สามารถพัฒนาเป็นแบบจำลองแก๊สในทฤษฎีจลน์ของแก๊ส ที่จะศึกษาในหัวข้อต่อไปครับ....
รวบรวมจาก
http://www.sa.ac.th/winyoo/thermo_gas/Gas/ideal_gas.htm
https://sites.google.com/site/wichakhemilem2m4/bth-thi-5-khxngkhaeng-khxnghelw-kaes
http://www.myfirstbrain.com/student_view.aspx?ID=69776
http://www.docstoc.com/docs/116195446/Ideal-Gas-Law-from-Kinetic-Theory
กลับไปที่เนื้อหา
กฎข้อที่ศูนย์ของอุณหพลศาสตร์
กฎข้อที่ศูนย์ของอุณหพลศาสตร์ (The zeroth law of thermodynamics) กล่าวถึงสภาวะสมดุลทางอุณหพลศาสตร์ โดยสามารถสรุปได้ว่า "ถ้าระบบ A และ B อยู่ในภาวะสมดุลทางอุณหพลศาสตร์ และระบบ B และ C อยู่ในสภาวะสมดุลทางอุณหพลศาสตร์แล้ว ระบบ A และ C จะอยู่ในภาวะสมดุลทางอุณหพลศาสตร์ด้วยเช่นกัน"
กล่าวโดยสรุปก็คือภาวะสมดุลทางอุณหพลศาสตร์มีคุณสมบัติถ่ายทอดได้นั่นเอง. อนึ่ง ที่มาของชื่อ กฎข้อศูนย์ นี้มีที่มาจากการที่นักวิทยาศาสตร์คิด ว่ากฎข้อนี้เป็นรากฐานที่สำคัญต่อกฎข้อที่หนึ่ง จึงต้องการจะให้ตัวเลขชื่อกฎอยู่ต่ำกว่ากฎข้อที่หนึ่ง แต่เนื่องจากกฎข้อนี้เพิ่งจะถูกตระหนักถึงความสำคัญเมื่อหลังจากกฎข้อที่ หนึ่งและสองมีชื่อเสียงมานานมากแล้ว นักวิทยาศาสตร์จึงตัดสินใจไม่เปลี่ยนลำดับตัวเลข และตั้งให้กฎข้อนี้เป็นกฎข้อที่ศูนย์.
กฎข้อนี้เป้นกฎที่ได้จากการทดลองและเป็นหลักการในการวัดอุณหภูมิของวัตถุ ต่างๆ ด้วยเครื่องมือวัดอุณหภูมิหรือเทอร์โมมิเตอร์ โดยการแทนวัตถุชิ้นที่สามเป็นเทอร์โมมิเตอร์ โดยเมื่อเทอร์โมมิเตอร์วัดระดับอุณหภูมิของวัตถุสองชิ้นนั้นแล้วพบว่าว่ามี ค่าเท่ากัน จากหลักการในข้อที่ศูนย์ของเทอร์โมไดนามิกส์สามารถระบุได้ว่าวัตถุสองชิ้น อยู่ในสมดุลความร้อนต่อกันได้ แม้ว่าวัตุสองชิ้นนั้นจะไมได้สัมผัสกันโดยตรง
http://www.physicsisawesome.com/Opinions/files/ba3d6b77f9a62fc433bf8b54b7450e2e-12.html
กฎข้อนี้จริง ๆ แล้วเป็นแนวคิด ที่เป็นที่มาของการสร้างเทอร์โมมิเตอร์คนส่วนใหญ่ไม่ได้สนใจหรอกว่า หลักการของเทอร์โมมิเตอร์ เป็นอย่างไรเพราะเป็นอะไรที่ง่ายเหลือเกิน แต่ลองนึกดูสักนิดสิว่า ถ้าไม่มีกฎข้อนี้รองรับแล้ว เทอร์โมมิเตอร์ คือ อะไร???
เทอร์โมมิเตอร์ก็คือ การนำเทอร์โมมิเตอร์ (สมมุติว่าเป็นระบบ B ) ให้ไปสัมผัสแล้วเกิดสมดุลทางความร้อนกับระบบAทำให้เราสามารถบอกว่าระบบAมีพลังงานอยู่เท่าไหร่ โดยพิจารณาจากการเปลี่ยนแปลงสมบัติทางกายภาพของสารที่อยู่ภายในเทอร์โมมิเตอร์ ซึ่งส่วนใหญ่แล้ว จะพิจารณาการขยายตัวของ ปรอท หรือ แอลกอฮอล์ ซึ่งตัวแปรที่เรากำหนดขึ้นเพื่อบ่งบอกถึงปริมาณของพลังงานก็คืออุณหภูมินั่นเอง จากกฎข้อ ศูนย์ จะทำให้บอกได้ว่า ถ้าเรานำเทอร์โมมิเตอร์ไปสัมผัสแล้วเกิดสมดุลทางความร้อนกับระบบอื่น เช่น ระบบCแล้ว สารที่อยู่ภายในเทอร์โมมิเตอร์เกิดการขยายตัวเท่ากัน แสดงว่าระบบกและคมีพลังงานเท่ากัน ดังนั้นเมื่อนำทั้งสองระบบมาสัมผัสกันจะไม่ทำให้เกิดการถ่ายเทความร้อน

เทอร์โมมิเตอร์ปรอทขนาด 0-100 องศา
http://www.thaiadapp.com
อุณหภูมิ (Temperature) คือ คุณสมบัติ หรือตัวแปรหนึ่งที่มีความสำคัญมาก ทางเทอร์โมไดนามิกส์ เพราะว่าเป็นตัวแปรที่บ่งบอกถึงปริมาณพลังงานของระบบ รวมไปทั้งบอกทิศทางการไหลของพลังงาน ซึ่งจะไหลจากระบบที่มีพลังงานสูงไปสู่พลังงานต่ำนั่นเอง ในช่วงแรกของการใช้เทอร์โมมิเตอร์วัดอุณหภูมินั้นได้กำหนดให้จุดหลอมเหลวของน้ำเท่ากับ ศูนย์ และจุดเดือดของน้ำเท่ากับ100(ระบบนี้ คือ สเกลแบบCelsius) แล้วก็กำหนดให้การขยายตัวของเหลวที่ใช้ในหลอดcapillaryของเทอร์โมมิเตอร์ที่เกิดขึ้นในช่วงอุณหภูมินี้เท่ากับ100oCแล้วก็ทำการแบ่งสเกลของการขยายตัวออกเป็น100ช่วงสเกล แต่ว่าข้อเสียของระบบนี้คือ การขยายตัวของของเหลวแต่ละชนิด เช่น ปรอท กับ แอลกอฮอล์ ที่พลังงานเท่ากันอาจแตกต่างกันเล็กน้อย ทำให้ค่าอุณหภูมิที่วัดได้เกิดการคลาดเคลื่อนได้ ดังนั้นสเกลที่มีความถูกต้องมากกว่า คือ สเกลแบบKelvin, K (thermodynamic temperature scale)ซึ่งพิจารณาจากการเปลี่ยนแปลงความดันของแก๊สสมบูรณ์แบบ(perfect gas)ต่อไปนี้อุณหภูมิที่จะกล่าวถึงในบทเรียนทั้งหมดจะอยู่ในสเกลแบบKelvinซึ่งมีความสัมพันธ์กับสเกลCelsiusดังนี้
T (K) = T (oC) + 273.15
ข้อมูลจาก
http://www.atom.rmutphysics.com/physics/oldfront/86/Thermo1/index.htm
กลับไปที่เนื้อหา
กฎข้อที่สองของเทอร์โมไดนามิกส์ (The second Law of Thermodynamics)
กฎข้อที่ 2 อธิบายเกี่ยวกับตัวแปรที่เป็นตัวกำหนดทิศทางของการเกิดกระบวนการต่าง ๆ ไม่ว่าจะเป็นทางกายภาพหรือทางเคมี (driving force of physical and chemical change) ซึ่งตัวแปรที่สำคัญเกี่ยวกับการกำหนดทิศทางของการเกิดกระบวนการต่าง ๆ คือเอนโทรปี (Entropy, S)
หลาย ๆ กระบวนการในธรรมชาติสามารถเกิดขึ้นได้เองโดยที่ไม่ต้องไปทำอะไรกับระบบเลย ในขณะที่บางกระบวนการไม่สามารถเกิดขึ้นได้เอง กระบวนการที่เกิดขึ้นได้เองจะเรียกว่า spontaneous change หรือ natural change ตัวอย่างของกระบวนการเหล่านี้ ได้แก่ การขยายตัวของแก๊สจากปริมาตรน้อยไปสู่ปริมาตรมากขึ้น, การเย็นตัวลงของวัตถุร้อนไปสู่อุณหภูมิของสิ่งแวดล้อม หรือ การเกิดปฏิกิริยาบางชนิดที่สามารถเกิดได้ในทิศทางเดียว เราสามารถทำให้แก๊สมีปริมาตรลดลงได้, ทำให้ปฏิกิริยาเกิดในทิศทางตรงข้ามได้ แต่ว่าการที่จะทำได้ต้องอาศัยการทำงานเข้ามาช่วยให้เกิดขึ้น นั่นคือ ไม่ใช่กระบวนการที่เกิดขึ้นเองโดยธรรมชาติ
จากการสังเกตุพิจารณากระบวนการที่เกิดขึ้นเองได้ในหลายๆแง่มุมพบว่า"กระบวนการที่เกิดขึ้นได้เองจะเกิดขึ้นได้เมื่อการเปลี่ยนแปลงนั้นทำให้ระบบมีความไม่เป็นระเบียบมากขึ้น"ซึ่งความไม่เป็นระเบียบที่ว่านี้หมายความรวมถึง การเกิดการกระจายตัว(dispersal)ของวัตถุ,สสาร, อะตอม,โมเลกุล หรือแม้แต่ การกระจายตัวของพลังงาน
เราจะเริ่มจากการนิยามตัวแปรทางเทอร์โมไดนามิกส์ที่จะเป็นตัวบ่งบอกทิศทางของการเกิดspontaneous changeหรือในอีกแง่หนึ่งคือ ตัวแปรที่บ่งบอกถึงความไม่เป็นระเบียบของระบบ ซึ่งตัวแปรนี้ คือเอนโทรปี,Sนั่นเอง ดังนั้นเราสามารถเขียนกฏข้อ2ได้ว่า
"ในการเกิดกระบวนการที่เกิดขึ้นเองได้ ค่าเอนโทรปีของระบบโดดเดี่ยวจะเพิ่มขึ้น:DStot> 0โดยที่Stotคือ เอนโทรปีทั้งหมดของระบบโดดเดี่ยว(isolated system)ที่บรรจุระบบที่เราสนใจอยู่ข้างใน"
กระบวนการที่ผันกลับไม่ได้(irreversible process)เป็นกระบวนการที่เกิดขึ้นได้เอง(เพราะเกิดกระบวนการไปข้างหน้าได้อย่างเดียว) ดังนั้นการเกิดกระบวนการที่ผันกลับไม่ได้จะทำให้ เอนโทรปี ของระบบเพิ่มขึ้น ในทางตรงข้าม สำหรับกระบวนการที่ผันกลับได้(reversible process)ระบบอยู่ในสภาวะสมดุลกับสิ่งแวดล้อมตลอดเวลาขณะเกิดการเปลี่ยนแปลง ดังนั้นในกระบวนการเหล่านี้จะไม่ทำให้เอนโทรปีเพิ่มขึ้น (เพราะว่ากระบวนการสามารถเกิดขึ้นในทิศทางไปข้างหน้าและย้อนกลับได้ตลอดเวลา) แต่ว่าการเกิดกระบวนการที่ผันกลับได้อาจทำให้ เกิดการโยกย้าย(transfer)ของเอนโทรปีจากส่วนหนึ่งของระบบโดดเดี่ยวไปสู่อีกส่วนหนึ่งของระบบได้
จริงๆแล้วต้องมีการแก้สมการหลายขั้นตอนเพื่อให้ได้ความสัมพันธ์ของเอนโทรปีกับตัวแปรอื่นทางเทอร์โมไดนามิกส์ ที่ได้นิยามในกฎข้อที่1แต่ในที่นี้จะยกความสัมพันธ์นั้นมาใช้เลย เพื่อลดความยุ่งยากของเนื้อหา
นิยามของเอนโทรปี
การเปลี่ยนแปลงของเอนโทรปีของระบบ ที่เกิดกระบวนการที่ผันกลับได้ แปรผันตรงกับความร้อนที่ถ่ายเทเข้าสู่ระบบ (qrev) แต่แปรผกผันกับอุณหภูมิ(T)ของระบบ นั่นคือจะได้ว่า
หรือ
(อย่าสับสนตรงนี้กับย่อหน้าก่อนหน้านี้ เพราะว่าตรงนี้พูดถึงเฉพาะ เอนโทรปีของระบบที่สนใจเท่านั้น ซึ่งบรรจุอยู่ภายในระบบโดดเดี่ยว การเปลี่ยนแปลงเอนโทรปีของระบบโดดเดี่ยวยังคงมีค่าเท่ากับศูนย์สำหรับกระบวนการเปลี่ยนแปลงที่ผันกลับได้)
|
รูปนี้แสดงตัวอย่างการเปลี่ยนแปลงเอนโทรปีของการเปลี่ยนสถานะของสสารจากของ แข็งไปเป็นของเหลว ซึ่งเป็นกระบวนการที่ผันกลับได้ จะเห็นว่า การเพิ่มขึ้นของความไม่เป็นระเบียบหรือเอนโทรปีแปรผันตรงกับความร้อนที่ถ่าย เทเข้าสู่ระบบแต่แปรผกผันกับอุณหภูมิของระบบในขณะที่เกิดการเปลี่ยนสถานะ |
ข้อมูลจาก http://www.sci.nu.ac.th/chemistry/elearning/E-Learning2/Chapters/Thermodynamics/Second%20Law.htm
กลับไปที่เนื้อหา
-
7233 ทฤษฎีจลน์ของแก๊ส (Kinetic Theory of Gases) /lesson-physics/item/7233-kinetic-theory-of-gasesเพิ่มในรายการโปรด


