พันธะเคมี (Chemical Bonding)
- 1. การแนะนำ
- 2. พันธะโคเวเลนต์ (Covalent bond)
- 3. พันธะไอออนิก (Ionic Bond)
- 4. พันธะโลหะ (Metallic bonding)
- 5. รูปร่างของโมเลกุลโคเวเลนต์
- 6. พันธะโคออร์ดิเนตโคเวเลนต์ (Coordinate Covalent Bond)
- 7. โมเลกุลที่ไม่เป็นไปตามกฏออกเตต (The Incomplete Octet)
- 8. การอ่านชื่อสารประกอบโคเวเลนต์
- 9. ความยาวพันธะและพลังงานพันธะ
- 10. โครงสร้างเรโซแนนซ์ (Resonance structure)
- 11. พันธะโคเวเลนต์กับความมีขั้วของพันธะ
- - ทุกหน้า -
ประเภทของพันธะเคมี
พันธะเคมี (Chemical Bonding) หมายถึง แรงยึดเหนี่ยวระหว่างอะตอมภายในโมเลกุลหรือระหว่างโมเลกุลด้วยกันเอง เพื่อทำให้วาเลนต์อิเล็กตรอนมีค่าเท่ากับแปด ทำให้อะตอมนั้น มีความเสถียรและสามารถดำรงอยู่อย่างอิสระ
พันธะเคมี (Chemical bonding) แบ่งออกเป็นประเภทใหญ่ๆ ได้ 2 ประเภทคือ
1. พันธะภายในโมเลกุล (Intramolecular bond) ได้แก่
- พันธะโคเวเลนต์ (Covalent bond)
- พันธะไอออนิก (Iionic bond)
- พันธะโลหะ (Metallic bond)
2. พันธะระหว่างโมเลกุล (Intermolecular bond)
- พันธะไฮโดรเจน(Hydrogen bond)
- แรงแวนเดอร์วาลส์ (van der Waals force)
- แรงลอนดอน (London force)
กลับไปที่เนื้อหา
พันธะโคเวเลนต์ (Covalent bond) หมายถึง พันธะเคมีที่เกิดจากอะตอมของธาตุใช้อิเล็กตรอนร่วมกัน
การเกิดพันธะโคเวเลนต์ (Covalent bond formation) พันธะโควาเลนต์มักเกิดขึ้นระหว่างอะตอมที่มีค่าอิเล็กโตรเนกาทิวิตีใกล้เคียงกัน โดยแต่่ละอะตอมต่างมีความสามารถที่จะึดึงอิเล็กตรอนไว้กับตัวใกล้เคียงกัน อิเล็กตรอนคู่ร่วมพันธะจึงไม่ได้อยู่ ณ อะตอมใดอะตอมหนึ่ง แต่เป็นการใช้อิเล็กตรอนร่วมกันเพื่อให้มีความเสถียรตามกฎออกเตต (Octet rule)
ตัวอย่างแสดงการเกิดพันธะโคเวเลนต์ของโมเลกุลน้ำ (H2O)
โดยปกติการเกิดพันธะโคเวเลนต์ จะเกี่ยวข้องกับแรง 2 ประเภท ได้แก่ แรงผลักและแรงดูดระหว่างอะตอมทั้งสองที่มีความสมดุลกัน กล่าวคือ เกิดแรงผลักระหว่างอิเล็กตรอน - อิเล็กตรอนของแต่ละอะตอม และแรงผลักระหว่างนิวเคลียส - นิวเคลียสของแต่ละอะตอม รวมทั้งแรงดึงดูดระหว่างนิวเคลียสกับอิเล็กตรอนของอะตอมทั่งสอง ดังภาพ
เมื่ออะตอมอยู่อย่างอิสระจะมีค่าพลังงานสูง ซึ่งไม่เสถียร ดังนั้น การรวมกันเป็นโมเลกุึล จะทำให้มีค่าพลังงานที่ต่ำกว่า และมีความเสถียรสูง จากภาพวิดีโอจะสังเกตเห็นว่า เมื่ออะตอมไฮโดรเจน 2 อะตอมเข้าใกล้กันเป็นระยะทาง 0.74 อังสตรอม (หรือ 74 พิโคเมตร) ซึ่งเป็นระยะทางที่เหมาะสมในการเกิดพันธะโคเวเลนต์ระหว่างไฮโดรเจน ค่าพลังงานจะต่ำที่สุด และเมื่ออะตอมเข้าใกล้กันมากขึ้น ค่าพลังงานกลับสูงขึ้น เนื่องจากเกิดการผลักกันระหว่างนิวเคลียส - นิวเคลียสของแต่ละอะตอมนั่นเอง
ประเภทของพันธะโคเวเลนต์ เราสามารถแบ่งประเภทของพันธะโคเวเลนต์ตามการใช้อิเล็กตรอนร่วมกันของอะตอม ได้เป็น 3 ประเภท ได้แก่
1. พันธะเดี่ยว (Single bond) เป็นพันธะที่เกิดจากอะตอมคู่สร้างพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่
2. พันธะคู่ (Double bone)เป็นพันธะที่เกิดจากอะตอมคู่สร้างพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่
3. พันธะสาม (Triple bond)เป็นพันธะที่เกิดจากอะตอมคู่สร้างพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่
ในปี 1916 Prof. Gilbert N. Lewis ได้เสนอแนวความคิดว่า พันธะโคเวเลนต์ เป็นเรื่องของการใช้อิเล็กตรอนร่วมกันระหว่างอะตอม 2 อะตอม โดยเป็นไปตามกฎออกเตด โดยทั่วไปมักเขียนพันธะในโมเลกุลตามแบบของลิวอิส โดยใช้จุดแทนอิเล็กตรอน และเรียกว่าสัญลักษณ์แบบจุด (Lewis dot structure) ดังรูป
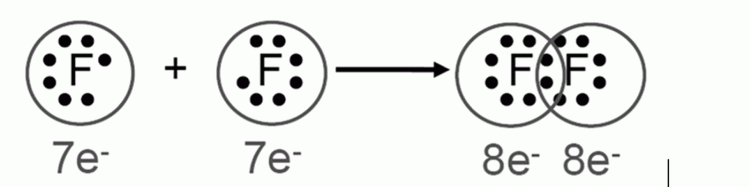
อิเล็กตรอนที่ไม่ได้ใช้ในการสร้างพันธะ จะเรียกว่า อิเล็กตรอนคู่โดดเดี่ยว (Lone pair electron) ในกรณีโมเลกุลฟลูออรีน อิเล็กตรอนที่ใช้ในการสร้างพันธะมี 1 คู่ จึงเป็นการเกิดพันธะที่เรียกว่า พันธะเดี่ยว และ ในโมเลกุลของออกซิเจน (O2) ซึ่งประกอบด้วยอะตอมออกซิเจน 2 ตัว และใช้อิเล็กตรอน 2 คู่ในการสร้างพันธะ จึงเรียกว่า พันธะคู่ ดังรูป
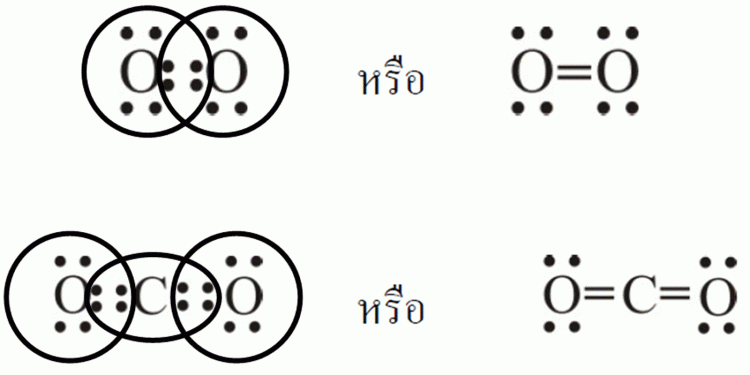
ในโมเลกุลของไนโตรเจน (N2) ซึ่งประกอบด้วยอะตอมไนโตรเจน 2 ตัว และใช้อิเล็กตรอน 3 คู่ในการสร้างพันธะ จึงเรียกว่า พันธะสามดังรูป
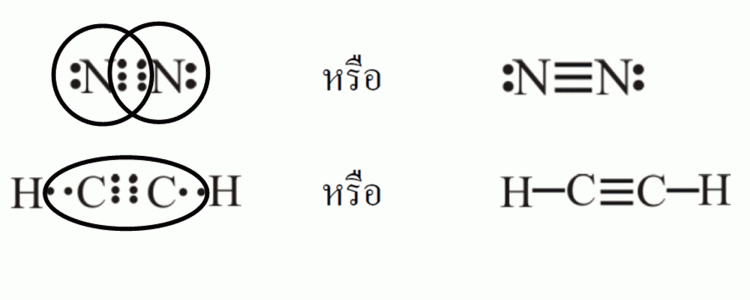
|
ธาตุ |
หมู่ |
จำนวนเวเลนซ์อิเล็กตรอน |
จำนวนอิเล็กตรอนที่ share |
|
F |
VIIA |
7 |
1 |
|
O |
VIA |
6 |
2 |
|
N |
VA |
5 |
3 |
|
C |
IVA |
4 |
4 |
กลับไปที่เนื้อหา
พันธะไอออนิก คือ พันธะที่เกิดขึ้นจากอะตอมโลหะ และอโลหะ โดยอะตอมโลหะจะทำหน้าที่ในการให้อิเล็กตรอนแก่อะตอมอโลหะ ทำให้เกิด ไอออนบวก(cation)และไอออนลบ(anion) ดังนั้น พันธะไอออนิกจึงเกิดแรงดึงดูดทางไฟฟ้าสถิตระหว่างไอออนบวกและไอออนลบ
การเขียนสูตร และการเรียกชื่อสารประกอบไอออนิก
1. การเขียนสูตรเอมพิริคัลของสารประกอบไอออนิก เราจะต้องรู้ประจุของไอออนแต่ละชนิดในสารประกอบ เช่น NaCl (โซเดียมคลอไรด์) ประกอบด้วย Na+ และ Cl- ซึ่งมีอัตราส่วน 1 : 1 หรือ MgCl2 (แมกนีเซียมคลอไรด์) ประกอบด้วย Mg2+ และ Cl- ซึ่งมีอัตราส่วน 1 : 2
2. การเรียกชื่อสารประกอบไอออนิก ต้องอ่านชื่อไอออนบวกก่อน แล้วจึงตามด้วยไอออนลบ ดังนี้
2.1 ถ้าไอออนบวกมีเลขประจุได้เพียงค่าเดียว เช่น Na+ (โซเดียมไอออน),K+ (โพแทสเซียมไอออน), Ba2+ (แบเรียมไอออน)และ Mg2+ให้อ่านชื่อไอออนโดยไม่ต้องใส่เลขโรมัน(แมกนีเซียมไอออน) เป็นต้น
2.2 ถ้าไอออนบวกมีเลขประจุได้มากกว่า 1 ค่า เช่น ธาตุพวกโลหะทรานสิชัน ให้อ่านชื่อไอออนแล้วตามด้วยเลขประจุของไอออน เช่น Fe2+ (ไอร์ออน (II)ไอออน),Fe3+ (ไอร์ออน (III)ไอออน) เป็นต้น
2.3 ไอออนลบที่มีออกซิเจนเป็นองค์ประกอบ จะใช้คำลงท้ายเป็น
ลักษณะสำคัญของสารประกอบไอออนิก
1. พันธะไอออนิกเกิดจากไอออนของธาตุโลหะ และธาตอโลหะ เช่น Li+และ Cl- (LiCl)
2. พันธะไอออนิก เกิดจากกลุ่มอะตอมที่เป็นไอออนบวก และกลุ่มอะตอมของไอออนลบ เช่น NH4+และ Cl- (NH4Cl) และ K+และ NO3- (KNO3)
3. โดยทั่วไปสารประกอบไอออนิกจะมีแต่สูตรเอมพิริคัล ไม่มีสูตรโมเลกุล
4. มีจุดเดือก จุดหลอมเหลวสูง
5. ในสภาพของแข็งจะไม่นำไฟฟ้า แต่เมือหลอมเหลวหรือเกิดการละลายจะนำไฟฟ้าได้
6. การละละายน้ำ สารประกอบไอออนิกโดยทั่วไปจะละลายน้ำได้ดี และไม่ละลายในตัวทำละลายอินทรีย์ ดังนั้น น้ำทะเลจึงมีรสเค็ม เพราะมีเกลือละลายอยู่เป็นจำนวนมากนั่นเอง

วัฏจักรบอร์น - ฮาเเบอร์ (Born-Haber cycle)
ในขั้นตอนการเกิดสารประกอบไอออนิก จะประกอบด้วยปฏิกิริยาเคมีหลายขั้นตอนด้วยกัน ดังรูป
ที่มา :http://cwx.prenhall.com
ขั้นตอนที่ 1 ผลึกโซเดียมกลายเป็นอะตอมโซเดียมในสภาวะแก๊
Na(s)→ Na(g) พลังงานที่ใช้เรียกว่า sublimation energy มีค่า 107 kJ/mol
ขั้นตอนที่ 2 โมเลกุลคลอรีนแตกตัวออกเป็นอะตอมในสภาวะแก๊ส
Cl2(g)→ Cl(g) พลังงานที่ใช้เรียกว่า dissociation energy มีค่า 244 kJ/mol
ขั้นตอนที่ 3 อะตอมโซเดียมเสียอิเล็กตรอน 1 ตัว กลายเป็น โซเีดียมไอออน(Na+) ซึ่งเป็นไอออนบวก
Na(g) → Na+(g) + e- พลังงานที่ใช้เรียกว่า ionization energy มีค่า 496 kJ/mol
ขั้นตอนที่ 4 อะตอมคลอรีนรับอิเล็กตรอน 1 ตัวจากโซเดียม กลายเป็น คลอไรด์ไอออน(Cl-) ซึ่งเป็นไอออนลบ
Cl(g)+ e- → Cl-(g) พลังงานที่ใช้เรียกว่า electron affinity energy มีค่า -349 kJ/mol
ขั้นตอนที่ 5 ไอออนบวกและไอออนลบจากขั้นตอนที่ 3 และ 4 รวมกัน เป็นโมเลกุลโซเดียมคลอไรด์ (NaCl)
Na+(g) + Cl-(g) → NaCl(s) พลังงานที่ได้ เรียกว่า Lattice energy มีค่า -787 kJ/mol
กลับไปที่เนื้อหา
พันธะโลหะ (Metallic bonding) เกิดจากพันธะระหว่างอะตอมโลหะซึ่งมีการเคลื่อนย้ายอิเล็กตรอนอิสระระหว่างแลตทิซของอะตอม โดยอิเล็กตรอนที่เคลื่อนย้ายเหล่านี้เปรียบได้กับทะเลอิเล็กตรอน(Sea of Electrons) ล้อมรอบขนาดใหญ่ของไอออนบวกในพันธะโลหะอิเล็กตรอนไม่ได้เป็นของอะตอมใดอะตอมหนึ่งเพียงอะตอมเดียว แต่อิเล็กตรอนทุกตัวสามารถเคลื่อนที่ไปยังอะตอมใกล้เคียงได้
สาเหตุของการเกิดพันธะโลหะ
เนื่องจากอะตอมโลหะ มีค่าพลังงานไอออไนเซชันต่ำ ดังนั้น อิเล็กตรอนจึงหลุดออกจากอะตอมได้ง่าย และในทำนองเดียวกันอะตอมโลหะเมื่อมาอยู่รวมกัน จึงมีแต่อะตอมที่ให้อิเล็กตรอน แต่ไม่มีตัวรับอิเล็กตรอน ดังนั้น อิเล็กตรอนจึงเคลื่อนที่ไปมาได้อย่างอิสระ จัดว่าเป็นพันธะที่มีแรงยึดเหนี่ยวที่แข็งแรงมาก
คุณสมบัติของพันธะโลหะ
1. เป็นตัวนำไฟฟ้า และตัวนำความร้อนที่ดี เนื่องจากอิเล็กตรอนเคลื่อนที่ได้ง่าย
2. จุดหลอมเหลวสูงมาก เนื่องจากอิเล็กตรอนยึดกันไว้อย่างเหนียวแน่น
3. สามารถตีเป็นแผ่นบางได้โดยไม่ขาดออกจากกัน เนื่องจากอิเล็กตรอนยึดกันไว้อย่างเหนียวแน่นเช่นกัน
4. สามารถสะท้อนแสง เนื่องจากความมันวาวของโลหะได้
5. โดยทั่วไปจะอยู่ในสถานะของแข็ง ยกเว้น Hg (ปรอท) ที่อยู่ในสถานะของเหลว ที่อุณหภูมิห้อง
ทฤษฎีที่ใช้อธิบายพันธะโลหะ
แบบจำลองทะเลอิเล็กตรอน (Electron sea model )
ทฤษฎีแถบพลังงาน (Band theory)
กลับไปที่เนื้อหา
รูปร่างของโมเลกุลโคเวเลนด์
รูปร่างของโมเลกุลโคเวเลนต์ ขึ้นอยู่กับ ทิศทางของพันธะโคเวเลนต์ , ความยาวพันธะ , และมุมระหว่างพันธะโคเวเลนต์รอบอะตอมกลาง โดยที่ทิศทางของพันธะขึ้นอยู่กับแรงผลักระหว่างพันธะรอบอะตอมกลางและแรงผลักของอิเล็กตรอนคู่อิสระของอะตอมกลางที่มีต่อพันธะรอบอะตอมกลาง
ทฤษฎีที่เกี่ยวข้องกับรูปร่างของโมเลกุลโคเวเลนต์ได้แก่
1. ทฤษฎีพันธะเวเลนซ์ (valence bond theory) และไฮบริไดเซชัน (Hybridization)
ทฤษฎีพันธะเวเลนซ์เป็นทฤษฎีที่ใช้อธิบายการเกิดพันธะด้วยการซ้อนเหลื่อมกันของออร์บิทัลอะตอม โดยทั่วไปแล้วถ้าอิเล็กตรอนมีสปินเหมือนกันเมื่อเข้าใกล้กันจะมีการผลักกันเกิดขึ้นทำให้พลังงานเพิ่มขึ้น ถ้าอิเล็กตรอนมีสปินตรงกันข้าม เมื่อเข้าใกล้กันจะมีการดึงดูดกันเกิดขึ้น ทำให้พลังงานลดลง นอกจากนี้ เรายังสามารถอธิบายการเกิดพันธะเมื่อทราบรูปร่างโมเลกุล และี้อธิบายได้ว่าทำไมพันธะเดี่ยวมีความยาวพันธะมากกว่าพันธะคู่ และพันธะคู่มีความยาวพันธะมากกว่าพันธะสาม รวมถึงอธิบายลำดับความแข็งแรงของพันธะได้อีกด้วย
ไฮบริไดเซซัน (hybridization) คือ ปรากฎการณ์ที่ออร์บิทัลในอะตอมเดียวกัน ที่มีระดับพลังงานใกล้เคียงกันเกิดการรวมกันเกิดเป็นไฮบริดออร์บิทัล (hybrid orbital) ซึ่งแต่ละไฮบริดออร์บิทัลจะครอบครองพื้นที่เท่ากัน และอยู่ห่างกันมากที่สุดเพื่อทำให้พลังงานรวมของออร์บิทัลมีพลังงานน้อยที่สุด ผลที่เกิดขึ้นก็คือ เกิดไฮบริดออร์บิทัลมีรูปร่างต่างๆกันไป ทำให้โมเลกุลมีรูปร่างต่างกันนั่นเอง และพลังงานรวมของไฮบริดออร์บิทัลจะน้อยกว่าผลรวมพลังงานทั้งหมด ของออร์บิทัลอะตอมก่อนการเกิดไฮบริไดเซซัน
ประเภทของไฮบริดออร์บิทัล มีดังนี้
1) ไฮบริดออร์บิทัลเกิดจากการรวมกันระหว่าง s 1 ออร์บิทัลและ p 3 ออร์บิทัลได้ไฮบริดออร์บิทัลป็นรูปทรงสี่หน้า เช่น CH4 ดังรูป
src="http://cwx.prenhall.com/bookbind/pubbooks/hillchem3/medialib/media_portfolio/text_images/CH10/FG10_12.JPG" width="500" border="0" />
2) sp2-ไฮบริดออร์บิทัลเกิดจากการรวมกันระหว่าง s 1 ออร์บิทัลและ p 2 ออร์บิทัลได้ไฮบริดออร์บิทัลป็นสามเหลี่ยมแบนราบ เช่น C2H4 ดังรูป
3) ไฮบริดออร์บิทัลเกิดจากการรวมกันระหว่าง s 1 ออร์บิทัลและ p 1 ออร์บิทัลได้ไฮบริดออร์บิทัลป็นสามเหลี่ยมแบนราบ เช่น C2H2 ดังรูป
นอกจากนี้ยังมีไฮบริดออร์บิทัลอีกหลายประเภท ซึ่งทำให้โมเลกุลโคเวเลนต์มีรูปร่างแตกต่างกันออกไป เช่นsp3d-ไฮบริดออร์บิทัล,sp3d2-ไฮบริดออร์บิทัล เป็นต้น
2.ทฤษฎีการผลักคู่อิเล็กตรอนในวงเวเลนซ์ (valence shell electron pair repulsion theory ; VSEPR)
ใช้ทำนายรูปร่างโมเลกุลโคเวเลนต์ในกรณีที่มีอิเล็กตรอนคู่โดดเดี่ยว (อิเล็กตรอนที่ไม่ได้ใช้สร้างพันธะ) เหลืออยู่ในโมเลกุล สามารถเขียนสูตรได้เป็นAXmEn
เมื่อ A เป็นอะตอมกลาง
X เป็นอะตอมหรือหมู่อะตอมที่ยึดอยู่กับ A โดยใช้พันธะโคเวเลนต์
E เป็นสัญลักษณ์แทนคู่อิเล็กตรอนที่ไม่ใช้สร้างพันธะ
m เป็นจำนวนคู่อิเล็กตรอนที่ใช้สร้างพันธะ
n เป็นจำนวนคู่อิเล็กตรอนที่ไม่ใช้สร้างพันธะหรือ อิเล็กตรอนคู่โดดเดี่ยว
ทฤษฎีนี้ถูกสร้างขึ้นมาเพื่อที่จะพยายามอธิบายรูปร่างของโมเลกุลซึ่งทฤษฎี้นี้ได้รับการพิสูจน์มาแล้วจริงๆ โดยอาศัยเทคนิคทาง electron- diffraction
กลับไปที่เนื้อหา
พันธะโคออร์ดิเนตโคเวเลนด์
สารโคเวเลนต์บางชนิดประกอบด้วย พันธะโควาเลนต์ที่อิเล็กตรอนคู่ร่วมพันธะมาจากอะตอมใดอะตอมหนึ่งเท่านั้น เรียกว่า พันธะโคออร์ดิเนตโควาเลนต์ เช่น NH4+
ตัวอย่าง เช่น การสร้างพันธะระหว่างโมเลกุลแอมโมเนีย (NH3) กับ น้ำ (H2O)

ตัวอย่าง การสร้างพันธะระหว่างโมเลกุลแอมโมเนีย (NH3) กับ โบรอนไตรฟลูออไรด์ (ฺBF3)

กลับไปที่เนื้อหา
โมเลกุลที่ไม่เป็นไปตามกฎออกเตต คือโมเลกุลที่เมื่ออะตอมแต่ละชนิดใช้อิเล็กตรอนร่วมกันแล้วอิเล็กตรอนวงนอกสุดไม่เท่ากับ 8 ตามกฎออกเตต (ยกเว้น H เท่ากับ 2) ได้แก่ สารประกอบ Be, B และ Al เช่น BeCl2 และ BF3 ซึ่ง Be มีอิเล็กตรอนล้อมรอบเพียง 4 ตัว หรือ B มีอิเล็กตรอนล้อมรอบเพียง 6 ตัว ดังรูป
สารบางชนิดมีอิเล็กตรอนมากกว่า 8 เช่น PCl5 ซึ่งมีอิเล็กตรอนล้อมรอบ 10 อิเล็กตรอน หรือ SF6 และ XeF4 ที่มีอิเล็กตรอนล้อมรอบ 12 อิเล็กตรอน ดังรูป

รูปแสดงโครงสร้างแบบจุดของโมเลกุลฟอสฟอรัสเพนตะคลอไรด์ PCl5), ซัลเฟอร์เฮกซะฟลูออไรด์ (SF6) และซีนอนแตตระฟลูออไรด์ (XeF4)
กลับไปที่เนื้อหา
การอ่านชื่อสารประกอบโคเวเลนต์มีหลักการดังนี้
1. อ่านเลขจำนวนอะตอมที่เป็นภาษากรีกของธาตุตัวแรกทางซ้ายมือก่อน (ถ้ามีหนึ่งอะตอมไม่ต้องอ่านโมโน)
ภาษากรีกหรือภาษาละตินที่นิยมใช้
หนึ่ง เท่ากับ มอนอ (mono)
สอง เท่ากับ ได (di)
สาม เท่ากับ ไตร (tri)
สี่ เท่ากับ เตตระ (tetra)
ห้า เท่ากับ เพนตะ (penta)
หก เท่ากับ เฮกซะ (hexa)
เจ็ด เท่ากับ เฮปตะ (hepta)
แปด เท่ากับ ออกตะ (octa)
เก้า เท่ากับ โนนะ (nona)
สิบ เท่ากับ เดคะ (deca)
2.อ่านชื่อธาตุที่อยู่ทางซ้ายมือ
3.อ่านเลขจำนวนอะตอมที่อยู่ทางขวามือ (เลขหนึ่งก็ต้องอ่าน แต่ถ้าตัวแรกเป็นไฮโดรเจนไม่อ่าน)
4.อ่านชื่อธาตุที่อยู่ทางขวามือต่อไปนี้ โดยเปลี่ยนพยางค์ท้ายเป็น ไ-ด์ (-ide) เช่น
ออกซิเจน เป็น ออกไซด์
ไนโตรเจน เป็น ไนไตรด์
ไอโอดีน เป็น ไอโอไดด์
ฟลูออรีน เป็น ฟลูออไรด์
คาร์บอน เป็น คาร์ไบด์
คลอรีน เป็น คลอไรด์
โบรมีน เป็น โบรไมด์
ซัลเฟอร์ เป็น ซัลไฟด์
ไฮโดรเจน เป็น ไฮไดรด์
5. ถ้าสารที่เกิดกับไฮโดรเจนและธาตุหมู่ VIA หรือ VIIA ไม่อ่านเลขจำนวนอะตอมของไฮโดรเจน เช่น
H2S อ่านว่า ไฮโดรเจนซัลไฟด์
H2Se อ่านว่า ไฮโดรเจนซีลิไนด์
HCl อ่านว่า ไฮโดรเจนคลอไรด์
ตัวอย่าง การอ่านชื่อสารประกอบโคเวเลนต์
|
สูตรโมเลกุล |
ชื่อสารประกอบโคเวเลนต์ |
|
CO |
คาร์บอนมอนอกไซด์ |
|
CO2 |
คาร์บอนไดออกไซด์ |
|
N2O |
ไดไนโตรเจนมอนอกไซด์ |
|
BF3 |
โบรอนไตรฟลูออไรด์ |
|
SiCl4 |
ซิลิคอนเตตระคลอไรด์ |
|
N2O3 |
ไดไนโตรเจนไตรออกไซด์ |
|
GeH4 |
เจอร์มาเนียมเตตระไฮไดร์ |
กลับไปที่เนื้อหา
ความยาวพันธะและพลังงานพันธะ (Bond Length and Bond Energy)
พลังงานพันธะ หมายถึง พลังงานที่น้อยที่สุดที่ใช้เพื่อสลายพันธะที่ยึดเหนี่ยวระหว่างอะตอมคู่หนึ่งๆในโมเลกุลในสถานะแก๊ส พลังงานพันธะสามารถบอกถึงความแข็งแรงของพันธะเคมีได้ โดยพันธะที่แข็งแรงมากจะมีพลังงานพันธะมาก และพันธะที่แข็งแรงน้อยจะมีพลังงานพันธะน้อย
พลังงานพันธะเฉลี่ย หมายถึง ค่าพลังงานเฉลี่ยของพลังงานสลายพันธะ ของอะตอมคู่หนึ่งๆ ซึ่งเฉลี่ยจากสารหลายชนิด เช่น การสลายโมเลกุลมีเทน (CH4) ให้กลายเป็นอะตอมคาร์บอนและไฮโดรเจน มีสมการและค่าพลังงานที่เกี่ยวข้องดังนี้
CH4(g) + 435 kJ → CH3(g) + H(g)
CH3(g)+ 453 kJ → CH2(g) + H(g)
CH2(g)+ 425 kJ → CH(g) + H(g)
CH(g) + 339 kJ → C(g) + H(g)
เราจะเห็นได้ว่าการสลายพันธะระหว่าง C-H ในแต่ละพันธะของโมเลกุลมีเทน (CH4) จะใช้พลังงานไม่เท่ากัน ดังนั้น เมื่อนำค่าพลังงานทุกค่ามาเฉลี่ย ก็จะได้เป็นค่าพลังงานพันธะเฉลี่ยนั่นเอง ดังแสดงในตาราง
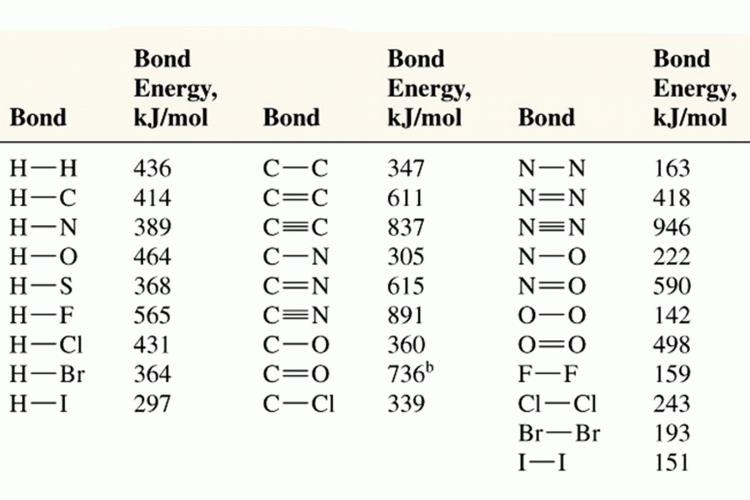
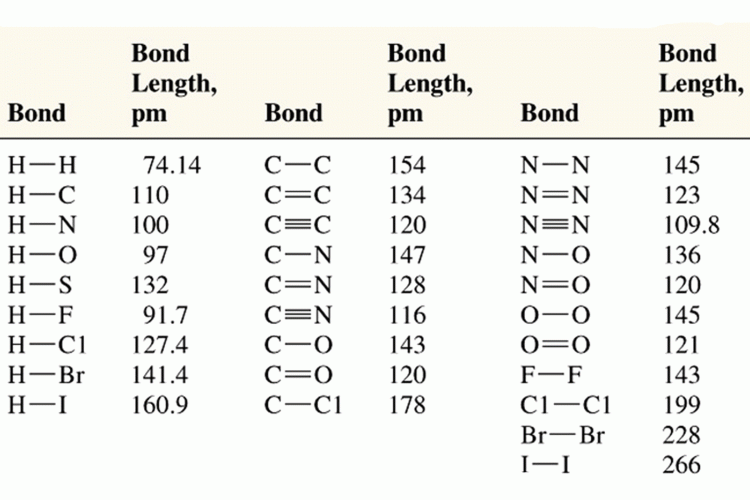
ความยาวพันธะ หมายถึงระยะระหว่างจุดศูนย์กลางของนิวเคลียสของอะตอมทั้งสองที่เกิดพันธะกัน (หน่วยเป็น Angstrom , 10-10 m , A0 )

(ที่มา : www.chem.ufl.edu/~chm2040/Notes/Chapter_11/covalent.html)
จากหัวข้อการเกิดพันธะโคเวเลนต์ นักเรียนทราบแล้วว่าอะตอมไฮโดรเจน 2 อะตอมเข้าใกล้กันเป็นระยะทาง 0.74 อังสตรอม (หรือ 74 พิโคเมตร) ซึ่งเป็นระยะทางที่เหมาะสมในการเกิดพันธะโคเวเลนต์ระหว่างไฮโดรเจน โดยระยะนี้เรียกว่า "ความยาวพันธะ" โดยปกติแล้วเราสามารถหาความยาวพันธะของสารได้จากการศึกษาการเลี้ยวเบนของรังสีเอ็กซ์ (X-ray diffraction ; XRD) ผ่านผลึกของสาร ทั้งนี้ความยาวพันธะระหว่างอะตอมคู่เดียวกันในโมเลกุลของสารต่างชนิดกัน จะมีค่าไม่เท่ากัน เช่น
|
สาร |
สูตรโมเลกุล |
ความยาวพันธะ O-H (pm) |
|
น้ำ |
H2O |
95.8 |
|
เมทานอล |
CH3OH |
95.6 |
ดังนั้น ความยาวพันธะระหว่างอะตอมคู่หนึ่ง จึงหาได้จากค่าเฉลี่ยของความยาวพันธะระหว่างอะตอมคูjเดียวกันในโมเลกุลต่างๆ เมื่อกล่าวถึงความยาวพันธะ โดยทั่วไปจึงหมายถึง “ความยาวพันธะเฉลี่ย”
ความสัมพันธ์ระหว่างความยาวพันธะกับพลังงานพันธะ
ความยาวพันธะและพลังงานพันธะ จะสามารถเปรียบเทียบกันได้ก็ต่อเมื่อเป็นพันธะที่เกิดจากอะตอมของธาตุคู่เดียวกัน ถ้าเป็นอะตอมต่างคู่กันเทียบกันไม่ได้ เช่น
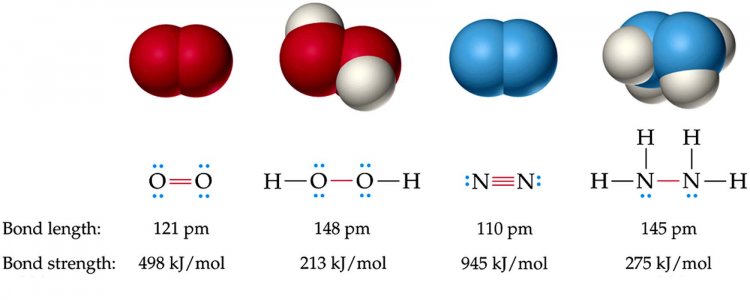
ดังนั้น ถ้าความยาวพันธะยิ่งสั้น พลังงานพันธะก็จะยิ่งมาก หรือพันธะมีความเสถียรมาก ซึ่งจากรูปเราสามารถสรุปได้ ดังนี้
1. ความยาวพันธะ พันธะเดี่ยว > พันธะคู่ > พันธะสาม
2. พลังงานพันธะ พันธะสาม > พันธะคู่ > พันธะเดี่ยว
กลับไปที่เนื้อหา
โครงสร้างเรโซแนนซ์คืออะไร ???
นักเรียนอาจจะเคยได้ยินคำว่า เรโซแนนซ์ ในทางฟิสิกส์กันมาบ้างแล้ว แล้วในทางเคมีล่ะ โครงสร้างเรโซแนนซ์ มันจะมีรูปร่างหน้าตาเป็นอย่างไรอันที่จริงแล้วโครงสร้างเรโซแนนซ์ก็เป็นโครงสร้างของโมเลกุลทางเคมี ที่เราไม่สามารถเขียนสูตรเคมีใดสูตรหนึ่ง เพื่อแสดงโครงสร้างและอธิบายสมบัติของสารหนึ่งๆ ได้ ปรากฏการณ์นี้เกิดจากการที่อิเล็กตรอนบริวเวณพันธะคู่หรือพันธะสามสามารถเคลื่อนที่ (delocalization) ไปมายังพันธะที่ใกล้เคียงได้ เช่น ไนเตรทไอออน (NO3-) และเบนซีน (C6H6) และเมื่อทำการวัดความยาวพันธะ เช่น โมเลกุลเบนซีน (C6H6)จะพบว่า ความยาวพันธะระหว่าง C-H จะยาวกว่าพันธะคู่ และสั้นกว่าพันธะเดี่ยว
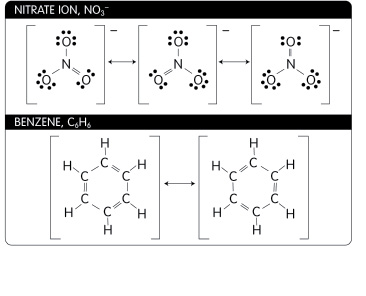
ภาพแสดงโครงสร้างของไนเตรทไอออน (NO3-) และเบนซีน (C6H6)
ที่มา :http://sparkcharts.sparknotes.com/chemistry/organicchemistry1/section3.php
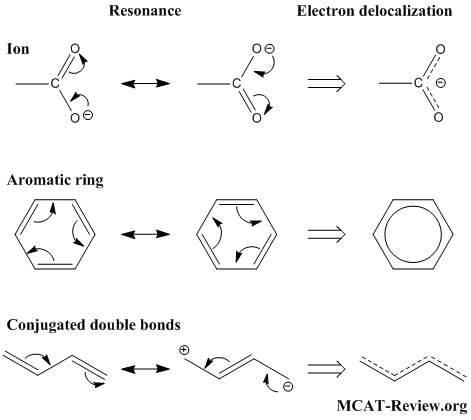
ภาพแสดงการเคลื่อนที่ของอิเล็กตรอน (electron delocalization)
ที่มา: http://mcat-review.org/covalent-bond.php
ตัวอย่างโมเลกุลที่เกิดเรโซแนนซ์ได้ เช่น O3, SO3, PO43-, CO32-, SO32-, SO42-
กลับไปที่เนื้อหา
พันธะโคเวเลนต์กับความมีขั้วของพันธะ
สภาพขั้วของพันธะเกิดขึ้นได้อย่างไร ???
นักเรียนทราบมาแล้วว่าพันธะไอออนิกเกิดจากการสร้างพันธะระหว่างไอออนบวกและไอออนลบ ซึ่งเกิดจากอะตอมโลหะให้อิเล็กตรอนกับอะตอมอโลหะ ทำให้เกิดเป็นไอออนบวก และไอออนลบขึ้น แต่ในกรณีของพันธะโคเวเลนต์ ซึ่งเป็นการใช้อิเล็กตรอนร่วมกันระหว่างอะตอมอโลหะ สภาพขั้วจะเกิดได้อย่างไร
ที่มา :http://cwx.prenhall.com
สภาพขั้้วของโมเลกุลโคเวเลนต์เกิดจาก การที่อะตอมต่างชนิดกัน หรืออะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันสร้างพันธะกัน โดยที่ความหนาแน่นของอิเล็กตรอนในอต่ละอะตอมจะกระจายตัวอย่างไม่สม่ำเสมอ โดยจะมีความหนาแน่นของอิเล็กตรอนสูงอยู่รอบๆ อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีสูงกว่า ทำให้เกิดเป็นพันธะโคเวเลนต์แบบมีขั้ว (polar covalent bond)
ที่มา :http://cwx.prenhall.com
นอกจากนี้ เราสามารถทำนายชนิดของพันธะได้จากผลต่างของค่าอิเล็กโทรเนกาติวิตีของอะตอมทั้งสองชนิดอย่างคร่่าว ดังรูป
ที่มา :http://cwx.prenhall.com
จากรูปจะพบว่าหากผลต่างระหว่างอะตอมมากกว่าหรือเท่ากับ 2 แสดงว่าพันธะที่เกิดขึ้นของสองะตอมนั้นจะเป็น "พันธะไอออนิก" และถ้าผลต่างระหว่างอะตอมอยู่ในช่วง 0.4-2 แสดงว่าพันธะที่เกิดขึ้นของสองอะตอมเป็น "พันธะโคเวเลนต์" โดยเป็นโมเลกุลโคเวเลนต์แบบมีขั้ว และถ้าผลต่างระหว่างอะตอมมีค่าเท่ากับ 0-0.4 แสดงว่าพันธะที่เกิดขึ้นของสองอะตอมเป็น "พันธะโคเวเลนต์" โดยเป็นโมเลกุลโคเวเลนต์แบบไม่มีขั้ว
โมเลกุลโคเวเลนต์แบบไม่มีขั้ว เป็นอย่างไร ???
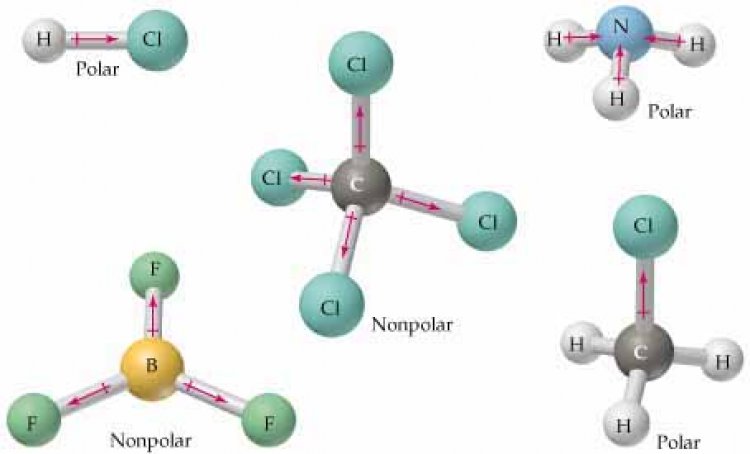
โมเลกุลโคเวเลนต์แบบไม่มีขั้วเกิดจากอะตอมทั้งสองมีค่าอิเล็กโทรเนตาติวิตีเท่ากันหรือใกล้เคียงกันมาก หรือโมเลกุลที่มีรูปร่างสมมาตร ทิศทางของขั้วพันธะทุกพันธะจะหักล้างกันหมดเหลือแต่ปริมาณ ถ้าอะตอมล้อมรอบเหมือนกันหมด ปริมาณของขั้วพันธะจะหักล้างกันหมด เช่น

ที่มา :http://wps.prenhall.com
การใช้สัญลักษณ์ในการระบุขั้วพันธะโคเวเลนต์
1. ใช้สัญลักษณ์δ+ แทนการแสดงความเป็นขั้วบวก และδ- แทนการแสดงความเป็นขั้วลบโดยอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีน้อยกว่าจะเป็นδ+ ดังรูป
2. สภาพขั้วของพันธะโคเวเลนต์เป็นเวกเตอร์ที่มีทั้งปริมาณและทิศทางโดยเราจะใช้ลูกศรบอกทิศทาง ซึ่งจะเขียนไปทางขั้วลบ ดังรูป

ตัวอย่างโมเลกุลไม่มีขั้ว ได้แก่ O2, N2, S8,CH4, BF3, BeCl2, PCl5 เป็นต้น
ตัวอย่างโมเลกุลมีขั้วได้แก่ NH3,CHCl3, H2O, OF2 เป็นต้น
กลับไปที่เนื้อหา
-
7074 พันธะเคมี (Chemical Bonding) /lesson-chemistry/item/7074-chemical-bondingเพิ่มในรายการโปรด




